Method Article
High Throughput Immunomagnetic Bead Separation을 통해 Buffy Coats에서 인간 말초 혈액 단핵 세포 분리
요약
이 프로토콜은 바이오뱅킹 및 기타 목적을 위해 인간 말초 혈액 단핵 세포를 분리하는 고처리량 자동화 호환 방법에 대해 자세히 설명합니다.
초록
말초 혈액 단핵 세포(PBMC)는 단핵구와 림프구의 이질적인 집단입니다. 동결 보존된 PBMC는 장기 보관에서 안정적인 생존력을 가지고 있어 유세포 분석, 면역 분석 및 게놈 염기서열 분석을 포함한 많은 다운스트림 연구 목적에 이상적인 세포 유형입니다. 일반적으로 PBMC는 밀도 구배 원심분리를 통해 분리되지만, 확장이 어렵고 비용이 많이 드는 저처리량 워크플로우입니다. 이 기사에서는 빠르게 구현할 수 있는 자기 비드 기반 PBMC 분리 방법을 사용하는 고처리량 워크플로우를 제시합니다. 밀도 구배 분리를 사용하여 얻은 PBMC를 사용한 총 세포 농도, 생존도 및 집단 분포를 비교하고 세포 생존율과 세포 유형의 비율을 두 기술 모두에 대해 비교했습니다. 분리된 PBMC는 채혈 후 9일까지 70% 이상의 생존율을 보였지만, 채혈 후 24시간 이내에 처리된 PBMC에 비해 5일 후 수율이 절반으로 감소했습니다. 요약하면, 이 기사에서는 비드 기반 접근 방식을 활용하여 고처리량 워크플로우에 적응하는 PBMC 프로토콜에 대해 설명하고, 수동 및 자동 비드 기반 방법 모두 처리 용량을 늘리고 다양한 예산에 유연성을 제공할 수 있음을 보여줍니다.
서문
말초 혈액 단핵 세포(PBMC) 분리는 림프구와 단핵구를 다른 전혈 성분에서 분리하고 분리하는 기술입니다. PBMC는 면역 요법, 백신 개발, 표적 또는 바이오마커 식별, 항체/저분자 약물 개발을 포함하되 이에 국한되지 않는 다양한 응용 분야에 사용되는 다목적 세포 유형입니다 1,2. 이러한 세포는 건강하거나 병든 개체로부터 분리할 수 있으며 다운스트림 공정에서 즉시 사용하거나 향후 연구를 위해 냉동 보존할 수 있습니다3. 어떤 경우에는 다운스트림 목적이 알려져 있는 반면, 다른 경우에는 바이오뱅킹에서 흔히 볼 수 있듯이 PBMC가 미래의 불특정 응용 분야를 위해 격리되어 저장된다4.
밀도 구배 원심분리는 원심분리 중 세포 밀도에 따라 구성 세포 유형의 차등 분리를 활용하여 전혈에서 PBMC 5,6,7을 분리하는 전통적인 기술입니다. 이 방법에는 약간의 변형이 있을 수 있지만 전혈은 일반적으로 인산염 완충 식염수(PBS)로 희석하고 특수 또는 표준 원심분리 튜브의 밀도 구배 매체 위에 층을 이룬 다음 회전시킵니다. 그 결과 4개의 뚜렷한 층이 형성됩니다: 상부 원형질층은 혈소판이 풍부하고, 얇은 PBMC 층은 밀도 구배 매질 위에 있으며, 마지막으로 최하층은 적혈구(RBC)와 과립구로 구성됩니다. 이 방법은 이전에 '황금 표준'8이라고 불렸지만, 긴 처리 시간, 원심분리기 용량, 다른 혈액 제제(예: 혈장 및 적혈구)의 분취 어려움, 번거로운 자동화 등의 한계가 있습니다. 이 방법9에 대해 자동화가 가능하지만, 액체 핸들러(원심분리 모듈이 완전히 자동화되어야 함)에 대한 포괄적인 프로그래밍이 필요하며 긴 프로세스로 남아 있습니다.
이제부터는 수동 처리를 위한 8개의 홀더 자석 또는 완전 자동화된 처리를 위한 기기를 사용하여 면역자성 비드 분리를 사용하는 대체 워크플로우가 제시됩니다. 이 방법은 세포에 첨가되어 원치 않는 세포 집단(이 경우 혈소판, 과립구 및 적혈구)과 결합하는 항체 칵테일을 사용합니다. 이러한 원치 않는 집단은 이후에 자기 분리에 의해 제거되며, 단핵구 및 림프구 집단은 다운스트림 처리(downstream processing)10를 위해 준비된 음의 분획(negative fraction)에 남게 된다. 이러한 negative selection method는 PBMCs에서 항체 및 magnetic bead complex를 제거하기 위해 추가 단계를 필요로 하는 positive selection method보다 빠르다. negative selection은 세포 기능성을 보존하는 방법으로 기술되어 왔기 때문에 추가적으로 유리하다(11,12).
프로토콜
품질 관리 혈액 검체 및 사내 생성 데이터(예: 세포 수, 생존력 및 처리 시 검체의 연령)는 NSW Health Statewide Biobank, Royal Prince Alfred Hospital(HREC 승인: 2019/ETH06776)의 동의된 연구 연구에서 얻었습니다. 처리된(즉, 혈장이 고갈된), 스크리닝되지 않은, 및 식별되지 않은 성인 인간 혈액 샘플을 EDTA 튜브에 수집했습니다. 이러한 품질 관리 혈액 검체는 채취 후 72시간 이내에 처리되었으며 밀도 구배와 비드 기반 방법을 비교하는 PBMC 분리 실험에 사용되었습니다. 대표 결과에 사용된 밀도 구배 분리 방법은 보충 파일 1의 절차를 참조하십시오. 이 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. 전혈 준비
- 실온에서 10mL 전혈관(에틸렌디아민테트라아세트산[EDTA], 산-시트레이트-덱스트로오스[ACD] 또는 리튬 헤파린으로 코팅됨)을 10회 부드럽게 뒤집습니다.
- 선택 사항: 전혈을 보관해야 하는 경우 -80°C 보관을 위해 극저온 튜브에 분발액합니다.
- 브레이크를 켠 상태에서 22°C에서 10분 동안 800 x g 의 스윙 버켓 로터를 사용하여 튜브를 원심분리합니다(9회 가속/9 감속).
2. 버피 코트 컬렉션
- 원심분리 후 샘플을 생물 안전 작업대에 넣고 3개의 뚜렷한 층이 있는지 확인합니다( 그림 1 참조).
참고: 적혈구는 원심분리 튜브의 아래쪽 짙은 빨간색 층에서 발견됩니다. 백혈구와 혈소판을 포함하는 백색 불투명층은 버피 코트(buffy coat)로 알려진 적혈구층 위에 위치합니다. 상단 노란색 층에는 플라즈마가 포함되어 있습니다. - 선택 사항: 플라즈마를 보관해야 하는 경우 -80°C 보관을 위해 혈장을 극저온 튜브에 분취합니다.
- 10mL 혈액 튜브에서 1mL의 버피 코트(시작 물질)를 피펫팅하고 수동 및 자동 방법에 대해 각각 3.1단계 및 4.1단계에서 지정되고 라벨이 지정된 튜브로 옮깁니다. 피펫 팁을 사용하여 버피 코트(흰색 불투명 층)를 소용돌이치고 흡인하여 버피 코트를 수집합니다.
참고: 흡인 중에는 100μL 미만의 혈장 및 RBC가 허용됩니다. 한 참가자에 대해 여러 개의 혈액 튜브를 채취하는 경우 버피 코트를 모을 수 있습니다. 그러나 이는 혈소판 농도에 영향을 미칠 수 있다13. - 수동 처리의 경우 섹션 3으로 진행합니다. 자동 처리의 경우 섹션 4로 진행하십시오.
- 선택 사항: 적혈구를 보관해야 하는 경우, -80 °C 보관을 위해 적혈구를 극저온 튜브에 분취합니다.
3. PBMC 정제 - 수동 방법
참고: 자석 홀더당 최대 8개의 샘플을 단일 작업자가 처리할 수 있습니다.
- 라벨: 3 x 5 mL 폴리스티렌 튜브(문자 A-C).
알림: 둘 이상의 샘플을 수행하는 경우(예: 1A, 1B, 1C, 2A, 2B, 2C) 순차 번호 매기기를 사용하십시오. - 60 μL의 0.1 M EDTA(6 mM, pH 8.0의 최종 EDTA 농도, 레시피에 대한 보충 파일 2 참조)를 2.3단계에서 전사된 버피 코트가 포함된 튜브 A에 추가합니다.
- 칵테일 믹스 튜브 50μL( 재료 표 참조)를 튜브 A에 추가하고 위아래로 피펫팅하여 3회 이상 혼합한 후 실온에서 5분 동안 배양합니다.
- 튜브 A에 PBS 890μL를 추가하고 위아래로 3회 이상 피펫팅하여 혼합합니다.
- 마그네틱 비드 튜브(재료 표 참조)를 30초 동안 소용돌이칩니다.
- 마그네틱 비드 50μL를 튜브 A에 추가하고 위아래로 피펫팅하여 3회 이상 혼합합니다.
- 즉시 튜브 A를 자석 스탠드에 넣고 실온에서 5분 동안 배양합니다.
- 최적의 PBMC 회수를 위해 농축된 세포 현탁액을 튜브 B에 조심스럽게 피펫팅하여 무/최소(<100 μL) 적혈구가 없는 투명 분획을 수집합니다.
알림: 자석에 묶인 구슬을 방해하지 마십시오. 이송 피펫을 사용하는 것이 좋습니다. - 마그넷 스탠드에서 튜브 A를 제거하고 폐기합니다.
- 튜브 B의 세포 현탁액에 50μL 마그네틱 비드를 추가하고 위아래로 3회 이상 피펫팅하여 혼합합니다.
- 즉시 튜브 B를 자석 스탠드에 넣고 실온에서 5분 동안 배양합니다.
- 농축된 세포 현탁액을 튜브 C에 조심스럽게 피펫팅하여 투명한 분획만 수집합니다.
알림: 자석에 묶인 구슬을 방해하지 마십시오. 이송 피펫을 사용하는 것이 좋습니다. - 마그넷 스탠드에서 튜브 B를 제거하고 폐기합니다.
- 즉시 튜브 C를 자석 스탠드에 넣고 실온에서 5분 동안 배양합니다.
- 농축된 세포 현탁액을 라벨이 부착된 원심분리 튜브에 조심스럽게 피펫팅하고 PBS로 최대 2mL를 보충합니다.
- 세포 현탁액 50 μL를 자동 세포 카운터의 샘플 컵으로 옮깁니다. 1:10 희석 세포 수를 위해 450μL의 PBS를 추가합니다. 세포 계수 단계에 대해서는 섹션 5로 진행합니다.
4. PBMC 정제 - 자동화된 방법
참고: 단일 자동 PBMC 기기로 최대 4개의 시료를 처리할 수 있습니다. 한 명의 작업자가 여러 기기를 병렬로 실행할 수 있습니다.
- 문자 A와 B가 있는 2 x 14 mL 튜브, 문자 C가 있는 1 x 50 mL 원심분리 튜브, "폐기물"이라고 표시된 1 x 50 mL 원심분리 튜브에 라벨을 붙입니다.
참고: 자동화된 PBMC 기기를 실행할 때마다 하나의 폐기물 용기만 필요합니다. 둘 이상의 샘플(예: 1A, 1B, 1C, 2A, 2B, 2C)을 수행하는 경우 순차 번호 매기기를 사용합니다. - 60단계에서 전사된 버피 코트가 포함된 튜브 A에 0.1M EDTA(최종 EDTA 농도 6mM)의 2.3μL를 추가합니다.
- 마그네틱 비드 튜브(재료 표 참조) 를 30초 동안 소용돌이칩니다.
- 기기 전면의 전원을 켜서 자동화된 PBMC 기기를 켭니다.
- 자동화된 PBMC 기기 홈 화면에서 프로필을 선택하고 원하는 프로토콜을 선택합니다.
참고: EasySep Direct Human PBMC 절연 19654 - Buffy Coat 는 이 PBMC 절연을 위해 선택된 프로토콜 프로필입니다. 프로토콜 보고서14에서 이 프로파일에 대한 제조업체의 표준 절차를 참조하십시오. - 시작 부피(튜브 A로 흡인된 버피 코트의 양)를 입력하고 각 샘플에 대해 반복합니다.
- 동일한 시약 키트를 사용할 모든 사분면을 선택합니다.
알림: 둘 이상의 사분면에 동일한 프로토콜이 사용되는 경우 자동화된 PBMC 기기는모든 사분면 14에 대해 동일한 시약 키트를 사용하도록 제안합니다. - 기기의 캐러셀에 라벨이 부착된 소모품, 필터 팁 및 버퍼 용기를 로드합니다. 마그네틱 비드 튜브와 칵테일 믹스 튜브가 포함된 시약 키트는 1사분면에 로드되어야 합니다.
알림: 기기는 사용자가 모든 사분면에 대해 1개의 시약 키트를 사용하기를 원하는지 묻습니다. 'yes'를 선택하고 시약 키트를 사용하여 모든 사분면을 강조 표시합니다. - 로딩이 완료되면 소모품 및 시약의 뚜껑을 제거하고 기기 화면에서 run을 선택합니다.
- 실행이 완료되면 기기의 캐러셀에서 샘플 (튜브 C에 라벨이 부착된 PBMC 현탁액 포함)을 언로드하고 제거합니다. 마그네틱 비드 튜브, 칵테일 믹스 튜브 및 버퍼 용기는 4°C에서 보관합니다. A, B로 표시된 튜브와 폐기물(4.1단계 참조)을 폐기하고 팁을 필터링합니다.
참고: PBMC 현탁액은 최종 부피가 7mL이므로 자동화된 분석법의 경우 PBS를 보충할 필요가 없습니다. - 희석되지 않은 세포 수를 위해 500μL의 세포를 시료 컵에 옮깁니다. 세포 계수를 위해 섹션 5로 진행합니다.
5. 세포 계수
- 제조업체의 지침에 따라 trypan blue 염료 배제 방법을 사용하여 세포 계수 및 생존율을 수행합니다15.
참고: 저자의 내부 프로세스의 경우, PBMC를 획득하기 위해 다음 설정과 함께 자동화된 세포 카운터를 사용하여 세포 분석을 수행합니다.
희석 계수 = 10(수동 프로토콜의 경우, 셀 현탁액의 부피가 적은 경우) 또는 1(자동 프로토콜의 경우)
세포 유형 : PBMC
농도 범위 = 5 x 104 - 1 x 107 cells/mL
크기 범위(직경) = 8 μm - 50 μm
이미지 수 = 50
6. 냉동 보존 준비
- 원심분리기(스윙 버킷 로터 사용)는 브레이크를 켠 상태(9 가속/9 감속)에서 22 °C에서 8분 동안 300 x g 에서 샘플 튜브를 주입합니다.
- 원심분리 후 샘플을 생물 안전 작업대에 다시 넣습니다.
- 피펫을 사용하여 상층액을 조심스럽게 제거합니다. PBMC 펠릿이 방해받지 않도록 소량의 상층액을 PBMC 펠릿과 함께 남겨둘 수 있습니다.
- 펠릿을 3mL의 저온 동결 보존 매체에 재현탁시킵니다. 균질해질 때까지 서스펜션을 위아래로 천천히 부드럽게 섞습니다.
참고: 순환 보존 매체의 부피는 원하는 최종 PBMC 농도에 따라 조정할 수 있습니다. - 재현탁 PBMC 1mL를 사전 할당된 cryotube에 분주하고 -80°C에서 최소 4시간 동안 제어 속도 동결 용기 안에 넣습니다.
참고: 각 cryotube에 할당된 PBMC의 부피는 연구자의 선호도에 따라 조정할 수 있습니다. - 극저온튜브를 -80°C에서 최소 4시간 동안 보관한 후 극저온튜브를 액체 질소 증기상 탱크로 옮겨 장기간 보관합니다.
7. 통계 데이터 분석
- 대표 결과 데이터는 보충 파일 3에 명시된 대로 통계 및 그래프 소프트웨어를 사용하여 분석되었습니다.
결과
비드 기반 또는 밀도 구배 분리법을 사용하여 PBMC를 분리할 때 림프구, 단핵구, 호중구, 호산구 및 호염기구 분리 전(즉, 전혈에서) 및 PBMC 후 분리의 비율을 측정했습니다. 림프구와 단핵구의 비율은 두 방법 모두에 의해 유의하게 농축되었습니다(그림 2A,B). 또한 호중구, 호산구 및 호염기구(즉, 과립구)의 비율은 비드 기반 방법으로 분리한 PBMC에서 유의하게 감소했습니다(그림 2C-F). 밀도 구배법과 비드 기반 방법 간에 림프구, 단핵구, 호중구, 호산구, 과립구의 비율에는 유의한 차이가 없었습니다(그림 2). 퍼센트 회수율은 위에 나열된 세포 유형에 대해 추가로 계산되었습니다(보충 그림 1 참조). 평균 세포 생존율은 두 방법 모두에서 95% 이상이었고 유의한 차이가 없었습니다(그림 3A). PBMC는 또한 8μm에서 50μm의 크기 범위(직경)를 사용하여 계수되었으며, 밀도 구배 분리 방법은 총 세포 수가 약 2배 더 많았습니다(그림 3B).
다음으로, 자동화된 비드 기반 방법과 수동 방법을 비교했습니다. 수동 또는 자동 방법을 사용하여 세포 생존율(그림 4A) 또는 총 세포 수(그림 4B)에 대한 유의미한 차이는 확인되지 않았습니다. 이 8개의 샘플을 처리하는 데 걸리는 시간을 비교했으며, 여기에는 사람의 개입이 필요하지 않은 휴무 시간도 포함되었습니다. 8개 샘플의 총 처리 시간은 43 분이었습니다. 57분 수동 vs. 자동화된 방법. 자동화된 방법에는 35분의 수동 처리가 포함되었습니다(그림 4C).
PBMC 분리(전혈 및 혈장 분취 포함)의 비드 기반 워크플로우는 9개월에 걸쳐 시범 운영되었으며, 처음 820명의 참가자에게는 수동 플랫폼을 사용하여 1410개의 PBMC 샘플을, 다음 590명의 참가자에게는 자동화된 방법을 사용하여 선별되지 않은 인간 혈액에서 분리했습니다. 처리는 연구 승인 기준에 따라 당일 또는 수집 후 최대 10일까지 수행되었으며, 주로 샘플 운송 시간으로 인해 처리가 지연되었습니다. 수동 또는 자동 방법을 사용할 경우, 채취 후 24시간 이내에 처리된 PBMC의 생존율과 회수율이 가장 높았습니다(그림 5). 평균 세포 생존율은 5일 이내에 처리된 PBMC의 경우 >90%, 10일 이내에 처리된 PBMC의 경우 >70%였습니다(그림 5A). 평균 PBMC 수율은 24시간 이내에 처리된 표본에 비해 5일 후 50% 감소했습니다(그림 5B).
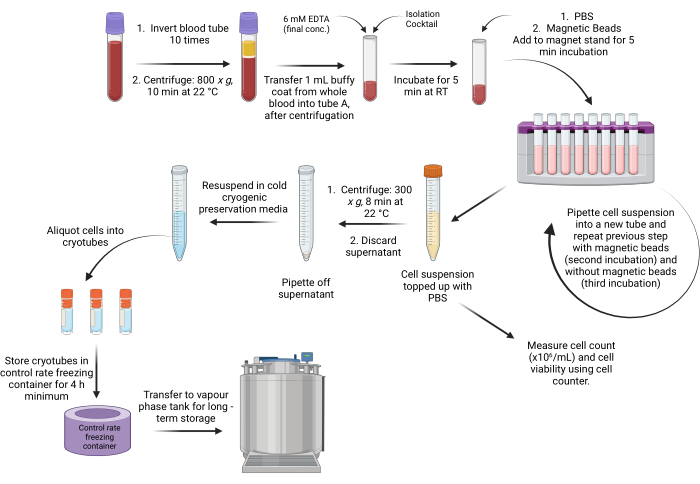
그림 1: buffy coat의 비드 기반 PBMC 분리 프로토콜의 개략도 워크플로우. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
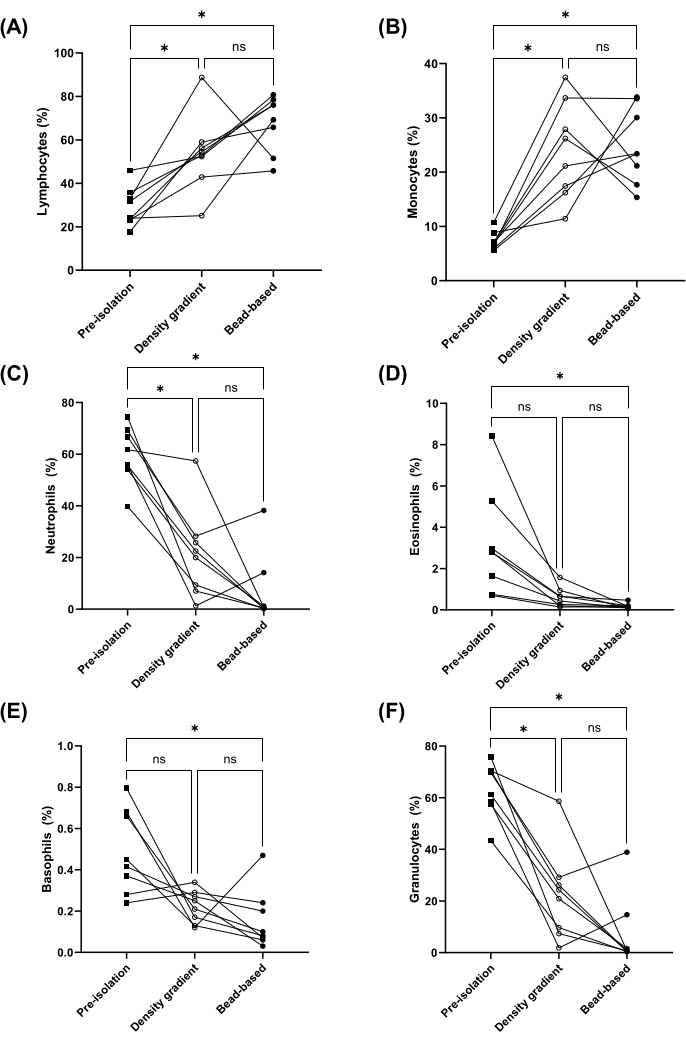
그림 2: 밀도 구배 및 비드 기반 방법에 의한 PBMC 전후 분리에서 림프구, 단핵구, 호중구, 호산구, 과립구의 비율. 밀도 구배(열린 원) 또는 비드 기반(닫힌 원) 방법(n = 8)을 통한 정합 전혈 pre-PBMC 분리(사각형) 및 PBMC 후 분리에서 림프구(A), 단핵구(B), 호중구(C), 호산구(D), 호염기구(E) 및 과립구(F)의 비율. ns = 유의하지 않음, *<p는 일원 분산분석(A 및 B) 또는 Friedman의 테스트(C- 에프). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
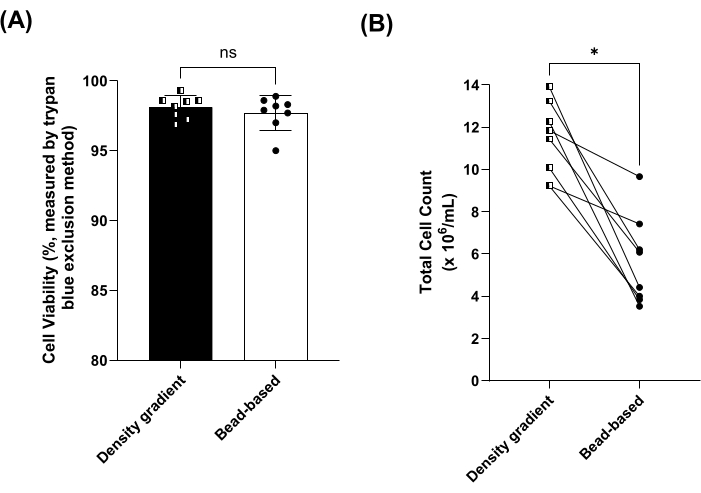
그림 3: 밀도 구배 및 비드 기반 방법으로 분리된 PBMC의 생존도 및 총 세포 수. (A) 밀도 구배(사각형, 어두운 막대)를 사용하여 처리된 샘플에 대한 평균(± SD) 세포 생존율 대 8쌍의 시료에 대한 비드 기반(원, 열린 막대) 방법. ns = 쌍체 t-검정에 의해 유의하지 않음. (B) 밀도 구배(사각형, 어두운 막대)를 사용하여 처리된 샘플의 총 세포 수 vs. 8쌍의 시료에 대한 비드 기반(원, 열린 막대) 방법. *P < 0.05는 쌍체 t-검정을 사용하여 측정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
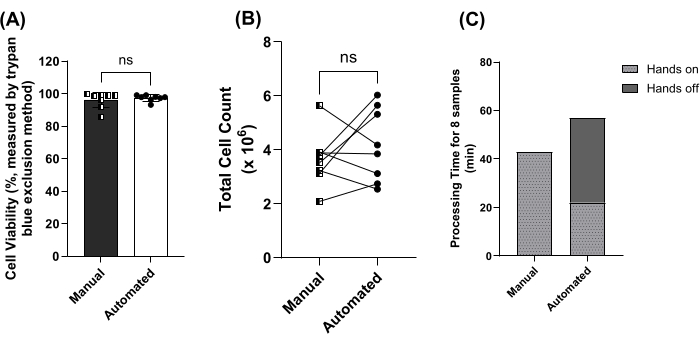
그림 4: 수동 및 자동 비드 기반 분석법 비교. (A) 수동(사각형, 어두운 막대)을 사용하여 처리된 샘플의 평균(± SD) 세포 생존율 대 8쌍의 시료에 대한 자동화된(Circles, Open Bar) 비드 기반 분석법. ns = Mann-Whitney 검정에 의해 유의하지 않음. (B) 수동(사각형)을 사용하여 처리된 샘플의 총 세포 수 vs. 8쌍의 시료에 대한 자동화된(원형) 비드 기반 분석법. ns = 쌍체 t-검정에 의해 유의하지 않음. (C) 수동으로 처리한 8개 샘플의 처리 시간 vs. 실습(라이트 바) 및 핸즈오프 기간(다크 바)을 포함한 자동화된 방법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
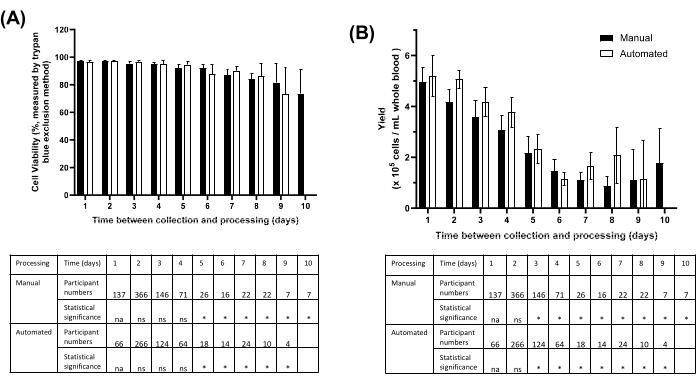
그림 5: 시료 채취와 PBMC 보관 사이의 시간에 따라 수동 또는 자동화를 사용하여 비드 기반 분석법에서 분리한 PBMC의 생존력 및 수율. (A) 수동(어두운 막대)을 사용하여 처리된 참가자 샘플에 대한 평균(± 95% CI) 세포 생존율 대 자동화된(오픈 바) 비드 기반 방법. 참가자 번호를 자세히 설명하는 표입니다. ns = 중요하지 않음. na = 해당 없음. *p < Tukey의 다중 비교 테스트에서 0.05입니다. (B) 수동(어두운 막대)을 사용하여 처리된 참가자 샘플의 총 세포 수 vs. 자동화된(오픈 바) 비드 기반 방법. 참가자 번호를 자세히 설명하는 표입니다. ns = 중요하지 않음. na = 해당 없음. *p < Tukey의 다중 비교 테스트에서 0.05입니다. 반복 횟수가 3보다 작기 때문에 자동화된 Day 10에 대한 값이 없습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 밀도 구배 및 비드 기반 방법을 사용한 차등 세포 백분율 회수 그림. 백분율은 밀도 구배 방법(사각형, 어두운 막대) 및 비드 기반 방법(원, 열린 막대)을 사용하여 전혈에서 분리 전 및 분리 후 세포 현탁액의 절대 세포 수를 사용하여 계산했습니다(n = 8). ns = 유의하지 않음, *p 는 쌍을 이루지 않은 t-검정에 의해 결정된 0.05<. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 밀도 그래디언트 프로토콜. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: PBS에서 0.1M EDTA, pH 8.0의 준비. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: 대표 데이터를 생성하기 위해 수행된 자세한 절차. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
인간 PBMC는 수많은 분석에 사용되는 다용도 세포 유형입니다. 그러나 분리 처리량은 바이오뱅크를 포함한 많은 실험실에서 종종 제한됩니다16. 이전에는 NSW Health Statewide Biobank가 밀도 구배 방법을 사용하여 PBMC를 분리했습니다. 처리 용량을 늘리기 위해 밀도 구배 분리 방법에 대한 자동화를 조사했지만, (i) 원심분리 장치가 있는 액체 처리기의 비용, 멸균 제품을 생산하기 위한 HEPA 장치에 대한 추가 요구 사항, (ii) 프로그래밍을 위한 숙련된 인력, (iii) 프로토콜 테스트에 필요한 시간 등 구현에 대한 장벽이 확인되었습니다. 따라서 본 연구는 대체 방법을 탐색하고 수동 및 자동 처리에 사용할 수 있는 상업적으로 획득된 Human PBMC 키트를 식별했습니다. 공정에 필요한 장비가 표준(길이 1.2m) 생물 안전 캐비닛에 맞기 때문에 멸균성이 보장됩니다. 이 백서는 품질 저하 없이 효율성을 높이고 시약 비용을 낮추기 위해 제조업체에서 권장하는 프로토콜14에 대한 수정 사항을 자세히 설명합니다. 또한 제조업체의 프로토콜은 원래 혈액 튜브에서 전혈(1.2단계), 혈장(2.2단계) 및 RBC(2.5단계)를 포함한 향후 연구를 위한 바이오뱅크 표본에 대한 단계를 자세히 설명하도록 확장되었습니다.
이 연구에서는 세 가지 PBMC 분리 프로토콜, 즉 밀도 구배 분리, 수동 및 자동 비드 기반 분리를 비교했습니다. PBMC 분리 전에 버피 코트 희석을 제거하고 원심분리를 위한 break OFF 요구 사항을 제거하는 등 제조업체의 수동 비드 기반 프로토콜에 대한 수정이 이루어졌으며, 이를 통해 연구자는 적응 가능하고 비용 효율적이며 처리량이 높은 PBMC 분리 프로토콜을 따를 수 있었습니다. 먼저, 밀도 구배 분리와 수동 비드 기반 기법을 비교하기 위해 PBMC를 분리하는 데 8개의 일치하는 전혈 샘플을 사용했습니다. 중요한 것은 세포 집단 분포, 세포 생존력 및 PBMC의 회수율이 그림 2A-F, 그림 3A 및 보충 그림 1에서 각각 볼 수 있듯이 비교된 두 방법 간에 크게 다르지 않았다는 것입니다. 대표 데이터에서 trypan blue 배제 방법을 사용한 밀도 구배 분리 방법에서는 세포 수가 더 높았지만 혈액학 세포 분석기를 사용한 경우에는 그렇지 않았습니다. 세포 카운터의 PBMC 세포 유형 설정은 8-50 μm의 세포 직경 범위를 사용하므로, 트리판 블루 배제 방법17을 사용할 때 계수에는 PBMC와 과립구(직경 약 12-15 μm)가 포함됩니다. 혈액 세포 카운터는 트리판 블루 배제 방법보다 더 높은 특이도를 제공했지만, 일부 회수 계산은 100%보다 높았으며, 이는 기기의 오차 한계를 반영합니다(보충 그림 1 참조). 따라서 대부분의 기법이 특이적 세포 계수와 고감도 차등 세포 계수를 모두 제공하지 않기 때문에 PBMC 분리 프로토콜의 수율을 비교할 때 연구자가 세포 계수 기법을 조합하여 적용하는 것이 좋습니다. 또한, 두 기법 중 하나에서 수득된 PBMC의 기능적 활성을 비교하기 위한 분석이 수행되지 않았으며, 이는 당사 분석의 한계입니다.
다음으로, 수동 및 자동 비드 기반 방법을 비교한 결과, 8개의 일치하는 샘플에서 PBMC 수율 또는 생존도 간에 유의미한 차이가 확인되지 않았습니다(그림 4A, B). 세포 집단은 개별적으로 비교하지 않았는데, 이는 동일한 항체 분리 칵테일이 두 방법 모두에 사용되었기 때문입니다. 중요한 것은 자동화된 프로토콜을 사용하여 8개의 시료를 처리하는 데 걸리는 수작업 시간이 43분에서 22분으로 단축되었다는 것입니다(그림 4C). 자동화를 사용하여 처리량, 기술자 소진 방지 및 시료 처리의 일관성이 보장되지만 시약 및 소모품 비용은 수동 비드 기반 방법보다 3-4배 더 높습니다. 이는 권장 범위인 2-5mL(전혈량 10mL 이상) 대신 1mL의 버피 코트(전혈량 10mL)를 사용하도록 제조 프로토콜을 수정한 후입니다. 예산이 제한적인 경우 수동 방법을 선택하면 처리 시간을 ~25% 줄이면서 밀도 분리 방법과 유사한 시약 및 소모품 비용을 유지할 수 있습니다. 8분의 배양 기간(30, 30 s/sample)의 적절한 엇갈림을 보장하기 위해 기술자당 한 번에 5개 이하의 샘플을 처리하는 것이 좋습니다(단계 3.7, 3.11 및 3.14).
수동 및 자동 비드 기반 분석법 모두에서 버피 코트를 제거하는 것은 최적의 PBMC 분리를 보장하기 위한 중요한 단계입니다. 이 프로토콜에서는 전혈이 아닌 버피 코트가 사용되는데, 이는 시약의 부피가 시작 물질의 부피10을 기준으로 하기 때문이라는 점에 유의하는 것이 중요합니다. 전체 버피 코트 볼륨을 효과적으로 제거하는 것은 기술적으로 어려울 수 있습니다. 처음에 이 방법은 0.5mL의 버피 코트를 제거하는 데 자세히 설명되어 있었지만 회수율을 높이기 위해 1mL로 늘렸습니다. 버피 코트의 적절하고 일관된 회복을 보장하기 위해 이 프로세스를 자세히 설명하는 것이 프로토콜 문서화 및 교육에서 중요합니다. 아래 층에서 너무 많은 적혈구를 흡입하지 않도록 주의하면서 버피 코트를 흡입하는 동안 피펫 팁을 소용돌이치게 하는 것이 좋습니다(2.3단계). 수율과 순도에 영향을 줄 수 있는 원치 않는 세포(즉, 과립구 및 적혈구)에 결합하는 항체 칵테일을 포화시키지 않는 것이 중요하다10. 버피 코트 추출 중에 포집되는 적혈구를 최소화하려면 피펫 팁이 플라즈마와 버피 코트 층 사이에 있어야 합니다. 버피 코트의 부피는 1mL에서 늘릴 수 있습니다. 그러나, 수집된 부피의 10% 이상이 적혈구를 포함하지 않도록 위에서 설명한 바와 같이 주의를 기울여야 한다. 대안적으로, 자동화된 액체 핸들러를 사용하여 버피 코트를 일관되게 수집할 수 있다18. 그러나 액체 취급 기기 프로토콜을 교정하고 문제를 해결하는 데 필요한 전용 시간, 특히 비용을 고려할 때 대부분의 실험실에서는 실현 가능하지 않을 수 있습니다.
향후 3년 동안 23,000개의 PBMC를 처리하려는 NSW Health Statewide Biobank의 목표를 감안할 때 자동화 비드 기반 프로토콜의 전환과 적용은 필수적이었습니다. 여기에서 PBMC는 채취 후 최대 9일까지 ACD 튜브에서 분리할 수 있으며 평균 생존율은 >70%에 달한다는 것이 입증되었습니다. 채취 후 24시간 동안 수율이 최적이었지만, 샘플을 운송해야 할 수 있으므로 이 기간 내에 처리하는 것이 항상 가능한 것은 아닙니다. 수동 또는 자동 비드 기반 분석법으로 분리한 PBMC는 채취 후 4일 이내에 분리할 경우 >3 x 105 cells/mL 전혈, 채취 후 10일 이내에 분리한 경우 >1 x 105 cells/mL 전혈을 얻을 수 있는 것으로 나타났습니다. 5일 이상 지속된 샘플의 낮은 수치는 이 분석의 한계로 언급됩니다. 또한, 참가자의 연령, 성별 및 임상 병력에 따라 데이터를 분리하지 않았는데, 이는 이 정보가 제공되지 않았기 때문입니다. 두 방법 모두에 대한 처리 시간 지연의 영향을 조사하기 위해 비교 분석이 필요하지만, 밀도 구배 방법을 사용한 PBMC 분리의 지연은 세포 품질을 저하시키고 RBC 오염을 크게 증가시킨다는 것이 이전에 보고되었습니다19,20. 또한, 처리가 지연되면 과립구 비율이 증가하므로 유사한 "연대"의 표본은 다운스트림 분석을 위해 그룹화되어야 합니다 20,21,22. 주목할 점은, 이 실험은 산성 시트르뎁스트로오스(즉, 시트르산삼나트륨, 시트르산 및 덱스트로오스)로 항응고된 혈액을 사용하여 수행되었습니다. 그러나, 수율 및/또는 세포 유형의 비율은 다른 항응고제가 사용되는 경우 달라질 수있다 23; 따라서 연구자는 의도된 다운스트림 PBMC 분석에 따라 적절한 항응고제를 선택하는 것이 좋습니다.
요약하면, 고처리량 워크플로우에 적응할 수 있는 마그네틱 비드를 사용한 PBMC 분리를 위한 프로토콜은 세포 생존력을 손상시키지 않으면서 확장에 대한 요구 사항을 충족하기 위해 상세하게 설명되어 있습니다. 수동 및 자동 분석법 모두 시작 및 재현탁 부피를 변경하여 특정 세포 농도를 생성하도록 최적화할 수 있습니다. NSW Health Statewide Biobank는 기존의 밀도 구배 분리 기법을 사용하여 월 ~60 PBMC를 추출하던 것에서 이 자동화 호환 비드 기반 기법을 사용하여 월 ~300 PBMC를 추출하는 것으로 전환했습니다. 저자의 다음 목표는 자동화된 플랫폼을 사용하여 매월 최대 1,200개의 PBMC를 처리하고, 마그네틱 비드 기반(수동 및 자동) 및 밀도 그래디언트 기법으로 분리된 PBMC를 추가로 비교하여 이 기법을 특히 바이오뱅크에 중점을 둔 다른 실험실에 적용하는 데 도움을 주는 것입니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
NSW Health Statewide Biobank는 NSW Health Pathology, NSW Office for Health and Medical Research 및 Sydney Local Health District의 지원에 감사드립니다. 또한, 저자들은 자체 생성 데이터를 게시하고 사용하지 않은 표본을 연구 목적으로 사용할 수 있도록 허가한 Omico와 NSW Health Statewide Biobank의 지원을 받는 기타 연구 조사에 감사를 표합니다. 저자는 제니퍼 브린(Jennifer Bryne) 교수(NSW 건강 병리학, 시드니 대학)의 비판적 리더십과 토론에 감사를 표한다. 그림 1 은 BioRender.com 로 만든 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| Cell cryopreservation media CS10, 100 mL (CRYOSTOR) | StemCellTM Technologies | 07930 | |
| Class II Biological Safety Cabinet | Thermo ScientififcTM | 51033311 | |
| CoolCell 1 mL FX | BioTools | BCS-407P | This is the control rate freezing container used. |
| Distilled Water | Bacto Laboratories | 561832 | |
| DxH 500 Hematology Analyzer | Beckman Coulter Life Sciences | B40601 | Referred to as external automated cell counter. |
| EasyEightsTM EasySepTM Magnet | StemCellTM Technologies | 18103 | |
| EasySepTM Direct Human PBMC Isolation Kit | StemCellTM Technologies | 19654 | Kit includes the magnetic bead tube and the cocktail mix tube |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich Pty Ltd | E6758-500G | Instructions to make 0.1M EDTA solution from EDTA salt is located in supplemental file 2. |
| LymphoprepTM Density Gradient Medium | StemCellTM Technologies | 7851 | |
| Megafuge ST4 Plus Centrifuge | Thermo ScientififcTM | THR75009903 | |
| Orion Star A211 pH meter electrode | Thermo ScientififcTM | STARA2110 | |
| Orion™ ROSS Ultra™ Glass Triode™ pH/ATC Combination Electrodes | Thermo ScientififcTM | 8302BNURCA | |
| Phosphate buffered saline (PBS), solution, 1X, 500ml | Life Technologies Australia Pty Ltd | 10010023 | |
| Prism | GraphPad | ||
| RoboSepTM Buffer 1X | StemCellTM Technologies | 20104 | Software used for statistical analysis. |
| RoboSepTM-S | StemCellTM Technologies | 21000 | Fully automated cell separator instrument. |
| RoboSep™ Filter Tips | StemCellTM Technologies | 20125 | |
| SepMateTM-50 (IVD) tubes | StemCellTM Technologies | 85460 | IVD - In vitro diagnostics. Also known as SepMateTM-50 tubes |
| Vi-CELL XR Cell Anlayzer | Beckman Coulter Life Sciences | Internal automated cell counter. Instrument obsolete and no longer available for purchase (as of December 31, 2022). Alternative instrument is the ViCell BLU Cell Viability Analyzer (Product no. C19196). | |
| Vi-CELL XR Quad Pack Reagent Kit | Beckman Coulter Life Sciences | 383722 |
참고문헌
- Alexovic, M., et al. Human peripheral blood mononuclear cells: A review of recent proteomic applications. Proteomics. 22 (15-16), e2200026 (2022).
- Zhang, M., Huang, B. The multi-differentiation potential of peripheral blood mononuclear cells. Stem Cell Res Ther. 3 (6), 48 (2012).
- Arimilli, S., Damratoski, B. E., Chen, P., Jones, B. A., Prasad, G. L. Rapid isolation of leukocyte subsets from fresh and cryopreserved peripheral blood mononuclear cells in clinical research. Cryo Lett. 33 (5), 376-384 (2012).
- Kleeberger, C. A., et al. Viability and recovery of peripheral blood mononuclear cells cryopreserved for up to 12 years in a multicenter study. Clin Diagn Lab Immunol. 6 (1), 14-19 (1999).
- Ulmer, A. J., Scholz, W., Ernst, M., Brandt, E., Flad, H. D. Isolation and subfractionation of human peripheral blood mononuclear cells (PBMC) by density gradient centrifugation on percoll. Immunobiology. 166 (3), 238-250 (1984).
- Fuss, I. J., Kanof, M. E., Smith, P. D., Zola, H. Isolation of whole mononuclear cells from peripheral blood and cord blood. Curr Protoc Immunol. 7, 711-718 (2009).
- Gautam, A., et al. Investigating gene expression profiles of whole blood and peripheral blood mononuclear cells using multiple collection and processing methods. PLoS One. 14 (12), e0225137 (2019).
- Hamot, G., Ammerlaan, W., Mathay, C., Kofanova, O., Betsou, F. Method validation for automated isolation of viable peripheral blood mononuclear cells. Biopreserv Biobank. 13 (3), 152-163 (2015).
- Coppola, L., et al. Purification of viable peripheral blood mononuclear cells for biobanking using a robotized liquid handling workstation. J Transl Med. 17 (1), 371 (2019).
- Stemcell Technologies. Vol. 27156. STEMCELL TECHNOLOGIES. , 1-4 (2020).
- Hornschuh, M., et al. Negative magnetic sorting preserves the functionality of ex vivo cultivated non-adherent human monocytes. Biology (Basel). 11 (11), 1583 (2022).
- Bhattacharjee, J., Das, B., Mishra, A., Sahay, P., Upadhyay, P. Monocytes isolated by positive and negative magnetic sorting techniques show different molecular characteristics and immunophenotypic behaviour. F1000Res. 6, 2045 (2017).
- Ohlsson, S., Diedrich, B., Uhlin, M., Sandgren, P. Optimized processing for pathogen inactivation of double-dose buffy-coat platelet concentrates: Maintained in vitro quality over 7-day storage. Vox Sang. 113 (7), 611-621 (2018).
- Easysep direct human PBMC isolation kit for processing 100 mL buffy coat. Stemcell Technologies Available from: https://www.stemcell.com/products/brands/easysep-cell-separation.html (2022)
- Vi-cell XR cell viability analyzer instructions for use. Beckman Coulter Available from: https://mbcbiolabs.com/wp-content/uploads/2022/08/Beckman-Coulter-ViCell-Manual.pdf (2017)
- Fuchs, Y. F., et al. Next-generation biobanking: Employing a robotic system for automated mononuclear cell isolation. Biopreserv Biobank. 21 (1), 106-110 (2023).
- Tigner, A., Ibrahim, S. A., Murray, I. V. Histology, white blood cell. StatPearls Publishing. , (2024).
- Mathay, C., Ammerlaan, W., Betsou, F. Automatic buffy coat extract on: Methodology, feasibility, optimization, and validation study. Biopreserv Biobank. 10 (6), 543-547 (2012).
- Golke, T., et al. Delays during PBMC isolation have a moderate effect on yield, but severly compromise cell viability. Clin Chem Lab Med. 60 (5), 701-706 (2022).
- Yi, P. C., et al. Impact of delayed PBMC processing on functional and genomic assays. J Immunol Methods. 519, 113514 (2023).
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t-cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Mallone, R., et al. Isolation and preservation of peripheral blood mononuclear cells for analysis of islet antigen-reactive t-cell responses: Position statement of the t-cell workshop committee of the immunology of diabetes society. Clin Exp Immunol. 163 (1), 33-49 (2011).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Curr Pathobiol Rep. 7 (2), 17-27 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유