Method Article
Объемная визуализация и анализ первичных ресничек в костно-мышечной ткани с использованием мышиной модели ARL13B-CENTRIN-2
В этой статье
Резюме
Этот метод описывает использование эндогенного сигнала в трансгенной мышиной модели ARL13B-CENTRIN-2 для визуализации первичных ресничек in situ, в трех измерениях на больших площадях минерализованной ткани, от сбора ткани до анализа организации ресничек. Этот протокол также может быть применен к другим типам тканей.
Аннотация
Первичная ресничка представляет собой неподвижную, одиночную органеллу, собранную большинством типов клеток. Он необходим для развития и гомеостаза скелета, а также для координации клеточных реакций на биохимические и механические сигналы окружающей среды. Из-за своего размера в микрометровом масштабе первичную ресничку сложно изобразить in situ , чтобы охарактеризовать в тканях с высокой пропускной способностью и без оптических смещений. Понимание его организации в 3D-среде in vivo будет ключом к пониманию роли цилиарий в физиологии и болезнях. В линейке мышей ARL13B-CENTRIN-2 представлена метка mCherry на белке аксонемы реснички ARL13B и метка зеленого флуоресцентного белка (GFP) на белке центриоле CENTRIN-2, локализованном в основании реснички. Эта линейка мышей позволяет визуализировать первичную ресничку без необходимости окрашивания, что сокращает количество этапов сбора изображений и позволяет обойти проблемы с соотношением сигнал/шум. В данной публикации описан пошаговый протокол визуализации первичных ресничек в костно-мышечных тканях с сохранением флуоресцентного сигнала. В нем также описывается универсально применимый конвейер анализа изображений, обеспечивающий несмещенную количественную оценку характеристик ресничек, таких как длина и 3D-ориентация.
Введение
Первичная ресничка является важной органеллой в развитии и гомеостазе многих тканей и органов, включая скелет. Во время постнатального роста регулирует минерализацию хряща во время эндохондрального окостенения1. У людей генетические мутации, которые влияют на белки, связанные с ресничками, вызывают ряд заболеваний и нарушений развития, известных как цилиопатии. Понимание организации первичных ресничек внутри тканей важно для понимания того, как они регулируют клеточное поведение на уровне органов. Было показано, что распространенность, длина и ориентация первичных ресничек варьируются внутри тканей и между ними, что указывает на роль организации тканей в их функции 2,3,4. Пластинка роста, слой хряща на концах длинных костей, где происходит большая часть постнатального роста костей с раннего возраста и на протяжении всего подросткового возраста, представляет собой высокоорганизованную ткань с хондроцитарными клетками, расположенными в столбцах. В пластинке роста хондроциты проходят стадии дифференцировки, от покоящейся до пролиферирующей и гипертрофированной.
Эта клеточная организация теряется при некоторых цилиопатиях, что позволяет предположить, что первичные реснички могут играть роль в координации этой клеточной организации и/или, по крайней мере, быть связаны с клеточной поляризацией. Кроме того, ориентация первичных ресничек, по-видимому, играет роль в их механосенсорной функции, при этом наблюдаются различия между несущими и ненесущими областями суставного хряща4. Наши собственные недавние исследования показали дифференциальную роль в разных областях суставного хряща и пластинки роста 5,6. Предыдущие исследования, в которых визуализировались первичные реснички в ростовой пластинке, были ограничены 2D, что приводит к потере информации, связанной с организацией ресничек в тканях, или ограничены небольшим количеством клеток в 3D, что снижает масштаб и мощность анализа 7,8.
К числу проблем, связанных с визуализацией первичной реснички, относятся ее размер в микрометровом масштабе и неспецифичность иммуногистохимических антител. Использование нативного флуоресцентного сигнала обеспечивает сильную локализацию и специфичность. Однако нативные флуоресцентные сигналы могут быть сложными для визуализации в минерализованных тканях, так как длительный процесс декальцинации для встраивания тканей в парафин может привести к потере сигнала. Криосекция образцов, замороженных в нативном состоянии, предотвращает эту потерю за счет ускорения процесса встраивания и секционирования.
Для визуализации первичных ресничек in situ Bangs et al. была создана двойная трансгенная мышиная линия, которая экспрессирует АДФ-рибозилированный фактороподобный белок (ARL13B), слитый с mCherry, и CENTRIN-2, слитый с GFP9. ARL13B представляет собой небольшую ГТФазу, локализованную на первичной мембране ресничек, а CENTRIN-2 представляет собой центриолярный белок, локализованный в двух центросомах в основании реснички10,11. Таким образом, эта линия мышей позволяет визуализировать флуоресцентно меченные первичные реснички без необходимости иммуногистохимии.
Описанный здесь протокол использует эту трансгенную линию для 3D-визуализации первичных ресничек в постнатальных пластинках роста мышей с помощью конфокальной микроскопии, требуя только дополнительного окрашивания 4',6-диамидино-2-фенилиндолом (DAPI). Сотни первичных ресничек в сотнях клеток могут быть визуализированы и проанализированы в совокупности в тканевом контексте. Затем конвейер анализа изображений измеряет распространенность, длину и ориентацию первичных ресничек в различных областях пластины роста. Конвейер также может количественно оценить эти характеристики для центриолей. Схема этапов протокола представлена на рисунке 1.
протокол
Животноводство и эксперименты проводились в соответствии с этическими рамками Оксфордского университета и в соответствии с лицензией проекта, выданной Министерством внутренних дел Великобритании. Этот протокол был выполнен на мышах в возрасте от 2 до 10 недель, но будет работать и на хрящах мышей и старше этого возраста.
1. Сбор тканей
- Усыпляют мышей, наполняя коробку, содержащую мышей, углекислым газом до 80% по объему и поддерживая его концентрацию в течение 5 минут. Выполнить вывих шейки матки.
- Рассеките интересующую ткань.
ПРИМЕЧАНИЕ: Ниже приведен протокол рассечения коленей задней ноги, включая большеберцовые и бедренные пластины роста и суставной хрящ.- Надрежьте кожу у стопы и срежьте до верхней части бедра. Удалите кожу с линии разреза с помощью щипцов.
- Обрежьте мышцы и жировую ткань с ног.
- Чтобы оторвать ногу от туловища, аккуратно разрежьте бедренную кость в верхней части бедра. Разрежьте ножку в нижней части голени.
- Удалите лишнюю мышечную и жировую ткань, оставшуюся на ноге.
2. Фиксация и встраивание тканей
ПРИМЕЧАНИЕ: На протяжении всего протокола следите за тем, чтобы ткань оставалась в темноте, чтобы избежать потери флуоресцентного сигнала.
- Зафиксируйте ткань в 10% формалине при комнатной температуре на 4 ч.
- Переведите салфетки в 2,5% формалин при температуре 4 °C на ночь.
- Перенесите ткани до 30% сахарозы в дистиллированную воду (dH2O) и аккуратно переверните при комнатной температуре в течение ночи или в течение 3 дней при 4 °C. Заполните трубки доверху, чтобы обеспечить полное погружение ткани во время вращения. После этой инкубации ткань опустится на дно трубки.
- Поместите небольшое количество сухого льда в отдельную коробку и расположите сверху криомолд. Проведите линию суперкриоэмбедирующей среды (SCEM) и поместите конечность вдоль нее, коленной чашечкой вниз и раздвинув большеберцовую и бедренную кости, чтобы нога была как можно более плоской. Удерживайте на месте щипцами до тех пор, пока SCEM не начнет затвердевать и конечность больше не будет двигаться, если ее не удерживать.
- Накройте полностью SCEM, заполнив форму доверху. Поместите образец в ящик с сухим льдом, держа образец ровным, чтобы избежать движения ткани, до тех пор, пока SCEM полностью не застынет.
- Переведите на -20 °C.
3. Секционирование
- Извлеките блок из формы и обрежьте до размера, который помещается на патроне криостата. Прикрепите блок к патрону, нанеся SCEM на патрон и поместив блок сверху.
- Дайте застыть не менее 5 минут при -20 °C в криостате.
- Прикрепите патрон к держателю образца, а лезвие — к держателю лезвия.
- Обрежьте блок до тех пор, пока не будет достигнута пластина роста большеберцовой кости. В идеале разрез так, чтобы голень была направлена вверх.
- Отрежьте криопленочную ленту до размера, который подходит к образцу и имеет достаточно места вокруг него. Закрепите криопленку на поверхности разреза, обеспечив плотное сцепление криопленки с помощью подходящего инструмента. Разрежьте срезы толщиной 40-60 мкм, чтобы получить срезы толщиной в две ячейки. Соберите ленту с помощью щипцов и поместите ее на предметное стекло образцом вверх, а большеберцовую пластину роста на одной линии с коротким слайдом предметного стекла.
- Храните предметные стекла при температуре -20 °C.
4. Подготовка и монтаж слайда
- Разморозьте предметное стекло в горизонтальном положении при комнатной температуре.
- Промойте предметное стекло каплей PBS в течение 3 х 5 минут, чтобы удалить SCEM.
- Окрашивать 10 мкМ DAPI в течение 1 мин.
- Промойте предметное стекло каплей PBS в течение 2 х 5 минут.
- Установите, накройте покровным стеклом и оставьте при комнатной температуре на ночь. Загерметизируйте края покровного стекла герметиком.
- Изображение на следующий день.
5. Визуализация с помощью конфокальной микроскопии
ПРИМЕЧАНИЕ: Разрешение объектива 40x/1.4 на используемом конфокальном микроскопе составляет 240 нм.
- Установите микроскоп.
- Включите микроскоп и откройте программное обеспечение. Нажмите на кнопку « Система ».
- На вкладке «Приобретение » нажмите « Умная настройка », чтобы настроить каналы. Выберите и добавьте каналы GFP, mCherry и DAPI. Выберите опцию Airyscan и функцию SR8Y в треугольнике Airyscan (между разрешением и мультиплексированием скорости 8Y). Нажмите на «Лучший сигнал» | OK (дополнительный рисунок S1A).
- На вкладке «Найти» в разделе «Управление микроскопом» выберите объектив 40x/1.4 с погружением в масло.
- Найдите интересующую область.
- Поместите затвор в держатель затвора и поднимите объектив вверх до тех пор, пока масло не коснется покровного стекла.
- Расположите пластину роста или другую интересующую область под световым путем.
- На вкладке «Найти» нажмите « Флуоресценция», выберите DAPI и с помощью окуляра переместите держатель слайда с помощью джойстика, чтобы расположить пластину роста или интересующую область под полем зрения.
- На вкладке Сбор данных начните с выбора только канала DAPI .
- Нажмите « Непрерывно», чтобы просмотреть изображение этого канала на экране и убедиться, что пластина роста находится в поле зрения.
- Откройте просмотрщик плиток , нажав на кнопку «Показать просмотрщик » на вкладке «Плитки ». Добавьте необходимое количество плиток (обычно 1 плитка в направлении x и 3-5 в направлении y) и нажмите кнопку «Предварительный просмотр и запуск » (дополнительный рисунок S1B).
- Убедитесь, что плитка покрывает три зоны пластины роста – покоящуюся, пролиферирующую и гипертрофированную. При необходимости отрегулируйте положение и количество плиток.
- Настройте параметры изображения.
- Нажмите « Непрерывно» на вкладке «Приобретение ». На вкладке «Каналы » отрегулируйте параметры «Усиление» (Master) и «Мощность лазера », чтобы ядра были четко видны на экране. Дайте детектору Airyscan выровняться. Откройте окно Настройка детектора Airyscan , нажав на мозаичный символ розетки в нижней части окна; как только он выровняется, все плитки станут зелеными (дополнительный рисунок S1C).
- Выберите каналы GFP и mCherry по отдельности и повторите эти шаги, установив усиление (ведущий), мощность лазера и выровняйте детектор Airyscan.
- Выберите все три канала и нажмите «Непрерывный». Дайте детектору Airyscan выровняться.
- На вкладке «Режим съемки» задайте значения «Размер изображения», «Пиксель», «Размер», «Размер кадра», «Скорость» и «Усреднение». На дополнительном рисунке S1D,E приведены значения настроек режима захвата, усиления (ведущего) и мощности лазера для используемых каналов.
- Получение изображений.
- На вкладке «Приобретение » нажмите на флажок Z-Stack .
- Выбрав только канал DAPI, нажмите « Непрерывно », чтобы просмотреть изображение на экране. Переместите объектив вниз к ближайшей плоскости для изображения. На вкладке Z-Stack нажмите « Установить первую плоскость», сфокусируйтесь на последней плоскости для просмотра и нажмите « Установить последнюю плоскость». Изображение 30-40 мкм z-стеков.
- Установите интервал равным 0,15 мкм.
- Переместитесь в центр z-стека. На вкладке «Плитки » в разделе «Области мозаики» нажмите «Проверить » и нажмите « Установить Z и перейти к следующему».
- На вкладке Стратегия фокусировки убедитесь, что для стратегии фокусировки выбрано значение Использовать значения Z/Поверхность фокусировки, определенные в параметре Настройка плиток.
- Нажмите « Начать эксперимент », чтобы начать получение изображения.
- Обработка изображений
- На вкладке Обработка выберите Одиночный или Пакетный режим. Выберите обработку Airyscan. Отметьте галочкой 3D обработку и выберите Стандартный автофильтр. Выберите полученное необработанное изображение и начните обработку (дополнительный рисунок S2A).
- После завершения обработки Airyscan выберите «Сшивка » в разделе «Методы обработки». Выберите «Новый выход», «Объединить плитки», «Исправить затенение» и «Все по ссылке», указав ссылку DAPI. Выберите обработанное изображение Airyscan и начните обработку (дополнительный рисунок S2B).
- Сохраните необработанные и дважды обработанные изображения. Последний сохраняется автоматически в пакетном режиме.
6. Анализ изображений
ПРИМЕЧАНИЕ: Используемый здесь конвейер анализа был адаптирован к целям данного исследования. Подробная информация об операциях с трубопроводом представлена на дополнительном рисунке S3.
- Импортируйте файл изображения czi в программу. Откройте панель анализа; в выпадающем списке выберите Новый конвейер...
- Чтобы создать конвейер обнаружения клеток, импортируйте сегментатор Python Cellpose в конвейер12. Установите Model_Name на cyto2, Input_channel на 2, Second_channel на 3, Diameter_in_μм на 10, Flow_threshold на 0,4 и Cellprob_threshold на 0. Добавьте Import Document Objects (переименованный в Import Manual Labels) до и оператор Object Feature Filter (переименованный в Size Filter) после конвейера, нажав на + Add Operation. Значения настроек конвейера см. на дополнительном рисунке S3A .
- Перемещение зрителя в первую интересующую плоскость
- Нажмите на иконку инструмента «Рисовать объекты»
- Нажмите на иконку режима полигона
- Область рисования для анализа
- Перемещение зрителя в последнюю интересующую плоскость
- Область рисования для анализа
- Нажмите на зеленую галочку «Применить изменения»
- Нажмите на иконку «Показать таблицу объектов »
- Щелкните правой кнопкой мыши созданный объект и выберите «Переименовать объект », чтобы переименовать объект в соответствующее имя. Щелкните правой кнопкой мыши по созданному объекту и нажмите « Добавить тег». Добавьте тег с именем Analysis Region.
- Запустите этот конвейер, щелкнув синюю стрелку вперед в верхней части панели анализа .
- Чтобы создать первичный конвейер обнаружения ресничек и центриолей, откройте панель анализа, в выпадающем списке выберите Новый конвейер.... Добавьте в конвейер следующие операторы: Импорт объектов документа (переименован в Импорт ручных меток), два оператора Intensity Threshold Segmenter (переименован в Cilia Threshold и Centriole Threshold), Splitting (переименован в Centriole Splitting), Object Feature Filter (переименован в Centriole Splitting size filter) и Compartment (переименован в Compartment - Cell). Значения настроек конвейера см. на дополнительном рисунке S3B .
- Запустите этот конвейер, щелкнув синюю стрелку вперед в верхней части панели анализа.
- Откройте окно «Объекты». Нажмите на Im/Export..., выберите Excel Export.... Выберите следующие элементы для сохранения: # Дочерние элементы, Имя, Родительские имена, 3D-ориентированные границы Короткая сторона, Средняя сторона, Длинная сторона, Угол XY, Угол XZ, Угол YZ, Ограничивающий прямоугольник X1, X2, Y1, Y2, Z1, Z2, SizeX, SizeY, SizeZ, Центр геометрии X, Y, Z, Первая плоскость, Последняя, Количество, Сферичность (сетка), Объем (сетка), Площадь поверхности (сетка).
Результаты
Пластинка роста 6-недельной мыши была визуализирована с использованием описанного протокола и первичной организации ресничек, картированной в ткани. Было получено изображение всех трех областей пластины роста — покоящейся, пролиферативной и гипертрофированной — и оно было пропущено через аналитический конвейер (рис. 2A). Отдельные клетки могут быть идентифицированы с помощью окрашивания DAPI, при этом их цилиарная аксонема выделена красным цветом, а центриоли — зеленым. Разрешение при использовании этого метода достаточно высокое, чтобы различать отдельные центриоли (рис. 2B). При таком разрешении реснички можно визуализировать в их 3D-среде, указывая в разных направлениях (видео 1).
Изображения с более низким разрешением, с более высокими объективами увеличения, также могут быть получены для визуализации первичных ресничек на большей площади ткани; однако они не подходят для анализа ориентации ресничек в 3D. Например, первичные реснички в суставном хряще были визуализированы с помощью объектива 20x, что свидетельствует о том, что метод работает и на других тканях (рис. 2C). При этом разрешении можно идентифицировать ресничные аксонемы красного цвета, но центриоли различить сложнее. Субхондральная кость имеет тенденцию представлять много фонового сигнала GFP, что затрудняет идентификацию центриоля в этой ткани.
Конвейер может обнаруживать отдельные клетки, первичные реснички и центриоли, и он работает для высокоорганизованных молодых пластин роста и старых пластин роста, где колонки менее четко определены, как у 10-недельных мышей (рис. 3). Клетки и реснички обнаруживаются в 3D, что можно увидеть на z-стеке.
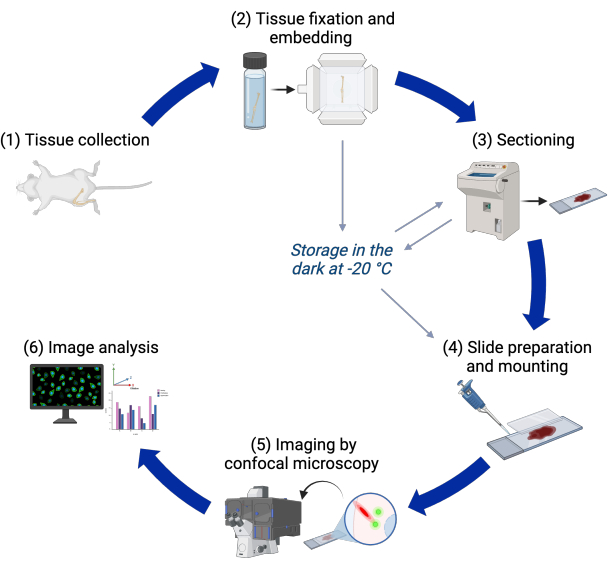
Рисунок 1: Экспериментальный рабочий процесс. Блок-схема различных этапов протокола от сбора тканей до анализа изображений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
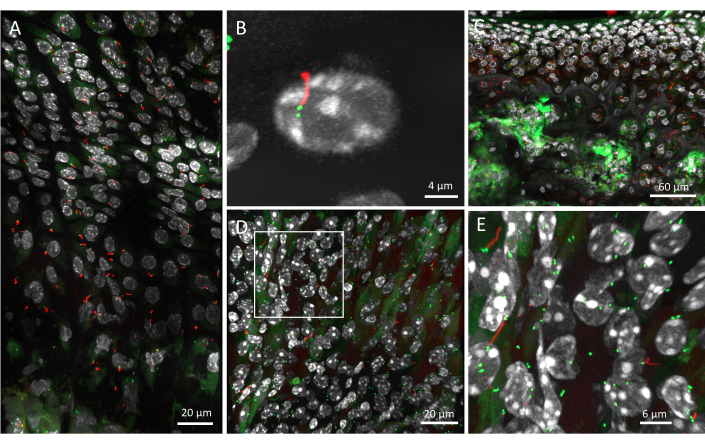
Рисунок 2: Первичные реснички в мышиных тканях мыши ARL13B-CENTRIN-2. (A) Пластинка роста 6-недельного возраста с DAPI белого цвета, CENTRIN-2 зеленым цветом и ARL13B красным цветом, полученная с объективом 40x. (B) Увеличьте масштаб отдельной первичной реснички и ее двух центриолей. (C) Суставной хрящ и субхондральная кость 4-недельной мыши, полученные с помощью объектива 20x. (D) Почка 6-недельной мыши, визуализированная с использованием того же конвейера, что и для скелетно-мышечной ткани. (E) Увеличение белого прямоугольника в D , показывающего отдельные первичные реснички и их центриоли в почке. Масштабные линейки = 20 μм (A,D), 4 μм (B), 60 μм (C), 6 μм (E). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
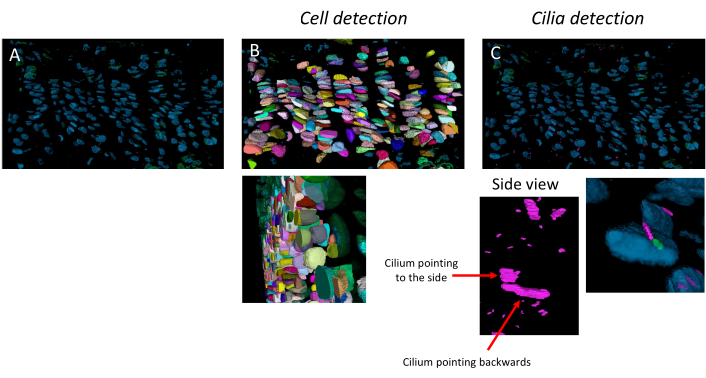
Рисунок 3: Конвейер обнаружения клеток и ресничек. Пример применения конвейера анализа изображений на 10-недельной пластине роста. (A) Изображение открыто в программном обеспечении. (B) Результат конвейера обнаружения клеток. (C) Результат процесса обнаружения ресничек и центриоль. Реснички розового цвета, а центриоли – зеленого. Вид сбоку показывает, что разрешение достаточно высокое, чтобы различать реснички, ориентированные в разных направлениях в 3D. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1: Трехмерная реконструкция пластины роста возрастом 6 недель у мыши ARL13B-CENTRIN-2. Трехмерная реконструкция была проведена в программном обеспечении Imaris и записана в виде анимационного ролика. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительный рисунок S1: Настройки получения изображения на микроскопе. (A) Окно Smart Setup для добавления каналов и выбора режима Airyscan . (B) Просмотрщик плиток для выбора и предварительного просмотра плиток на изображение. (C) Окно настройки детектора Airyscan , в котором выравнивание детекторов Airyscan подтверждается, когда все плитки становятся зелеными. (D) Настройки лазера для трех каналов. (E) Настройки режима сбора данных и Z-Stack. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2: Настройки обработки изображений в системе микроскопа. (A) Настройки обработки Airyscan. (B) Настройки сшивки. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S3: Пользовательские конвейеры анализа изображений. (A) Конвейер обнаружения клеток с использованием каналов GFP и DAPI. (B) Первичный конвейер обнаружения ресничек и центриол с использованием каналов mCherry и GFP соответственно. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В этом протоколе важно приступить к этапам обработки и внедрения ткани сразу после сбора. Блоки и предметные стекла ткани, однако, могут храниться не менее 3 месяцев при температуре -20 °C. Несколько шагов в этом протоколе могут быть изменены в соответствии с различными приложениями, в частности, толщиной сечения, увеличением и параметрами z-стека. Это повлияет на глубину изображения и получаемое разрешение. Изменения в числовой апертуре и режиме разрешения могут быть использованы для получения еще более высокого разрешения, а размер интервала z-стеков уменьшится. Однако это увеличит время визуализации или уменьшит размер поля зрения, которое можно визуализировать. Описанные параметры визуализации являются минимальными требованиями, определенными для 3D-анализа ориентации первичных ресничек.
Выбор монтажной среды важен для получения высокого разрешения. Показатель преломления монтажной среды должен быть аналогичен показателю преломления иммерсионной среды, чтобы свести к минимуму ухудшение качества изображения в z-стеке. Показатель преломления монтанта и используемого здесь иммерсионного масла имеет показатели преломления 1,52 и 1,518 соответственно. Функция Airyscan на используемом здесь конфокальном микроскопе позволяет получать изображения со сверхвысоким разрешением. Можно было бы использовать и другие микроскопы сверхвысокого разрешения; Тем не менее, мы обнаружили, что только конфокальная мода недостаточна для получения разрешения, необходимого для размера изображаемых областей. Максимальное разрешение режима Multiplex SR-8Y Airyscan составляет 120/160 нм по x/y и 450 нм по z, а максимальное количество кадров/с — 47,5. Мы обнаружили, что режим Multiplex SR-4Y Airyscan, который представляет максимальное разрешение 140 нм в x/y и 450 нм в z, но изображения в два раза быстрее с максимальным числом кадров в секунду 25, не представляет существенной разницы для визуализации первичных ресничек в 3D. Аналогичным образом, режим сверхвысокого разрешения Airyscan (SR), который предлагает самое высокое разрешение на этом микроскопе — 120 нм в x/y и 350 нм в z — займет больше времени для получения изображения, так как его максимальное количество кадров в секунду составляет 4,713.
Фоновый сигнал GFP может наблюдаться в других тканях, таких как мышца. Чтобы свести это к минимуму, диапазон лазеров может быть сужен, чтобы уменьшить перекрытие с другими длинами волн. Эта линия ранее использовалась для визуализации первичных ресничек в эмбрионе, первичных клеточных культур, мышечных волокон и пигментного эпителиясетчатки 9,14,15. Мы успешно визуализировали первичные реснички в почках, хрящах и костной ткани. Вероятно, потребуется некоторая оптимизация настроек визуализации для различных тканей; Тем не менее, этот протокол криосекции должен обеспечивать сохранность сигнала.
Срезы толщиной в две клетки (40-60 мкм) достаточны для получения 3D-информации об ориентации в ростовой пластине, так как это позволяет визуализировать целые клетки и их первичные реснички. Для других тканей, где клетки крупнее хондроцитов, таких как адипоциты, для сбора данных о клеточной популяции могут потребоваться более толстые срезы. В зависимости от глубинного разрешения используемого микроскопа может оказаться невозможным получить изображение глубоко в более толстых срезах. Методы очистки тканей, вероятно, приведут к потере эндогенного сигнала mCherry и GFP из-за необходимого для этого времени. Это было изучено, так как для других визуализаций в конечности использовались методы очищения, но в данном контексте это не было признано необходимым. Наш опыт работы с эндогенным CD31-RFP показал, что методы очистки требуют тщательной, адаптированной к выборке, оптимизации.
Эту линию ARL13B-CENTRIN-2 можно скрещивать с другими линиями мышей для дальнейшего изучения организации первичных ресничек в тканях. Например, мы скрестили его с aggrecan-CreIFT88 fl/fl, чтобы условно выбить IFT88, первичный белок ресничек, делеция которого предотвращает реснитчатость, в аггрекан-экспрессирующих клетках (постнатальных хондроцитах)5,6. Эти флуоресцентные сигналы ARL13B и CENTRIN-2 могут быть затем использованы для измерения эффективности генетических возмущений на уровне ресничной структуры в тканях и любых связанных с ними изменений в организации ресничек. В настоящее время ведутся работы именно по этому направлению. Наша первая цель будет заключаться в количественной оценке, с помощью этой более надежной методологии, влияния делеции IFT88 на распространенность ресничек. Ранее мы оценивали это с помощью иммунофлюоресценции и оценили это снижение на 20%6. Этот метод также может быть объединен с иммуногистохимией для визуализации первичных ресничек в сочетании с другими белками, например, белком клеточной мембраны.
Трансген ARL13B может влиять на экспрессию ARL13B и длину первичных ресничек. В предыдущих исследованиях измеряли различную длину первичных ресничек с линией ARL13B-CENTRIN-2 по сравнению с нетрансгенным ARL13B в определенных областях мозга мышей, без различийв других областях мозга. В другом исследовании наблюдались различия в длине первичных ресничек в линии мышей ARL13B с меченой GFP по сравнению с немеченой ARL13B в эмбриональных фибробластах мышей10. В настоящее время проводится работа по проверке любых изменений длины первичных ресничек в пластинке роста и других тканях путем сравнения результатов с использованием мышиной линии ARL13B-CENTRIN-2 с окрашиванием антител против нетрансгенного ARL13B.
Конвейер анализа изображений в этом протоколе был разработан для последующего измерения процента ресничек, длины и 3D-ориентации первичных ресничек, а также числа центриолей и положения в пластине роста. Программное обеспечение для анализа изображений позволяет создавать пользовательские конвейеры, изменяя соответствующие этапы. Выходными данными этого конвейера является электронная таблица с измерениями выбранных признаков для обнаруженных клеток, ресничек и центриолей. Затем постанализ может быть выполнен в R или другом программном обеспечении в соответствии с целями исследования. Как и в случае с настройками визуализации, этапы конвейера и конкретные настройки могут быть изменены для работы с различными изображениями и в соответствии с целями исследования. В целом, этот метод позволяет проводить высокопроизводительный анализ первичных ресничек, чем было опубликовано ранее в ростовой пластине. Количество клеток и связанных с ними ресничек, которые могут быть изучены, позволяет проводить более крупные и надежные измерения.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Благодарим всех сотрудников БГУ в Институте ревматологии им. Кеннеди, в частности Альбертино Бонифачо, за животноводство. Мы благодарим Центр передового опыта в области биомедицинской визуализации Oxford-ZEISS за помощь в использовании микроскопа, в частности, доктора Джеки (Ка Лонг) Ко за помощь в разработке конвейера анализа изображений. Эта работа была поддержана студенческой стипендией Фонда Кеннеди по исследованиям в области ревматологии (Johnson) и Исследовательским советом по биотехнологии и биологическим наукам (BBSRC, BB/X007049/1).
Материалы
| Name | Company | Catalog Number | Comments |
| 22 x 50 mm cover slips | fisherscientific | 12373128 | |
| arivis Vision4D software | Zeiss | N/A | Image analysis software |
| Confocal laser scanning microscope | Zeiss | Zeiss 980 Airyscan 2 | |
| CoverGrip Coverslip Sealant | Biotium | 23005 | |
| Cryofilm type 3C(16UF) (sheet type) 2.0 cm width | Section-lab | C-FUF303 | To be purchased from Section-lab directly |
| Cryostat | Leica | CM1900 UV | |
| DAPI | invitrogen | D1306 | |
| Disposable Base Molds | epredia | 58952 | |
| Dulbecco's Phosphate Buffered Saline | gibco | 14190 | |
| Formalin | Sigma | 20260630 | |
| Imaris software | Oxford Instruments | N/A | Image analysis software for 3D reconstruction |
| Immersion Oil 518F | Zeiss | ISO 8036 | |
| Microtome blades | Feather | 02.075.00.006 | |
| SlowFade Glass Antifade Mountant | invitrogen | S36917 | |
| Sucrose | Sigma | S9378 | |
| Super Cryoembedding Medium (SCEM) | Section-lab | C-EM001 | To be purchased from Section-lab directly |
| Superfrost Plus Microscope slides | avantor | 631-0108 | |
| Zen software | Zeiss | N/A | Freeware for Confocal laser scanning microscopy |
Ссылки
- Wheatley, D. N., Wang, A. M., Strugnell, G. E. Expression of primary cilia in mammalian cells. Cell Biol Int. 20 (1), 73-81 (1996).
- Donnelly, E., Ascenzi, M. G., Farnum, C. Primary cilia are highly oriented with respect to collagen direction and long axis of extensor tendon. J Orthop Res. 28 (1), 77-82 (2010).
- McGlashan, S. R., et al. Mechanical loading modulates chondrocyte primary cilia incidence and length. Cell Biol Int. 34 (5), 441-446 (2010).
- Farnum, C. E., Wilsman, N. J. Orientation of primary cilia of articular chondrocytes in three-dimensional space. Anat Rec. 294 (3), 533-549 (2011).
- Coveney, C. R., et al. The ciliary protein IFT88 controls post-natal cartilage thickness and influences development of osteoarthritis. Arth Rheumatol. 74 (1), 49-59 (2021).
- Coveney, C. R., et al. Ciliary IFT88 protects coordinated adolescent growth plate ossification from disruptive physiological mechanical forces. J Bone Miner Res. 37 (6), 1081-1086 (2022).
- Andrea, C. E. D., et al. Primary cilia organization reflects polarity in the growth plate and implies loss of polarity and mosaicism in osteochondroma. Lab Invest. 90 (7), 1091-1101 (2010).
- Ascenzi, M. -. G., et al. Effect of localization, length and orientation of chondrocytic primary cilium on murine growth plate organization. J. Theor Biol. 285 (1), 147-155 (2011).
- Bangs, F. K., Schrode, N., Hadjantonakis, A. K., Anderson, K. V. Lineage specificity of primary cilia in the mouse embryo. Nat. Cell Biol. 17 (2), 113-122 (2015).
- Larkins, C. E., Aviles, G. D. G., East, M. P., Kahn, R. A., Caspary, T. Arl13b regulates ciliogenesis and the dynamic localization of Shh signaling proteins. Mol Biol Cell. 22 (23), 4694-4703 (2011).
- Higginbotham, H., Bielas, S., Tanaka, T., Gleeson, J. G. Transgenic mouse line with green-fluorescent protein-labeled Centrin 2 allows visualization of the centrosome in living cells. Transgenic Res. 13 (2), 155-164 (2004).
- arivis. . Application Note #47 - Applying Cellpose models in arivis Vision4D. , 1-20 (2021).
- Huff, J., Bergter, A., Luebbers, B. Application Note: Multiplex mode for the LSM 9 series with Airyscan 2: fast and gentle confocal super-resolution in large volumes. Nat Methods. , (2019).
- Ning, K., et al. Cilia-associated wound repair mediated by IFT88 in retinal pigment epithelium. Sci Rep. 13 (1), 8205-8219 (2023).
- Palla, A. R., et al. Primary cilia on muscle stem cells are critical to maintain regenerative capacity and are lost during aging. Nat Commun. 13 (1), 1439-1451 (2022).
- Brewer, K. K., et al. Postnatal dynamic ciliary ARL13B and ADCY3 localization in the mouse brain. Cells. 13 (3), 259-277 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены