JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
신경 세포와 Glia 개발 연구 랫 두뇌 집계 문화의 준비
요약
배아 쥐의 두뇌 집합의 문화 시스템을위한 프로토콜이 설명되어 있습니다. 집계에 Multipotent progenitors 개발하고 뉴런, astrocytes 및 oligodendrocytes로 구별하실 수 있습니다.
초록
중추 신경계의 성숙 뉴런과 glia (CNS)에 progenitors의 recapitulates 개발과 차별화는 axo - glial 상호 작용, 속성과 multipotent progenitors의 분화, 그리고 oligodendroglial의 진행을 조사 neuroscientists위한 강력한 플랫폼을 제공하는 것이 체외 시스템 세포 및 분자 수준에서 세포 혈통. 우리는 여기 3~4주에 혈청이없는 배지에서 유지 수 있으며, 신경 세포 - glia 상호 작용과 CNS의 myelination을 연구하는 모델로 저희 연구실에서 사용되는 배아의 쥐 forebrains에서 CNS의 집계 문화 시스템을 설명합니다. 이 비디오 클립은 E16 쥐의 두뇌에서 이러한 CNS의 집계 문화를 분리하고 성장하는 방법을 보여줍니다. 또한, 동일한 뇌 해부에서 매우 풍부한 정기 dissociated의 연결을 문화가 쉽게 얻을 수 있으며, 다양한 연구에 사용 CNS의 뉴런 또는 다른 세포 공동 배양에 사용.
프로토콜
절개 전에 준비
수술 도구 : 압력솥의 모든 해부 가위와 집게를 소독
Coverslip 청소 :
- 최소 24 H에 대한 33% HCL에 1L 잔디 비커의 모든 coverslips을 (24 잘 접시 직경 15mm) 소크
- 모든 잔류 HCL을 제거 가끔 흔들어 10 분 물을 실행하는 와시
- Millipore 물로 헹굼
- 물을 배수하다
- 95~98% 에탄올에 coverslips 소크
- 플랫 플레이트와 공기의 깨끗한 조직 전송 coverslips은 coverslips을 건조
- 알루미늄 호일과 압력솥와 커버, 유리 비커에 coverslips을 전송
참고 : Coverslips이 단계에서 저장할 수 있습니다 - 문화 접시에 개인 coverslip를 놓습니다. 코팅 준비
Coverslip 코팅 :
- PBS 및 필터 - 소독 (0.22 μm의)와 폴리 - D - 라이신 100 X 주식 (PDL, -20 ° C에서 aliquots로 저장 PBS에서 알부민 0.5 % 소 혈청에서 10 MG / ML을) 희석
- 37 2 H 1 X PDL 솔루션 (~ 0.15 ML / cm 2) · 인큐베이터에서 C와 외투 coverslips
- PDL 솔루션을 제거하고 완전히 멸균 ddH 2 O 건조 coverslips 3 번 씻어
참고 : coverslips / 각 해부에 대한 번호판 충분한 문장. PDL - 코팅 coverslips 4에서 몇 주 동안 저장할 수 있습니다 ° C.
미디어 솔루션
해부 매체 (DM)는 10 MM의 HEPES (Invitrogen 15,630)과 보충 (HBSS, Invitrogen 14175) 무균 얼음 차가운 행크의 밸런스드 소금 솔루션 (W / O 칼슘 2 +, MG 2 +)를 사용합니다.
누계 문화 미디어 : 2% B27, 1 X 사토, 0.5 MM 나트륨 pyruvate, 0.75mM GlutaMAX, 60μg/ml N - acetylcysteine, 5 μg / ML : DMEM/NBB27 매체 DMEM / Neurobasal를 (권 1시 1분 권)를 포함 인슐린, 10nM D - 비오틴, 1 % 페니실린 / 스트렙토 마이신. 집계 문화 매체의 100 ML하려면 50 ML DMEM (W / O pyruvate / 글루타민, Invitrogen 11,960) 50 ML Neurobasal 매체 (Invitrogen 211034), 375 μl GlutaMax (100 X, Invitrogen 35,050), 5.5 MG 나트륨 pyruvate를 섞어 (시그마 P2256), 2 ML B27 (Invitrogen 17,504)는, 6.3 MG N - acetylcysteine (시그마 A8199), 사토 주식 1 ML, D - 비오틴 주식 (4000 X 주식 40 25 μl를 (100 X 주식은 아래 참조) PBS에서 μm의는 -20에서 aliquots ° C. 시그마 B4639), 인슐린 100 μl (1000 X 주식, -20에서 aliquots로 저장 0.01N HCL 5 MG / ML ° C, 시그마 16,634), 1 ML 페니실린로 저장 / 스트렙토 마이신 (100 X 주식, Invitrogen 15140)은, 필터 소독 및 저장 4 ° C.
사토 100 X 주식 솔루션 : 주식의 40 ML을하려면 다음과 같이 혼합 400가, 400 밀리그램의 BSA (시그마 A9647), progesterone 10 μl (25 MG / ML 에탄올은 같은 MG APO - 트랜스페린 (시그마 T2252) 저장된 40 ML의 Neurobasal -20에서 aliquots ° C. 시그마 P8783), 64 MG putrescine (시그마 P7505), 그리고 나트륨 selenite (-20에서 aliquots로 저장 PBS에서 30 μm의, ° C, 시그마 S5261) 40 μl. -20 ° C.에 aliquots로 사토 재고 솔루션, 그리고 상점을 소독 필터
신경 도금 매체 (PM) : Neurobasal 매체, 2퍼센트 B27, 2mM 글루타민 (100x 주식, -20 ° C, Invitrogen 25,030에 저장된 aliquots), 25μM 글루탐산 (100 주식, -20 ° C에 저장된 aliquots), 1 % 페니실린은 / 스트렙토 마이신.
신경 세포의 문화 매체 (CM) : Neurobasal 매체, 2퍼센트 B27, 2mM 글루타민 (100x 주식, -20 ° C에 저장된 aliquots), 1 % 페니실린 / 스트렙토 마이신.
5 FdU 주식 : Neurobasal 매체 100x 재고, 1mM 5 - 플루오로 - 2' - deoxyuridine (시그마 F0503) and1mM 유리딘 (시그마 U3003). 필터 -20 ° C.에 살균 및 aliquots로 저장
Papain의 소화 솔루션 (이전 해부 신선한 확인) :
- 4ml DM의 3.2 MG L - 시스테인 (시그마 C - 7352)를 디졸브
- 37 1N NaOH (산도 검사 스트립에서 테스트)와 물을 욕조에 장소 주변 7.4으로 산도를 조절 ° C
참고 : 오른쪽 조직 소화하기 전에 다음 단계를 (아래 참조) 수행합니다. - 20 단위 / ML의 최종 농도 papain 추가
- (0.22mm) 소독 필터, 그리고 37 물 목욕에서 개최 ° C
트립신 억제제 솔루션 (이전 해부 신선한 확인) :
- 20ml DM 0.2 g 트립신 억제제 (시그마 T7295)를 디졸브
- 산도를 확인하고 1 N NaOH로 ~ 7.4으로 산도를 조절
- 소독 필터, 그리고 37 물 목욕에서 개최 ° C
뇌 해부
설정 :
- 소독 집게와 가위
- 70 % 에탄올
- 클린 조직 종이와 diap벤치에 어 패드
- 벤치에서 자궁과 태아를위한 얼음처럼 차가운 DM과 10cm의 페트리 요리
- 해부 현미경에서 얼음 플랫폼
- 얼음 DM과 2-3 6cm 요리
- 37 ° C의 물을 욕조에 따뜻한 PM
- 임신 스프 라그 - 돌리 귀하의 기관 애니멀 케어의 승인 절차에 따라 쥐 (E16) 우리위원회 (IACUC)를 안락사
- 복부에 기저귀 패드와 ...의 난소를 제거하다 알코올에 쥐하다
- V 모양의 절개는 피부를 절단하기 위해 복부 피부와 가위를 잡아 핀셋을 사용하여
- 피부를 따로 확산과 근육 계층을 통해자를 다른 소독 핀셋과 가위를 사용
- 배아 주머 니나의 사슬을 추출하고 얼음처럼 차가운 DM을 포함 10cm 접시에 그들을 전송
- microdissection 가위를 사용하면, 신중하게 각각의 배아에서 색 및 뇌 각 배아를 제거하고, 장소는 얼음 플랫폼에 DM과 함께 깨끗한 10cm 접시에 두뇌를 해방
- 판상 후드와 해부 현미경 아래 midbrain / hindbrain 섹션을 제거하고 meninges를 제거하는 미세 집게를 사용하여 얼음 팩 DM으로 새 6cm 접시에 청소 cortices / 해마를 전송
참고 :이 단계에서, 조직은 효소 분해를위한 준비가되었습니다. - papain과 트립신 억제제 솔루션과 필터 소독 만들기
- cortices에서 DM 초과 / hippocampi을 제거
- 준비 papain의 소화 솔루션의 4ml 추가
- 50ml 튜브에 모든 내용을 전송 37에서 물을 욕조에 팔콘 튜브를 삽입 ° C 정확히 5 분
- 피펫과 papain 솔루션을 제거
- 2-3 분 5ml 트립신 억제제 솔루션, 소용돌이 관, 37에서 물이 욕조에서 개최 ° C 추가
- 트립신 억제제 솔루션을 제거
- 단계 13 14 세 번 반복
- 20ml 따뜻한 PM 추가
- 모든 대단히 짧은 시간이 (~ 20-30 회)까지 사라졌습니다 씹다
- 7min에 대한 100xg에서 원심 분리기
- 10ml PM의 펠렛을 Resuspend 및 원심 분리에 의해 두 번 씻어
- 일반적인 신경 세포 배양 또는 총체적 문화 NBB27/DMEM에 10ml PM에 펠릿을 Resuspend
- 70μm 셀 sieves 통해 세포 패스
- 라이브 세포를 카운트
- 일반적인 신경 세포 배양을위한 세포를 아래에 설명된이나 접시 등 총체적 문화로 이동
참고 :이 단계에서 매우 풍부한 신경 세포 배양은 실험 목적에 따라 2 200-640 셀 / mm의 밀도에서 PDL - 코팅 접시에 dissociated 세포를 도금하여 얻을 수 있습니다. 세포 (~ 2 4h) 첨부 후, 따뜻한 PM과 매체를 바꿉니다. 일 4 시간 연장 기간에 대해 culturing 경우, 따뜻한 CM과 함께 매체의 절반을 교체하십시오. 고도의 연결을 문화, mitotic 억제제를 정화를위한 5 FdU (최종 농도 10 μm의)이 (DIV2 - 3 동안 즉,) 비의 연결을 세포 증식을 억제하기 위해 DIV2에 추가할 수 있습니다. 2 일 CM에서 복구 후에, 세포는 맥박이 완전한 매체 변경 다음 다른 이일 (DIV 6-7) 5 - FdU로 다시 처리됩니다. 그 이후, 신선한, 따뜻한 CM 모든 3~4일과 매체의 절반을 교체하십시오. 최대 4 주 동안 뉴런이 가능한 있습니다.
합산 준비와 도금
- 2x10 6 셀 / ML의 밀도에 1X 사토 10ng/ml CNTF 및 10μM forskolin을 포함 NBB27/DMEM 매체에 dissociated 세포를 일시 중지
- uncoated 6 잘 플레이트의 각 우물에 세포 현탁액의 2ml을 전송
- 3 박에 대한 문화. 매일, 부드럽게 한번 P1000 Pipetman를 사용하여 셀을 resuspend
참고 : 세포 집합체 (그림 1)을 형성 시작합니다. - 집계 도금 전날에 코팅 플레이트 / Matrigel과 coverslips :
- 주식 Matrigel (성장 인자는 감소, BD Biosciences 354230) 얼음 추위 DMEM과 1시 20분을 희석
참고 : Matrigel의 aliquots가 제조 업체 절차에 따라 작성되어야합니다. 모든 팁, Eppendorf 튜브 및 재고 aliquots을 만들기위한 솔루션 Matrigel 중합을 피하기 위해 추운해야합니다. Matrigel의 Aliquots는 -80 ° C에서 보관 및 4 ° C.에 해동 아르 - 37 ° C 배양기에서 하룻밤 희석 Matrigel 솔루션의 300μl/well와 코트는 이전 PDL - 코팅 coverslips
- 따뜻한 PBS로 세척 후 살균 따뜻한 ddH 2 O와 접시를 세척하고 인큐베이터에있는 접시를 두십시오.
- 주식 Matrigel (성장 인자는 감소, BD Biosciences 354230) 얼음 추위 DMEM과 1시 20분을 희석
- 골재 형성 후 3 일, 부드럽게 50ml 팔콘 튜브에 200μm 메쉬를 통해 중지를 다시 세포를 resuspend 및 체. 집계 중력 (~ 3 - 5 분)에 의해 튜브의 바닥에 정착하도록 허용
- 조심스럽게 뜨는을 제거
- 미디어를 추가 부드럽게 집계를 resuspend하고 다시 쉬라 구. 죽은 세포, 개별 세포와 찌꺼기를 제거하려면이 절차를 여러 번 반복합니다. 뜨는 아직 집계되지 않은 세포와 debri를 포함 여부를 확인하도록 현미경을 사용하여에스
- 부드럽게 같은 NBB27/DMEM 매체에서 집계 (그림 1) resuspend 및 집계 계산
- 25-30 주위 aggreggats/50ul로 집계의 밀도를 조절
- 도금에 대한 2ml Eppendorf 튜브에 집계 정지 전송 aliquots (500 1000μl)
참고 : 집합체가 튜브의 바닥에 정착하는 경향이 있기 때문에 그것이 도금에 대한 총체적 정학의 여러 튜브를 만들기 위해 매우 중요합니다. 부드럽게 자주 각 coverslip에 도금 집계 비슷한 번호를 보장하기 위해 코팅 coverslips 또는 문화 접시에 그들을 심는 전에 집계를 resuspend. - 인큐베이터에서 Matrigel - 코팅 coverslips을 포함하고있는 문화 판을 가져가라. 각 우물에서 솔루션을 제거, 따뜻한 PBS 및 ddH 2 O와 coverslips을 씻어 후 건조 짧게. 그들은 골재 시딩을 위해 지금 준비가되어
- 그들이 시딩 전에 균일하게 배포할 수 있도록 집계 중지를 포함한 튜브를 반전. 각 coverslip의 중심에 집계 정지 50μl를로드하고, 부드럽게 집계는 coverslip에 균일하게 연결할 수 있도록 더 이상 방해하지 않고 인큐베이터에 다시 접시를 넣어
참고 : 집합체의 밀도는 매우 중요합니다. 집합체가 씨앗을 품고있다면 너무 서로 가까이에 또는 시딩 밀도가 높은 경우, 그들의 성장으로 함께 병합하는 경향이있다. - 나중에 또는 이른 다음날 아침마다 잘 4-6 H에 추가 DMEM/NBB27medium (500 μl)를 추가
- 집계 문화를 유지하려면, 반은 모든 3~4일 매체를 변경합니다. 매체를 변경하면, 집계를 방해하지 않도록주의하고 이것은 부드럽게 잘 측면 벽을 따라 미디어를 추가하여 이루어집니다.
참고 : 몇 시간 판에 부착된 집계 후 집계에서 neurite 가지를 볼 수 있습니다. Axons 처음 2 주 동안 빠르게 성장하고 집계 (그림 2) 사이의 풍부한 연결을 형성합니다. Glial progenitors 밖으로 집계의 반경 마이 그 레이션 및 astrocytes과 성숙 oligodendrocytes로 시간이 지남에 따라 구별.
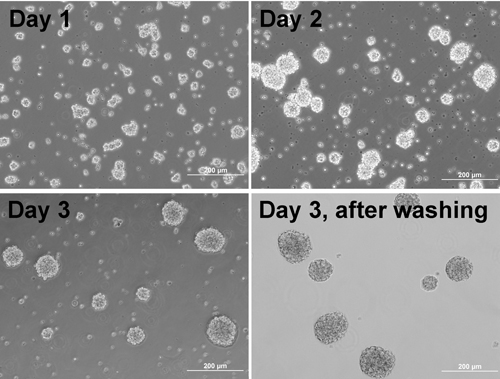
그림 1. 세정 후 다른 일 집계에 합산을 형성 세포의 위상 콘트라스트 이미지를 표시합니다.

2 12일 Matrigel - 코팅 coverslips에 씨뿌린 후 집계 문화 그림 2. 위상 콘트라스트 이미지를 표시합니다.
토론
초기 연구는 시냅스 및 회전 - 중재 부유 집계 문화 1 성숙 myelin 형성을보고했다. 여기에 설명된 CNS의 집계 문화 시스템은 세포 개발, 마이 그 레이션 및 체외에서 분화의 분석을 촉진하기 위하여 전통적인 2D 문화의 편의와 입체 집계에 multipotent 전구 세포의 혈청이없는 성장을 결합한 제품입니다. 체제가 신경 전구체에 대한 수정하여 사용할 수 있습니다 세포 연구 및 신경 ?...
감사의 말
이 연구는 텍사스 A & M 대학에서 시작 펀드로 일부 자금되었습니다
참고문헌
- Matthieu, J. M. Myelination in rat brain aggregating cell cultures. Neuroscience. 3, 565-56 (1978).
- Chen, Y. i. n. g. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat. Protocols. 2, 1044-10 (2007).
- Watkins, T. A., Emery, B., Mulinyawe, S., Barres, B. A. Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron. 60, 555-55 (2008).
- Svenningsen, A. F., Shan, W. e. i. -. S. o. n. g., Colman, D. a. v. i. d. R., Pedraza, L. i. l. i. a. n. a. Rapid method for culturing embryonic neuron-glial cell cocultures. Journal of Neuroscience Research. 72, 565-56 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유