Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
In utero électroporation suivie par la culture neuronale primaire pour étudier la fonction des gènes dans un sous-ensemble des neurones corticaux
Dans cet article
Résumé
Électroporation in utero est une méthode utile pour transfecter des cellules progénitrices neuronales in vivo. Selon le placement des électrodes et la période de développement de l'électroporation, certains sous-ensembles de cellules corticales peuvent être ciblées. Cellules ciblées peuvent ensuite être analysées in vivo ou in vitro des effets de l'altération génétique.
Résumé
Dans l'étude in vitro de cultures primaires de neurones permet une analyse quantitative de la croissance des neurites. Afin d'étudier comment des altérations génétiques affectent excroissance processus neuronaux, shRNA ou des constructions d'ADNc peuvent être introduits dans les neurones primaires via la transfection chimiques ou transduction virale. Cependant, avec des cellules primaires du cortex, une piscine hétérogène de types de cellules (neurones glutamatergiques de différentes couches, les neurones inhibiteurs, les cellules gliales) sont transfectées en utilisant ces méthodes. L'utilisation d'électroporation in utero à introduire les constructions d'ADN dans le cortex des rongeurs embryonnaire permet de certains sous-ensembles de cellules d'être la cible: alors que l'électroporation de début des cibles du cortex embryonnaire couches profondes du cortex, électroporation à la fin de timepoints embryonnaire cibles couches les plus superficielles. En outre, le placement des électrodes différentielles travers les têtes des résultats individuels des embryons dans le ciblage des régions dorso-ventrale par rapport médial-latéral du cortex. Après électroporation, les cellules transfectées peuvent être disséquées, dissocié, et plaqué in vitro pour l'analyse quantitative de la croissance des neurites. Ici, nous fournissons une méthode, étape par étape pour mesurer quantitativement excroissance processus neuronaux sous-ensembles de cellules corticales.
Le protocole de base pour électroporation in utero a été décrite en détail dans deux articles JoVE d'autres du laboratoire Kriegstein 1, 2. Nous allons donner un aperçu de notre protocole d'électroporation in utero, en se concentrant sur les détails les plus importants, suivie par une description de notre protocole qui s'applique électroporation in utero à l'étude de la fonction des gènes dans le processus d'excroissance neuronale.
Protocole
Le protocole de base pour électroporation in utero a été décrite en détail dans un autre article JoVE du laboratoire Kriegstein 1, 2. Cette technique a été initialement décrite dans les 3 Osumi laboratoire et notre protocole est basé sur celui développé dans le laboratoire LoTurco 4. Nous allons donner un aperçu du protocole notre pour électroporation in utero d'embryons de rats, en se concentrant sur les détails les plus importants, suivie par une description de notre protocole qui s'applique électroporation in utero à l'étude de la fonction des gènes dans le processus d'excroissance neuronale.
1. Électroporation in utero
- Préparation de l'ADN et des aiguilles de chargement
La première étape dans électroporations utero est de concevoir votre expérience pour déterminer ce que vous voulez constructions d'ADN à injecter. Cette méthode est utile pour les deux misexpressing ou abattre des gènes d'intérêt. Si vous avez décidé de misexpressing ou surexprimant un gène, veillez à utiliser un promoteur qui est actif dans les cellules précurseurs des neurones. Nous recommandons au promoteur CAGGS, qui consiste en la bêta-actine de poulet promoteur et l'enhancer du CMV 5. Puisque seule une petite partie des cellules sont transfectées en utilisant électroporation in utero, il est essentiel d'inclure un plasmide codant pour une protéine fluorescente comme la GFP de sorte que vous pouvez suivre ces cellules qui ont été avec succès électroporé. Pour le plasmide codant pour la GFP, nous recommandons de préparer l'ADN à une concentration de 0,5 pg par microlitre. Pour les constructions shRNA, nous avons constaté que de 0.5 à 1.0 ug par des résultats efficaces uL dans assommer de votre gène d'intérêt. Pour surexpression ou misexpression, nous utilisons entre 1,0 et 3,0 mg par microlitre, selon la taille du gène et le niveau d'expression que l'expérience des appels. ADN sont préparés en utilisant un kit Qiagen de préparation sans endotoxine, et dilué dans 1 x PBS. Nous injecter environ 0,5 à 1,0 l par le cerveau embryonnaire, donc, pour une portée d'animaux nous préparons 10 uL du mélange d'ADN pour l'injection. Nous ajoutons 1 pl de vert rapide à l'ADN de sorte que nous pouvons suivre l'ADN injecté.
Tirer les aiguilles à la forme correcte est une étape critique. Walantus et coll. Utilise un système différent pour la prestation de l'ADN et donc leur préparation aiguille est également différente slighly 1,2, puis les nôtres. Les paramètres que vous utilisez pour tirer votre aiguilles dépendra de la marque de l'aiguille extracteur que vous avez. Nous utilisons le modèle 750 de David Kopf. Les paramètres que nous utilisons sont: Série 1: 9,0, Heat 2: 0, Soleniod: 0, taille filament 3,0 mm, Proximité chauffe: 3 mm, Durée: 10 sec. Une fois retiré, nous avons réduit nos aiguilles avec une lame de rasoir à un angle de ~ 45 degrés tels que la distance de la plus grande partie de l'ouverture à la pointe est de 11 mm. Nous avons ensuite la charge de l'ADN de l'extrémité arrière de l'aiguille. Nous avons ensuite remplir l'espace restant dans l'aiguille avec de l'huile de maïs. Pour l'injection d'ADN, nous utilisons un Picospritzer III. Selon la conique exacte qui est coupé pour chaque aiguille, nous avons mis l'Picospritzer 4,0 à 6,0. Nous utilisons une pédale pour fournir l'air sous pression qui expulse l'ADN de l'aiguille. - Préparation pour la chirurgie des animaux
Nous utilisons exempts d'agents pathogènes rats Sprague-Dawley exclusivement pour ces chirurgies. Plusieurs autres laboratoires utilisent des souris de différentes génotypes ainsi. Ici, nous décrivons montrer notre protocole pour l'électroporation de E15 embryons de rat, mais électroporation in utero est systématiquement réalisée chez le rat entre les âges de la E13 et E18. Alors que l'électroporation stade précoce les cibles les couches profondes du cortex, électroporations ultérieurement cibler les couches les plus superficielles.
Les animaux sont donnés une dose pré-opératoire de la buprénorphine (0,05-0,1 mg / kg) avant la chirurgie commence. Il ya plusieurs options pour anesthésier l'animal. Walantus et coll. Utilise l'inhalation isofuorane, alors que nous utilisent régulièrement l'injection intrapéritonéale de kétamine (40-80 mg / kg) et de xylazine (5-10 mg / kg) 1,2. Un pincement de l'orteil doit toujours être effectuée pour s'assurer que les animaux sont complètement anesthésiés et ne répond pas. Les animaux sont maintenus sur un coussin chauffant pendant toute la procédure chirurgicale.
La fourrure de l'animal est rasé dans la région de l'incision, et lavée trois fois avec de l'éthanol suivie par trois fois avec de l'iode. Une incision est faite dans la peau juste latérales à la ligne médiane, suivie par une incision dans le muscle. Les cornes utérines sont exposés très attentivement. Ils sont légèrement taquiné hors de la cavité du corps en utilisant vos doigts. Gardez embryons hydraté avec du PBS stérile pendant qu'ils sont en dehors de la cavité du corps. - L'ADN par injection et l'électroporation
Lorsque vous commencez l'exécution de ces chirurgies, le plus difficile est de se familiariser avec l'endroit où vous devez vous injecter de l'ADN, afin que vous remplissez les ventricules latéraux, et s'habituer à quelle profondeur vous vous injectez votre aiguille afin de frapper la région correcte. Les embryons sont manipulés délicatement avec les doigts afin que vous puissiez identifier où la tête est, et si vous regardez attentivement, vous pourrez voir la suture médiane. Cela sert comme point de repère général que vous pouvez utiliser pour déterminer où le ventricule latéral est situé. Nous injectons de l'ADN à travers la paroi utérine et dans le ventricule latéral. Nous utilisons une pédale pour contrôler l'injection de l'ADN - impulsions multiples de l'ADN sont effectués jusqu'à ce que le ventricule latéral est rempli avec de l'ADN / mélange colorant. Nous avons ensuite placer les électrodes sur les aubes de chaque côté de la tête de l'embryon et utiliser une autre pédale pour livrer le pouls à travers la tête de l'embryon. Le placement des électrodes est essentielle pour déterminer dans quelle région du cortex est électroporé. Comme l'ADN est chargé négativement, l'ADN se déplacent vers l'électrode positive quand une charge est dissipée à travers la pagaie. Selon l'emplacement exact des électrodes, différents sous-ensembles de cellules seront ciblés. Nous avons régulièrement placer les électrodes positives près des positions dorsale-médiale à travers le cerveau. Cependant, le laboratoire a montré que LoTurco magnifiquement si vous placez les électrodes dans plus ventrale régions latérales du cerveau, vous pouvez cibler les cellules des cellules de frontière et a frappé cortico-striatale du flux latéral corticale 6. Chaque embryon peut être électroporées, et différentes combinaisons de constructions d'ADN peuvent être utilisés dans chaque embryon. - Sutures et soins post-opératoires
Après électroporation de tous les embryons, les cornes utérines sont soigneusement remis à la cavité du corps, et la fois la couche musculaire et la peau sont suturés. La technique pour cela est décrit dans Walantus et al 1,2. Les animaux sont surveillés en permanence jusqu'à leur remettre de l'anesthésie, et la buprénorphine analgésique (0,05-0,1 mg / kg) est administré toutes les 8-12 heures.
2. La culture électroporées neurones corticaux
- La récolte et la dissection des cerveaux électroporées région électroporées
Pour les analyses in vivo suivants électroporation in utero, les animaux peuvent être récoltées à n'importe quel point l'heure de 24 heures après l'électroporation au début après la naissance à l'âge adulte. Cependant, les neurones en culture primaire où nous récoltons les 24 heures suivant l'électroporation au E16. A cette époque, les embryons sont électroporées exprimer des niveaux détectables de la GFP.
Les animaux sont euthanasiés par inhalation de dioxyde de carbone et décapitation rapide. Les embryons sont disséqués hors de l'utérus et placés dans HBSS avec des cations divalents, en gardant la trace des embryons ont été électroporés avec laquelle plasmides d'ADN. Il est essentiel d'utiliser HBSS filtré, tubes stériles et des plaques, et des outils autoclave pour la dissection. Le cortex est disséqué et les méninges enlevé en utilisant un microscope dans une hotte. Ces cortex sont ensuite observés sous un microscope à dissection avec la capacité de visualiser la GFP. Régions GFP-positives du cortex sont identifiés, et nous ue une paire de ciseaux pour découper Vanna les régions GFP-positives dans le cortex. Ces pièces sont placées dans HBSS sans cations divalents dans un tube de 15 ml conique. - La dissociation et le placage neurones
Une fois que toutes les régions GFP-positives sont disséqués, HBSS est remplacée par la trypsine à 0,25%, et incubées à 37 degrés pendant 5 minutes. La trypsine est retiré, remplacé par les médias placage (DMEM + 5% de FBS + Penn / strep glutamine +), et trituré 5-7 fois de dissocier les cellules. Les volumes utilisés dépendent de la quantité de tissu. Les cellules dissociées sont ensuite étalées sur CC2 diapositives chambre de revêtement. Pour deux lames de chambre, nous avons la plaque 200,000-350,000 cellules par chambre dans un volume de 1,5 ml de milieu de placage. Après 4 heures, les médias placage est aspiré et remplacé par 1,5 ml de milieu de culture neuronale (Neurobasal médias + B27 + supplément glutamax + gentamycine) par chambre.
3. Analyser l'excroissance neuronale processus
- Fixation et immunomarquage cultures
Afin de mesurer court terme effecs de la manipulation génétique de ces cellules, nous récoltons les neurones primaires après trois jours in vitro. Si les neurones primaires doivent être cultivés plus pour des analyses supplémentaires, la moitié des médias doivent être remplacés tous les trois jours. Pour la fixation des cultures, nous aspirer les médias depuis les chambres, et de fixer les neurones dans paraformaldhyde 4% pendant 15 minutes. Après fixation, les cellules sont lavées deux fois dans du PBS et ensuite mis en solution de blocage (sérum d'âne 2% avec 0,1% de Triton X-100 dans du PBS) pendant une heure. Les cellules sont ensuite incubées dans l'anticorps primaire pendant 1 heure. Pour les analyses d'excroissance neuronale processus, nous utilisons des anticorps anti-bêta tubululin pour identifier les neurones - immunomarquage bêta tubuline II étiquettes des neruonal cellule du corps, les dendrites et les axones. Les cellules sont ensuite lavées trois fois dans du PBS pendant cinq minutes, puis incubés en Cy3 anti-souris pendant 1 heure, suivi par des lavages PBS trois de plus, une contre-coloration des noyaux au DAPI et le montage. - Mesure NELongueur urite
Images de la GFP positives, les neurones tubuline bêta-III positifs sont acquis sur une Axioskop Zeiss avec un système MC100 caméra. Plusieurs variables peuvent être examinés dans ces cellules GFP-positives, notamment la durée de tous les neurites, la longueur de la plus longue des neurites, ramification des neurites, la taille du corps cellulaire, etc Nous avons utilisé cette méthode pour analyser les processus d'excroissance neuronale lors de renverser ou de surexpression des gènes relatives au développement neurologique et la neurodégénérescence, avec un accent sur la longueur processus neuronaux. Afin de mesurer les processus neuronaux excroissance, nous utilisons AxioVision LE 4.4 du logiciel (de Zeiss). Dans ce logiciel, il ya une option pour sélectionner le "schéma" de l'outil. Grâce à cet outil, vous pouvez utiliser la souris de votre ordinateur pour repérer toute la longueur de chacun des processus neuronaux. Il est essentiel de définir l'objectif que vous utilisez afin d'obtenir une mesure précise de votre neurites. Pour ces analyses, nous utilisons habituellement un objectif 20x.
4. Les résultats représentatifs
Nous avons constaté que la taille des rats Sprague-Dawley litières varie entre 6 et 14 embryons. En général, nous électroporation de tous les embryons. Chaque embryon peut être une électroporation avec une combinaison différente d'ADN. Toutefois, nous avons l'habitude électroporation au moins quatre cerveaux avec le même état et de la piscine avant dissociant ces cerveaux et le placage.
Nous avons constaté que cette technique d'environ 75% de cerveaux électroporées sont ciblés pour la région désirée du cortex, que ce soit dorsale du cortex médial ou ventral latéral (figure 1). En outre, nous avons trouvé électroporations tôt à neurones cibles E13-14 couches profondes comme TBR1 neurones positifs VI couche, tandis électroporations tard cible positive CTIP2, TBR1 cellules négatives couche V, et plus tard encore cibler électroporations Brn2 positifs couche II / III cellules. Une excellente description de différents marqueurs et l'explication des spécifications sous-type de neurones dans le cortex en trouve un article de Moleneaux et al 7. La figure 2 montre coupes coronales du cerveau soit une électroporation à jour embryonnaire 15,5 ou 17,5 et récoltées à jour postnatal 5. Montré dans le rouge est immunocoloration pour Oct6. Vous pouvez immunocoloration des marqueurs dans la culture de confirmer ce que les populations couche de cellules que vous avez ciblé. Nous avons constaté que vous pouvez vous attendre à cibler la population des cellules mêmes couches de cellules dans chaque embryon de la même portée (en d'autres termes, le ciblage dépend du timepoint embryonnaire plutôt que sur d'autres variantes techniques).
Dans la culture, le pour cent des cellules GFP-positives qui sont peut varier considérablement selon la façon conservatrice vous êtes quand dissection de la région GFP-positives (figure 3). Cependant, même lorsque nous sommes très conservateurs et disséquer que le patch GFP positive des cellules, le pourcentage le plus élevé que nous observons est de 5-10% - bien que vous êtes dissection de la région du cortex qui a été électroporées, les cellules en une seule couche sera être ciblées. Cette effciency transfection faible est utile pour identifier quels processus appartiennent à la cellule electoporated que vous analysez. Cellules Placage à ce densité plus élevée contribue à avoir heathier cultures, cependant, il est difficile de discerner ce qui appartient à quelle procédure corps cellulaire dans les cellules GFP négative (figure 3).
Si vous avez du mal à voir l'ensemble des processus fine des cellules par électroporation, vous pouvez soit augmenter la concentration d'ADN GFP que vous êtes électroporation pour augmenter l'expression de la GFP, ou vous pouvez immunocoloration les cellules dissociées en utilisant un anticorps anti-GFP (chez Invitrogen ) avec un anticorps Cy2 secondaire.

Figure 1. E15.5 rats Sprague-Dawley ont été électroporés avec le plasmide GFP et récolté trois jours plus tard. Basé sur le placement des électrodes, des différentes régions du cortex seront ciblés. AF montrent fluorescence de la GFP dans le cerveau tout entier.
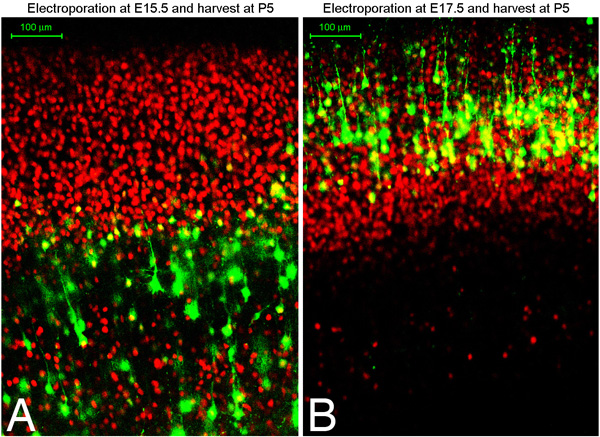
Figure 2. E15.5 (A) ou E17.5 (B) rats Sprague-Dawley ont été électroporés avec la GFP plasmide et la récolte à jour postnatal 5. Les cerveaux ont été fixés, sectionnés coronaire utilisant un vibratome (100 sections microns), et immunocolorées pour Oct6 (rouge). A et B montrent des images de sections immunocolorés confocale.
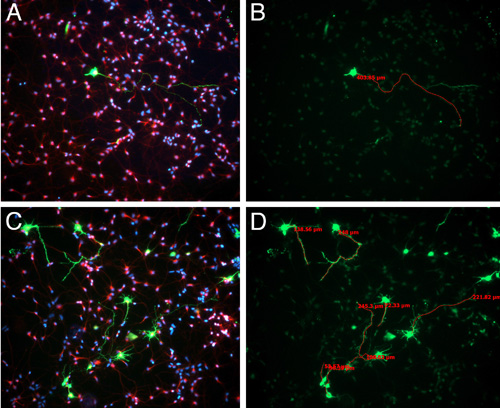
Figure 3. E15.5 rats Sprague-Dawley ont été électroporés avec le plasmide GFP. 24 heures suivant l'électroporation, les cerveaux ont été récoltés et GFP-positives, les régions électroporées ont été disséqués et dissociées, comme décrit dans la vidéo. Après 3 jours in vitro, les cellules ont été fixés et immunocolorées pour BIII-tubuline (en rouge) et la coloration des noyaux au DAPI (bleu) (A, C). La longueur de la plus longue des neurites a été mesurée à l'aide du logiciel AxioVision(B, D).
Discussion
Dans l'étude in vitro de cultures primaires de neurones permettent des analyses quantitatives des neurites. Afin d'étudier comment des altérations génétiques affectent excroissance neuronale processus, des constructions ou des shRNA misexpression peuvent être introduits dans les neurones primaires via la transfection chimiques ou transduction virale. Cependant, avec des cellules primaires du cortex, une piscine hétérogène de types de cellules (neurones glutamatergiques de différentes couches, ...
Déclarations de divulgation
Remerciements
Les auteurs tiennent à remercier Joseph LoTurco et Dennis Selkoe pour des discussions utiles sur cette technique. Les auteurs remercient les donateurs de la Fondation d'aide de la Santé, pour le soutien de cette recherche.
matériels
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Cortical Neuron Preparation | ||||
| Dissection Media: | ||||
| 10X Hanks' Balanced Salt Solution (HBSS) (Ca+2 /Mg +2 free) | Gibco | 14185-052 | ||
| 10X Hanks' Balanced Salt Solution (HBSS) (with Ca+2 /Mg +2 ) | Gibco | 14065-056 | ||
| 1M HEPES pH 7.4 | Gibco | 15630-080 | ||
| Dishes and Vials: | ||||
| 100 x 15 mm Petri Dishes | Fisherbrand | 08-757-12 | ||
| 60 x 15 mm Petri Dishes | BD Falcon | 351007 | ||
| 15 mL conical vial | Sarstedt | 62-547-205 | ||
| 50 mL conical vial | Sarstedt | 62-554-205 | ||
| Dissection Tools: | ||||
| Scissors | Fine Science Tools | 91402-12 | ||
| Standard Forceps | Fine Science Tools | 11000-12 | ||
| Curved Forceps | Fine Science Tools | 11273-20 | ||
| Fine Forceps | Fine Science Tools | 11255-20 | ||
| Vannas spring scissors | Fine Science Tools | 15000-00 | ||
| Miscellaneous: | ||||
| .25% Trypsin-EDTA | Gibco | 25200 | ||
| Reichert Bright-Line Hemacytometer | Hausser Scientific | 1490 | ||
| Hand-Held Tally Counter | Sigma | Z169021 | ||
| Plating Medium: | ||||
| Dulbecco's Modified Eagle Medium (D-MEM) | Gibco | 11960-051 | ||
| Fetal Bovine Serum | Sigma | F4135 | ||
| Penicillin-Streptomycin | Gibco | 15140 | ||
| L-glutamine | Gibco | 25030 | ||
| Growth Medium: | ||||
| NEUROBASAL Medium | Gibco | 21103-049 | ||
| B-27 Serum-Free Supplement | Gibco | 17504-044 | ||
| GlutaMAX -I Supplement | Gibco | 35050-061 | ||
| Gentamicin Reagent Solution | Gibco | 15750-060 | ||
| Immunostaining: | ||||
| Fixative, Washes, and Blocking Buffer: | ||||
| Paraformaldehyde | Sigma | P6148 | ||
| Phosphate Buffered Saline | Sigma | P4417 | ||
| Triton X-100 | Sigma | T9284 | ||
| Donkey Serum | Jackson Immuno | 017-000-121 | ||
| Antibodies: | ||||
| beta-III tubulin antibody | Chemicon | MAB1637 | ||
| MAP2 antibody | Chemicon | AB15452 | ||
| Donkey Cy3 anti-mouse | Jackson Immuno | 715-166-151 | ||
| Donkey Cy2 anti-chicken | Jackson Immuno | 703-226-155 | ||
| DAPI | Gibco | D3571 | ||
| Slide Preparation: | ||||
| CC2 Coated Two-Chamber Slides | Lab-Tek | 154852 | ||
| Fluorescent Mounting Media | KPL | 71-00-16 | ||
| 24 x 60 mm Micro Cover Glasses | VWR | 48393-106 | ||
| Clear nail polish | Electron Microscopy Sciences | 72180 | ||
| Electroporation: | ||||
| Ketamine | Henry Schein | 995-2949 | ||
| Xylazine | Henry Schein | 4015809TV | ||
| buprenorphine | Henry Schein | 1118217 | ||
| Picospritzer III | Parker | |||
| BTX square wave electroporator | Fisher | BTXECM830 | ||
| Tweezertrodes, 7 mm, platinum | Harvard Apparatus | 450488 |
Références
- Walantus, W., Castaneda, D., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E15 mouse embryos. J Vis Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J Vis Exp. , (2007).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70 (4-5), 155-1562 (2002).
- Bai, J., Ramos, R. L., Ackman, J. B., Thomas, A. M., Lee, R. V., LoTurco, J. J. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nat Neurosci. , 1277-1283 (2003).
- Okada, A., Lansford, R., Weimann, J. M., Fraser, S. E., McConnell, S. K. Imaging cells in the developing nervous system with retrovirus expressing modified green fluorescent protein. Exp Neurol. 156 (2), 394-406 (1999).
- Bai, J., Ramos, R. L., Paramasivam, M., Siddiqi, F., Ackman, J. B., LoTurco, J. J. The role of DCX and LIS1 in migration through the lateral cortical stream of developing forebrain. Dev Neurosci. , 144-156 (2008).
- Molyneaux, B. J., Arlotta, P., Menezes, J. R., Macklis, J. D. Neuronal subtype specification in the cerebral cortex. Nat Rev Neurosci. , 427-437 (2007).
- Young-Pearse, T. L., Bai, J., Chang, R., Zheng, J. B., Loturco, J. J., Selkoe, D. J. A Critical Function for -Amyloid Precursor Protein in Neuronal Migration Revealed by In Utero RNA Interference. J Neurosci. 27, 14459-14469 (2007).
- Young-Pearse, T. L., Chen, A. C., Chang, R., Marquez, C., Selkoe, D. J. Secreted APP regulates the function of full-length APP in neurite outgrowth through interaction with integrin beta1. Neural Develop. 3, 15-15 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon