Method Article
FISH para diagnóstico pré-implantação Genética
Resumo
Este artigo descreve a seleção de sondas adequadas para uma única célula FISH, técnicas de espalhamento de núcleos de blastômeros, e hibridização in situ e marcando sinal, aplicada ao diagnóstico genético pré-implantação (PGD) em um ambiente clínico.
Resumo
Pré-implantação de diagnóstico genético (PGD) é uma alternativa criada para diagnóstico pré-natal, e envolve a seleção de pré-implantação de embriões a partir de uma coorte gerada pela tecnologia de reprodução assistida (ART). Esta seleção pode ser necessária por causa da doença monogênica familiar (fibrose cística, por exemplo), ou porque um dos parceiros traz um rearranjo de cromossomos (por exemplo uma translocação recíproca de duas vias). PGD está disponível para casais que tiveram filhos anteriores afetadas, e / ou no caso de rearranjos cromossômicos, abortos de repetição ou infertilidade. Oócitos aspirados estimulação ovariana seguintes são fertilizados por em imersão in vitro do sêmen (FIV) ou por injeção intra-citoplasmática de um espermatozóide individual (ICSI). Pré-implantação de clivagem estágio embriões são biopsiados, geralmente pela remoção de uma única célula no dia 3 pós-fertilização, ea célula biópsia é testado para determinar o estado genético do embrião. Hibridização fluorescente in situ (FISH) no núcleo fixo de células biopsiadas com alvo específico sondas de DNA é a técnica de escolha para detectar o desequilíbrio do cromossomo associado com rearranjos cromossômicos, e para selecionar embriões do sexo feminino em famílias com doença ligada ao X para os quais existe nenhuma mutação específica do teste. FISH também tem sido usado para embriões de tela para aneuploidia cromossômica espontânea (também conhecido como PGS ou PGD-AS), a fim de tentar melhorar a eficiência de reprodução assistida, no entanto, o valor preditivo deste teste usando a divulgação e técnica de FISH descritas aqui é provável que seja um nível inaceitavelmente baixo nas mãos da maioria das pessoas e não é recomendado para uso clínico de rotina. Descrevemos a seleção de sondas adequadas para uma única célula FISH, técnicas de espalhamento de núcleos de blastômeros, e hibridização in situ e marcando sinal, aplicado a PGD, em um ambiente clínico.
Protocolo
1. Lise e Espalhando um Núcleo de uma biópsia de blastômeros
- Tampão de lise celular para as células se espalhando (0,2% Tween20 em 0,01 M HCl, pH 2.0) deve ser preparada 24 horas de antecedência e armazenado a -20 ° C. Prepare 100 mL e 20 mL de filtro para um recipiente estéril 30 mL universal, utilizando uma seringa estéril 20 ml e filtrar seringa. Dispense um alíquotas mL em 10-15 1,7 mL tubos de microcentrífuga estéril, fechar e rotular os tubos antes do congelamento. É recomendável ter dois lotes diferentes é o uso, o novo lote eo lote anterior, que foi testado e pode ser usado se o novo lote é insatisfatória.
- Descongelar o tampão de lise em temperatura ambiente 30 minutos antes do procedimento de biópsia. Para fins práticos, a temperatura de trabalho será entre temperatura ambiente e temperatura da mão.
- Marcar um círculo pequeno (aproximadamente 5 mm de diâmetro) na parte de baixo um slide amina revestido (por exemplo, Genetix), utilizando uma caneta de diamante e pré-label o slide com o número do processo, número do slide único, e data da biópsia. Use um slide separado para cada blastômero em ordem numérica, e etiqueta com o número de embriões. As lâminas devem ser rotulados com um lápis duro, tais como 4H, e "apagados", com uma luva de látex para remover qualquer poeira de grafite.
- Coloque um pequeno volume de tampão de lise dentro do círculo.
- Transferir os blastômeros biopsiados no tampão de lise. Se necessário, adicionar tampão de lise dentro do círculo até que a célula começa a lise, a célula deve lisar completamente e citoplasma dispersar antes da seca buffer.
- Observe o núcleo para assegurar que ela permaneça dentro do círculo e não é perdida; se a célula não tem um núcleo ou tem múltiplos núcleos, a biópsia outra célula.
- Deixe o slide para ar seco em temperatura ambiente.
2. Hibridização In Situ de um único núcleo de blastômeros
- Prepare uma série de etanol (70, 90 e 100%) feita em água destilada estéril.
- Ligue e definir o bloco quente (por exemplo Hybaid Omnislide ou Vysis Hybrite) a 75 ° C.
- Sondas de descongelar, vortex, e centrifugar. Os reagentes devem ser testemunhado e verificou-se correta antes de fazer a mistura da sonda. Volumes da pipeta, conforme especificado pelo fabricante para fazer a mistura em uma sonda de 0,65 mL tubo de microcentrífuga estéril e vortex e centrifugar antes de usar. O volume total da mistura de sonda deve ser suficiente para permitir que 2 mL por núcleo a ser testado e arredondado para aproximação de 10 mL para permitir uma margem de segurança.
- Pré-lavagem das lâminas em frascos coplin usando tampão fosfato (PBS) (pH 7,0: 0,14 M NaCl, 3 mM KCl, 10 mM Na 2 HPO 4, 2 mM KH 2 PO 4) por 5 min à temperatura ambiente.
- Enxaguar as lâminas duas vezes em água destilada estéril.
- Desidratar as lâminas com a série de etanol (70, 90 e 100%) para cada 2 min à temperatura ambiente e ar seco. Garantir slides são totalmente imerso e se todo o pó de grafite flutua à superfície, banhe-se com um tecido limpo.
- Registrar a posição do núcleo dentro do círculo, visualizando com um microscópio de contraste de fase.
- Desidratam com etanol 100% por 2 min à temperatura ambiente e ar seco.
- Aplicar 2 mL da mistura de sonda, e cubra com um 9 x 9 mm lamela (um quarto de um jovem de 18 x 18 mm no.1 lamela).
- Selar as bordas da lamínula com borracha de cimento (por exemplo, Gum Cow; Proofing Cow).
- Codenature as lâminas sobre um bloco quente a 75 ° C por 5 min, e depois hibridizam os slides durante a noite (16-20 h) em câmara úmida a 37 ° C. Mistura sonda que consistem inteiramente de sondas centrômero (ou seja, para casos ligados ao sexo) vai dar um resultado satisfatório após 60 min de hibridização.
- Prepare um banho de água com jarros suficiente coplin e calor a 71 ° C.
- Preparar um padrão de citrato 0.4x salina (SSC) solução de lavagem rigorosa (pH 7,0 a 71 ° C, 0,06 M NaCl, 6 mM C 6 H 5 Na 3 O 7 .2 H 2 O) e calor em banho-maria.
- Pipetar 50 mL de lavagem rigorosa por coplin jar requeridos e verificar se a temperatura é de 71 ° C imediatamente antes de usar usando um termômetro limpo.
- Remova cuidadosamente o cimento de borracha de cada slide e enxaguar a lamela usando% SSC/0.05 4x Tween20 (pH 7,0) em temperatura ambiente.
- Lavar as lâminas na lavagem SSC 0.4x rigorosas a 71 ° C por 5 min. Lavar não mais de 6 slides por frasco coplin.
- Lavar as lâminas em Tween20 SSC/0.05% 4x em temperatura ambiente por 2 min.
- Se a mistura contém sonda sonda indiretamente rotulado (s), drenar o excesso de líquido de slides e aplicar 20 mL de anticorpo fluorescente conjugado com um quadrado 20 mm x 20 de Parafilm.
- Incubar em câmara úmida a 37 ° C por 15 min.
- Remover o Parafilm e lavar uma vez em Tween20 SSC/0.05% 4x em temperatura ambiente por 2 min.
- Lavar duas vezes por 2 min em PBS umt temperatura ambiente e drenar os slides.
- Aplicar 6 mL de DAPI / Vectashield (160 ng de 4 ',6-diamidino-2-phenylindole dicloridrato em 1 mL de Vectashield meio de montagem, Vector Laboratories) para a 22 x 22 mm não. 0 lamela e inverter a deslizar sobre a lamínula.
- Blot e selar as bordas da lamínula com esmalte de unha clara.
3. Análise, usando um microscópio de fluorescência devidamente equipados com filtros adequados para a sondas utilizadas.
- Sinais de pontuação através da visualização direta utilizando um microscópio de fluorescência e única filtros passa-banda para cada fluorocromo no ensaio. Cada núcleo deverá ser marcado por dois analistas. A orientação geral deve levar a pontuação de um único sinal, onde dois sinais espaçados são menos do que um domínio (sinal de largura), para além, no entanto, o julgamento baseado na experiência precisa ser exercido para interpretar os sinais de intensidade variável, tamanho, e separação.
- Use software de imagem (por exemplo, Isis, MetaSystems, Altlussheim, Alemanha; Cytovision, Genetix) para capturar uma imagem do núcleo para confirmação do diagnóstico visual, e para arquivamento de imagens como parte de um plano de garantia de qualidade laboratorial.
4. Resultados representativos:
Metáfase e interfase núcleos de cultura de linfócitos do sangue periférico deve ser examinada para confirmar que as sondas selecionados são específicos para os cromossomos translocação, informativo para os pontos de interrupção (as sondas subtelomere deve hibridizar apenas para os segmentos translocados ea sonda centromérica (s) à centric segmento (s)) e os sinais em núcleos interfásicos deve ser brilhante e discreta. Marcar o número de sinais para cada sonda em 100 núcleos interfásicos de cada parceiro é recomendado para avaliar a eficiência do ensaio. Neste caso, dois sinais foram marcados em 95% -99% de núcleos para cada sonda. A Figura 1 mostra uma metáfase e núcleo interfásico de uma preparação para uma translocação recíproca entre os braços curtos dos cromossomos 5 e 9.
Sinais em núcleos interfásicos de blastômeros de embriões deve ser brilhante e discreta e marcou usando filtros de banda separada para passar as cores usadas. A Figura 2 mostra um núcleo blastômero com um padrão de sinal normal (2 cópias para todos os loci testados) consistente com um complemento cromossômico normal ou equilibrado para o cromossomo 5 e 9, e um núcleo com um padrão anormal de sinal consistente com um produto desequilibrado da translocação que tem monossomia (uma cópia) para o segmento translocado do cromossomo 5 e trissomia (três cópias) para o segmento translocado do cromossomo 9.
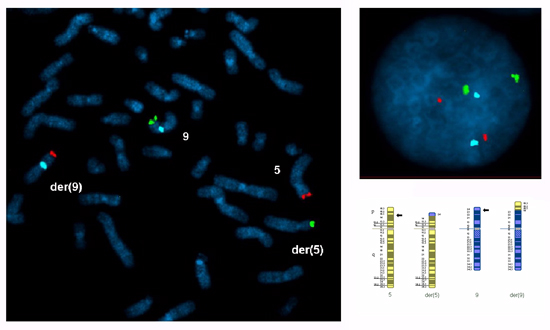
Figura 1 A disseminação metáfase e um núcleo interfásico preparados a partir de cultura de linfócitos do sangue periférico de um portador de uma translocação recíproca entre os braços curtos dos cromossomos 5 e 9, com pontos de interrupção em 5p14.3 e 9p24.1:. 46, XY, t (5 ; 9) (p14.3;. p24.1) ish t (5; 9) (5ptel48, 9ptel30 +; 9ptel30, 5ptel48 +, 9cen +). Sondas de FISH foram selecionados para ambos os segmentos translocados (5p14.3 → 5pter, vermelho Cytocell subtelomere5ptel48 TexasRed; 9p24.1 → 9pter, verde Cytocell subtelomere 9ptel30 FITC) eo segmento centric do cromossomo 9 (9p24.1 → 9qter, azul Abbott CEP 9 alfa satélite SpectrumAqua).
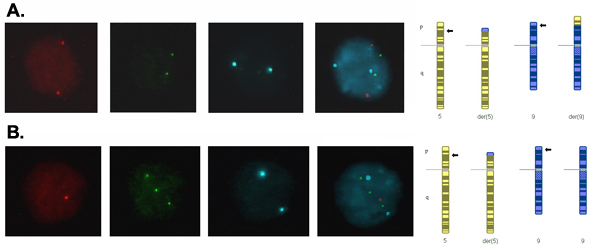
Figura 2. Signals em interfase núcleos de blastômeros do dia-3 embriões capturados usando um filtro diferente para cada fluorocromo e se fundiram para formar uma imagem composta. (A) Dois sinais para cada sonda indicando duas cópias de cada locus, o que é consistente com um complemento normal ou equilibrado para os cromossomos translocação. (B) Um sinal vermelho, três sinais verdes e dois sinais de azul, indicando uma cópia do segmento translocado do cromossomo 5, três cópias do segmento translocado do cromossomo 9 e duas cópias do segmento central do cromossomo 9, que é consistente com adjacentes -1 segregação da translocação resultando em um produto desequilibrado com monossomia para 5p14.3 → 5pter e trissomia para 9p24.1 → 9pter.
Discussão
A aplicação de hibridização fluorescente in situ (FISH) para uma célula de embrião único (blastômero) apresenta desafios especiais, tanto em aspectos práticos e na interpretação do padrão de sinal. A célula de biópsia precisa ser espalhado em uma área pré-definida no slide, a fim de facilitar a sua localização FISH seguinte; extremo cuidado deve ser tomado para garantir que a célula é lisada, que o citoplasma tem sido dispersa, e que o núcleo é visível e intacta, e, como o diagnóstico depende dos resultados a partir desta única célula, marcando rigorosos e interpretação diretrizes devem ser aplicadas. No entanto, em mãos experientes, o peixe é uma técnica robusta para a pré-implantação de diagnóstico genético (PGD) na prática clínica. O princípio da PGD por FISH é que as sondas dirigidas a públicos específicos DNA marcadas com fluorocromos diferentes ou haptenos pode ser usado para detectar o número de cópias de loci específicos, e, assim, para detectar desequilíbrio associado a segregação de cromossomos meióticos de rearranjos cromossômicos (1), incluindo Robertsoniana translocações, translocações recíprocas, inversões, e rearranjos complexos (2). FISH também pode ser usado para selecionar embriões do sexo feminino em famílias com doença ligada ao X, para o qual não existe um teste de mutação específica (3, 4). Mais controversa, FISH também tem sido usada para triagem de aneuploidias cromossômicas esporádicas, a fim de tentar melhorar a eficiência de reprodução assistida (5, 6), no entanto, o valor preditivo deste teste usando FSIH é susceptível de ser inaceitavelmente baixos na maioria das pessoas mãos e não é recomendado para uso clínico de rotina (7). Este artigo concentra-se nos aspectos técnicos e as limitações de FISH aplicada ao diagnóstico clínico de uma única célula.
Métodos de divulgação e fixação blastômeros única incluem metanol / ácido acético (5, 8), Tween / HCl (9), e uma combinação de Tween / HCl e metanol / ácido acético (10). Variações incluem o tratamento hipotónico das células antes da divulgação e / ou tratamento de pepsina e paraformaldeído após a fixação. O método deve ser devidamente validados para o laboratório (14). O método de Tween / HCl é descrito em detalhes neste artigo. O método de Tween / HCl é tecnicamente simples e altamente reprodutível em laboratórios diferentes. Este método pode ser usado para preparar núcleos único para o diagnóstico FISH de determinação do sexo e rearranjos cromossômicos com uma precisão de diagnóstico aceitável (7).
Mistura sonda pode combinar diretamente e indiretamente rotulados sondas marcadas, e sondas de diferentes fabricantes. Sondas para conhecer regiões cromossômicas polimórficas (11, 12), ou aqueles que se sabe cross-hibridizar de forma significativa com outros cromossomos (13) devem ser evitados, embora possa ser usado se mostrado para ser mais específico e adequado para PGD por testes antes de ambos os parceiros reprodutivos . Fluorocromos disponível / haptenos e estratégias para sondas de discriminar incluem o seguinte: Texas Red (TR), fluoresceína isotiocianato (FITC), SpectrumGreen (Vysis), SpectrumOrange (Vysis), SpectrumAqua, sondas biotiniladas detectado com TR-avidina, FITC-avidina, ou Cy-5 estreptavidina (visualizada usando um filtro FarRed), uma mistura de sondas de vermelho e verde para produzir um sinal amarelo, uma segunda rodada de hibridação e uma terceira cor criado por captura seqüencial de SpectrumOrange usando um TexasRed e um filtro SpectrumGold).
Um conjunto de sonda contendo três sondas, específicas para as regiões do centrômero cromossomos X e Y e um autossomo, é recomendado para a determinação do sexo (14), a sonda autossômica é usado para estabelecer ploidia e, assim, para diferenciar entre trissomia do X (2n, 47 , XXX) e triploidia (3n, 69, XXX), e entre tetrassomia X (48, XXXX) e tetraploidia (4n, 92, XXXX). A sonda típico set aplicada neste cenário é a mistura AneuVysion Abbott contendo alfa-satélite X, Y, e 18; este conjunto de sonda mostrou ter uma taxa de polimorfismo muito baixa e, portanto, o tratamento pré-work-up dos parceiros reprodutivos não é necessário (14).
O mix de sonda para qualquer rearranjo específicas devem: O ideal é conter sondas, pelo menos, suficiente para detectar todos os produtos esperados do rearranjo com desequilíbrio cromossômico. Se isso não for possível, sonda mistura onde os produtos detectados desequilibrada foram avaliados como não-viáveis em uma gravidez reconhecível e são susceptíveis de ter prevalência muito baixa pode ser aceitável (14). Ser testada em cultura de linfócitos metáfases de ambos os parceiros reprodutivos. Pelo menos dez spreads metáfase devem ser examinados para a especificidade da sonda, polimorfismos e hibridação cruzada, e, para o portador de rearranjo cromossômico, para garantir que as sondas hibridizam como esperado para os diferentes segmentos do rearranjo. Além disso, pelo menos 100 núcleos interfásicos de essas preparações devem ser marcados para avaliar a especificidade do sinal, brilho e singularidade (14).
Commercial sets PGS sonda estão disponíveis (por exemplo, Abbott MultiVysion PB ou PGT), tendo como alvo os cromossomos mais freqüentemente encontrado para ser aneuplóides em produtos da concepção, e que compreende uma única sonda por cromossomo alvo. Tipicamente, o núcleo pode ter um segundo de hibridização com sondas para os cromossomos adicionais que fornecem um ensaio para os cromossomos 13, 15, 16, 18, 21, 22, e XY (14). O valor preditivo deste teste usando a divulgação e técnica de FISH aqui descrito é provável que seja um nível inaceitavelmente baixo nas mãos da maioria das pessoas e não é recomendado para uso clínico de rotina (7, 15).
Técnicas como a hibridização genômica comparativa (CGH) aplicados a células individuais são capazes de teste para o número de cópias de cada cromossomo (Wilton et al. 2001), eo uso de polimorfismos de nucleotídeo único (SNP) e matrizes de análise quantitativa (Wells et al . 2008) ou genotipagem "karyomapping" (Handyside et al. 2009) são técnicas alternativas promissoras para detectar aneuploidias cromossômicas. No entanto, o limite de resolução e precisão para o desequilíbrio segmento permanece incerta e é provável que FISH continuará a ser a técnica de escolha para rearranjos cromossômicos envolvendo pequenos segmentos.
Divulgações
Materiais
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Hydrochloric Acid, 2.5L | VWR | 101254H | ||
| Sodium Chloride, 5Kg | VWR | 443827W | ||
| Potassium Chloride, 250g | VWR | 26764.232 | ||
| di-Sodium Hydrogen Orthophosphate Anhydrous, 500g | VWR | 102494C | ||
| Potassium Dihydrogen Orthophosphate, 500g | VWR | 10203 4B | ||
| Sodium Hydroxide Pellets, 500g | VWR | 28245.265 | ||
| Tween20, 500mL | VWR | 663684B | ||
| Ethanol, 2.5L | VWR | 8.18760.2500 | Duty Paid | |
| Tri-Sodium Citrate, 5Kg | VWR | 27833.363 | ||
| Cow Gum, 250mL | Cow Proofings Ltd. | No longer available | Old stocks can still be found in art shops | |
| DAPI/Antifade ES, 0.125μg/mL, 500ul | Cytocell | DES500L | 150μl vial rec’d with each Cytocell TEL Probe | |
| Nail Varnish, 12mL | Boots | 10088316001 | ||
| Amine-coated Slides, 25 | Genetix | K2615 | ||
| DAPI, 0.1mL | Sigma-Aldrich | D-9542 | ||
| Vectashield, 10mL | Vector Laboratories | H1000 | ||
| Texas-Red-avidin, 0.001mL | Vector Laboratories | A-2016 | ||
| FITC-avidin, 0.001mL | Vector Laboratories | A-2011 | ||
| Cy-5 Streptavidin, 0.001mL | GE Healthcare | PA45001 | ||
| Microcentrifuge Tubes, 1.75mL, box of 500 | Thistle Scientific | AX-MCT-175-C | ||
| Microcentrifuge Tubes, 0.6mL, box of 1000 | Thistle Scientific | AX-MCT-060-C-CS | ||
| 30ml Universal Containers, box of 400 | Sterilin | 128B | Available from NHS Supply Chain, Cat No. KCP053 | |
| Hot Block | ||||
| Spirit Burner Spirit Burner Socket Spirit Burner Wick | VWR VWR VWR | 451-0107 451-3112 451-3111 | ||
| Plugged Glass Pipettes | Fisher Scientific | PMK-300-052R | ||
| Dissecting Microscope | Wild Heerbrugg | |||
| Tissues, 100boxes | NHS SUPPLY CHAIN | MJT058 | ||
| Metal Culture Trays | ||||
| Plastic Melamine Trays | VWR | 682-009 | ||
| Oven | ||||
| Mouth Pipette Mouthpiece | Scientific Laboratory Supplies | HAE3700 | ||
| Tubing | ||||
| Syringe Filter, 0.2μm pore size, 25mm diameter | Fisher Scientific | FDM-340-010U | ||
| Diamond Pen | VWR | 818-0021 | ||
| Hot Block for Slides | Thermo Hybaid | HBOSBB | ||
| Hybridization Chamber | ||||
| Tissue Roll | NHS SUPPLY CHAIN | MJT004 | ||
| Schieferdecker Jar | VWR | 631-9313 | ||
| Coplin Jar | VWR | 631-9331 | ||
| Forceps, Fine | VWR | 232-2123 | ||
| Forceps, Blunt | VWR | 232-2113 | ||
| 1000mL Beaker | VWR | 213-1642 | ||
| Phase Contrast Microscope | Nikon | E200 | ||
| Fibre-free Blotting Cards, box of 100 | Fisher Scientific (Raymond Lamb) | SDE1 | ||
| Blue-Frosted Microscope Slides, box of 100 | Scientific Laboratory Supplies | MIC3022 | ||
| Coverslips, 18x18mm, No. 1, box of 200 | Scientific Laboratory Supplies | MIC3110 | ||
| Coverslips, 22x22mm, No. 0, box of 200 | Scientific Laboratory Supplies | MIC3104 | ||
| Coverslips, 22x50mm, No. 0, box of 100 | Scientific Laboratory Supplies | MIC3206 | ||
| 1mL Syringe, box of 100 | NHS Supply Chain | FWC045 | ||
| 1mL Pipette Tip, 10racks of 1000 | Thistle Scientific | AX-T-1000-C-L-R | ||
| Incubator | LEEC | |||
| Waterbath | Grant | W22 | ||
| Alcohol Thermometer | Various sources available | |||
| pH Meter | Jenway | 3305 | ||
| pH Electrode | VWR | 662-1759 | BNC Plug to fit Jenway pH meter 3305 | |
| Heated Stirrer | Bibby | HC502 | ||
| 1mL Pasteur Pipettes, box of 500 | Scientific Laboratory Supplies | PIP4202 | ||
| Parafilm, 50mm x 75m | VWR | 291-1214 |
Referências
- Scriven, P. N., Handyside, A. H., Ogilvie, C. M. Chromosome translocations: segregation modes and strategies for preimplantation genetic diagnosis. Prenat. Diagn. 18, 1437-1449 (1998).
- Mackie Ogilvie, C., Scriven, P. N., Harper, J. C. Preimplantation genetic diagnosis for chromosome rearrangements. Preimplantation Genetic Diagnosis. , 194-201 (2009).
- Harper, J. C., Coonen, E., Ramaekers, F. C. S., Delhanty, J. D. A., Handyside, A. H., Winston, R. M. L., Hopman, A. H. N. Identification of the sex of human preimplantation embryos in two hours using an improved spreading method and fluorescent in situ hybridisation using directly labelled probes. Hum. Reprod. 9, 721-724 (1994).
- Mackie Ogilvie, C., Scriven, P. N., Harper, J. C. Preimplantation genetic diagnosis for sex-linked diseases and sex-selection for non-medical reasons. Preimplantation Genetic Diagnosis. , 230-235 (2009).
- Munné, S., Lee, A., Rosenwaks, Z., Grifo, J., Cohen, J. Diagnosis of major chromosome aneuploidies in human preimplantation embryos. Hum. Reprod. 8, 2185-2192 (1993).
- Mackie Ogilvie, C., Scriven, P. N., Harper, J. C. Preimplantation genetic diagnosis for infertility (preimplantation genetic screening). Preimplantation Genetic Diagnosis. , 203-229 (2009).
- Scriven, P. N., Bossuyt, P. M. Diagnostic accuracy: theoretical models for preimplantation genetic testing of a single nucleus using the fluorescence in situ hybridization technique. Hum Reprod. Cytogenetics. 5, 394-400 (2010).
- Coonen, E., Dumoulin, J. C., Ramaekers, F. C., Hopman, A. H. Optimal preparation of preimplantation embryo interphase nuclei for analysis by fluorescence in-situ hybridization. Hum. Reprod. 9, 533-537 (1994).
- Dozortsev, D. I., McGinnis, K. T. An improved fixation technique for fluorescence in situ hybridization for preimplantation genetic diagnosis. Fertil. Steril. 76, 186-188 (2001).
- Hsu, L. Y., Benn, P. A., Tannenbaum, H. L., Perlis, T., Carlson, A. D. Chromosomal polymorphisms of 1, 9, 16, and Y in 4 major ethnic groups: a large prenatal study. Am. J. Med. Genet. 26, 95-101 (1987).
- Shim, S. H., Pan, A., Huang, X. L., Tonk, V. S., Varma, S. K., Milunsky, J. M., Wyandt, H. E. FISH variants with D15Z1. J. Assoc. Genet. Technol. 29, 146-151 (2003).
- Knight, S. J., Flint, J. Perfect endings: a review of subtelomeric probes and their use in clinical diagnosis. J. Med. Genet. 37, 401-409 (2000).
- Thornhill, A. R., de Die-Smulders, C. E., Geraedts, J. P., Harper, J. C., Harton, G. L., Lavery, S. A., Moutou, C., Robinson, M. D., Schmutzler, A. G., Scriven, P. N., Sermon, K. D., Wilton, L. ESHRE PGD Consortium (PGS) ESHRE PGD Consortium 'Best practice guidelines for clinical preimplantation genetic diagnosis (PGD) and preimplantation genetic screening (PGS)'. Hum. Reprod. 20, 35-48 (2005).
- Munné, S., Wells, D., Cohen, J. Technology requirements for preimplantation genetic diagnosis to improve assisted reproduction outcomes. Fertil. Steril. 94, 408-430 (2010).
- Wilton, L., Williamson, R., McBain, J., Edgar, D., Voullaire, L. Birth of a healthy infant after preimplantation confirmation of euploidy by comparative genomic hybridization. N. Engl. J. Med. 345, 1537-1541 (2001).
- Wells, D., Alfarawati, S., Fragouli, E. Use of comprehensive chromosomal screening for embryo assessment: microarrays and CGH. Mol. Hum. Reprod. 14, 703-710 (2008).
- Handyside, A. H., Harton, G. L., Mariani, B., Thornhill, A. R., Affara, N., Shaw, M. A., Griffin, D. K. Karyomapping, a universal method for genome wide analysis of genetic disease based on mapping crossovers between parental haplotypes. J. Med. Genet. 47, 651-658 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados