Method Article
Изготовление Micropatterned гидрогелей для нейронных системах культуры с использованием динамических Фотолитография Проекция маски
В этой статье
Резюме
Простые методы описаны для быстрого производства microfabricated нервной системе культуры с помощью цифровых устройств микрозеркальным для динамической проекции литографии маску на регулярной субстратов клеточной культуры. Эти культуры системы могут быть более представительным естественных биологических архитектуры, и методы, описанные могут быть адаптированы для многочисленных приложений.
Аннотация
Increasingly, patterned cell culture environments are becoming a relevant technique to study cellular characteristics, and many researchers believe in the need for 3D environments to represent in vitro experiments which better mimic in vivo qualities 1-3. Studies in fields such as cancer research 4, neural engineering 5, cardiac physiology 6, and cell-matrix interaction7,8have shown cell behavior differs substantially between traditional monolayer cultures and 3D constructs.
Hydrogels are used as 3D environments because of their variety, versatility and ability to tailor molecular composition through functionalization 9-12. Numerous techniques exist for creation of constructs as cell-supportive matrices, including electrospinning13, elastomer stamps14, inkjet printing15, additive photopatterning16, static photomask projection-lithography17, and dynamic mask microstereolithography18. Unfortunately, these methods involve multiple production steps and/or equipment not readily adaptable to conventional cell and tissue culture methods. The technique employed in this protocol adapts the latter two methods, using a digital micromirror device (DMD) to create dynamic photomasks for crosslinking geometrically specific poly-(ethylene glycol) (PEG) hydrogels, induced through UV initiated free radical polymerization. The resulting "2.5D" structures provide a constrained 3D environment for neural growth. We employ a dual-hydrogel approach, where PEG serves as a cell-restrictive region supplying structure to an otherwise shapeless but cell-permissive self-assembling gel made from either Puramatrix or agarose. The process is a quick simple one step fabrication which is highly reproducible and easily adapted for use with conventional cell culture methods and substrates.
Whole tissue explants, such as embryonic dorsal root ganglia (DRG), can be incorporated into the dual hydrogel constructs for experimental assays such as neurite outgrowth. Additionally, dissociated cells can be encapsulated in the photocrosslinkable or self polymerizing hydrogel, or selectively adhered to the permeable support membrane using cell-restrictive photopatterning. Using the DMD, we created hydrogel constructs up to ~1mm thick, but thin film (<200 μm) PEG structures were limited by oxygen quenching of the free radical polymerization reaction. We subsequently developed a technique utilizing a layer of oil above the polymerization liquid which allowed thin PEG structure polymerization.
In this protocol, we describe the expeditious creation of 3D hydrogel systems for production of microfabricated neural cell and tissue cultures. The dual hydrogel constructs demonstrated herein represent versatile in vitro models that may prove useful for studies in neuroscience involving cell survival, migration, and/or neurite growth and guidance. Moreover, as the protocol can work for many types of hydrogels and cells, the potential applications are both varied and vast.
протокол
1. ДМД установки
- ДМД борту, УФ световод (с коллиматором) и 4-кратным объективом, все установлены вертикально на столе виброизоляции.
- УФ световод должен быть отрегулирован так, что свет попадает на зеркало массиве под углом 45 ° относительно плоскости зеркала, и 24 ° ниже плоскости зеркала (рис. 1).
- Объектив установлен так, чтобы расстояние от DMD для объектива соответствует фокусное расстояние связано с линзой.
- Инвертированный микроскоп помещается ниже объектива, так, что сфокусированный свет, отраженный от DMD могут быть визуализированы в микроскоп. Расстояние от объектива до полимеризации поверхность должна примерно соответствовать рабочим расстоянием объектива. Этап на микроскоп может быть использован для регулировки этого расстояния до мелко фокус изображения. Это расстояние может варьироваться в зависимости от выбранного полимеризации поверхности.
2. Двойной Создает Гидрогель для культур тканей эксплантов
А. DRG эксплантов адгезии
- Пальто стены 6-и коллаген покрытых клеточной культуре вставками (Corning) с дождем-X, заботясь, чтобы избежать сама мембрана. (Кроме того, гидрофобный барьер пера может быть использован.)
- Гидратов вставки на ночь с 1,5 мл адгезии среды в инкубаторе при температуре 37 ° С и 5% СО 2. Адгезия среды neurobasal среде с 10% эмбриональной телячьей сыворотки, 1% пенициллин / стрептомицин, 0,5 мм L-глутамина и 20 мкг / мл NGF.
- Урожай эмбриональных ганглиях спинного корень (DRG) с E-15 крысят. DRG должны быть покрыты на коллаген покрытием 6-и вставками, по меньшей мере четыре на вставке.
- Инкубируйте вставками в течение 2 часов, чтобы обеспечить соблюдение DRG мембраны.
Б. Динамическая маска фотополимеризации
Цифровых устройств микрозеркальным (DMD) является 1024 х 768 массив отдельных зеркал, подобный тому, в проекционных телевизоров, которые избирательно отражает свет на основе положения зеркала. Для наших целей, DMD используется для картины ультрафиолетового (УФ) свет на photocrosslinkable гидрогели, создавая specifiable геометрии гидрогеля в простой и быстрый способ. На рисунке 1 показана настройка DMD-и УФ-светом путь. Хотя наш DMD представляет собой автономный блок, устройство также может быть интегрирован для работы с многими существующими микроскопы.
- Удалите все излишки жидкости из вставки и добавить 500 мкл полимеризации среды внутри вставки. Полимеризация среда содержит 10% ПЭГ (MW 1000) и 0,5% Irgacure 2959 растворенных в neurobasal среде, дополненной 20 мкг / мл NGF и 1% Pen / Strep.
- Место вставки под DMD устройства на Дождь-X рассматривается стекло.
- Загрузите соответствующий черно-белое изображение, которое будет использоваться в качестве "фотошаблонов" на DMD, за счет использования включены ALP-3 основные программы графического интерфейса. Для наших целей, бифурцирующих форма была выбрана, чтобы обеспечить внедрение систем аксонов руководства.
- Использование инвертированного микроскопа для визуализации, выровнять ткани эксплантов с соответствующем месте на фотошаблонов использование видимого источника света, отражающегося от МДД.
- Коммутатор видимого источника света для УФ-источник света, и осветить PEG раствора до сшивания достаточно. (Для условий, указанных и 5,0 Вт / см 2, падающих на DMD, сшивание может быть завершена менее чем за 55 секунд.) Повторите эти действия для всех четырех DRG на вставке.
- Вымойте каждой вставки в три раза стерильной DPBS и 1% Пен-Strep.
- Добавить 1,5 мл ростовой среды под ячейки вставки культуры, и позволить, чтобы уравновесить в инкубаторе в течение 30 минут. Рост среды neurobasal среде, содержащей 2% B-27, 1% Pen / Strep, 0,5 мм L-глутамина и 20 мкг / мл NGF.
С. Вторичный гидрогеля
Puramatrix
- Для нейронов приложений, 1% Puramatrix разбавляют в соответствии с инструкциями изготовителя до 0,15% в стерильной H 2 O и с добавлением 1 мкг / мл растворимого ламинин.
- Все избыточные средства массовой информации должны быть удалены из ПЭГ пустот, в которых содержатся DRG эксплантов, используя стерильный аппликатор наконечником хлопок, Kimwipe или микропипетки.
- Puramatrix добавляют ПЭГ пустот с микропипетки для того, чтобы заполнить пустое пространство, не переполнены. В зависимости от свободном объеме, как правило, ~ 1 мкл используется в конструкции.
- Puramatrix начинается процесс самосборки сразу после контакта с физиологическим раствором соли, то есть опухшие ПЭГ, но 1,5 мл ростовой среды добавляется под вставки и поместили в инкубатор на один час, чтобы гарантировать полную гелеобразования.
- Первоначально Puramatrix слегка кислой, так смены носителя через час, чтобы позволить рН в равновесие.
- Медиа изменений не требуется примерно раз в 48 часов. Будьте осторожны, что все СМИдобавил под вставки, для защиты целостности механически слабые Puramatrix.
Агароза
- Для нейронов приложений, агарозном разбавляют до 1% раствор в питательную среду и помещены в 60 ° С водяной бане до полного растворения агарозы (~ 1 час). Затем раствор с добавлением 1 мкг / мл растворимого ламинин.
- Все избыточные средства массовой информации должны быть удалены из ПЭГ пустот.
- Агарозном добавляется PEG пустот для того, чтобы заполнить пустое пространство, не переполнены. В зависимости от объема пустоты, как правило, ~ 1 мкл используется в конструкции.
- 1,5 мл ростовой среды предварительно охлажденной (8 ° С) в 6-луночный планшет, а агарозном содержащих вставки передаются охлажденной СМИ и сохраняется в холодильнике при температуре 8 ° С в течение не менее трех минут, чтобы дать агарозы, чтобы гель.
- Наконец, вставки передано 1,5 мл подогретого ростовой среде (37 ° С) и содержаться в инкубаторе при температуре 37 ° С, с изменениями, средств массовой информации требуется каждые 48 часов.
3. Двойной Гидрогель 3D Инкапсуляция сотовый
Двойная инкапсуляции гидрогеля подходит при использовании любого самоорганизации геля. Photocrosslinkable гель, в данном случае ПЭГ, служит структурную поддержку геометрические представления самоорганизации геля, например Puramatrix или агарозы. Некоторые из методов, в частности, типа геля и выбор фотошаблонов, будет зависеть от конкретного искомого приложения.
- Нагрузка соответствующую маску на МДД. Для нашего приложения выживаемость клеток, мы просто выбрали цилиндрический презентация Puramatrix, чтобы помочь в визуализации клеток. Исследователи, изучающие клеточной сигнализации может быть заинтересован в compartmental геометрии для обеспечения диффузии молекул хемотаксиса. Кроме того, грубое приближение артерии было показано, представляют собой возможность применения в кровь научно-исследовательское судно.
- Лечить стены культуре полиэфирных ячейки вставки с дождем-X, и место под дождь на DMD-X покрытием слайда.
- Добавить 500 мкл полимеризации средних вставки. Вызвать PEG сшивания под воздействием ультрафиолетового излучения в течение 55 секунд.
- Вымойте три раза стерильной DPBS и 1% Пен-Strep.
- Удалить все лишние средства массовой информации от PEG пустот.
- Спином вниз клетки в нужной плотности в гранулах. Необходимо соблюдать осторожность, чтобы удалить все среды от осадок клеток перед смешиванием, как Puramatrix начинается самосборки сразу после контакта с раствором соли. Приостановить клетки внутри 0,15% Puramatrix разводят в стерильной H 2 O с добавлением 10% сахарозы.
- Inject Puramatrix / элемент / сахарозы смесь внутри пустот в ПЭГ.
- Добавить 1,5 мл ростовой среды под вставку, и позволяют гель внутри инкубатора в течение одного часа.
- Изменение средств массовой информации через час, и ~ каждые 48 часов после этого.
4. Одноместный Гидрогель 3D Инкапсуляция сотовый
Одного инкапсуляции гидрогеля бы целесообразно для любой ситуации, в которой клетки могут быть рассмотрены внутри photocrosslinkable гидрогеля.
- Нагрузка соответствующую маску на МДД. Для исследования выживаемости клеток, мы снова выбрали основной круговой маски для представления цилиндра. Маски, подобные показанным в методе 4 вновь может быть применен для соответствующей области исследований.
- Лечить культуре полиэфирных ячейки вставки с дождем-X, и место под дождь на DMD-X покрытием слайда.
- Клетки в любой желаемой концентрации могут быть добавлены непосредственно в 10% ПЭГ решение, смешивания и обеспечить однородное распределение.
- Добавить 500 мкл полимеризации средних вставки. Вызвать PEG сшивания под воздействием ультрафиолетового излучения в течение 55 секунд.
- Вымойте три раза стерильной DPBS и 1% Пен-Strep.
- Залейте ростовой среды как ниже, так и в верхней части вставки, меняются примерно каждые 2 дня.
5. Тонкие полимеризации гидрогеля фильм
- Нагрузка соответствующую маску на МДД.
- Лечить коллагена покрытием полиэстер культуре клеток вставки с дождем-X, и место на Дождь-X покрытием слайда.
- Добавьте достаточное количество среду полимеризации только крышку в нижней части вставки (~ 250-300 мкл для 6-и вставки пластины). Разрешить СМИ проникать вставки мембраны в течение 30-45 минут при комнатной температуре.
- Удалите излишки среду полимеризации из вставка с микропипетки или Kimwipe. Добавить достаточное количество УФ-прозрачное масло, чтобы полностью покрыть дно вставки. Разрешить вставку, чтобы сидеть в течение 15-30 минут при комнатной температуре, достаточно долго, для нефти для формирования отдельного слоя выше насыщения полимеризационной среды вставить мембрану.
- Место вставки и слайд-под МДД. Вызвать PEG сшивания под воздействием ультрафиолетового излучения. Из-за малой толщины слоя PEG, сшивание может быть завершена менее чем за 15 секунд на уровне 5,0 Вт / см 2, падающих на МДД.
- Мойте вставить три раза стерильной DPBS и 1% Пен-Strep. (Если сохранение маслянистый остаток озабоченность, мягкого моющего средства, такие как Tween 20 (1%) могут быть добавлены в промывочный буфер.)
- Магазин вставки в 6-луночного планшета для культуры ткани. Добавить роста средних взвешенных клеток, в нужной концентрации, и пипетки достаточный объем клеточной суспензии внутрь вставить культуры клеток для получения желаемой плотности клеток. Затем добавить достаточно средний рост ниже вставить, чтобы полностью поддерживать жизнеспособность клеток (~ 1,5 мл).
- Через 48 часов прошло, мыть вставить три раза стерильной DPBS и 1% Пен-Strep выбить любые unadhered клеток. Изменение СМИ примерно раз в 48 часов.
6. Представитель Результаты
Примеры двойной гидрогеля конструкций содержащих DRG эксплантов показаны на рисунке 2. Обратите внимание, что сотовые миграции и аксонов расширение ограничено ячейки разрешительной области двойного гидрогеля конструкции. На рисунке 3 показана диссоциированных клетки инкапсулированные аналогичным внутри двойной конструкции гидрогеля. Из-за динамичного характера фотошаблонов DMD, геометрии для инкапсуляции ограничен только размерами и разрешением оптики. Сотовые инкапсуляции также возможна внутри одной фотополимеризующихся гидрогеля, ПЭГ, и жить / мертвых жизнеспособность Тест проводился о чем свидетельствует на рисунке 4. Инкапсуляция в ПЭГ предназначена только в качестве примера, как ПЭГ не представляет идеальную среду для нервных клеток. Таким образом, жизнеспособность клеток реализуется в нашей конструкции PEG понятным низким. Наконец, примеры использования тонких пленок PEG как узорные ограничительный слой клеточной адгезии на вставками культуре клеток показано на рисунке 5. Кроме того, примеры возможных "плохих" результатов предлагаются на рисунке 6.
Результаты представляют собой лишь малую часть возможностей использования методов, разработанных в нашей лаборатории. Они предназначены для демонстрации простоты, универсальности и жизнеспособности нашего подхода, и могут рассматриваться как "доказательство принципа" для исследователей для разработки своих собственных возможных адаптаций.
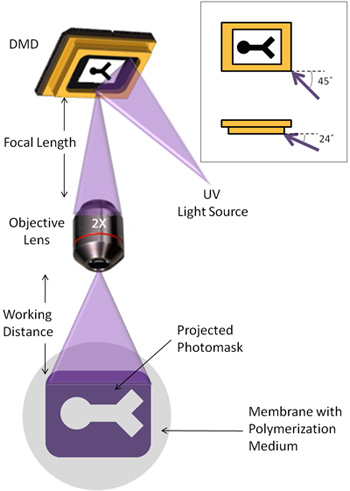
Рисунок 1. Схематическое изображение светом путь, используемый для фотолитографии. Врезка: УФ-свет освещает DMD под углом 45 ° и 24 ° ниже плоскости зеркала массива.

Рисунок 2. Маркированный роста и распространения в DRG содержащие двойной конструкции гидрогеля. Н.э.) Изображения изображающие полимеризованного PEG конструкций (серый) с нейритов помечены Бета III тубулина (зеленый), DAPI окрашенных клеточных ядер (синий). DRG эксплантов содержатся в Puramatrix и расположен в круговых областях образца, с растущим нейритов к бифуркации (ы).
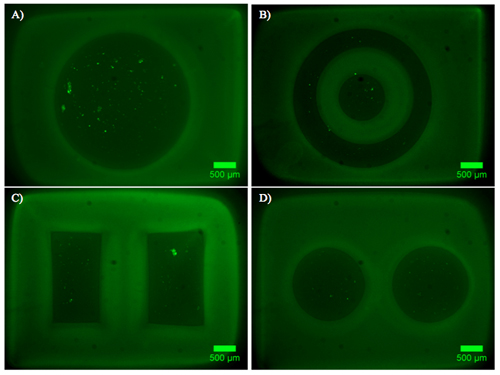
Рисунок 3. Двойной конструкций гидрогель, содержащий клетки помечены кальцеин А.М., жить маркер ячейки, после 48 часов в ростовой среде. Н.э.) Различные формы PEG, наполненный Puramatrix содержащие диссоциированных нейронов DRG (~ 5x10 3 клеток / мл).
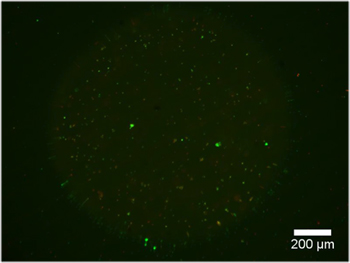
Рисунок 4. Одноместный гидрогеля построить, содержащие живые клетки помечены кальцеин AM (зеленый) и мертвые клетки помечены этидия гомодимера-1 (красный), после 24 часов в ростовой среде (5х10 3 клеток / мл).
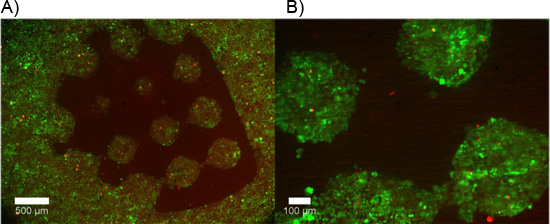
Рисунок 5. Сотовый ограничительные PEG полимеризованного в виде тонкой пленки с использованием "тестовый образец" выборочно придерживаться диссоциированных клетки коллагена покрытые оболочкой проницаемой поддерживает. А, В) живые клетки помечены после 48 часов с кальцеин AM (зеленый), в то время как мертвые клетки помечены этидия гомодимера-1 (красный). Минимальная адгезии клеток происходит в области, содержащей тонкую пленку ПЭГ.

Рисунок 6. Представителю образы нежелательных результатов. ) Частичный полимеризации PEG, что приводит к непригодным для использования PEG конструкции. Неправильное полимеризации может происходить из-за присутствия мениска в предварительно полимера среды, недостаточное количество полимеризационной среды, недостаточное воздействие УФ лучей или ненадлежащее фокус оптики. Б) изображение изображением полимеризованного PEG конструкций (серый) с нейритов помечены Бета III тубулина (зеленый), DAPI окрашенных клеточных ядер (синий). Нейритов смогли вырастить вне узорной PEG каналов. Это часто происходит в условии, что Puramatrix переполнения в верхней части PEG во время инъекции.
Обсуждение
Метод, описанный здесь может быть использован любой следователь ищет простые и воспроизводимые системах клеточных культур. Теоретически, из-за широкого спектра фотополимеризующихся гидрогелей доступны, окружающей среде могут быть приспособлены, чтобы для использования с любым типом клеток, в том числе целые эксплантаты ткани. Кроме того, двойная система позволяет гидрогель для улучшения пространственного контроля в презентации собственного полимеризации гидрогелей, которые склонны к образованию аморфной формы сами по себе. В результате "2.5D" строит micropatterned гидрогеля обеспечивают 3D-матрицы для нейронных роста представлены в 2D конфигурации, которая позволяет удобно микроскопические оценки. Подложки, на которой гели полимеризуются также могут быть разнообразны, что позволяет лучше контролировать в экспериментальном дизайне. Наши методы оптимизированы для работы с культурой клеток поддерживает проницаемой, как мы видели улучшение жизнеспособности (рис. 4) по сравнению с полимеризацией на стеклах (данные не приведены). Тем не менее, другие поверхности полимеризации может быть более применимо для различных областей применения: изготовление на стеклах, используемых в экспериментах или микрофлюидики образований ячейки совокупности, например.
Наш опыт работы с этими системами культуры привело к выявлению потенциальных областей сложности. Во-первых, осторожно методы, необходимые для поддержания стерильности конструкций. Из-за громоздкого характера DMD установки, трудно работать полимеризации шаги в стерильных условиях. Для борьбы с этой проблемой, промойте шаг описан в методах полезно, и антибиотики должны использоваться во всех средствах массовой информации. Кроме того, конечная толщина и форма построить полимеризованного очень сильно зависит от жидкости поведение предварительно полимерная смесь, а также наличие мениска может привести к геля конструкции, слишком тонкие или не полностью полимеризованной (рис. 6). Два шаги могут быть предприняты, чтобы минимизировать образование мениска внутри вставки культуре клеток. Для толстых гидрогели (> 200 мкм), простое покрытие дождя-X вокруг внутренней стенки вставки достаточно. Однако, как кратко описано выше, для тонких конструкций (<200 мкм), масляный слой необходимо как минимизировать мениска и свести на нет кислорода тушения радикальной полимеризации. Резолюция была установлено, что в зависимости от толщины, с уменьшением размера элемента осуществляется с более толстыми гели. Резолюция также варьировать в зависимости от того, представлена функция положительного или отрицательного рельефа в гидрогеля. Тем не менее, мы достигли достаточного разрешения для конструкции с минимальными размерами функция в масштабе ~ 100 мкм, используя только цели микроскопом, как фокусирующей оптикой.
Наши эксперименты показали, что двойной конструкции гидрогеля, описанные здесь, представляют собой прекрасную основу для формирования основных в лабораторных моделях роста аксонов и руководство. Micropatterning используемой техники является адаптация существующих методов 18,19, но наши настройки подчеркнул, прост в реализации дизайна и была оптимизирована для производства двойной конструкции гидрогеля на вставками культуре клеток; вставками культуре клеток жизненно важное значение для повышения жизнеспособности клеток, а также в качестве сшивающего вокруг ранее приверженцем эксплантатов ткани. Сфера результаты, показанные ограничивается интересами нашей лаборатории, однако мы считаем, что методы, описанные в данной публикации, окажутся полезными для исследователей поисках относительно дешевой, быстрой и простой в использовании метод для изготовления 3D культуре клеток моделей.
Раскрытие информации
Благодарности
Авторы хотели бы поблагодарить лабораторию профессора Энтони Windebank для обмена опытом по DRG рассечение и культуры, а также профессор Чен Shaochen за полезные обсуждения, касающиеся DMD установки. Это исследование было профинансировано частично Тьюлейн университета и грантов от штата Луизиана Совет регентов (LEQSF [2009-10]-RD--18) и NIH (NS065374).
Материалы
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Digital Micromirror Device | Texas Instruments | DLPD4X00KIT | ||
| Collagen Coated Transwell Permeable Support | Corning | 3491 | Also referred to as Cell Culture Insert in manuscript | |
| Polyester Transwell Permable Support | Corning | 3412 | Also referred to as Cell Culture Insert in manuscript | |
| Neurobasal Medium | Invitrogen | 21103-049 | ||
| Fetal Bovine Serum | Invitrogen | 16000-036 | ||
| L-glutamine | Invitrogen | 25030-164 | ||
| Nerve Growth Factor | Invitrogen | 13257-019 | ||
| Pen/Strep | Invitrogen | 15140-122 | ||
| B-27 Supplement | Invitrogen | 17504-044 | ||
| DPBS | Invitrogen | 14190-250 | ||
| Puramatrix | BD Biosciences | 354250 | ||
| PEG 1000 | Polysciences, Inc. | 15178 | ||
| Irgacure 2959 | Ciba Specialty Chemicals | 0298913AB | ||
| Oil | Have used both canola oil and silicon oil | Needs to be UV transparent, and minimize +/- meniscus formation | ||
| OmniCure Series 1000 | Exfo | |||
| Rain-X |
Ссылки
- Abbott, A. Cell culture: biology's new dimension. Nature. 424, 870-872 (2003).
- Schindler, M. Living in three dimensions: 3D nanostructured environments for cell culture and regenerative medicine. Cell Biochem Biophys. 45, 215-227 (2006).
- Maltman, D. J., Przyborski, S. A. Developments in three-dimensional cell culture technology aimed at improving the accuracy of in vitro analyses. Biochemical Society Transactions. 38, 1072-1075 (2010).
- Smalley, K. S., Lioni, M., Herlyn, M. Life isn't flat: taking cancer biology to the next dimension. In Vitro Cell Dev Biol Anim. 42, 8-9 (2006).
- Irons, H. R. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. Journal of Neural Engineering. 5, 333-341 (2008).
- Bursac, N. Cultivation in rotating bioreactors promotes maintenance of cardiac myocyte electrophysiology and molecular properties. Tissue Eng. 9, 1243-1253 (2003).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294, 1708-1712 (2001).
- Cushing, M. C., Anseth, K. S. Materials science. Hydrogel cell cultures. Science. 316, 1133-1134 (2007).
- Kloxin, A. M., Kasko, A. M., Salinas, C. N., Anseth, K. S. Photodegradable hydrogels for dynamic tuning of physical and chemical properties. Science. 324, 59-63 (2009).
- Geckil, H., Xu, F., Zhang, X., Moon, S., Demirci, U. Engineering hydrogels as extracellular matrix mimics. Nanomedicine (Lond). 5, 469-484 (2010).
- Luo, Y., Shoichet, M. S. A photolabile hydrogel for guided three-dimensional cell growth and migration. Nature Materials. 3, 249-253 (2004).
- Wylie, R. G., Shoichet, M. S. Two-photon micropatterning of amines within an agarose hydrogel. Journal of Materials Chemistry. 18, 2716-2721 (2008).
- Ji, Y. Electrospun three-dimensional hyaluronic acid nanofibrous scaffolds. Biomaterials. 27, 3782-3792 (2006).
- Moeller, H. C., Mian, M. K., Shrivastava, S., Chung, B. G., Khademhosseini, A. A microwell array system for stem cell culture. Biomaterials. 29, 752-763 (2008).
- Xu, T. Viability and electrophysiology of neural cell structures generated by the inkjet printing method. Biomaterials. 27, 3580-3588 (2006).
- Liu Tsang, V. Fabrication of 3D hepatic tissues by additive photopatterning of cellular hydrogels. FASEB J. 21, 790-801 (2007).
- Beebe, D. J. Microfluidic tectonics: A comprehensive construction platform for microfluidic systems. Proceedings of the National Academy of Sciences of the United States of America. 97, 13488-13493 (2000).
- Lu, Y., Mapili, G., Suhali, G., Chen, S. C., Roy, K. A digital micro-mirror device-based system for the microfabrication of complex, spatially patterned tissue engineering scaffolds. Journal of Biomedical Materials Research Part A. 77, 396-405 (2006).
- Naiser, T., Mai, T., Michel, W., Ott, A. Versatile maskless microscope projection photolithography system and its application in light-directed fabrication of DNA microarrays. Review of Scientific Instruments. 77, 063711-063711 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены