Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Micro-ondes assisté one-pot de synthèse des N-Succinimidyl-4-[ 18 F] fluorobenzoate ([ 18 F] SFB)
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Une facile, un pot de synthèse du N-succinimidyl-4-[ 18 F] fluorobenzoate ([ 18 F] SFB) a été développé basé sur une non-aqueuse, un processus en trois étapes radiochimique. Utilisant un chauffage à micro-ondes, toute la procédure peut être complété en moins de 30 min ou 60 min avec une purification supplémentaire par HPLC préparative. La décroissance des rendements corrigés radiochimique (RCYs) étaient 35-5% (n> 30).
Résumé
Biomolécules, y compris des peptides, 1-9 protéines, 10,11 et les anticorps et leurs fragments conçu, 12-14 gagnent en importance à la fois comme agents thérapeutiques potentiels et des agents d'imagerie moléculaire. Notamment, quand étiquetés avec des radio-isotopes émettant des positrons (par exemple, Cu-64, Ga-68 ou F-18), ils peuvent être utilisés comme sondes pour l'imagerie ciblée de nombreux processus physiologiques et pathologiques. 15-18 conséquent, des efforts importants ont consacrée à la synthèse et l'exploration de 18 F-étiquetés biomolécules. Bien qu'il existe des exemples élégant de la 18 F-étiquetage directe de peptides, 19-22 les conditions de réaction sévère (c.-à-solvant organique, le pH extrêmes, température élevée) associée à radiofluorination directs sont généralement incompatibles avec les échantillons de protéines fragiles. À ce jour, par conséquent, l'incorporation de groupements prosthétiques radiomarqué dans des biomolécules reste la méthode de choix. 23,24
N-succinimidyl-4-[18 F] fluorobenzoate ([18 F] SFB), 25-37 un réactif du type de Bolton-Hunter, qui réagit avec les groupes amino primaire de biomolécules, est un groupe très polyvalent prothétique pour le 18 F-étiquetage d'un large éventail d'entités biologiques, en termes de son évidente stabilité in vivo et le rendement élevé de radiomarquage. Après marquage avec [18 F] SFB, le résultant [18 F] biomolécules fluorobenzoylated pourraient être explorées comme traceurs PET potentiels dans les études d'imagerie in vivo. La plupart des 1 [18 F] radiosyntheses SFB décrits dans les littératures actuelles exigent deux ou même trois réacteurs et purifications multiples en utilisant soit l'extraction en phase solide (SPE) ou la chromatographie liquide haute performance (CLHP). Ces longs processus d'entraver sa production de routine et des applications répandues dans le radiomarquage des biomolécules. Bien que plusieurs modules assistée [18 F] synthèses SFB ont été signalés, 29-32, 41-42, ils sont principalement basées sur des procédures longues et compliquées en utilisant coûteuses boîtes radiochimie commercialement disponibles (tableau 1). Par conséquent, une nouvelle simplification des radiosynthèse du [18 F] SFB en utilisant une configuration à faible coût serait très bénéfique pour son adaptation à un processus automatisé.
Ici, nous rapportons une préparation concise du [18 F] SFB, basé sur une version simplifiée one-pot micro-ondes synthèse assistée (figure 1). Notre approche ne nécessite pas de purification entre les étapes ou tout réactifs aqueux. En outre, l'irradiation micro-ondes, qui a été utilisé dans les synthèses de plusieurs traceurs TEP, 38-41 donne peut plus RCYs et une meilleure sélectivité que les réactions correspondantes thermique ou qu'ils fournissent des rendements similaires dans les temps de réaction plus courts. 38 Plus important encore, lorsque l'étiquetage des biomolécules , le temps ainsi économisé pourrait être détournée vers bioconjugaison ultérieure ou une étape d'imagerie TEP 28,43 La nouveauté de notre améliorée [18 F] SFB synthèse est double: (1). déprotection de la stratégie anhydre ne nécessite pas de purification de l'intermédiaire (s) entre chaque étape et (2) le micro-transformations radiochimiques aidé permettre la rapide, une production fiable de [18F] SFB.
Protocole
1. Les premiers préparatifs
- Un V-flacon (5 ml) RV1 (avec agitation bar) est utilisé comme récipient à réaction principale pour réaliser la synthèse micro-ondes. Il est connecté à un adaptateur PEEK avec sept entrée / sortie des ports se connecte et placé à l'intérieur de la cavité micro-onde (voir figure 2). RV2 est connecté à cartouche SPE (I) pour recueillir le brut [18 F] SFB. RV3 est connecté à cartouche SPE (II) pour la collecte de la finale [18 F] SFB solution. Il peut être placé dans un bain d'eau tiède (40 ° C) pour concentrer la solution correspondante avant de reconstituer dans un tampon PBS, en particulier pour le radiomarquage aval de biomolécules.
- Configuration de la collecte brute [18 F] SFB: Remplissez MeCN / H 2 O [6 ml; 1:4 (v: v)] solution aqueuse à 5% AcOH (8 ml), MeCN (2 ml) pour le réservoir A, B et C, respectivement. Puis activer une cartouche SPE (I) (polystyrène, Merck LiCholut FR) avec de l'éthanol (10 ml), suivie par aqueuse à 5% AcOH (10 ml) à laver.
- Configuration de la collecte purifiée [18 F] SFB: Préparer réservoir D et E rempli avec 10 ml de H 2 O et 3 ml d'éther éthylique, respectivement. La seconde cartouche SPE (II) (polystyrène, Merck LiCholut FR) est activé par la même procédure mentionnée ci-dessus.
- Démarrez le CLHP (tampon d'élution: MeCN / H 2 O, 1:1 (v / v) contenant 0,2% TFA; débit: 3 ml / min) pour le pré-conditionnement de la colonne de CLHP [une phase inverse semi-prep colonne (Luna, 5 um C18 (2) 100 A, 250 x 10 mm), Phenomenex, Torrance, CA, USA].
2. Préparation du séchées [ie non porteur ajoutée, (NCA)] [18 F] de fluorure
- [18 F] une solution de fluorure dans [18 O] H 2 O (100 pi) a été ajouté à un mélange de Kryptofix 222 (20 mg), aqueuse 1M de K 2 CO 3 (26 pi) et MeCN (0,8 ml) dans un Eppendorf tube. La solution complète est alors bien mélangé avant d'être transféré à l'RV1 via la ligne d'entrée 1. Le [18 F] une solution de fluorure peut aussi être passé à travers une cartouche anioniques de change (par exemple, l'AMQ-légers Sep-Pak de Waters) pour piéger le fluor-18 et ensuite éluée avec un mélange de K 2 CO 3 et Kryptofix dans MeCN.
- Exécuter la séquence de séchage (20W, 3 min) en vertu du programme de contrôle à micro-ondes pour éliminer l'eau résiduelle dans RV1 [sous vide]. Après le refroidissement de la température du système est inférieure à 50 ° C, MeCN supplémentaires (1,0 ml) a été introduit dans le réacteur et la séquence est répétée une fois.
3. Synthèse de l'éthyl-4 - [18 F] fluorobenzoate
- Pour une solution de DMSO (0,4 ml) contenant éthyl-4 - (N, N, N-triméthylammonium) benzoate de triflate (1,5 mg) a été ajouté dans RV1 via la ligne d'arrivée 2.
- Exécuter la séquence d'étiquetage (50W, 1 min) dans le cadre du programme de contrôle à micro-ondes avec un refroidissement cuve sous agitation, et toutes les vannes fermées à payer éthyl-4 - [18 F] fluorobenzoate ([18 F] 2).
4. Synthèse du 4 potassium - [18 F] fluorobenzoate
- Pour une solution de DMSO (0,5 ml) contenant KOtBu (13 mg) a été ajouté dans RV1 via la ligne d'entrée 3.
- Exécuter le programme Déprotéger (40 W, 1 min) dans le cadre du programme de contrôle à micro-ondes avec un refroidissement cuve sous agitation, et toutes les vannes fermées à payer les 4 - [18 F] fluorobenzoate sel ([18 F] 3).
5. Synthèse de brut [18 F] SFB
- Pour une solution d'acétonitrile (2,5 ml) contenant TSTU (30 mg) a été ajouté à RV1 via la ligne d'entrée 6. TSR à l'humidité et la lumière sensible. Il devrait être répartie dans des flacons de petites et conservés à 4 ° C dans un récipient couvert et fermé par une feuille d'aluminium.
- Exécuter la séquence d'accouplement (30W, 2 min) en vertu du programme de contrôle à micro-ondes avec un refroidissement cuve sous agitation, et toutes les vannes fermées à payer le brut [18 F] SFB.
6. La préparation de la SPE-purifiée [18 F] SFB
- Aqueuse à 5% AcOH (1,0 ml) a été ajouté à RV1 via la ligne d'entrée de 7 à neutraliser le mélange réactionnel. La solution a ensuite été transféré en B flacon contenant 8 ml d'AcOH aqueuse à 5% (figure 2).
- Passez le mélange réactionnel dilué par cartouche SPE (I) à piège grossier [18 F] d'azote à l'aide du SFB (10 psi).
- WASH cartouche SPE (I) avec un mélange de MeCN et H 2 O [10 mL, 1:4 (v: v)] du réservoir A.
- [18 F] SFB a été élue à l'aide en RV2 MeCN (2 ml) du réservoir C.
7. Purification du brut [18 F] SFB avec Radio-HPLC
- Diluer soit bruts [18 F] SFB ou SPE-purifiée [18 F] SFB avec H 2 O (2 ml) de RV2 et transférer le mélange dans la boucle HPLC (5 ml). La solution a été injectée dans le radio-HPLC [O MeCN / H 2, 1:1 (v / v) contenant 0,2% TFA; débit: 3 ml / min].
- Recueillir la fraction purifiée contenant [18 F] SFB (rétention Time: 8-10 minutes) dans le flacon (pré-rempli avec 10 ml de H 2 O) D (figure 2). Une étape cruciale: s'il est effectué correctement, le volume fraction recueillie ici devrait être 4-5 ml.
- Passez le mélange réactionnel dilué par cartouche SPE (II) pour piéger purifiée [18 F] d'azote à l'aide du SFB (10 psi). Sécher la cartouche avec un courant d'azote pendant 2-3 minutes.
- [18 F] SFB a été élue à l'aide en RV3 diéthyléther (3 ml) du réservoir E..
- Evaporer le solvant RV3 à sec par un léger courant d'azote gazeux (10 psi) en utilisant un bain d'eau (40 ° C). Le séchées final [18 F] SFB peut être reconstitué dans du tampon PBS pour l'application en aval.
8. Les résultats représentatifs:
Nous avons développé une version simplifiée, rapide, un pot-méthode de synthèse [18 F] SFB utilisant une stratégie de déprotection dans des conditions anhydres et le chauffage micro-ondes pendant chaque transformation radiochimique / chimiques. La figure 1 présente les détails de notre radiosynthèse. L'identité du produit final a été confirmé par la comparaison des temps de rétention HPLC avec une référence non radioactifs SFB. Le purifiée [18 F] SFB a également été analysé par la radio-TLC et HPLC-afin de déterminer son radiochimique et la pureté chimique. Le RCY du [18 F] SFB était de 35 ± 5% dans les 60 min après purification par HPLC (n> 30), avec une pureté radiochimique élevée (> 99%) et une bonne pureté chimique (voir la trace UV dans le profil HPLC, la figure 3 ). L'activité spécifique a été env. 67-330 GBq / mol (1,8 à 9,0 Ci / mol), selon la radioactivité de départ.

Figure 1. Microwave assistée one-pot radiosynthèse du [18 F] SFB. Premièrement, le radiofluorination d'éthyl-4 - (N, N, N-triméthylammonium) benzoate de triflate (1) a été réalisée sous chauffage micro-ondes (50 W, 1 min), en présence de [K ⊃ 2.2.2] [18 F] F - complexe dans le diméthylsulfoxyde (DMSO) pour donner le 4 - [18 F] fluorobenzoate ([18 F] 2). Sans purification, une solution de DMSO de tert-butoxyde de potassium (t BuOK) a été ajouté et le réacteur a été irradié à micro-ondes (40 W, 1 mn) pour compléter la déprotection anhydre. La conversion finale du [18 F] 3 dans [18 F] SFB a été réalisé en utilisant O-(N-succinimidyle) - N, N, N ', N'-tétraméthyluronium (TSR) d'activation. TSR dans l'acétonitrile a été ajoutée au mélange réactionnel contenant le 4 - [18 F] fluorobenzoate ([18 F] 3) le sel; cette dernière étape de synthèse donné brut [18 F] SFB après chauffage (30 W, 2 min).

Figure 2. Le schéma de la configuration des micro-ondes assisté one-pot [18 F] SFB synthèse.
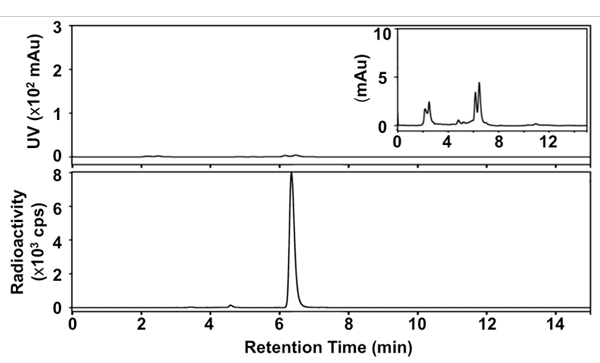
Figure 3. Radio-HPL chromatogrammes de finale [18 F] SFB. En haut: signal UV à 254 nm; en bas: le signal radioactif; en médaillon: le signal UV à 254 nm (x 33,3).
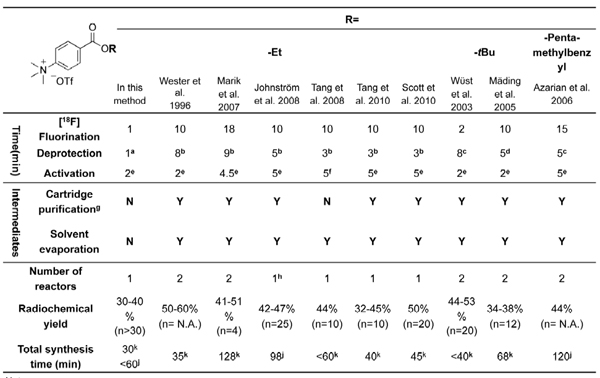
. Tableau 1 Récapitulatif des [18 F] radiosyntheses SFB rapportés dans la littérature en utilisant alkyle 4 - (triméthylammonium) triflate benzoate comme précurseurs.
Discussion
Cela a simplifié en trois étapes, un pot de radiosynthèse des 18 F-acylation réactifs [18 F] SFB est développé sur la base non aqueuse chimie. Ce processus a une excellente reproductibilité et pourrait être utilisé de manière fiable pour la production de [18F] SFB dans les modules de radiochimie automatisé, grâce à deux modifications clés décrits comme suivants: 1. Nous employons une étape de déprotection / saponification en anhydre KOtBu / DMSO système pour remplacer l...
Déclarations de divulgation
Remerciements
Cette étude a été soutenue par le Département américain de l'Énergie (DE-FG02-09ER09-08 et DE-PS02-09ER09-18), le Centre Anti Cancéreux Jonsson Comprehensive de l'UCLA, et le Programme de l'industrie-université de recherche coopérative (UC subvention à la découverte, bio07 -10 665). Nous remercions le Dr Nagichettiar Satyamurthy et le personnel à l'installation de l'UCLA Biomedical Cyclotron pour fournir le F-18 radio-isotopes et des discussions perspicaces nombreuses. Nous remercions les Drs. Michael Collins, Greg Leblanc, Joseph Lambert, et Keller Barnhardt du CEM pour leurs conseils techniques et de soutien. Nous tenons à remercier Dirk Williams, Darin Williams, les Drs. Joseph Hong Dun Lin, et Michael van Dam pour les pièces de la conception et l'usinage de modifier le réacteur à micro-ondes CEM et pour les modules de purification SPE.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
| l'acide acétique en solution aqueuse (5%, v / v) | Fisher | A38-500 | Préparé dans notre laboratoire |
| Acétonitrile | Sigma-Aldrich | 75-05-8 | |
| L'éther diéthylique | Sigma-Aldrich | 14775 | |
| Diméthylsulfoxyde (DMSO) | Sigma-Aldrich | 472301 | |
| Ethyl 4 - (N, N, N-triméthylammonium) benzoate de triflate | Préparé dans le laboratoire | ||
| 4,7,13,16,21,24-hexaoxa-1 ,10-diazabicyclo [8.8.8] hexacosane (K222) | Sigma-Aldrich | 29,111-0 | |
| O - (N-succinimidyle) - N, N, N ', N'-tétraméthyluronium (TSR) | Sigma-Aldrich | 105832-38-0 | |
| Le carbonate de potassium en solution aqueuse (1M) | Sigma-Aldrich | 209619 | Préparé dans notre laboratoire |
| Tert-butoxyde de potassium | Sigma-Aldrich | 156671 |
Références
- Okarvi, S. M. Recent progress in fluorine-18 labeled peptide radiopharmaceuticals. Eur. J. Nucl. Med. 28, 929-938 (2001).
- Chen, X. Y., Park, R., Hou, Y. P., Khankaldyyan, V., Gonzales-Gomez, I., Tohme, M., Bading, J. R., Laug, W. E., Conti, P. S. MicroPET imaging of brain tumor angiogenesis with 18F-labeled PEGylated RGD peptide. Eur. J. Nucl. Med. Mol. Imaging. 31, 1081-1089 (2004).
- Wu, Z., Li, Z. -. B., Chen, K., Cai, W., He, L., Chin, F. T., Li, F., Chen, X. MicroPET of tumor integrin αvβ3 expression using 18F-labeled PEGylated tetrameric RGD peptide. J. Nucl. Med. 49, 1536-1544 (2007).
- Cheng, D., Yin, D., Zhang, L., Li, G., Wang, M., Li, S., Zheng, M., Cai, H., Wang, Y. Radiolabeling and in vitro and in vivo characterization of [18F]FB-[R8,15,21, L17]-VIP as a PET imaging agent for tumor over-expressed VIP receptors. Chem. Biol. Drug Des. 68, 319-325 (2006).
- Cheng, D., Yin, D., Zhang, L., Wang, M., Li, G., Wang, Y. Preparation of the novel fluorine-18-labeled VIP analog for PET imaging studies using two different synthesis methods. J. Fluorine Chem. 128, 196-201 (2007).
- Fredriksson, A., Johnstroem, P., Stone-Elander, S., Jonasson, P., Nygren, P. -. A., Ekberg, K., Johansson, B. -. L., Wahren, J. Labeling of human C-peptide by conjugation with N-succinimidyl-4-[18F]fluorobenzoate. J. Label. Compd. Radiopharm. 44, 509-519 (2001).
- Bergmann, R., Scheunemann, M., Heichert, C., Mäding, P., Wittrisch, H., Kretzschmar, M., Rodig, H., Tourwe, D., Iterbeke, K., Chavatte, K. Biodistribution and catabolism of 18F-labeled neurotensin(8-13) analogs. Nucl. Med. Biol. 29, 61-72 (2002).
- Guenther, K. J., Yoganathan, S., Garofalo, R., Kawabata, T., Strack, T., Labiris, R., Dolovich, M., Chirakal, R., Valliant, J. F. Synthesis and in vitro evaluation of 18F- and 19F-labeled insulin: a new radiotracer for PET-based molecular imaging studies. J. Med. Chem. 49, 1466-1474 (2006).
- Zhang, X., Cai, W., Cao, F., Schreibmann, E., Wu, Y., Wu, J. C., Xing, L., Chen, X. 18F-labeled bombesin analogs for targeting GRP receptor-expressing prostate cancer. J. Nucl. Med. 47, 492-501 (2006).
- Murakami, Y., Takamatsu, H., Taki, J., Tatsumi, M., Noda, A., Ichise, R., Tait, J. F., Nishimura, S. 18F-labelled annexin V: a PET tracer for apoptosis imaging. Eur. J. Nucl. Med. Mol. Imaging. 31, 469-474 (2004).
- Yagle, K. J., Eary, J. F., Tait, J. F., Grierson, J. R., Link, J. M., Lewellen, B., Gibson, D. F., Krohn, K. A. Evaluation of 18F-annexin v as a PET imaging agent in an animal model of apoptosis. J. Nucl. Med. 46, 658-666 (2005).
- Vaidyanathan, G., Zalutsky, M. R. An improved synthesis of N-succinimidyl 4-[18F]fluorobenzoate and its application to the labeling of a monoclonal antibody fragment. Bioconjugate Chem. 5, 352-356 (1994).
- Garg, P. K., Garg, S., Zalutsky, M. R. Fluorine-18 labeling of monoclonal antibodies and fragments with preservation of immunoreactivity. Bioconjugate Chem. 2, 44-49 (1991).
- Cai, W., Olafsen, T., Zhang, X., Cao, Q., Gambhir, S. S., Williams, L. E., Wu, A. M., Chen, X. PET imaging of colorectal cancer in xenograft-bearing mice by use of an 18F-labeled T84.66 anti-carcinoembryonic antigen diabody. J. Nucl. Med. 48, 304-310 (2007).
- Cai, W., Chen, X. Multimodality molecular imaging of tumor angiogenesis. J. Nucl. Med. 49, 113-128 (2008).
- Jong, M. d. e., Breeman, W. A., Kwekkeboom, D. J., Valkema, R., Krenning, E. P. Tumor imaging and therapy using radiolabeled somatostatin analogues. Acc. Chem. Res. 42, 873-880 (2009).
- Fani, M., André, J. P., Maecke, H. R. 68Ga-PET: a powerful generator-based alternative to cyclotron-based PET radiopharmaceuticals. Contrast Media Mol. Imaging. 3, 53-63 (2008).
- Shokeen, M., Anderson, C. J. Molecular imaging of cancer with copper-64 radiopharmaceuticals and positron emission tomography (PET. Acc. Chem. Res. 42, 832-841 .
- McBride, W. J., Sharkey, R. M., Karacay, H. C., D'Souza, A., Rossi, E. A., Laverman, P., Chang, C. -. H., Boerman, O. C., Goldenberg, D. M. A novel method of 18F radiolabeling for PET. J. Nucl. Med. 50, 991-998 (2009).
- Becaud, J., Mu, L., Karramkam, M., Schubiger, P. A., Ametamey, S. M., Graham, K., Stellfeld, T., Lehmann, L., Borkowski, S., Berndorff, D., Dinkelborg, L., Srinivasan, A., Smits, R., Koksch, B. Direct one-step 18F-labeling of peptides via nucleophilic aromatic substitution. Bioconjugate Chem. 20, 2254-2261 (2009).
- Mu, L., Höhne, A., Schubiger, P. A., Ametamey, S. M., Graham, K., Cyr, J. E., Dinkelborg, L., Stellfeld, T., Srinivasan, A., Voigtmann, U., Klar, U. Silicon-based building blocks for one-step 18F-radiolabeling of peptides for PET imaging. Angew. Chem. Int. Ed. 47, 4922-4925 (2008).
- Schirrmacher, R., Bradtmöller, G., Schirrmacher, E., Thews, O., Tillmanns, J., Siessmeier, T., Buchholz, H. G., Bartenstein, P., Wängler, B., Niemeyer, C. M., Jurkschat, K. 18F-labeling of peptides by means of an organosilicon-based fluoride acceptor. Angew. Chem. Int. Ed. 45, 6047-6050 (2006).
- Olberg, D. E., Hjelstuen, O. K., Solbakken, M., Arukwe, J., Karlsen, H., Cuthbertson, A. A novel prosthetic group for site-selective labeling of peptides for positron emission tomography. Bioconjugate Chem. 19, 1301-1308 .
- Wuest, F., Köhler, L., Berndt, M., Pietzsch, J. Systematic comparison of two novel, thiol-reactive prosthetic groups for 18F labeling of peptides and proteins with the acylation agent succinimidyl-4-[18F]fluorobenzoate ([18F]SFB. Amino Acids. 36, 283-295 (2009).
- Vaidyanathan, G., Zalutsky, M. R. Synthesis of N-succinimidyl 4-[18F]fluorobenzoate, an agent for labeling proteins and peptides with 18F. Nat. Protocols. 1, 1655-1661 .
- Guhlke, S., Coenen, H. H., Stöcklin, G. Fluoroacylation agents based on small N.C.A. [18F]fluorocarboxylic acids. Appl. Radiat. Isot. 45, 715-727 (1994).
- Wester, H. J., Hamacher, K., Stöcklin, G. A comparative study of N.C.A. Fluorine-18 labeling of proteins via acylation and photochemical conjugation. Nucl. Med. Biol. 23, 365-372 (1996).
- Wüst, F., Hultsch, C., Bergmann, R., Johannsen, B., Henle, T. Radiolabeling of isopeptide NE epsilon-(γ-glutamyl)-L-lysine by conjugation with N-succinimidyl-4-[18F]fluorobenzoate. Appl. Radiat. Isot. 59, 43-48 (2003).
- Zijlstra, S., Gunawan, J., Burchert, W. Synthesis and evaluation of a 18F-labelled recombinant annexin-V derivative, for identification and quantification of apoptotic cells with PET. Appl. Rad. Isot. 58, 201-207 (2003).
- Mäding, P., Füchtner, F., Wüst, F. Module-assisted synthesis of the bifunctional labeling agent N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB. Appl. Rad. Isot. 63, 329-332 (2005).
- Marik, J., Sutcliffe, J. L. Fully automated preparation of N.C.A. 4-[18F]fluorobenzoic acid and N-succinimidyl 4-[18F]fluorobenzoate using a Siemens/CTI chemistry process control unit (CPCU). Appl. Rad. Isot. 65, 199-203 (2007).
- Johnström, P., Clark, J. C., Pickard, J. D., Davenport, A. P. Automated synthesis of the generic peptide labelling agent N-succinimidyl 4-[18F]fluorobenzoate and application to 18F-label the vasoactive transmitter urotensin-II as a ligand for positron emission tomography. Nucl. Med. Biol. 35, 725-731 (2008).
- Tang, G., Zeng, W. B., Yu, M. X., Kabalka, G. Facile synthesis of N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB) for protein labeling. J Label. Compd. Radiopharm. 51, 68-71 .
- Azarian, V., Gangloff, A., Seimbille, Y., Delaloye, S., Czernin, J., Phelps, M. E., Silverman, D. H. S. Synthesis and liposome encapsulation of a novel 18F-conjugate of ω-conotoxin GVIA for the potential imaging of N-type Ca2+ channels in the brain by positron emission tomography. J. Label. Compd. Radiopharm. 49, 269-283 (2006).
- Toretsky, J., Levenson, A., Weinberg, I. N., Tait, J. F., Uren, A., Mease, R. C. Preparation of F-18 labeled annexin V: a potential PET radiopharmaceutical for imaging cell death. Nucl. Med. Biol. 31, 747-752 (2004).
- Glaser, M., Arstad, E., Luthra, S. K., Robins, E. G. Two-step radiosynthesis of [18F]N-succinimidyl-4-fluorobenzoate ([18F]SFB. J. Label. Compd. Radiopharm. 52, 327-330 (2009).
- Carroll, M., Yan, R., Aigbirhio, F., Soloviev, D., Brichard, L. The first nucleophilic synthesis of 3-[18F]fluoroethylbenzoate. J. Nucl. Med. 49, 303P-303P (2008).
- Stone-Elander, S., Elander, N. Microwave application in radiolabeling with short-lived positron-emitting radionuclides. J. Label. Compd. Radiopharm. 45, 715-746 (2002).
- Guo, N., Alagille, D., Tamagnan, G., Price, R. R., Baldwin, R. M. Microwave-induced nucleophilic [18F]fluorination on aromatic rings: synthesis and effect of halogen on [18F]fluoride substitution of meta-halo (F, Cl, Br, I)-benzonitrile derivatives. Appl. Rad. Isot. 66, 1396-1402 (2008).
- Mandap, K. S., Ido, T., Kiyono, Y., Kobayashi, M., Lohith, T. G., Mori, T., Kasamatsu, S., Kudo, T., Okazawa, H., Fujibayashi, Y. Development of microwave-based automated nucleophilic [18F]fluorination system and its application to the production of [18F]flumazenil. Nucl. Med. Biol. 36, 403-409 (2009).
- Scott, P. J. H., Shao, X. Fully automated, high yielding production of N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB), and its use in microwave-enhanced radiochemical coupling reactions. J. Label. Compd. Radiopharm. 53, 586-591 (2010).
- Tang, G., Tang, X., Wang, X. A facile automated synthesis of N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB) for 18F-labeled cell-penetrating peptide as PET tracer. J. Label. Compd. Radiopharm. 53, 543-547 (2010).
- Olma, S., Liu, K., Chen, Y. -. C., Dam, R. v. a. n., Shen, C. K. -. F. Microfluidic Droplet Mixer for Fluorine-18 Labeling of Biomolecules. J. Label. Compd. Radiopharm. 52, S10-S10 (2009).
- Olma, S., Lambert, J., Barnhardt, E., Liu, K., Shen, C. K. -. F., van Dam, R. A compact microwave system for rapid, semi-automated radiosyntheses. J. Label. Compd. Radiopharm. 52, S509-S509 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon