Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Диагностическое вскрытие и выбранной коллекции тканей и образцов у крыс и мышей
В этой статье
Резюме
В этой статье описывается порядок проведения экспертизы основных посмертных от мыши или крысы, и набор основных органов, а также более сложные типы выборки из для гистологического, микробиологических и ПЦР оценки.
Аннотация
Есть несколько типов образцов, которые могут быть собраны из эвтаназии животных в целях диагностики или обнаружить возбудителей инфекционных заболеваний животных в колонии. Правильное коллекции тканей для дальнейшего гистологического обработка может повлиять на качество результатов контроля. В этой статье описывается поведение основных макроскопическом исследовании включая определение сердца, печени, легких, почек и селезенки, а также как собирать эти органы. Кроме того, четыре из наиболее сложных тканей / образец методы коллекции демонстрируются. Коллекция легких и перфузии может быть особенно трудно, так как ткань должна быть должным образом раздуты с фиксатором для того, чтобы внутри ткани исправить должным образом и дать возможность тщательного гистологического оценки. В этой статье показано шаг за шагом технику для удаления легких и раздувать его с фиксатором для достижения оптимальной фиксации ткани в течение 24 часов. Мозг коллекции можно так же трудно, так как ткань мягкая и легко повреждается. В этой статье показано шаг за шагом техника выявить и удалить мозг из черепа с минимальным повреждением тканей. Брыжеечных лимфатических узлов хороший тип образца, в котором для обнаружения многих распространенных инфекционных агентов, как кишечные вирусы сохраняются дольше в лимфатических узлах, чем они пролили в кале. В этой статье показано шаг за шагом процедуры для поиска и удаления асептически брыжеечных лимфатических узлов. Наконец, выявление возбудителей инфекционных заболеваний дыхательных путей может выполняться бактериальной культуры или ПЦР тестирование носа и / или бронхиальной жидкости всасывает принято на вскрытии. Эта процедура описывает получение и подготовку дыхательных образца аспирата для бактериальной культуры и ПЦР-тестирование.
протокол
1. Подготовка к вскрытии
- Важная часть любой макроскопическом исследовании посмертных (брутто вскрытия) являются история животных и описание результатов.
- Ветеринарный патолог читать ваши гистопатология слайды, возможно, не видели животное и полагается на вас за справочной информации.
- Опишите точно, что вы видите перед собой усыпить животное. Например, "женская мышь, одна из пяти в клетке; C57BL/6N, голова наклонена вправо" или "коричневой самцов крыс, напряжение неизвестно; животное царапин, есть пятнистый выпадение волос на спинке, около хвоста и голова ".
- Используйте ясно, описательные, объективный язык. Модификаторы, такие как "мягкие", "умеренный" и "тяжелой" может быть полезно, если отключений между уровнями четко разграничены. Описание вещей с точки зрения продовольственной или бытовые предметы, как правило, не рекомендуется.
- Взвешивания и измерения животных, находки, или органы часто бывает полезно. "Большой селезенки", чтобы Вы могли бы быть нормальной селезенки в другой наблюдатель. Сказать, что селезенка меры 3см х 1,5 см обеспечивает более объективную информацию.
- Photodocumentation может иметь неоценимое значение.
- Соблюдайте все соответствующие гигиены и индивидуальной защиты, необходимые для работы с живыми животными, потенциально инфекционных туши, или химических веществ, таких как формалин.
2. Валовой место вскрытие и исследование сердца, легких, печени, почек и селезенки
- Соберите необходимые материалы до эвтаназии животных. Как минимум, это должно включать плату рассечение или аналогичных рабочую поверхность, пинцеты, ножницы, наклейки для контейнеров, фиксатора, и любые средства массовой информации или сбор трубы / чашки, которые потенциально могут быть необходимы.
- Кратко оценки состояния, поведения, и движения животного. Наблюдать и записывать дыхание моделей (например, быстрое, мелкий), а также возможность амбулаторного и походки (например, хромая, кружит, тремор).
- Усыпить животное в соответствии со стандартными процедурами в вашем учреждении, всегда придерживаясь AVMA руководящих принципов.
- Оценка состояния организма животного для кожи и шерсти нарушения, истощение, или обезвоживания. Обратите внимание на каких-либо искусственных манипуляций, имплантанты, или хирургических рубцов.
- Проверьте все внешние отверстия (уши, глаза, нос, ануса, половых отверстий, и полости рта). Использование рассекает сферу рекомендуется для более тесного наблюдения.
- Положите эвтаназии мыши или крысы тушу в спинных лежачее положение на чистую борту рассечение или аналогичных рабочей поверхности.
- Использование ножницы, надрезать кожу по всей длине нижняя из ануса к подбородку, отражающие кожи и надрезание брюшной стенки, подвергая брюшной полости, слюнных и препуциальный / клиторальный железы и шейки матки и подмышечных лимфатических узлов. Вырезать грудной клетки для выявления и изучения внутренних органов грудной, сделав два сокращения боков до каждой стороне грудной клетки, то в поперечнике, в верхней части грудины, чтобы открыть пространство достаточно широким, чтобы тщательно изучить все доли легких.
- Проверьте появление опорно-двигательного аппарата структуры.
- Оцените все органы для отклонения. В частности найти и идентифицировать сердце и легкие в грудной полости. В частности найти и идентифицировать печени, почек и селезенки в брюшной полости. Обратите внимание на любые изменения цвета, различия в размерах, и пропавших без вести или mislocated органов. Обратите внимание на последовательность поверхностей, любые дополнительные ткани (например, массы), жидкость карманы, или наличие жидкости в брюшной / грудной полости.
- Обратите внимание на желудочно-кишечный тракт за содержание или отсутствие содержания, обращая особое внимание на утолщенными стенками, массы и / или кровотечения. Надрезать почки (слева продольного сечения, щелкните правой кнопкой сечения, на средней линии, но не в центре) с помощью скальпеля или лезвия бритвы и проверить паренхимы для каких-либо отклонений. Проверьте брыжейки для увеличения лимфатических узлов и / или массы.
- Изучить мочеполовой системы, ищет завалов, жидкость карманы, кровоизлияния или другие нарушения.
3. Посмертные коллекция сердца, печени, почек и селезенки гистопатология
- Соберите соответствующего размера, маркированный контейнер (ы), наполненный подходящим размере 10% нейтральный буферный формалин (НБФ). Отрегулируйте размере 10% NBF с целью получения 20:01 Отношение фиксатором для ткани.
- Место мыши или крысы тушу в спинных лежачее положение на чистую борту рассечение или аналогичных рабочую поверхность и подвергать ткани интересов.
- Удаление ткани от туши использованием щипцы и ножницы.
- Ткань должна быть тесно обрезается, чтобы удалить жир и ненужные соединительной ткани. Ткань должна быть чистой крови; использовать обычные (или физиологический) раствор) для полоскания при необходимости. Никогда не используйте дистиллированную или водопроводную воду для полоскания тканей.
- Место ткани в контейнере 10% NBF.
4. Посмертные сбора и перфузии легочной ткани
- Соберите соответствующего размера, маркированный контейнер (ы), наполненный подходящим размере 10% NBF. Отрегулируйте размере 10% NBF с целью получения 20:01 Отношение фиксатором для ткани.
- Место мыши или крысы тушу в спинных лежачее положение на чистую борту рассечение или аналогичных рабочей поверхности.
- Expose трахеи, сердца и легких.
- Использование ножницами и щипцами удалить кожу и мышцы вышележащих вентральной грудного и шейного регионах.
- Использование ножницы и пинцет, удалите грудную клетку подвергая сердца и легких, делая 2 сокращения боков до каждой стороне грудной клетки, то через возле ключицы, чтобы открыть пространство достаточно широким, чтобы тщательно изучить все доли легких.
- Срежьте мышц шеи простирается от грудины и ребер в челюсть, в том числе вышележащих трахеи.
- Вставить ножницы под передним краем грудной клетки и сделать 2 порезы, по одному с каждой стороны, чтобы удалить часть кости вышележащих трахеи.
- Возьмитесь трахеи возле челюсть щипцами и вырезать полностью через трахею с помощью ножниц, расположенных выше щипцы
- Аккуратно буксир трахеи вверх использованием щипцов, Ножницы вентральной соединения ткани с помощью ножниц, пока весь набор грудной ткани (трахеи, легких и сердца, это иногда называется "срывать") была удалена из организма.
- Положите легких квартира на рабочей поверхности.
- Свободно галстук часть шовного материала или кухни вьются вокруг трахеи заботясь, чтобы не тянуть туго.
- Заполните шприц с фиксатором и прикрепить иглу, которая достаточно мала, чтобы войти в трахею. Для мышей, 1 мл или 3 мл шприц с иглой 26 работает хорошо. Для крыс, 5 мл шприц с 18 калибра шприц работает хорошо.
- Вставьте иглу в отверстие трахеи и использовать щипцы провести трахеи окружающих иглы. Начните медленно заполнения легких с фиксатором.
- Заполните легких, пока полностью надут. Не пере-или underinflate. Количество фиксатора, необходимых для полного раздувать легкие варьируется в зависимости от возраста, процедить, и здоровье животных.
- Чрезмерная инфляция обнаруживается жидкость просачивается и вспенивание из легких тканей.
- Недостаточное давление обнаруживается легких появляются плоские и не полное во всех областях.
- Удалите иглу из трахеи.
- Затяните шовный материал или строки окружающие трахею для предотвращения обратного потока фиксатор из легких.
- Место завышенным легких в использовании фиксатора приблизительный 20:01 фиксатора на ткань отношение.
5. Посмертные коллекция мозга
- Соберите соответствующего размера, маркированный контейнер (ы), наполненный подходящим размере 10% NBF. Отрегулируйте размере 10% NBF с целью получения 20:01 Отношение фиксатором для ткани.
- Место эвтаназии мыши или крысы тушу с брюшной лежачее положение на чистую борту рассечение или аналогичных рабочей поверхности.
- Использование ножницы и щипцы, удалить кожу и мышцы вышележащих черепа.
- Использование ножниц удалить голову полностью от туши.
- Использование маленькие ножницы вставки нижней лезвие в затылочное отверстие, открытие которой череп открывается в спинномозговой канал, и держать ножницеобразный советы указал вверх, начните вырезать прямо вверх и через среднюю линию черепа.
- Использование щипцов, отражают назад обе половины черепа подвергая головной мозг.
1. Если возможно, поместите подвергается мозг в фиксатор в то же время в черепе. Это позволит ткани, чтобы стать фирмой до снятия с черепом, если это требуется. Многие предпочитают патологи, что разделы вырезаны из мозга в то же время в черепе.
- Аккуратно переверните черепа так, что гравитация поможет ткани выпасть из черепа.
- Использование изогнутых щипцов, тщательно слайд пинцетом вдоль внешнего края головного мозга и в головном мозге, начиная с обонятельных долей, транспортируемых в головном мозге и в сторону мозжечка. Аккуратно шнура с пинцетом любой соединительной ткани и нервов, которые препятствуют мозга от падения с черепом.
- Место мозг в фиксатор использованием приближенных 20:01 Отношение ткани фиксатором.
6. Посмертные коллекция брыжеечных лимфатических узлов (МЛН)
- Ткани коллекции для ПЦР-анализа должны быть сделано с использованием асептических условиях. Пламя стерилизовать, автоклаве или, что эквивалентно стерилизовать инструменты должны быть использованы.
- Соберите стерильные пробирки Эппендорф и стерильные ножницы и пинцет.
- Место эвтаназии мыши или крысы тушу в спинных лежачее положение на чистую борту рассечение или аналогичных рабочей поверхности.
- Использование стерилизованные ножницы и щипцы надрезать вентральной брюшной стенки от области половых органов до основания грудной клетки, Удаление кожи и мышц и подвергая кишечника.
- МЛН расположены в брюшной полости в брыжеечной ткани вдоль толстой кишки, в непосредственной близости от слепой кишки.
- Чтобы найти МЛН, сначала найти слепой кишки, который является большим, запятая образный кишечника. Толстой кишки простирается от слепой кишки и его часто можно определить наличие фекальных шариков. МЛН расположены в брыжейке по толстой кишке, прилегающих к слепой кишки. Она может быть определена как желтые, овальные или сферические небольшой кусок ткани в белую ткань брыжеечной и часто немного толще и тверже в текстуре, чем окружающие брыжейки и жира. Использование книги анатомии текста, сколько необходимо для ориентации.
- Использование асептических и стерильных инструментов удалить МЛН и поместить в пробирку Эппендорфа помечены идентификационной информации.
7. Посмертные коллекция дыхательных аспирата
- Соберите необходимые материалы - стерильные пипетки, стерильные ножницы и пинцет, стерильные растворы, чтобы быть сброшены через дыхательные пути, а чистая рассекает платы или аналогичных рабочей поверхности.
- Положите эвтаназии мыши или крысы тушу в спинных лежачее положение на вскрытии борту.
- Для бронхиальной аспирации у крыс, доступ дыхательных путей путем трахеи. Для носовых аспирата у крыс, доступ либо через трахею или через носоглотки проход. Для бронхиальной или носовой всасывает у мышей, доступ в дыхательные пути через носоглотки проход.
- Если оба носовой и бронхиальной аспиратов необходимо выполнить бронхиальной аспирации в первую очередь. Выполните носовой аспирата с использованием новой стерильной пипеткой.
- Трахеи доступа (рекомендуемый метод для крыс):
- Отражение кожу от шейной области подвергать подкожных тканей.
- Удаление слюнных желез и шейки мускулатуры подвергать трахеи.
- Использование стерильных инструментов, надрезать трахеи для обеспечения доступа к просвет. Поддерживать асептики всей коллекции (Перейдите к шагу 7.7).
- Носоглотки доступ прохода (носовые аспирации и бронхиальной аспирации, рекомендуемый метод для мышей, из-за меньшего размера трахеи):
- Эта процедура может быть выполнена как для аспирации носовой и бронхиальной аспирации.
- Использование пламени стерилизации или автоклавного инструментов, разорвать височно (челюсть) сустава и отражают челюсти от верхней челюсти, выставляя носоглотки проход. Поддерживать асептики всей коллекции (Перейдите к шагу 7.7).
- Нарисуйте примерно 1 мл отбор проб жидкости в стерильные пипетки. Это может быть физиологический раствор, фосфатным буферным раствором, или Trypticase соевый бульон. (Перейдите к шагу 7.8 или 7.9, в зависимости от аспирации вы собираете.)
- Бронхиальная аспирации:
1. Асептических вставлять пипетки в просвет трахеи, направленной каудально и медленно вводят отбор проб жидкости в бронхах и легких. Вывод выборки жидкости из бронхов и легких в пипетку и удалять пипеткой из трахеи. Не все жидкости вернется в пипетку. Повторите, если больше жидкости необходимо для тестирования.
- Носовые аспирации:
- Асептических вставлять пипетки в носоглотки прохода (мыши) или трахеи просвет (крысы), режиссер краниально, и медленно вводят отбор проб жидкости в полости носа.
- Убедитесь, что полость носа достигается при контакте носовых неба кончиком пипетки или путем наблюдения жидкости вынуждены полости, который рассматривается как менисков, образующихся на носовые отверстия (ноздри) или в виде жидкости видно через полупрозрачные устной неба. Жидкость не должна рассматриваться выходят через рот. Если это так, переориентировать пипетки.
- Вывод выборки жидкости из полости носа в пипетку и удалить из пипетки прохода или трахеи.
- Асептических условиях передачи образца соответствующие средства или контейнера для тестирования.
8. Представитель результаты
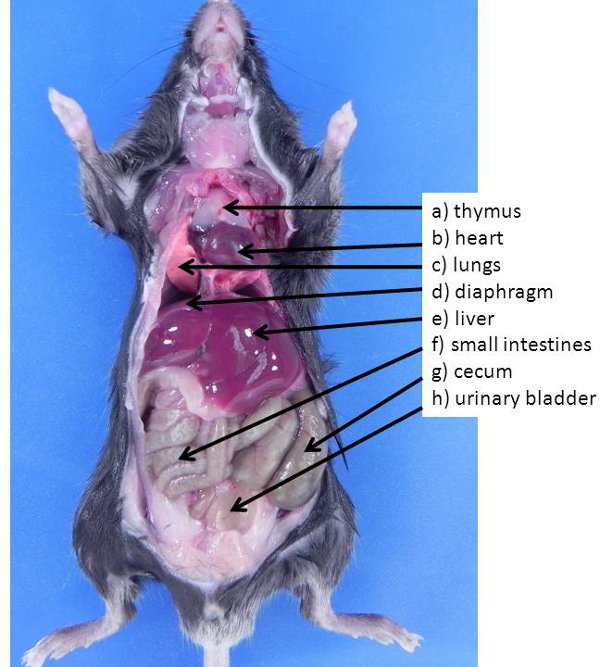
Рисунок 1. Пресса и органов грудной клетки в мышь. Эти органы, как правило, видны при животное в первый раз открыл (ни один из органов были перемещены подвергать других органов также присутствует в брюшной полости).) Вилочковой железы, б) сердце, в) легкие, г) диафрагма, е), печени , е) тонкий кишечник, г) слепой кишки, ч) мочевого пузыря.

Рисунок 2. Брюшной полости и забрюшинного органов в мышь. Если кишечник и печень поднимать и перемещать (или удалить), эти органы окн не было видно.) печени (для справки), б) кишечник (для справки), в) желудка, г) селезенки, е), почек, е) нисходящей ободочной кишки, г) матки.
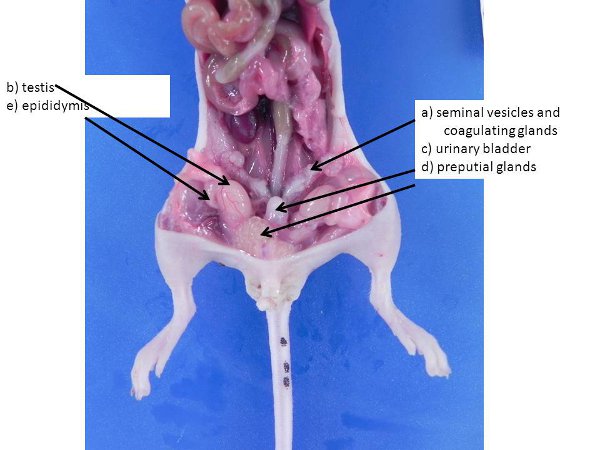
Рисунок 3. Мужских половых органов. Они могут быть больше, в крупных и половозрелых самцов.) Семенных пузырьков и коагулирующих желез, б) яичка (втолкнули в брюшную полость от мошонки через паховые кольца, которые остаются открытыми для мышей и крыс), в) мочевого пузыря, г) препуциальный желез, е), придатка яичка.
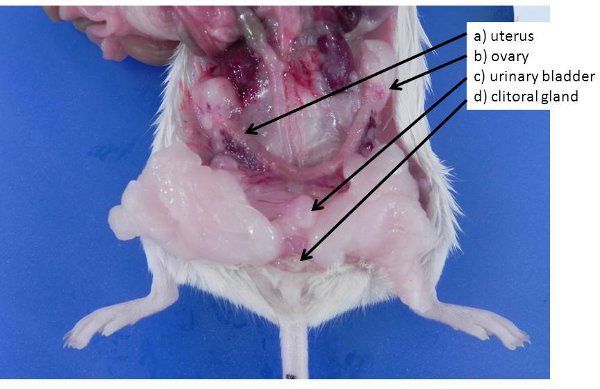
Рисунок 4. Женских половых органов.) Не беременной матки (мышей и крыс двурогий матки) б) яичников, похоронен в жировой ткани яичников, в) мочевого пузыря, г) клиторальный желез (аналог мужской препуциальный желез) .
Обсуждение
Сбор данных в конце исследования могут потребовать вскрытии животных. Опишите также то, что видел и помню, чтобы изучить все ткани. Эти процедуры предназначены прежде всего для оптимизации вскрытия и отбора образцов для эпиднадзора за инфекционными болезнями, но большинство из них лег...
Раскрытие информации
Авторы всех сотрудников лаборатории грызунов Чарльз реки диагностической лаборатории, где эти услуги предоставляются на коммерческой основе.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент имя | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| Обрезная доска | Thermo Electron Corp Cat # 36114 | Cat # 36114 | |
| Малый ножницы | ROBOZ | RS-5910, G204 | 23 мм лезвия, 3,5 "длины, прямой |
| Средний ножницы | ROBOZ | RS-6808, G207 | 5 " |
| Большие ножницы | ROBOZ | RS-6826, G65 " | 6.25 " |
| Пинцет-изогнутые | ROBOZ | RS-8254 (M1/21004) | 4,5 ", зубчатые, небольшой кривой |
| Пинцет-Microdissecting | ROBOZ | RS-5238 | Хадсон-(Эвальд) |
| Пинцет хирургический пинцет- | ROBOZ | RS - 8160 | Крыса зуба |
| Пламя стерилизатор | Оксфорд лабораторное продукты | Bacti-Cinerator # 5889-001007 | |
| Скальпель | Рак Diagnostics, Inc | Finger Скальпели # 60, Cat # FS0060 | |
| Пипетки | VWR | Пастера Пипетируйте 5 3 / 4 ", Cat # 14672-400 | |
| Автоклав сумки | Правильное компании Производство | Стерилизатор бумажный мешок сумки Cat # 021002 (3100923) E09110 | Для пипетки Пастера |
| Внесите лампы | VWR | Cat # 56310-240 | |
| Эппендорф труб | Sarstedt | SafeSeal 2 мл микропробирок, Ref # 72,695 | |
| Эппендорф труб | Аргос | 5 мл Cat микропробирку # T20765-C | |
| Шприц | BD (Бектон Дикенсон) | 1 мл-309 602 3 300 910 мл-5 мл, 10 мл 309603 Cat # 309604 20 мл Cat # 309661 | |
| Хвоя | BD | 26G-18G-309 625 305 195 | |
| Нейтральный буферный формалин | VWR | 20L 10% NBF, Cat # 16004-128 | |
| Солевой | ThermoScientific | Буферизацией Банк крови Saline, Cat # 23-309-178 | |
| Trypticase соевом бульоне | Бектон Дикенсон | БСЭ: обезвоженные, Cat # 211825 | |
| Фосфатным буферным солевым раствором | Sigma Aldrich | HA буфера, Cat # P3813-10PAK | |
| Формалин чашки | VWR | 4 унции Cat # 36318-852 8 унций Cat # 36318-860 16oz Cat # 36318-858 | |
| Большой формалина чашки | Окридж продукты | 32oz контейнер Cat # 0432-1100 | |
| Большой формалина чашки | VWR | HDPE Многоцелевой 160oz Cat контейнер # 89038-282 | |
| Шовный материал | Генри Шайн | Плетеный шелк хирургический шов, Ref # 100-5000, M766750 | Для мыши инфляции легких |
| Шпагат | Скобы | Cat # QUA-46173 | Для крыс инфляции легких |
Ссылки
- AVMA. . AVMA Guidelines on Euthanasia. , (2007).
- Feldman, D. B., Seely, J. C. . Necropsy Guide: Rodents and the rabbit. , (1988).
- King, J. M., Dodd, D. C., Roth, L. . The Necropsy Book. , (2006).
- Kittel, B. Revised guides for organ sampling and trimming in rats and mice--Part 2. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 413-431 (2004).
- Komarek, V., Fox, J. G. Chapter 1. The Mouse in Biomedical Research. , 1-22 (2007).
- Morawietz, G. Revised guides for organ sampling and trimming in rats and mice--Part 3. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 433-449 (2004).
- Popesko, P., Raijtová, V., Horák, J. . Colour Atlas of Anatomy of Small Laboratory Animals. 2, 91-106 (2002).
- Ruehl-Fehlert, C. Revised guides for organ sampling and trimming in rats and mice--part 1. Exp Toxicol Pathol. 55, 91-106 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены