È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Generazione di microsfere di alginato per applicazioni biomediche
In questo articolo
Riepilogo
Nelle sezioni seguenti, si delineano le procedure per la preparazione di microsfere di alginato per l'uso in applicazioni biomediche. Specificatamente illustrano una tecnica per creare multistrato alginato microsfere per il duplice scopo di incapsulamento delle cellule e proteine come potenziale trattamento di diabete di tipo 1.
Abstract
Materiali a base di alginato hanno ricevuto una notevole attenzione per le applicazioni biomediche a causa della loro natura idrofila, biocompatibilità e architettura fisica. Le applicazioni includono l'incapsulamento delle cellule, la consegna della droga, delle cellule staminali della cultura, e impalcature di ingegneria dei tessuti. In realtà, studi clinici sono attualmente eseguite in cui isolotti sono incapsulati in alginato microperline rivestite PLO come trattamento di diabete tipo. Tuttavia, un gran numero di isolette sono necessari per efficacia a causa trapianto scarsa sopravvivenza seguente. La capacità di stimolare a livello locale la formazione di microvascolare rete intorno alle cellule incapsulate possono aumentare la loro redditività attraverso il miglioramento dei trasporti di ossigeno, glucosio e altri nutrienti vitali. Fibroblast Growth Factor-1 (FGF-1) è un fattore di crescita naturale che è in grado di stimolare la formazione di vasi sanguigni e migliorare i livelli di ossigeno nei tessuti ischemici. L'efficacia di FGF-1 è aumentata quando si è consegnato in una sustained moda piuttosto che un unico grande-bolo amministrazione. Il locale a lungo termine rilascio di fattori di crescita da sistemi di incapsulamento delle isole possano stimolare la crescita dei vasi sanguigni direttamente verso le cellule trapiantate, potenzialmente migliorare i risultati innesto funzionali. In questo articolo, si delineano le procedure per la preparazione di microsfere di alginato per l'uso in applicazioni biomediche. Inoltre, si descrive un metodo che abbiamo sviluppato per la generazione di microsfere di alginato multistrato. Le celle possono essere incapsulati in alginato nucleo interno, e le proteine angiogeniche nello strato esterno alginato. Il rilascio di proteine da questo strato esterno potrebbe stimolare la formazione di reti locali microvascolari direttamente verso le isole trapiantate.
Protocollo
Il protocollo qui descrive una procedura in tre fasi per la generazione di microperle alginato multistrato (Figura 1). In primo luogo, microperle alginato sono formati (Figura 2A). Questa procedura è descritta nella sezione 1 di seguito. Cellule o proteine può essere aggiunta alle microperline in questa fase in modo da agire come un sistema di consegna. Il passo successivo comporta la formazione di uno strato di permeazione selettiva delle microperline e viene descritto nella sezione 2. La fase finale consiste nella formazione di uno strato supplementare e alginato è descritto nella sezione 3. Questa forma uno strato all'esterno della superficie dei granuli (Figura 2B) può essere utilizzata per incapsulare e fornire molecole terapeutiche (Figura 2C) per dirigere risposta cellulare al trapianto seguente sistema.
1. Alginato microsfere Preparazione
- Preparare una 1,5% (w / v) soluzione di alginato LVM sciogliendo 15 g di alginato LVM in 1 mL dialginato soluzione strato interno (25 mM tampone HEPES, 118 mM NaCl, 5,6 mM KCl, e 2,5 mM MgCl 2 in acqua deionizzata, regolato a pH 7,4). Miscelare con un vortex finché la potenza alginato è completamente disciolta per formare una soluzione limpida, viscosa. Nota: Questo protocollo descrive condizioni ottimali per l'incapsulamento isoletta entro microcapsule alginato 1 La concentrazione e la composizione del alginato microsfere può essere alterato per regolare le proprietà per altre applicazioni (per esempio farmaci consegna, ingegneria dei tessuti, ecc) Nota:. Per incapsulamento isolotto gli isolotti possono essere aggiunti alla soluzione di alginato in questa fase prima di caricare nel microencapsulator.
- Preparare la soluzione di reticolazione (22 mM CaCl 2 in acqua DI) disciogliendo 100 mM CaCl 2 e 10 mM di tampone HEPES in acqua deionizzata e regolando a pH 7,4. Nota: altri cationi bivalenti come Br 2 +, Sr 2 + etc può essere usato al posto di Ca 2 +, a seconda della natura di gelificazione d alginatoesired.
- Impostare due canali microencapsulator giacca aria alginato aggiungendo un ago calibro 25 ad una siringa, e regolare le valvole su ogni lato per assicurarsi che l'ago si trova al centro della giacca aria. Aghi di calibro differenti possono essere utilizzati per questa fase, a seconda delle dimensioni delle microsfere mirate alginato.
Questa fase può anche essere effettuata con una siringa, non dovrebbe essere uno microencapsulator disponibile. Aggiungere la soluzione di alginato alla siringa, e selezionare un ago calibro sulla base delle dimensioni di microperle desiderati. - Inserire un pallone contenente 10 ml di soluzione di reticolazione direttamente sotto l'ago. Mettere una barra di agitazione nella soluzione.
- Iniettare goccioline direttamente nella soluzione di CaCl 2 per reticolare il alginato per formare microsfere. Incubare le perle nella soluzione di reticolazione per la cura per almeno quindici minuti, mescolando continuamente.
- Trasferire le microsfere una provetta da centrifuga da 15 mL. Rimuovere la soluzione residua,ed eseguire tre lavaggi con CaCl 2 0.2% in soluzione fisiologica per due minuti ciascuno.
2. Rivestimento delle microsfere con poli-L-ornitina
- Preparare 3 mL di una soluzione 0,1% (w / v) di poli-L-ornitina (OLP) in soluzione fisiologica. Posizionare la soluzione su un vortice finché non è completamente sciolto, formando una soluzione limpida. Poly-L-lisina (PLL) può essere utilizzato al posto di OLP per questa fase, che risulta in livelli simili di permselectivity.
- Trasferire le microsfere di alginato nella soluzione OLP. Inserire un Vortex per 30 minuti per permettere il tempo OLP sufficiente per interagire con l'alginato formando un policatione-polianione complesso. Alla fine di 30 minuti, dovrebbe esserci un rivestimento bianco chiaramente visibile attorno alle microperline alginato.
- Rimuovere la soluzione OLP, ed eseguire tre lavaggi con lo 0,2% CaCl 2 in soluzione salina normale per due minuti ciascuno.
3. Creazione del alginato esterno Layer
- Preparare una soluzione di alginato di concentrazione desiderata che deve essere utilizzato per creare lo strato esterno. La soluzione viene preparata come descritto in (1,1) sopra. La dimensione dello strato esterno è influenzato dalla composizione e la concentrazione di alginato usato (Figura 3).
- Trasferire le microsfere di alginato a una cella-filtro. Utilizzare un Kimwipe per assorbire soluzione in eccesso in modo da asciugare le microperline per quanto possibile.
- Trasferire le microsfere ad una superficie Parafilm. Altre superfici lisce, come vetro o addirittura una capsula Petri di plastica può essere sostituito Parafilm, se desiderato.
- Trasferire la soluzione preparata in alginato (3.1) sulle microsfere di alginato. Il volume di soluzione di alginato essere deve coprire completamente le microperline alginato. Sia le microsfere rimangono nella soluzione di alginato per 45 minuti.
- Usare una pipetta per rimuovere l'eccesso di soluzione di alginato non è vincolata alle microsfere.
- Trasferire le microsfere inad una soluzione di CaCl 2 22mm. Questa reticola soluzione di alginato intorno alle microperline, causando la formazione dello strato distinto alginato esterno.
- Eseguire tre lavaggi con 22 mM CaCl 2 in soluzione salina normale per due minuti ciascuno. Visualizzazione le microperline sotto un microscopio dovrebbe consentire uno strato distinto alginato esterno da vedere formato intorno al nucleo microsfere.
4. Risultati rappresentativi
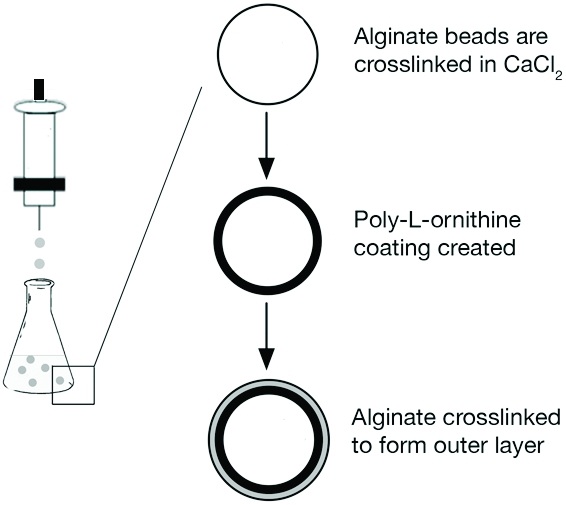
Figura 1. Uno schema della procedura di creazione microperle alginato multistrato. Riprodotto con il permesso di Khanna et al. J Biomed Mater Res A. Novembre, 95 (2), 632-40 (2010).

Figura 2. (A) e (B) sono immagini contrasto di fase di microperle alginato. (A) mostra una microsferedopo la sintesi fase (1,7), mentre (B) mostra uno strato distinto alginato esterno presenti dopo il completamento della fase (3,7). (C) è una immagine di fluorescenza FITC-marcato proteina BSA incapsulate nello strato esterno. Riprodotto con il permesso di Khanna et al. J Biomed Mater Res A. Novembre, 95 (2), 632-40 (2010).

Figura 3. La dimensione dello strato esterno alginato può essere variata in base alla composizione e concentrazione di alginato usato. I nostri risultati mostrano che, sia per LVM e alginato LVG, le dimensioni esterne di livello aumenta con la concentrazione alginato crescente, e che alginato LVG produce più spessi strati esterni di alginato di LVM a concentrazioni uguali. Riprodotto con il permesso di Khanna et al. J Biomed Mater Res A. Novembre, 95 (2), 632-40 (2010).
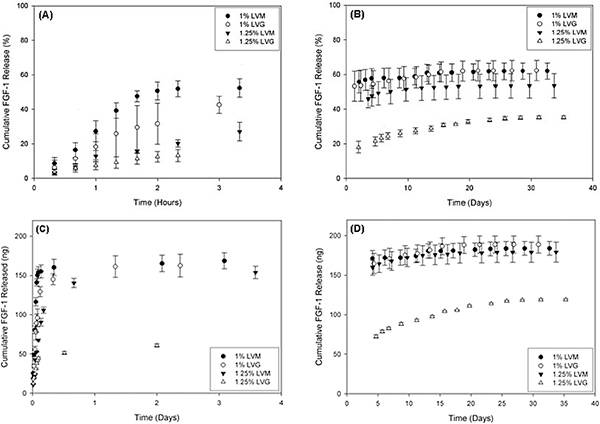
Figura 4. Rilascio di FGF-1, una proteina fattore di crescita angiogenetico, dallo strato esterno alginato variata in base alla concentrazione di LVM e alginato LVG utilizzato. (A) e (B) mostra rilascio cento, e (C) e (D) indica il rilascio corrispondente massa di FGF-1 rispetto al tempo per diverse formulazioni dello strato esterno. C'è una versione scoppio esposti per tutte le condizioni entro i primi 5 h (A e C) e basse dosi di rilascio continuo per un massimo di 30 giorni (B e D). Riprodotto con il permesso di Khanna et al. J Biomed Mater Res A. novembre;. 95 (2), 632-40 (2010) Clicca qui per ingrandire la figura .
Discussione
Alginato è un naturale, polisaccaride acido estratto dalle alghe ed è composto di unità di 1,4 '-β-D-mannuronico (M) e α-L-guluronico acido (G) 2,3. Gelazione semplice verifica quando cationi divalenti, quali Ca 2 +, Sr 2 +, Ba 2 + o interagire con G-monomeri che formano ponti ionici tra le catene adiacenti di alginato. Microperle di alginato sono state utilizzate per fornire una varietà di proteine, inclusi fattore di crescita dei fibroblasti-1 (FGF-1), fattore di c...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo studio è stato supportato dal US Department of Veterans Affairs (Washington DC), le sovvenzioni 0852048 e 0731201, 0854430 e dalla National Science Foundation (Arlington, VA), e Grant RO1 DK080897 dal National Institutes of Health (Bethesda, MD) . Mr. Khanna ricevuto il sostegno di una generosa donazione da Mr. Edward Ross e il dottor Monica Moya dalla Bill & Melinda Gates Foundation (Seattle, WA).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Commenti (opzionale) |
| Pronova ultrapura LVG alginato | Nova-Matrix | 4200006 | Una varietà di formulazioni alginato sono disponibili. La scelta di alginato influenza le proprietà finali dei microperle, tra cui dimensioni, proprietà meccaniche e di trasporto. La composizione utilizzato deve essere ottimizzato per una data applicazione. |
| Pronova ultrapura LVM alginato | Nova-Matrix | 4200206 | Una varietà di formulazioni alginato sono disponibili. La scelta di alginato influenza le proprietà finali dei microperle, tra cui dimensioni, proprietà meccaniche e di trasporto. La composizione utilizzato deve essere ottimizzato per una data applicazione. |
| Poly-L-ornitina cloridrato | Sigma-Aldrich | P2533 |
Riferimenti
- Darrabie, M. D., Kendall, W. F., Opara, E. C. Characteristics of Poly-L- Ornithine-coated alginate microcapsules. Biomaterials. 26, 6846-6852 (2005).
- Yamagiwa, K., Kozawa, T., Ohkawa, A. Effects of alginate composition and gelling conditions on diffusional and mechanical properties of calcium-alginate gel beads. J. Chem. Eng. Jpn. 28, 462-467 (1995).
- Amsden, B., Turner, N. Diffusion characteristics of calcium alginate gels. Biotechnol. Bioeng. 65, 605-610 (1999).
- Uriel, S., Brey, E. M., Greisler, H. P. Sustained low levels of fibroblast growth factor-1 promote persistent microvascular network formation. Am. J. Surg. 192, 604-609 (2006).
- Moya, M. L., Lucas, S., Francis-Sedlak, M., Liu, X., Garfinkel, M. R., Huang, J. J., Cheng, M. H., Opara, E. C., Brey, E. M. Sustained delivery of FGF-1 increases vascular density in comparison to bolus administration. Microvasc. Res. 78, 142-147 (2009).
- Moya, M. L., Cheng, M. H., Huang, J. J., Francis-Sedlak, M. E., Kao, S. W., Opara, E. C., Brey, E. M. The effect of FGF-1 loaded alginate microbeads on neovascularization and adipogenesis in a vascular pedicle model of adipose tissue engineering. Biomaterials. 31, 2816-2826 (2010).
- Khanna, O., Moya, M. L., Greisler, H. P., Opara, E. C., Brey, E. M. Multilayered Microcapsules for the Sustained-Release of Angiogenic Proteins From Encapsulated Cells. Am. J. Surg. 200, 655-658 (2010).
- Khanna, O., Moya, M. L., Opara, E. C., Brey, E. M. Synthesis of multilayered alginate microcapsules for the sustained-release of fibroblast growth factor-1. J. Biomed. Mater. Res. A. 95, 632-640 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon