É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microarray de anticorpos quimicamente bloqueada para Multiplexed perfil de alta capacidade de glicosilação proteína específica em amostras complexas
Neste Artigo
Resumo
Neste estudo, nós descrevemos um protocolo melhorado para um microarray anticorpo multiplexado de alto rendimento com o método de detecção de lectina que pode ser usado em perfil de glicosilação de proteínas específicas. Este protocolo apresenta novos reagentes fiáveis e reduz significativamente o tempo, custo e requisitos de equipamento de laboratório, em comparação com o procedimento anterior.
Resumo
In this study, we describe an effective protocol for use in a multiplexed high-throughput antibody microarray with glycan binding protein detection that allows for the glycosylation profiling of specific proteins. Glycosylation of proteins is the most prevalent post-translational modification found on proteins, and leads diversified modifications of the physical, chemical, and biological properties of proteins. Because the glycosylation machinery is particularly susceptible to disease progression and malignant transformation, aberrant glycosylation has been recognized as early detection biomarkers for cancer and other diseases. However, current methods to study protein glycosylation typically are too complicated or expensive for use in most normal laboratory or clinical settings and a more practical method to study protein glycosylation is needed. The new protocol described in this study makes use of a chemically blocked antibody microarray with glycan-binding protein (GBP) detection and significantly reduces the time, cost, and lab equipment requirements needed to study protein glycosylation. In this method, multiple immobilized glycoprotein-specific antibodies are printed directly onto the microarray slides and the N-glycans on the antibodies are blocked. The blocked, immobilized glycoprotein-specific antibodies are able to capture and isolate glycoproteins from a complex sample that is applied directly onto the microarray slides. Glycan detection then can be performed by the application of biotinylated lectins and other GBPs to the microarray slide, while binding levels can be determined using Dylight 549-Streptavidin. Through the use of an antibody panel and probing with multiple biotinylated lectins, this method allows for an effective glycosylation profile of the different proteins found in a given human or animal sample to be developed.
Introduction
Glycosylation of protein, which is the most ubiquitous post-translational modification on proteins, modifies the physical, chemical, and biological properties of a protein, and plays a fundamental role in various biological processes1-6. Because the glycosylation machinery is particularly susceptible to disease progression and malignant transformation, aberrant glycosylation has been recognized as early detection biomarkers for cancer and other diseases 7-12. In fact, most current cancer biomarkers, such as the L3 fraction of α-1 fetoprotein (AFP) for hepatocellular carcinoma 13-15, and CA199 for pancreatic cancer 16, 17 are all aberrant glycan moieties on glycoproteins. However, methods to study protein glycosylation have been complicated, and not suitable for routine laboratory and clinical settings. Chen et al. has recently invented a chemically blocked antibody microarray with a glycan-binding protein (GBP) detection method for high-throughput and multiplexed profile glycosylation of native glycoproteins in a complex sample 18. In this affinity based microarray method, multiple immobilized glycoprotein-specific antibodies capture and isolate glycoproteins from the complex mixture directly on the microarray slide, and the glycans on each individual captured protein are measured by GBPs. Because all normal antibodies contain N-glycans which could be recognized by most GBPs, the critical step of this method is to chemically block the glycans on the antibodies from binding to GBP. In the procedure, the cis-diol groups of the glycans on the antibodies were first oxidized to aldehyde groups by using NaIO4 in sodium acetate buffer avoiding light. The aldehyde groups were then conjugated to the hydrazide group of a cross-linker, 4-(4-N-MaleimidoPhenyl)butyric acid Hydrazide HCl (MPBH), followed by the conjugation of a dipeptide, Cys-Gly, to the maleimide group of the MPBH. Thus, the cis-diol groups on glycans of antibodies were converted into bulky none hydroxyl groups, which hindered the lectins and other GBPs bindings to the capture antibodies. This blocking procedure makes the GBPs and lectins bind only to the glycans of captured proteins. After this chemically blocking, serum samples were incubated with the antibody microarray, followed by the glycans detection by using different biotinylated lectins and GBPs, and visualized with Cy3-streptavidin. The parallel use of an antibody panel and multiple lectin probing provides discrete glycosylation profiles of multiple proteins in a given sample 18-20. This method has been used successfully in multiple different labs 1, 7, 13, 19-31. However, stability of MPBH and Cys-Gly, complicated and extended procedure in this method affect the reproducibility, effectiveness and efficiency of the method. In this new protocol, we replaced both MPBH and Cys-Gly with one much more stable reagent glutamic acid hydrazide (Glu-hydrazide), which significantly improved the reproducibility of the method, simplified and shorten the whole procedure so that the it can be completed within one working day. In this new protocol, we describe the detailed procedure of the protocol which can be readily adopted by normal labs for routine protein glycosylation study and techniques which are necessary to obtain reproducible and repeatable results.
Protocolo
1. Imprimir um microarray de anticorpos para o Ensaio
- Diluir todos os anticorpos para 0,5 mg / ml em solução salina de tampão fosfato, pH 7,2 (PBS).
- Alíquota 40 uL de cada anticorpo na placa de fonte 384 poços.
- Coloque a placa de fonte de 384-bem para o microarrayer sciFLEXARRAYER Scienion.
- Carregar 20 lâminas de microarray PATH para o microarrayer como alvo.
- Defina o microarrayer para imprimir 48 subarrays idênticas, em que 27 anticorpos e proteínas de controle são vistos em triplicado em um padrão 9x9 (Figura 1E, 1F).
- Inicie o microarrayer para imprimir os slides microarray de anticorpos.
- Colete as lâminas de microarray de anticorpos, e armazená-los em lâminas cassete com dessecante. Aspire selar a cassete em um saco plástico usando vácuo sealer (FoodSaver).
- Armazenar as lâminas microarray seladas a 4 ° C no frigorífico.
2. Quimicamente Bloquear o microarray de anticorpos para Prevenir GBPLigação aos anticorpos de captura
O ensaio é iniciado microarray uma vez que as lâminas microarray são quimicamente bloqueado e dura cerca de 8 horas. Uma vez iniciado o ensaio de microarray tem de ser concluída (Passos 2 a 8).
- Leve o microarray desliza para fora da geladeira, e equilibrar-los à temperatura ambiente por 30 minutos.
- Remover a corrediça a partir da caixa de armazenamento e brevemente enxagúe em tampão fosfato pH 7,2 salina com 0,1% de Tween 20 (PBST0.1) uma vez em uma lâmina de lavagem bacia e, em seguida, em 15 mM de tampão acetato de sódio pH 5,0 com 0,1% de Tween (CBT0 .1) de uma forma sequencial. Incubar as lâminas em CBT0.1 durante 10 minutos em bacia lâmina de lavagem.
- Prepare 150 mM fresco NaIO 4 em 15 mM tampão acetato de sódio pH 5,0 (CB), e mantê-lo em em um slide lavatório em um refrigerador, evitando a luz antes do uso.
- Remova a lâmina do CB, e colocá-lo na bacia contendo NaIO fresco 4 com o lado de anticorposvoltada para cima. Cobrir a bacia com folha de alumínio para evitar a luz, e incubar a bacia corrediça durante 2 horas com agitação suave a 4 ° C num frigorífico.
- Preparar 300 mL de 10 mM de ácido glutâmico hidrazida (o bloqueador) em CB.
- Remover o slide da bacia, e lave-o brevemente no CB 3 vezes durante 5 minutos de cada vez na bacia de slides de lavar roupa.
- Incubar as lâminas no bloqueador numa bacia de lavagem durante 2 horas à temperatura ambiente com agitação suave.
- Retire as lâminas da bacia, e lavá-los com PBST0.1 por 3 minutos.
3. Bloquear ligações não específicas para o Microarray com albumina de soro bovino (BSA)
- Preparar 300 ml de BSA a 1% em tampão fosfato pH 7,2 com Tween salina a 0,5% (PBST0.5) numa bacia lâmina de lavagem, e incubar a corrediça microarray na bacia durante 1 hora à temperatura ambiente com agitação suave.
- Lavam-se as lâminas em PBST0.1 três vezes durante 3 minutos de cada vez.
- Coloque o slideem um porta-lâminas, e centrifugação a 1.200 xg em uma centrifugação durante 2 minutos para secar a corrediça microarray.
4. Imprint Grade cera para o slide Microarray para separar cada subarray
- Pré-aquecimento do impressor de cera, a 70 ° C durante 5 minutos.
- Carregue a lâmina de microarray bloqueado no imprinter cera com anticorpo lado virado para a cera. Puxe delicadamente a alça de cera marca na lâmina uniformemente.
5. Aplicar amostras de soro para o slide Microarray
- Durante o Passo 2.4, preparar amostras de soro para qualquer ensaio de perfil glico em uma amostra (5.1.1), ou único glico medição epiptope entre várias amostras (5.1.2).
- Em uma experiência para os profilings glicano de múltiplas glicoproteínas em uma amostra de soro usando GBPs múltipla (ver exemplo de experimento 1), uma amostras de soro irá ser aplicado sobre todos os subarrays. Neste caso, 40 uL ampla soro é diluído em 360 ul de PBS contendo 0,1%Tween-20, 0,1% de Brij 35, 100 ug / mL de IgG de rato, 100 ug / mL de rato IgG, 100 ug / mL de IgG de coelho, 100 ug / mL de IgG de cabra e 100 ug / ml de burro IgG. Este volume é suficiente para a aplicação de 6 uL de solução de soro diluído em cada subarray.
- Em uma experiência para a medição de glicano um em várias proteínas séricas entre múltiplas amostras de soro utilizando um detecções GBP (ver experiência amostra 2). Neste caso, 1 ul ampla soro é diluído em 9 ul de PBS contendo 0,1% de Tween-20, 0,1% de Brij 35, 100 ug / mL de IgG de rato, 100 ug / mL de rato IgG, 100 ug / mL de IgG de coelho , 100 ug / mL de IgG de cabra e 100 ug / mL de burro IgG. Este volume é suficiente para a aplicação de 6 uL de solução de soro diluído em cada subarray.
- Após impressão de cera no Passo 4, cuidadosamente aplicar 6 uL das amostras diluídas ou amostras de controlo (PBST0.1) para cada subarray da lâmina. Incubar a lâmina em um cassete umidificado com toalhas de papel molhadas em temperatura ambientedurante 1 hora.
- Lavar a lâmina com PBST0.1 três vezes para 3 minutos de cada vez.
- Secar a lâmina girando-o em 1200 xg por 2 minutos.
6. Aplicar GBP biotinilado (anticorpo ou Lectina Anti-glicano) para o slide
- Durante o Passo 2.4, preparar 10μg/ml de lectinas biotiniladas / Gbps em PBST0.1.
- Em glicano experimento perfil que sonda uma amostra com lectinas múltiplos (exemplo de experimento 1), preparar 350 uL de lectina biotinilada que é suficiente para todos os subarrays.
- Em único epítopo de triagem / biomarcador glicano em amostras múltiplas usando lectinas múltiplas, preparar 10 uL de cada lectina biotinilado que é suficiente para uma subarray.
- Aplicar 6 uL da lectina diluída biotinilado (s) para cada subarray da lâmina, e incubar na caixa corrediça humidificada com toalhas de papel molhado à temperatura ambiente durante 1 hora.
- Lavar as lâminas com PBST0.1 três vezes por 3 minutos cada time.
- Secar a lâmina girando-o em 1200 xg em centrífuga de 2 minutos.
7. Aplicar NeutrAvidin Identificada Dye para detecção da fluorescência
- Prepare-se 350 uL de Dylight NeutrAvidin 549 rotulado que é suficiente para todos os subarrays.
- Aplicar 6 uL de Dylight NeutrAvidin 549 rotulados para cada subarray, e incubar a lâmina na cassete de corrediça humidificada à temperatura ambiente durante 1 hora.
- Lavar a lâmina com PBST0.1 três vezes para 3 minutos de cada vez.
- Secar a lâmina girando a ele em 1200 xg em centrífuga de 2 minutos.
8. Obter Microarray de corrediça da imagem por varredura do Slide
- Digitalização do slide usando um scanner de microarray de fluorescência em resolução de 10 mM. Os parâmetros utilizados e PMT deve ser o mais forte possível, mas nenhum ponto de saturação é observado.
9. Extração de dados e análise
- Abra a imagem no ArrayPro 3.2.
- Configure o modelo de matriz de acordo com o mapa matriz que mostra os pontos dos locais de anticorpos. Cuidadosamente alinhar cada círculo do molde para o ponto correspondente na imagem.
- Extrai-se a intensidade de cada mancha em um arquivo Excel para análise posterior.
10. Os resultados representativos
Experimento Amostra 1
Perfil de glicosilação de múltiplas glicoproteínas em hepatocelular amostra do paciente carcinoma soro usando microarray anticorpo quimicamente bloqueada com detecção lectinas múltipla.
O objetivo deste experimento é explorar o perfil de glicosilação indivíduo de 20 glicoproteínas no carcinoma hepatocelular (HCC) amostra de soro do doente através de microarray de anticorpos quimicamente bloqueada com detecção de lectina. Um microarray anticorpo, que contém 48 subarrays idênticos que incluem anticorpos e 26 biotina-BSA, foi concebido e produzido como descrito em Step 1. Estes anticorpos foram 26 contra 20 glicoproteínas que identificados como promissores valor diagnóstico precoce para pacientes com carcinoma hepatocelular usando imunoprecipitação baseado lectina combinada com a identificação da proteína de massa por espectrometria de 12, 32 como mostrado na Tabela 1. O padrão e disposição dos pontos de anticorpos impressas em triplicado em um subarray representativo são apresentados na Figura 1E e 1F, respectivamente. Duas lâminas microarray idênticos, não era um quimicamente bloqueado (Figura 1A), enquanto o outro foi (Figura 1B), foram utilizados para realizar a experiência de perfis mesmo glicosilação, a fim de demonstrar a importância do procedimento quimicamente de bloqueio para a análise. Para a corrediça quimicamente bloqueado (Figura 1B), a experiência começou no Passo 2; para a nenhum corrediça quimicamente bloqueado (Figura 1A), o experimento iniciado a partir do Passo 3. O experimento foi conduzido por following todos os passos descritos no protocolo exceto para a etapa 5.1.2 e 6.1.2. No Passo 5,2, uma amostra de controlo PBST0.1 foi aplicada sobre subarrays na coluna 1 e 3, e um pool HCC amostra de soro foi aplicado sobre subarrays na coluna 2 e 4, respectivamente (como mostrado na Figura 1G). Esta comparação é o de mostrar a eficácia, a eficiência do processo, bem como a afinidade de ligação ao antigénio dos anticorpos após quimicamente bloqueio. 22 lectinas biotinilado (como mostrado na Tabela 1) que específico para glicanos diferentes 18, 20 foram aplicadas em cada subarray como mostrado na Figura 1G para perfilação de glicosilação. Imagens das quimicamente bloqueados (Figura 1B) e não-bloqueado quimicamente (Figura 1A) microarrays após o ensaio de perfil de glicosilação, seguindo o protocolo. Como mostrado nas subarrays na coluna 1 e 3 em não-quimicamente microarrays bloqueados (Figura 1A e Figura 1C), sobre as quaisapenas PBST0.1 foi aplicada, a maioria das lectinas ligado para capturar os anticorpos, e mostrou fundo muito elevada que comparável aos subarrays na coluna 2 e 4, em que a amostra de soro foi aplicado. É impossível obter informações de perfil de glicano este slide microarray. Pelo contrário, quando a mesma experiência foi realizada sobre uma lâmina quimicamente bloqueada anticorpo microarray, os subarrays na coluna 1 e 3, sobre os quais é apenas PBST0.1 foi aplicada, a maioria das lectinas mostrou ligações nenhum ou muito baixo para capturar os anticorpos, enquanto que o antigénio de alto ligações foram ainda observados em subarrays na coluna 2 e 4, em que foi aplicada amostra de soro (Figura 1B e 1D). Estes resultados mostraram o procedimento quimicamente bloqueio foi um passo crítico tona a medição de glicanos de anticorpo capturado glicoproteínas. Seguindo o protocolo, os perfis de glicosilação de 22 glicoproteínas em CHC soro pode ser obtida.
Experimento 2
Tela para fucos alteradosylation em glicoproteínas específicas como biomarcadores para cirrose hepática discriminadas e pacientes com carcinoma hepatocelular.
O objetivo deste experimento é a tela para fucosilação alteradas em glicoproteínas específicas como biomarcadores que discriminam cirrose hepática e carcinoma hepatocelular (HCC) pacientes. Diferente da Experiência 1, em que apenas uma amostra de soro foi aplicado sobre a cada subarrays e sondadas com lectinas vários, neste ensaio, o total de 40 diferentes amostras de soro de HCC e cirrose pacientes foram aplicadas em cada subarray, e sondado com um lectina (AAL ). A análise estatística, tais como teste T, receiver operating-curva característica (ROC), foi feito para avaliar a distribuição ou a realização de diagnóstico da epiptope glicano / biomarcador em cada proteína individual em todas as amostras de soro. Utilizou-se o mesmo anticorpo microarray fabricado na Experiência 1, com excepção para o anti-CA19-9 e anticorpos anti-Lewis X neste estudo. O experiment foi realizado de 02 de setembro para o Passo 9, exceto para o Passo 5.1.1 e 6.1.1. Total de 40 amostras de soro de 20 cirrose e 20 pacientes com carcinoma hepatocelular foram aplicados em subarray aleatória dos 48 subarrays, juntamente com as amostras de controlo de PBS como controlo negativo. Fucosilação de cada proteínas dos capturados foi então detectada usando lectina-fucose específico biotinilado. A imagem microarray mostrado na Figura 1 demonstram a AAL lectina apenas ligada a proteínas séricas capturadas no microarray (Figura 2D) em vez de anticorpos capturados (Figura 2E). As intensidades AAL de ligação de todas as manchas foram então extraídos e analisados usando teste T e as curvas de ROC para avaliar o desempenho do fucosilação (intensidade de ligação AAL) de cada proteína de soro sobre a discriminação entre os grupos e HCC cirrose. Os resultados mostraram que a proteína GP73 de fucosilação deu a melhor discriminação entre os dois grupos com p = 0,03 e área sob acurva da curva de ROC igual a 0,72. Esta experiência demonstrou este procedimento é um método rápido e eficiente para o rastreio de glicano epítopo / biomarcador em amostras múltiplas dentro múltiplas proteínas.
| ID | Nome do reagente | Abreviatura | Companhia | Catalogo |
| L1 | Concanavalina A biotinilado | ConA | Vector Laboratories | BK-1000 |
| L2 | Biotinilado Sambucus Nigra Lectina | SNA | Vector Laboratories | B-1305 |
| L3 | Biotinilado Lens culinaris aglutinina | LCA | Vector Laboratories | BK-2000 |
| L4 | Biotinilado Ricinus communis aglutinina eu | RCA | Vector Laboratories | BK-1000 |
| L5 | Biotinilado Aleuria Lectina Aurantia | AAL | Vector Laboratories | B-1395 |
| L6 | Biotinilado Erythrina Lectina Cristagalli | ECL | Vector Laboratories | BK-3000 |
| L7 | Biotinilado Griffonia (Bandeiraea) Lectina Simplicifolia II | GSL II | Vector Laboratories | BK-3000 |
| L8 | Biotinilado Gérmen de Trigo aglutinina | WGA | Vector Laboratories | BK-1000 |
| L9 | Erythroagglutinin vulgaris biotinilado Phaseolus | PHA-E | Vector Laboratories | BK-2000 |
| L10 | Leucoagglutinin vulgaris biotinilado Phaseolus | PHA-L | Vector Laboratories | BK-2000 |
| L11 | Bioaglutinina de amendoim tinylated | PNA | Vector Laboratories | BK-1000 |
| L12 | Biotinilado Pisum sativum aglutinina | PSA | Vector Laboratories | BK-2000 |
| L13 | Biotinilado Dolichos biflorus aglutinina | DBA | Vector Laboratories | BK-1000 |
| L14 | Lectina Stramonium biotinilado Datura | DSL | Vector Laboratories | BK-3000 |
| L15 | Aglutinina Sophora Japonica biotinilado | SJA | Vector Laboratories | BK-2000 |
| L16 | Aglutinina de soja biotinilado | SBA | Vector Laboratories | BK-1000 |
| L17 | Biotinilado Solanum tuberosum (Batata) Lectina | STL | Vector Laboratories | BK-3000 |
| L18 | Biotinilado griffonia simplicifolia Lectina (Bandeiraea) I | Eu GSL | Vector Laboratories | BK-2000 |
| L19 | Biotinilado Vicia Lectina Villosa | VVL | Vector Laboratories | BK-2000 |
| L20 | Biotinilado Lycopersicon esculentum (tomate) Lectina | LEL | Vector Laboratories | BK-3000 |
| L21 | Ulex biotinilado Europaeus aglutinina eu | UEA I | Vector Laboratories | BK-1000 |
| L22 | Jacalina biotinilado | Jacalina | Vector Laboratories | BK-3000 |
| A1 | F cabra (ab ') 2 Fragmento IgM anti-humana, o anticorpo Fc5μ | IgM | Jackson Immuno Research | 109-006-129 |
| A2 | Burro F (ab ') 2Frag IgG anti-humano de anticorpo (H + L) | AB1 | Jackson Immuno Research | 709-006-149 |
| A3 | De ratinho anti-IgG humana F (ab ') 2 de anticorpo monoclonal | AB3 | Jackson Immuno Research | 209-005-097 |
| A4 | Cabra anti-humano alfa 2 macroglobulina anticorpo policlonal | A2M | GeneTex | GTX62924 |
| A5 | De coelho anti-anticorpo humano alfa-1-antitripsina policlonal | A1AT | Lee Biosiences | CA1T-80A |
| A6 | De ratinho anti-anticorpo humano alfa-1-antitripsina monoclonal | A1AT | Sigma Aldrich | SAB4200198 |
| A7 | De coelho anti-anticorpo humano alfa-1-antitripsina policlonal | ACT | Neomarkers | RB-367-A1 |
| A8 | De coelho anti-humano de alfa-1-antichymotrypsin anticorpo policlonal | ACT | Fisher Scientific | RB9213R7 |
| A9 | Rato anti-humana de anticorpo monoclonal de transferrina | Transferrina | GeneTex | GTX101035 |
| A10 | De coelho anti-anticorpo humano policlonal de transferrina | Transferrina | GeneTex | GTX77130 |
| A11 | Cabra anti-humano apolipoproteína anticorpo policlonal J | ApoJ | Abcam | ab7610 |
| A12 | Rato anti-humana de GP73 anticorpo monoclonal | GP73 | Abbott | 14H4-23 |
| A13 | Rato anti-humana de GP73 anticorpo monoclonal | GP73 | Santa Cruz Biotechnology, Inc. | sc-101.275 |
| A14 | De coelho anti-anticorpo humano de alfa-1 fetoproteína policlonal | AFP | GenWay | GWB-41C966 |
| A15 | De ratinho anti-anticorpo humano de alfa-1 fetoproteína monoclonal | AFP | Fitzgerald | 10-A05A |
| A16 | Rato anti-humana de anticorpo monoclonal hemopexina | Hemopexina | Assaypro | 60190-05011 |
| A17 | Rato anti-humano glypican-3 (1G12) anticorpo monoclonal | GPL3 | Santa Cruz Bio | sc-65.443 |
| A18 | Rato anti-humano Cininogênio anticorpo (LMW) monoclonal | Cininogênio | Assaypro | 20333-05011 |
| A19 | De coelho anti-anticorpo humano MMP-21 monoclonal | MMP21 | Epitomic | 1955-1 |
| A20 | Rato anti-humano CEACAM-1 anticorpo monoclonal | CEACAM | R & D Systems | MAB1180 |
| A21 | Rat anti-humano DPPIV/CD26 anticorpo monoclonal | DPPIV | R & D Systems | MAB22441 |
| A22 | Rato anti-humano PIVKA anticorpo monoclonal II | PIVICA | Cristal chem | 8040 |
| A23 | Antigénio de ratinho anti-carcinoembriónico | CEA | EUA biológica | C1300 |
| A24 | Antigen de ratinho anti-CA125 Câncer | CA125 | EUA biológica | C0050-01D |
| A25 | Antigénio de ratinho anti-CA19-9 Câncer | CA19-9 | EUA biológica | C0075-18 |
| A26 | De ratinho anti-Lewis anticorpo monoclonal x | Lewis X | Calbiochem | 434631 |
| bio | Biotinilado BSA (controle positivo) | Bio | Home-made | N / A |
Lista Tabela 1. De lectinas e anticorpos utilizados neste protocolo.
| Nome do reagente s / equipamentos | Companhia | Número de catálogo |
| Microarrayer sem contato | BioDot Inc | sciFLEXARRAYER |
| 384 microplacas | Pescador | 14-230-243 |
| FoodSaver | FoodSaver | V3835 |
| Nitrocelulose Ultrathin Coate microarray desliza | Gentel | PATH |
| Deslize Imprinter (opcional) | A Companhia Gel | WSP60-1 |
| Sacudidor | Pescador | 15-453-211 |
| Centrifugar | Eppendorf | 5804 000.013 |
| Deslize lavatório / Slide Coloração Dish wiª removível rack | Pescador | 08-812 |
| Deslize incubação caixa de lâminas câmara / microscópio | Pescador | 03-448-5 |
| Brij 35, 30% de solução w / v em água | Acros Organics | AC32958-0025 |
| Tween-20 | Pescador | P337-100 |
| Periodato de sódio (NaIO4) | Sigma | 311448 |
| Ácido L-glutâmico γ-hidrazida | Sigma | G-7257 |
| De acetato de sódio anidro (CH 3 COONa) | Sigma | S2889 |
| Albumina de soro bovino (BSA) | Lampire Biológica Labs | 7500804 |
| Tampão fosfato salino (PBS) (10X) | Denville Científico | CP4390-48 |
| Dylight NeutrAvidin 549 conjugado | Thermo | 22837 |
| Protease Comprimidos Coquetel Inibidor | Roche | 4693159001 |
| ChromPure IgG humana, fragmento Fc | Jackson Immunoresearch | 009-000-008 |
| ChromPure IgG humana, molécula inteira | Jackson Immunoresearch | 009-000-003 |
| ChromPure IgG de rato, molécula inteira | Jackson Immunoresearch | 015-000-003 |
| ChromPure IgG de rato, fragmento Fe | Jackson Immunoresearch | 015-000-008 |
| ChromPure IgG de coelho, molécula inteira | Jackson Immunoresearch | 011-000-003 |
| ChromPure Donkey IgG, molécula inteira | Jackson Immunoresearch | 017-000-003 |
| Microarray Scanner | Tecan | LS Reloaded |
Tabela 2. Listade equipamentos e reagentes utilizados neste protocolo.
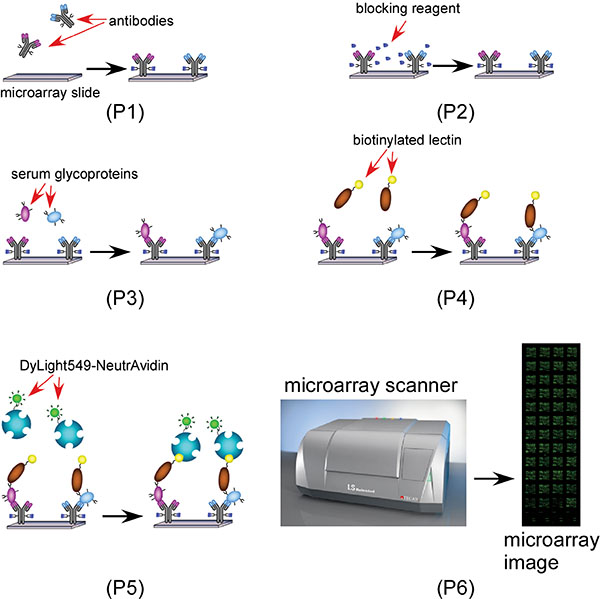
Esquema 1 Um esquema que mostra a microarray anticorpo lectina baseado glicano processo descoberta de biomarcadores 1 (Passo 2 a 4): Bloquear o microarray anticorpo com o bloqueador (Glu-hidrazida) e BSA; 2 (Passo 5):.. Aplicar amostras de soro e capturar glicoproteínas específicas com anticorpos específicos; 3 (Passo 6): aplicam lectina biotinilada (s), 4 (Passo 7): Sonda o AAL biotinilado com Dylight NeutrAvidin 549 rotulado para microarray de imagem.
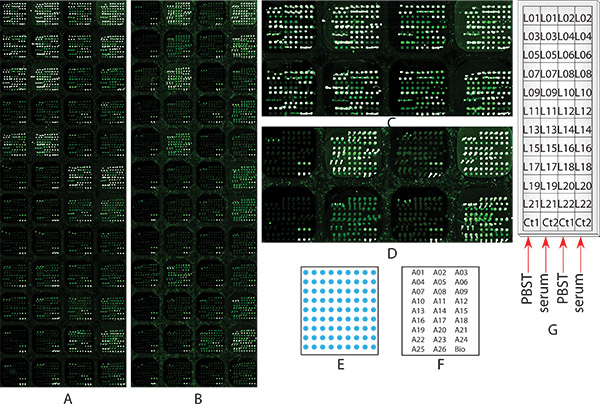
Figura 1. Imagens Microarray da Amostra perfil de glicosilação Experimento 1 de múltiplas glicoproteínas em HCC amostra de soro do doente usando chemicaliado bloqueado microarray de anticorpos com a detecção de lectina múltipla. Duas lâminas microarray idênticos, (a) nenhum quimicamente bloqueada, ou (B) quimicamente bloqueado, tal como descrito no Passo 2, ambos passou por todas as etapas de 2 a 9 para o perfil de glicosilação, bem como para fins de comparação. (A) e (B) são as imagens microarray digitalizada no Passo 8, em uma resolução de 10 micron. (C) o zoom na imagem das duas primeiras linhas da nenhum quimicamente bloqueada microarray corrediça (A), (D) o zoom na imagem das duas primeiras linhas da lâmina não microarray quimicamente bloqueado (B)); (E) o diagrama da disposição anticorpo dentro de cada subarray; (F) mapas de matriz: a localização de cada anticorpo dentro do subarray, cada nome de anticorpo representa 3 manchas; (G) da amostra de soro e localização lectina: mostra um diagrama que subarray cada amostra de soro e lectina foi aplicada sobre.

Imagens Figura 2. Microarray doamostra experimento 2 tela para fucosilação alteradas em glicoproteínas específicas como biomarcadores que discriminam cirrose hepática e pacientes com carcinoma hepatocelular. O ensaio de microarray foi realizada como descrito no Exemplo de secção Experiência 2. (A) A imagem do slide conjunto da lâmina de microarray a partir do Passo 8; (B) o diagrama da disposição anticorpo dentro de cada subarray; (C) mapas de matriz: a localização de cada anticorpo dentro do subarray, cada nome de anticorpo representa 3 pontos; (D) um zoom-in imagem de um subarray que foram incubadas com amostra de soro, (E) um zoom-in imagem de um subarray que foram incubadas com PBS de controlo.
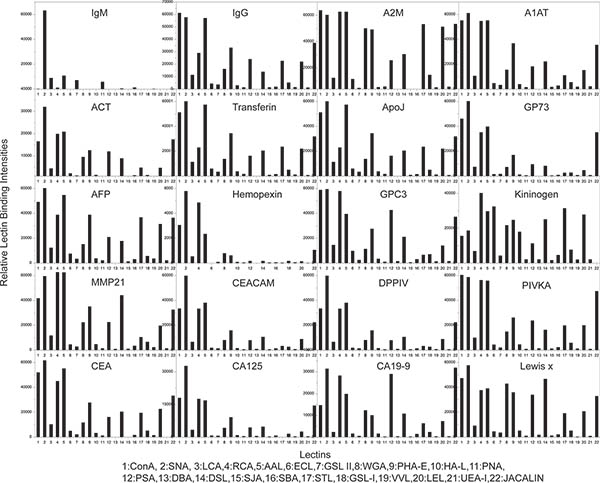
Figura 3. Resultados da caracterização de glicanos exemplo de experimento 1. Cada gráfico de barras representam o perfil de lectina de ligação (ou perfis de glicano) de uma da proteína 20 testado. Total de 22 lectinas diferentes foram usados para analisar the perfil de glicano de cada proteína.
Discussão
1. Proteína alvo e seleção anticorpo de captura
Antes do ensaio microarray anticorpo, alguns reagentes e materiais são necessários para ser considerado e preparado. Para conceber um microarray anticorpo para glicano perfil ou rastreio de glicano biomarcador, um painel de anticorpos específicos para os candidatos de glicoproteína deve ser determinada de acordo com a literatura ou a partir dos resultados anteriores. Esses anticorpos foram normalmente compradas de fornecedores diferentes, t...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado pelo Instituto de Pesquisa de Vírus Hepatite e.
Materiais
| Name | Company | Catalog Number | Comments | |
| ID | Nome do reagente | Abreviatura | Companhia | Catalogo |
| L1 | Concanavalina A biotinilado | ConA | Vector Laboratories | BK-1000 |
| L2 | Biotinilado Sambucus Nigra Lectina | SNA | Vector Laboratories | B-1305 |
| L3 | Biotinilado Lens culinaris aglutinina | LCA | Vector Laboratories | BK-2000 |
| L4 | Biotinilado Ricinus communis aglutinina eu | RCA | Vector Laboratories | BK-1000 |
| L5 | Biotinilado Aleuria Lectina Aurantia | AAL | Vector Laboratories | B-1395 |
| L6 | Biotinilado Erythrina Lectina Cristagalli | ECL | Vector Laboratories | BK-3000 |
| L7 | Biotinilado Griffonia (Bandeiraea) Lectina Simplicifolia II | GSL II | Vector Laboratories | BK-3000 |
| L8 | Biotinilado Gérmen de Trigo aglutinina | WGA | Vector Laboratories | BK-1000 |
| L9 | Erythroagglutinin vulgaris biotinilado Phaseolus | PHA-E | Vector Laboratories | BK-2000 |
| L10 | Leucoagglutinin vulgaris biotinilado Phaseolus | PHA-L | Vector Laboratories | BK-2000 |
| L11 | Aglutinina de amendoim biotinilado | PNA | Vector Laboratories | BK-1000 |
| L12 | Biotinilado Pisum sativum aglutinina | PSA | Vector Laboratories | BK-2000 |
| L13 | Biotinilado Dolichos biflorus aglutinina | DBA | Vector Laboratories | BK-1000 |
| L14 | Lectina Stramonium biotinilado Datura | DSL | Vector Laboratories | BK-3000 |
| L15 | Aglutinina Sophora Japonica biotinilado | SJA | Vector Laboratories | BK-2000 |
| L16 | Aglutinina de soja biotinilado | SBA | Vector Laboratories | BK-1000 |
| L17 | Biotinilado Solanum tuberosum (Batata) Lectina | STL | Vector Laboratories | BK-3000 |
| L18 | Biotinilado Griffonia (Bandeiraea) Simplicifolia Lectina I | Eu GSL | Vector Laboratories | BK-2000 |
| L19 | Biotinilado Vicia Lectina Villosa | VVL | Vector Laboratories | BK-2000 |
| L20 | Biotinilado Lycopersicon esculentum (tomate) Lectina | LEL | Vector Laboratories | BK-3000 |
| L21 | Ulex biotinilado Europaeus aglutinina eu | UEA I | Vector Laboratories | BK-1000 |
| L22 | Jacalina biotinilado | Jacalina | Vector Laboratories | BK-3000 |
| A1 | F cabra (ab ') 2 Fragmento IgM anti-humana, o anticorpo Fc5μ | IgM | Jackson Immuno Research | 109-006-129 |
| A2 | Burro F (ab ') 2 Frag anti-IgG humana (H + L) umtibody | AB1 | Jackson Immuno Research | 709-006-149 |
| A3 | De ratinho anti-IgG humana F (ab ') 2 de anticorpo monoclonal | AB3 | Jackson Immuno Research | 209-005-097 |
| A4 | Cabra anti-humano alfa 2 macroglobulina anticorpo policlonal | A2M | GeneTex | GTX62924 |
| A5 | De coelho anti-anticorpo humano alfa-1-antitripsina policlonal | A1AT | Lee Biosiences | CA1T-80A |
| A6 | De ratinho anti-anticorpo humano alfa-1-antitripsina monoclonal | A1AT | Sigma Aldrich | SAB4200198 |
| A7 | De coelho anti-anticorpo humano alfa-1-antitripsina policlonal | ACT | Neomarkers | RB-367-A1 |
| A8 | De coelho anti-humanoalfa-1-antiquimotripsina anticorpo policlonal | ACT | Fisher Scientific | RB9213R7 |
| A9 | Rato anti-humana de anticorpo monoclonal de transferrina | Transferrina | GeneTex | GTX101035 |
| A10 | De coelho anti-anticorpo humano policlonal de transferrina | Transferrina | GeneTex | GTX77130 |
| A11 | Cabra anti-humano apolipoproteína anticorpo policlonal J | ApoJ | Abcam | ab7610 |
| A12 | Rato anti-humana de GP73 anticorpo monoclonal | GP73 | Abbott | 14H4-23 |
| A13 | Rato anti-humana de GP73 anticorpo monoclonal | GP73 | Santa Cruz Biotechnology, Inc. | sc-101.275 |
| A14 | De coelho anti-humano de alfa-1 fetoprotein anticorpo policlonal | AFP | Genway | GWB-41C966 |
| A15 | De ratinho anti-anticorpo humano de alfa-1 fetoproteína monoclonal | AFP | Fitzgerald | 10-A05A |
| A16 | Rato anti-humana de anticorpo monoclonal hemopexina | Hemopexina | Assaypro | 60190-05011 |
| A17 | Rato anti-humano glypican-3 (1G12) anticorpo monoclonal | GPL3 | Santa Cruz Bio | sc-65.443 |
| A18 | Rato anti-humano Cininogênio anticorpo (LMW) monoclonal | Cininogênio | Assaypro | 20333-05011 |
| A19 | De coelho anti-anticorpo humano MMP-21 monoclonal | MMP21 | Epitomic | 1955-1 |
| A20 | Rato anti-humano CEACAM-1 anticorpos monoclonaisy | CEACAM | R & D Systems | MAB1180 |
| A21 | Rat anti-humano DPPIV/CD26 anticorpo monoclonal | DPPIV | R & D Systems | MAB22441 |
| A22 | Rato anti-humano PIVKA anticorpo monoclonal II | PIVICA | Cristal chem | 8040 |
| A23 | Antigénio de ratinho anti-carcinoembriónico | CEA | EUA biológica | C1300 |
| A24 | Antigen de ratinho anti-CA125 Câncer | CA125 | EUA biológica | C0050-01D |
| A25 | Antigénio de ratinho anti-CA19-9 Câncer | CA19-9 | EUA biológica | C0075-18 |
| A26 | De ratinho anti-Lewis anticorpo monoclonal x | Lewis X | Calbiochem | 434631 |
| bio | Biotinilado BSA (controle positivo) | Bio | Home-made | N / A |
Lista Tabela 1. De lectinas e anticorpos utilizados neste protocolo.
| Nome do reagente s / equipamentos | Companhia | Número de catálogo |
| Microarrayer sem contato | BioDot Inc | sciFLEXARRAYER |
| 384 microplacas | Pescador | 14-230-243 |
| FoodSaver | FoodSaver | V3835 |
| Nitrocelulose Ultrathin Coate microarray desliza | Gentel | PATH |
| Deslize Imprinter (opcional) | A Companhia Gel | WSP60-1 |
| Sacudidor | Pescador | 15-453-211 |
| Centrifugar | Eppendorf | 5804 000.013 |
| Deslize prato de coloração de lavagem bacia / Slide com rack removível | Pescador | 08-812 |
| Deslize incubação caixa de lâminas câmara / microscópio | Pescador | 03-448-5 |
| Brij 35, 30% de solução w / v em água | Acros Organics | AC32958-0025 |
| Tween-20 | Pescador | P337-100 |
| Periodato de sódio (NaIO4) | Sigma | 311448 |
| Ácido L-glutâmico γ-hidrazida | Sigma | G-7257 |
| De acetato de sódio anidro (CH 3 COONa) | Sigma | S2889 |
| Albumina de soro bovino (BSA) | Lampire Biológica Labs | 7500804 |
| Tampão fosfato salino (PBS) (10X) | Denville Científico | CP4390-48 |
| Dylight NeutrAvidin 549 conjugado | Thermo | 22837 |
| Protease Comprimidos Coquetel Inibidor | Roche | 4693159001 |
| ChromPure IgG humana, fragmento Fc | Jackson Immunoresearch | 009-000-008 |
| ChromPure IgG humana, molécula inteira | Jackson Immunoresearch | 009-000-003 |
| ChromPure IgG de rato, molécula inteira | Jackson Immunoresearch | 015-000-003 |
| ChromPure IgG de rato, fragmento Fe | Jackson Immunoresearch | 015-000-008 |
| ChromPure IgG de coelho, molécula inteira | Jackson Immunoresearch | 011-000-003 |
| ChromPure Donkey IgG, molécula inteira | Jackson Immunoresearch | 017-000-003 |
| Microarray Scanner | Tecan | LS Reloaded |
Lista Tabela 2. De equipamentos e reagentes utilizados neste protocolo.
Referências
- Fang, M. The ER UDPase ENTPD5 promotes protein N-glycosylation, the Warburg effect, and proliferation in the PTEN pathway. Cell. 143, 711-724 (2010).
- Marino, K., Bones, J., Kattla, J. J., Rudd, P. M. A systematic approach to protein glycosylation analysis: a path through the maze. Nat. Chem. Biol. 6, 713-723 (2010).
- Shental-Bechor, D., Levy, Y. Effect of glycosylation on protein folding: a close look at thermodynamic stabilization. Proc. Natl. Acad. Sci. U. S. A. 105, 8256-8261 (2008).
- Hossler, P., Khattak, S. F., Li, Z. J. Optimal and consistent protein glycosylation in mammalian cell culture. Glycobiology. 19, 936-949 (2009).
- Nothaft, H., Szymanski, C. M. Protein glycosylation in bacteria: sweeter than ever. Nat. Rev. Microbiol. 8, 765-778 (2011).
- Sola, R. J., Griebenow, K. Effects of glycosylation on the stability of protein pharmaceuticals. J. Pharm. Sci. 98, 1223-1245 (2009).
- Li, C., Lubman, D. M. Analysis of serum protein glycosylation with antibody-lectin microarray for high-throughput biomarker screening. Methods Mol. Biol. 723, 15-28 (2011).
- Dwek, M. V., Jenks, A., Leathem, A. J. A sensitive assay to measure biomarker glycosylation demonstrates increased fucosylation of prostate specific antigen (PSA) in patients with prostate cancer compared with benign prostatic hyperplasia. Clin. Chim. Acta. 411, 1935-1939 (2010).
- Drake, P. M. Sweetening the pot: adding glycosylation to the biomarker discovery equation. Clin. Chem. 56, 223-236 (2010).
- Kim, Y. -. P., Park, S., Oh, E., Oh, Y. -. H., Kim, H. -. S. On-chip detection of protein glycosylation based on energy transfer between nanoparticles. Biosensors & Bioelectronics. 24, 1189-1194 (2009).
- Boland, M., Rudd, P. M. Disease related glycosylation changes and biomarker discovery: challenges and possibilities in an emerging field. Editorial. Dis. Markers. 25, 189-192 (2008).
- Norton, P. A. N-linked glycosylation of the liver cancer biomarker GP73. J. Cell Biochem. 104, 136-149 (2008).
- Nakagawa, T. Glycomic analysis of alpha-fetoprotein L3 in hepatoma cell lines and hepatocellular carcinoma patients. J. Proteome Res. 7, 2222-2233 (2008).
- Durazo, F. A. Des-gamma-carboxyprothrombin, alpha-fetoprotein and AFP-L3 in patients with chronic hepatitis, cirrhosis and hepatocellular carcinoma. J. Gastroenterol Hepatol. 23, 1541-1548 (2008).
- Kobayashi, M. Fucosylated fraction of alpha-fetoprotein, L3, as a useful prognostic factor in patients with hepatocellular carcinoma with special reference to low concentrations of serum alpha-fetoprotein. Hepatol. Res. 37, 914-922 (2007).
- Maisey, N. R. CA19-9 as a prognostic factor in inoperable pancreatic cancer: the implication for clinical trials. Br. J. Cancer. 93, 740-743 (2005).
- Talar-Wojnarowska, R. Clinical value of serum neopterin, tissue polypeptide-specific antigen and CA19-9 levels in differential diagnosis between pancreatic cancer and chronic pancreatitis. Pancreatology. 10, 689-694 (2010).
- Chen, S. Multiplexed analysis of glycan variation on native proteins captured by antibody microarrays. Nat. Methods. 4, 437-444 (2007).
- Shao, C. Antibody microarray analysis of serum glycans in esophageal spuamous cell carcinoma cases and controls. Proteomics Clinical Applications. 3, 923-931 (2009).
- Chen, S., Haab, B. B. Analysis of glycans on serum proteins using antibody microarrays. Methods Mol. Biol. 520, 39-58 (2009).
- Yue, T. The Prevalence and Nature of Glycan Alterations on Specific Proteins in Pancreatic Cancer Patients Revealed Using Antibody-Lectin Sandwich Arrays. Molecular & Cellular Proteomics. 8, 1697-1707 (2009).
- Wolf-Yadlin, A., Sevecka, M., MacBeath, G. Dissecting protein function and signaling using protein microarrays. Current Opinion in Chemical Biology. 13, 398-405 (2009).
- Richard, E. Proteomics as Applied to Inherited Metabolic Diseases. Current Proteomics. 6, 140-153 (2009).
- Nolen, B., Winans, M., Marrangoni, A., Lokshin, A. Aberrant tumor-associated antigen autoantibody profiles in healthy controls detected by multiplex bead-based immunoassay. Journal of Immunological Methods. 344, 116-120 (2009).
- Kuno, A. Focused Differential Glycan Analysis with the Platform Antibody-assisted Lectin Profiling for Glycan-related Biomarker Verification. Molecular & Cellular Proteomics. 8, 99-108 (2009).
- Hsu, K. -. L., Mahal, L. K. Sweet tasting chips: microarray-based analysis of glycans. Current Opinion in Chemical Biology. 13, 427-432 (2009).
- Borrebaeck, C. A. K., Wingren, C. High-throughput proteomics using antibody microarrays: an update. Expert Review of Molecular Diagnostics. 7, 673-686 (2007).
- Sanchez-Carbayo, M. Antibody array-based technologies for cancer protein profiling and functional proteomic analyses using serum and tissue specimens. Tumor Biology. 31, 103-112 (2010).
- Porter, A. A motif-based analysis of glycan array data to determine the specificities of glycan-binding proteins. Glycobiology. 20, 369-380 (2010).
- Maupin, K. A. Glycogene Expression Alterations Associated with Pancreatic Cancer Epithelial-Mesenchymal Transition in Complementary Model Systems. Plos One. 5, (2010).
- Sevecka, M., Wolf-Yadlin, A., MacBeath, G. Lysate Microarrays Enable High-throughput, Quantitative Investigations of Cellular Signaling. Molecular & Cellular Proteomics. 10, (2011).
- Wang, M. Novel fucosylated biomarkers for the early detection of hepatocellular carcinoma. Cancer Epidemiol. Biomarkers Prev. 18, 1914-1921 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados