A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Multiphoton المجهر من مخ الفأر مسح تعرب عن YFP
In This Article
Summary
المجهر Multiphoton من أجهزة الماوس كله هو ممكن عن طريق مسح ضوئيا الجهاز قبل التصوير، ولكن ليس كل البروتوكولات الحفاظ على إشارة الفلورسنت من البروتينات الفلورية. باستخدام أسلوب المقاصة البصرية مع الايثانول القائمة على الجفاف وكحول البنزيل: بنزيل بنزوات المقاصة، وتبين لنا صور عالية الدقة multiphoton من مخ الفأر كله معربا عن YFP.
Abstract
يتم توليد المجهر Multiphoton الجوهرية التوافقي مضان والثانية (SHG) من أجهزة الماوس كله ممكن عن طريق مسح ضوئيا الجهاز قبل التصوير. 1،2 ومع ذلك، لأجهزة التي تحتوي على البروتينات الفلورية مثل GFP وYFP، وبروتوكولات تبادل المعلومات البصرية التي تستخدم الميثانول الجفاف واضحة باستخدام كحول البنزيل: بنزيل بنزوات (BABB)، في حين دون وقاية من 3 ضوء لا تحتفظ إشارة الفلورسنت. بروتوكول المعروضة هنا هي طريقة الرواية التي لأداء الجهاز كله المقاصة الضوئية على مخ الفأر مع الحفاظ على إشارة مضان من الخلايا العصبية التي أعرب عنها في YFP. تغيير بروتوكول تبادل المعلومات البصرية مثل أن الجهاز يعاني من الجفاف باستخدام الإيثانول سلسلة متدرجة وقد وجد للحد من الأضرار التي لحقت البروتينات الفلورية والحفاظ على إشارة الفلورسنت للتصوير multiphoton. 4 استخدام أسلوب الأمثل من المقاصة البصرية مع الايثانول القائمة على الجفاف و تطهير من BABBبينما محمية من الضوء، وتبين لنا صور عالية الدقة multiphoton من الفلورسنت الأصفر التعبير (YFP) البروتين في الخلايا العصبية لدماغ فأرة أكثر من 2 ملم تحت سطح الأنسجة.
Protocol
1. الإرواء (5) والجامع الحيوانية المقاصة مخ الفأر
- يمكن على طول الإجراء تختلف تبعا لطول الفترة الزمنية المستخدمة في الخطوة الجفاف، ولكن في المجموع يمكن أن تجرى العملية برمتها في غضون يومين.
- وزن الفئران YFP ثم تخدير عميق مع حقنة داخل الصفاق من الكيتامين / زيلازين (100 ملغ / كغ: 10 مغ / كغ).
- تأكيد طائرة الجراحية التخدير العميق قبل الشروع في عملية جراحية. تحقق من كل الحيوانات 5 دقائق لمعرفة ما اذا كان يتفاعل مع شركة في احد اصابع القدم أو قرصة الذيل. إذا كان الحيوان يتفاعل، لا بد من جرعة تكميلية (1/3 من الجرعة الأصلية) من الكيتامين / زيلازين.
- مرة واحدة تخدير عميق، كبح جماح الماوس من خلال الالتزام كل الأطراف إلى سرير الجراحية باستخدام الشريط المختبر بحيث الماوس في موقف ضعيف (recumbancy الظهرية)، وفضح صدره لعملية جراحية. يتم عادة السرير الجراحي للمعدن أو شبكة بلاستيكية ووضعها في الحوض أو على رأس عموم الشفاه بحيث الدم ومثبتيمكنك بسهولة أن تجمع النفايات.
- لتبدأ، دون إجراء شق عملية سيفي الشكل. قطع على طول قاعدة القفص الصدري باستخدام مقص وملاقط وسحب الجلد، حيث يتم إجراء خفض الانتاج. جعل اثنين تخفيضات على طول جانبي القص الماوس (عن طريق الأضلاع) لإنشاء رفرف من الأنسجة التي تعقد بعيدا عن تجويف الصدر باستخدام مرقئ لمغادرة القلب عرضة للخطر.
- اضافة الى وجود إبرة ز 23 إلى البطين الأيسر من القلب، وجعل شق صغير في جدار عضلة الأذين الأيمن للسماح الدم من الفرار. يرجى الرجوع إلى المادة إن الرب 2497 للحصول على فيديو من هذا الإجراء .. 5
- مباشرة بعد قطع الأذين الأيمن، يبدأ نضح مع 4 ° C مخزنة المالحة الفوسفات، PBS، (الرقم الهيدروجيني 7.2) حتى لم يعد لاحظ الدم استنزاف من الأذين الأيمن للقلب (30 - 40 مل بمعدل حوالي 5 مل / دقيقة).
- مرة واحدة وقد تم استنزاف كل الدم (السائل الخروج من الأذين الأيمن واضح)، والتبديل وسيلة التروية إلى 4٪ المبردةPFA حل. يروي الجسم حتى الماوس، يصبح صلبا بشكل ملحوظ والباردة لمسة (حوالي 30 حتي 40 مل بمعدل حوالي 5 مل / دقيقة). (يتم تخفيف المركزة حل PFA 16٪ وفقا لتعليمات الشركة الصانعة ويتم إضافة هيدروكسيد الصوديوم حتى يتم التوصل درجة الحموضة 7.2. ارتداء قفازات ومعطف المختبر والتعامل مع المواد الكيميائية وتخلط داخل غطاء الدخان.)
- بعد نضح، إزالة الماوس من السرير الجراحية وقطع رأس لبدء استئصال الدماغ.
- باستخدام ملقط ومقص القزحية، وإزالة أجزاء صغيرة في الجمجمة بدءا من الجزء الخلفي من الجمجمة والمضي قدما. إجراء تخفيضات صغيرة كل 2 - 4 مم مع مقص عبر الجمجمة أثناء استخدام الملقط لسحب العظام بعناية بعيدا عن الدماغ في أجزاء صغيرة. القيام بذلك حتى يتم كشف كامل السطح العلوي من الدماغ.
- استئصال الدماغ من الجمجمة باستخدام مم 5 اسعة، ملعقة مسطحة ومكان إلى قارورة زجاجية. يغرق في PFA 4٪ لمدة 6 ساعة في 4 درجات مئوية لمدة تثبيت آخر.
- بعد آخرتثبيت، وغسل الدماغ مرتين في درجة حرارة الغرفة قبل صب PBS PFA من القارورة الزجاجية واستبدالها PBS. دوامة الدماغ في حل PBS قبل صب بها واستبدال مع PBS لغسل الثاني.
- يذوى الدماغ في درجة حرارة الغرفة من خلال سلسلة متدرجة من الايثانول حضانات (مرة واحدة في 50٪، 70٪، 95٪، و٪ في مرتين 100) في 2 ساعة في الحضانة، ثم 12 ساعة لحضانة 2 الإيثانول بنسبة 100٪، ل استخراج المياه من أنسجة الثابتة. لكل الحضانة، من اجل الخروج الحل الايثانول السابقة من القارورة الزجاجية واستبدالها الحل لاحقة حتى يتم مغمورة تماما الدماغ.
- بعد الحضانة الثانية في الإيثانول بنسبة 100٪، من اجل الخروج واستبدال الحل مع الإيثانول أجزاء متساوية والحل المقاصة التي تحتوي على كحول البنزيل بنزوات البنزيل و(1:2 المجلد: المجلد نسبة). بعد 2 ساعة من، حضانة حل هذا صب واستبدالها مع حل 100٪ من الكحول البنزيل بنزوات البنزيل و(1:2 المجلد: المجلد نسبة). وrefraمؤشر التفاعلية الذي نظمه من الحل المقاصة هو ن = 1.54.
- مرة واحدة في BABB، سوف تصبح شفافة الدماغ بشكل ملحوظ، في غضون 4-5 ساعة. لأفضل النتائج المقاصة، وترك لمسح الدماغ لمدة 6 أيام في درجة حرارة الغرفة في حين محمية من الضوء الساطع.
2. المجهر الإعداد
- مرة واحدة يتم مسح الدماغ وجاهزة للتصوير، اللاحقه إلى الجزء السفلي من طبق بيتري باستخدام CYANOACRYLATE. السماح لاصقة لتجف قبل المتابعة.
- بعد التجفيف، يغرق في الدماغ BABB ووضع طبق بتري تحت المجهر الهدف للتصوير.
- نستخدم المجهر multiphoton أن يتضمن تاي ماي الليزر الياقوت التيتانيوم قابل للتعديل بين 710-990 نانومتر نانومتر الطول الموجي الإثارة. الطول الموجي الإثارة التي نستخدمها لتوليد إشارات YFP هو 886 نانومتر. الليزر السلطة يختلف 30 حتي 100 ميغاواط اعتمادا على عمق التصوير.
- التقاط اشارة تعكس الفلورسنت باستخدام نيكون الهدف 5X (NA، 0.5) الذي يسمح لكبيرمجال للرؤية والتصوير (2 × 2 ملم).
- تصفية إشارة تعكس الفلورسنت باستخدام فلتر 535/50 وممر الموجة أنه جمع باستخدام PMT GaAsP (H7422PA-40، هاماماتسو، بريدجووتر، نيو جيرسي).
- صور العملية باستخدام برمجيات ScanImage 6 في قرار من 2048 بكسل 2048 × باستخدام معدل مسح من 2 مللي خط في لتوليد عالية الدقة والصور YFP.
- مرة واحدة التصوير اكتمال إزالة الدماغ من طبق بتري باستخدام ملقط وتخزينها في BABB محمية من الضوء للتصوير في المستقبل. للعينات لصقها، وإزالة الأنسجة عن طريق تشغيل شفرة حلاقة بين الغراء وطبق بتري بزاوية أكبر من 30 درجة لا. نحن بتخزينها في عينات BABB لمدة تصل إلى 1 سنة مع أي تدهور مرئية.
3. ممثل النتائج
الصور ومقاطع الفيديو ممثل المعروضة هنا تظهر قدرة عالية الدقة التصوير multiphoton بفضل تبادل المعلومات البصرية. تصوير الدماغ كله يسمحلYFP التي تحمل علامات الخلايا العصبية في طبقات مختلفة من الحصين والقشرة لتكون مرئية بوضوح على عمق 2 ملم تحت سطح الأنسجة. ويظهر الشكل 1 صورة ممثل وجهة نظر الاكليلية الموافق الميزات التشريحية للقرن آمون في 2،92 مم الذيلية لbregma 7. كان عمق التصوير في العينة 1،94 مم. وكان بعض هذا الاختلاف يرجع إلى إزالة المخيخ في نهاية الذيلية من الدماغ وكان التوازن بسبب الانكماش من عملية الجفاف. صورة أخرى من المكدس يظهر طبقة V / VI الخلايا العصبية الهرمية من القشرة المخية الحديثة معربا عن YFP 2 مم تحت سطح النسيج (الشكل 2). تم الحصول عليها باستخدام جميع الصور تم الهدف نيكون التكبير 5X وباستخدام ميزة تقريب رقمي للصورة في اقتناء البرمجيات ScanImage.
من يركز اهتمامه على القشرة المخية الحديثة، ومحاور عصبية فردية وأجسام الخلايا العصبية من الخلايا العصبية الهرمية في V طبقة من القشرة المخية الحديثة واضحةلاي مميزة تصل إلى 1.02 ملم تحت سطح الأنسجة (الشكل 3). باستخدام كومة من الصور الشكل 3، قدم التعمير 3D من الخلايا العصبية في المنطقة باستخدام البرمجيات يماغيج 8 (الشكل 4).
القدرة عالية الدقة من MPM كما يسمح لنا لتقديم صور من الخلايا العصبية، كاملة الفردية. هنا نعرض لإعادة بناء الخلايا العصبية الهرمية طبقة من القشرة المخية الحديثة V في العمليات التي شجيري الفردية واضحة للعيان (الشكل 5).

الشكل 1 صورة الممثل كومة من الصور 1.2 مم (0.8 - 2 مم تحت سطح الأنسجة). من مخ الفأر كله تظهر القشرة المخية الحديثة وطبقات مختلفة من قرن آمون. ملامح قرن آمون مرئية 1.1 مم تحت سطح الأنسجة ووقد وصفت باستخدام متابعةجي رمز: DG = التلفيف المسنن، GrDG = طبقة الحبيبية من DG، Lmol = الجوبية الجزيئية طبقة، الطبقة الجزيئية مول = DG، أو طبقة المتجهة =، = PoDG المفصصة طبقة DG، PY = طبقة الخلايا الهرمية، راد = الطبقة المشععة 7 الصورة هو 1.8 × 1.8 ملم في الحجم والنطاق بار = 200 ميكرومتر. تم اضافته في نهاية منقاري من الدماغ إلى طبق بتري مع نهاية الذيلية مواجهة نحو الهدف. هذا سهل التصوير في الطائرة الاكليلية.
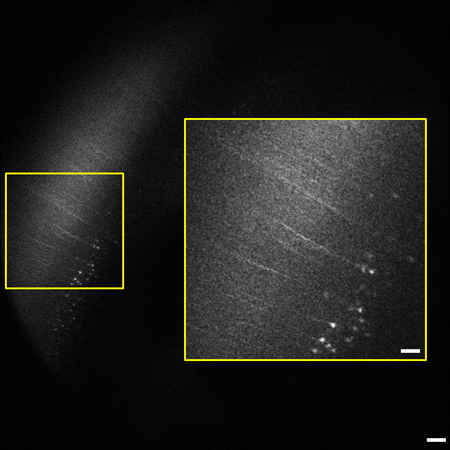
الشكل 2 الإطار الممثل من المكدس مم الصورة 1.2 (0.8 - 2 مم تحت سطح الأنسجة). من مخ الفأر كله تسليط الضوء على القشرة المخية الحديثة. الخلايا الهرمية والعمليات معربا عن YFP في طبقة V / VI من القشرة واضحة 2 مم تحت سطح الأنسجة. درجة العلامات يتفق مع التقارير السابقة للوضع العلامات متفرق في القشرة المخية الحديثة. يتم تكبير 9 أقحم (يمين) من ب oxed المنطقة على اليسار. الصورة هو 1.8 × 1.8 ملم في الحجم والنطاق بار = 200 ميكرومتر (50 ميكرومتر الشكل).
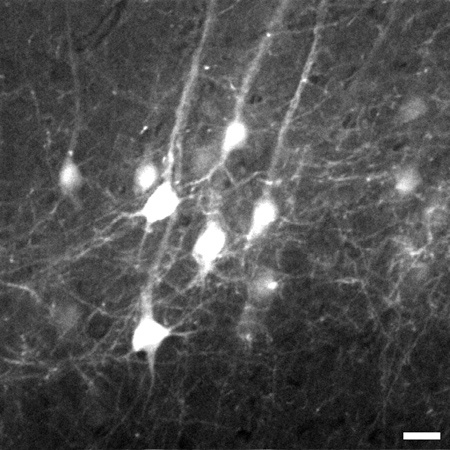
الشكل 3. الإطار الممثل المتخذة 774 ميكرومتر تحت سطح الأنسجة من المكدس صورة الخلايا العصبية الهرمية في الطبقة V القشرة المخية الحديثة من الدماغ. كومة من 700 ميكرومتر يذهب إلى 1،020 ميكرومتر تحت سطح الأنسجة. تم استخدام تقريب رقمي 8x لالتقاط تفاصيل مثل العمليات الدقيقة. صورة هو 225 × 225 ميكرون في الحجم، حجم شريط = 20 ميكرومتر.

الشكل 4. صورة الممثل إعادة الإعمار 3D (225 × 225 × 320 ميكرون) من المكدس الصورة في الشكل 3. صورة هو 225 × 225 ميكرون في الحجم، حجم شريط = 28 ميكرومتر.
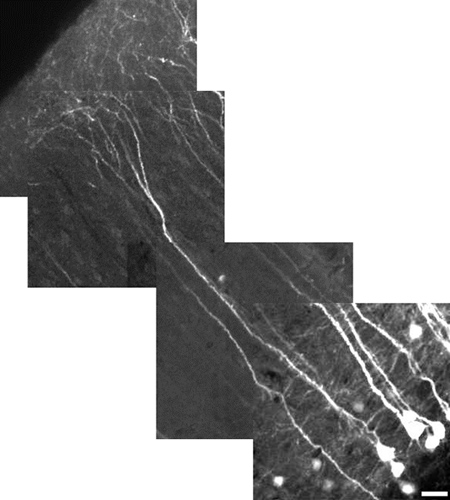
الشكل 5. صورة عالية الدقة أعيد بناؤها من الخلايا العصبية الهرمية طبقة من القشرة المخية الحديثة V باستخدام تكبير 10X الرقمية. الخلايا العصبية يقيس 485 ميكرومتر في الطول، الحجم = 25 بار ميكرومتر. مجال الرؤية لكل البلاط صورة هو 180 × 180 ميكرومتر ميكرومتر. كل البلاط هو على عمق مختلفة (ض المستوى). والتشعبات القشرية قمي لا، بصفة عامة، YFP صريحة وكذلك في سوما. أن يكون كل من في نفس المجال للعرض، كما هو موضح هنا، تم تخفيض القدرة على تقليل تشبع سوما، وهذا يجعل من نظرة عملية غرامة باهتة. كان تركيزنا هنا على إثبات مجال للرؤية بدلا من التفاصيل الدقيقة. للكشف عن التفاصيل الدقيقة، واستخدام الزوم الرقمي، والتركيز على منطقة دون سوما، وزيادة قوة الليزر.
Discussion
بينما الأصباغ العضوية القياسية متوافقة مع مجموعة من المذيبات العضوية، وبالتالي لا تشكل تحديا خاصا لتطهير البروتوكولات والبروتينات الفلورية وغالبا ما تكون أقل تسامحا من التغييرات في المذيبات .. 4 والهدف من هذا العمل هو التغلب قيدا خطيرا من البروتوكولات السابق?...
Disclosures
أجريت تجارب على الحيوانات وفقا للمبادئ التوجيهية واللوائح التي وضعتها العناية جامعة ييل الحيوان المؤسسية واللجنة الاستخدام.
Acknowledgements
نود أن نشكر يعقوب سوليس على مساعدته في تحرير الفيديو.
وقد تم تمويل هذا العمل في جزء من جائزة CAREER NSF-0953902 DBI ليفين MJ.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج رقم | تعليقات |
| التخزين المؤقت المالحة الفوسفات | سيغما الدريخ، وشركة | D8537 | 500 مل، ودرجة الحموضة 7.2 |
| بارافورمالدهيد | علوم المجهر الإلكتروني | 15710 | 10 × 10 مل، 16٪ بارافورمالدهيد |
| الكحول الإيثيلي | Bioanalytical الأمريكية | AB00515-00500 | 500 مل، 200 دليلا |
| الكحول الإيثيلي | Pharmco المنتجات، وشركة | 111000190 | 1 غال.، 190 دليلا |
| البنزيل الكحول | سيغما الدريخ، وشركة | 402834 | 500 مل، 99 +٪ |
| بنزيل بنزوات | سيغما الدريخ، وشركة | B6630-IL | 500 مل، ≥ 99٪ |
| 5X/0.5 NA الهدف | نيكون | AZ الدقيق خطة 5X | 15 WD |
References
- Parra, S. G., Chia, T. H., Zinter, J. P., Levene, M. J. Multiphoton microscopy of cleared mouse organs. J. Biomed. Opt. 15, 036017 (2010).
- Vesuna, S., Torres, R., Levene, M. J. Multiphoton fluorescence, second harmonic generation, and fluorescence lifetime imaging of whole cleared mouse organs. J. Biomed. Opt. 16, 106009 (2011).
- Zucker, R. M. Whole insect and mammalian embryo imaging with confocal microscopy: Morphology and apoptosis. Cytometry. A69, 1143-1152 (2006).
- Sakhalkar, H. S. Functional imaging in bulk tissue specimens using optical emission tomography: Fluorescence preservation during optical clearing. Phys. Med. Biol. 52, 2035-2054 (2007).
- Dazai, J., Spring, S., Cahill, L. S., Henkelman, R. M. Multiple-mouse Neuroanatomical Magnetic Resonance Imaging. J. Vis. Exp. (48), e2497 (2011).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomed. Eng. Online. 2, (2003).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M., Nerbonne, J. M., Lichtman, J. W., Sanes, J. R. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28, 41-51 (2000).
- Hama, H. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat. Neuro. 14, 1481-1488 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved