Method Article
De alto rendimiento de purificación de afinidad de proteínas marcadas con recombinantes
En este artículo
Resumen
Se describe un método para la purificación por afinidad de etiquetado de proteínas recombinantes utilizando robótica de manejo de líquidos. Este método es generalmente aplicable a la purificación a pequeña escala de solubles Su-etiquetados proteínas en un formato de alto rendimiento.
Resumen
Cristalografía de rayos X es el método de elección para obtener una vista detallada de la estructura de las proteínas. Tales estudios deben ser complementados por otros análisis bioquímicos para obtener una detallada comprensión de las relaciones estructura / función. Los avances en la tecnología de síntesis de oligonucleótidos y el gen de hacer grandes estrategias de mutagénesis cada vez más factibles, incluyendo la sustitución de residuos diana por todos los 19 aminoácidos distintos. Ganancia o pérdida de función de los fenotipos después permitir conclusiones sistemáticas a extraer, tales como la contribución de los residuos particulares para la estabilidad de la proteína actividad catalítica, y / o proteína-proteína interacción especificidad.
Con el fin de atribuir a los diferentes fenotipos de la naturaleza de la mutación - en lugar de a la fluctuación de las condiciones experimentales - es vital para purificar y analizar las proteínas de una manera controlada y reproducible. De alto rendimiento estrategias y la automatización de los protocolos de manuales sobrerobotizados de manipulación de líquidos plataformas han creado oportunidades para llevar a cabo tales procedimientos complejos moleculares biológicos con poca intervención humana y las tasas mínimas de error 1-5.
Aquí, se presenta un método general para la purificación de Su-etiquetados proteínas recombinantes en una forma de alto rendimiento. En un estudio reciente, se aplicó este método a una detallada estructura-función de investigación de TFIIB, un componente de la maquinaria de transcripción basal. TFIIB es indispensable para el promotor dirigido por la transcripción in vitro y es esencial para el reclutamiento de la polimerasa de ARN en un complejo de preiniciación 6-8. TFIIB contiene un dominio de unión flexible que penetra en la hendidura del sitio activo de la ARN polimerasa 9-11. Este dominio de unión confiere dos actividades cuantificables bioquímicamente en TFIIB, a saber, (i) la estimulación de la actividad catalítica durante la 'abortivo' fase de iniciación de transcripción, y (ii) una contribución adicional a lareclutamiento específico de la ARN polimerasa en el complejo de preiniciación 4,5,12. Hemos explotado el método de purificación de alto rendimiento para generar sustitución de un solo, doble y triple y mutaciones supresiones dentro del enlazador TFIIB y para posteriormente analizar en ensayos funcionales para su efecto de estimulación de la actividad catalítica de la polimerasa de ARN 4. En total, hemos generado, se purificó y se analizó 381 mutantes - una tarea que habría sido mucho tiempo y es laborioso de realizar manualmente. Hemos producido y se analizaron las proteínas en multiplicates lo que nos permitió apreciar las variaciones experimentales y nos dio una idea clara de la reproducibilidad de los resultados.
Este método sirve como un protocolo genérico para la purificación de Su-etiquetados proteínas y se ha utilizado con éxito para purificar otras proteínas recombinantes. En la actualidad está optimizado para la purificación de proteínas de 24, pero se puede adaptar a purificar hasta 96 proteínas.
Protocolo
PARTE A: alto rendimiento de crecimiento de cultivos bacterianos.
1. Las bacterias crecen Noche en 2 ml de medio de autoinducción Utilizando placas de 24 pocillos
- Esterilizar las placas de 24-así por microondas.
- Inocular 1,5 ml de medio de autoinducción (durante la noche Medium Express) con recién crecido colonias bacterianas o stocks congelados glicerol. Normalmente inocular tres pocillos por mutante con tres colonias individuales clonados. Reserva seis pozos para los controles positivos y negativos. Para los controles positivos que crecen tres clones de tipo silvestre y para los controles negativos que crecen 2 clones que han sido transformadas con un plásmido que no expresa. Entrada para la esterilización suficiente de la placa, dejando así espacio en blanco uno para el control del medio de sólo.
- Cultivar las células durante 18 horas a 37 ° C y agitación a 250 rpm. Usamos lac inducible BL21 (DE3) Rosetta 2 células. Medio de autoinducción contiene una mezcla de glucosa y lactosa. Las bacterias inicialmentealimentan de glucosa y luego comenzar a utilizar la lactosa, que también induce la expresión de las proteínas recombinantes.
- Retire la tapa y coloque la placa en la plataforma robótica.
PARTE B: Robótica purificación de proteínas recombinantes.
2. Prepare la plataforma robótica
Completar hasta el tampón de lavado que consiste en 20 mM de imidazol, 0,1% Triton X-100, 0,5 M NaCl, 20 mM Tris-acetato, pH 7,9, 10 mM de MgOAc 2, 0,7 mM ZnOAc 2, 10% de glicerol, y el tampón de elución consistente de 0,5 M imidazol, 0,1% Triton X-100, 0,5 M NaCl, 20 mM Tris-acetato, pH 7,9, 10 mM de MgOAc 2, 0,7 mM ZnOAc 2, 10% de glicerol. Estos tampones se utilizan para lavar las perlas después de las proteínas etiquetadas se han unido a ellos, o para eluir las proteínas de las perlas, respectivamente.
- Completar el diluyente bacteriana (100 ml de agua destilada con 15 l de reactivo antiespumante). Esta solución será utilizadapara hacer diluciones de los cultivos bacterianos durante la noche para la densidad óptica (A600) mediciones. La presencia de agente antiespumante en el diluyente evita la formación de burbujas de aire que podrían interferir con las mediciones lector de placas.
- Hacer la solución de lisis reactivo que consiste en FastBreak 10x, 2 lysonase l por muestra y 15 mM MgOAc 2. FastBreak contiene una mezcla de detergentes y sales que se rompen las paredes celulares de las bacterias y facilitar la liberación de las proteínas intracelulares. Lysonase es una mezcla patentada de lisozima y una nucleasa. La lisozima asiste en la interrupción de la pared celular y la nucleasa digiere las Autorizaciones de ácidos nucleicos bacterianos.
- Opcional: Haga una solución 6 M de clorhidrato de guanidina. Algunas proteínas recombinantes tienden a adherirse a las agujas recubiertos de teflón de pipeteado. La guanidina clorhidrato desnaturaliza las proteínas de la solución y los lava fuera más efectiva que el agua que se usa rutinariamente para enjuagar las puntas lavables robóticas de pipeteo después de cada step.
- Preparar la BCA (ácido bicinconínico) de reactivo cuantificación de proteínas por la solución de mezcla de ácido bicinconínico (reactivo A) y la solución de sulfato de cobre (reactivo B): Los enlaces peptídicos reducir Cu 2 + de la CuSO 4 componente presente en el reactivo BCA a Cu 1 + mediante el cual la cantidad de Cu 1 + es proporcional al número de enlaces peptídicos presentes en la solución. En una segunda etapa, dos moléculas de ácido bicinconínico quelato de Cu 1 + que resulta en un cambio de absorbancia a 562 nm, lo que resulta en un color púrpura. La reacción de color es dependiente del tiempo y por lo general necesita varias horas para ser definitivo. Después de que el color es estable durante varias horas.
- Llene cubetas o placas del tamaño adecuado y colocarlos en su posición pre-asignados en la plataforma robótica.
- Coloque un 24-así placa para los residuos hidrocloruro de guanidina, dos placas transparentes de 96 pocillos para OD 600 y medidas de absorbancia y uno azul placa de 96 pocillos para the purificado proteínas en sus posiciones sobre la plataforma. Coloque una placa de 96 pozos profundos en el soporte magnético.
- Diluir MagneHis Ni-partículas que se unen a las proteínas mediante la formación de quelatos con sus His-tag de 5 veces en agua destilada y llenar ellos en la unidad de talón-agitación. Encienda el agitador para mantener las cuentas en suspensión.
- Encienda la plataforma robótica y lave las agujas de pipeteo durante varios minutos para eliminar las burbujas de aire que de otra forma interferir con la precisión de pipeteo. Las agujas de pipeteo reutilizables se lavan entre los pasos de pipeteo individuales. Alternativamente, puntas desechables podrían ser utilizados. Todas las etapas subsiguientes se llevan a cabo robóticamente. El protocolo de robótica está disponible bajo petición.
3. El crecimiento celular se comprobarse midiendo la DO600
- 10 l de cultivo de una noche se diluye en 90 l de solución diluyente.
- Medir el diámetro exterior 600 para asegurar que las bacterias han crecido hasta densidades similares(Figura 1).
4. Las células se dividen para liberar las proteínas y permitir a bolas de unión
- 100 l de suspensión magnética Ni-talón se distribuyen en cada pocillo de una segunda placa de 24 pocillos.
- 900 l de cada cultivo bacteriano a pequeña escala se transfiere a la placa de 24-pocillos que contiene las perlas. Añadir 100 l de 10 veces el FastBreak / lysonase mezcla.
- La placa de 24-así se transfiere a la plataforma de agitación para una agitación rápida (800 rpm) durante 30 min a temperatura ambiente. Las paredes celulares bacterianas se rompen mediante una combinación de fuerzas mecánicas y reacciones químicas y las proteínas producidas por recombinación se liberan en solución. Con sus etiquetas de afinidad que de inmediato se unen las perlas paramagnéticas quelantes de níquel.
5. Las perlas se lavan
- Los celulares lisados que contienen las perlas magnéticas resuspendidas se transfirieron a una placa de 96 pozos profundos que se coloca en un soporte con magnetic varillas que se deslizan entre los pocillos. Las placas de 96 pocillos tienen un cuadrado en forma de cono inferior que permite una fácil eliminación del sobrenadante. Los pozos pueden contener volúmenes de hasta 2,1 ml, pero se llenan con volúmenes mucho más pequeños. Esto nos permite realizar vigorosos pasos que sacuden sin muestra la contaminación cruzada por salpicaduras.
- Las puntas de pipeta se lavan entre cada uno de los pasos de pipeteado con 6 M guanidina-HCl. Este paso es crucial para la purificación de TFIIB y otras proteínas "pegajosas" para evitar la contaminación cruzada. Con otras proteínas, puede ser suficiente para enjuagar las agujas extensamente con agua entre las etapas de pipeteado.
- Las barras magnéticas del soporte magnético atraer las perlas paramagnéticas, tirando de ellos lejos de los centros de los pocillos y se permiten las agujas de pipeteado libre acceso al sobrenadante. El sobrenadante se desecha.
- 500 l de tampón de lavado se añade a la primera placa de 24 pocillos y posteriormente transferido a la placa de 96 pocillos a eNsure la transferencia completa de las cuentas. La placa de 24-así se elimina de la coctelera.
- Otro l de tampón de lavado 500 se añade directamente a la placa de 96-pocillos, la placa se transfiere al agitador y se agita vigorosamente durante 1 min. La placa se mueve hacia atrás en el soporte magnético y se desechó el tampón de lavado.
- Este paso se repitió dos veces y el procedimiento de lavado ha terminado por la eliminación de restos de amortiguamiento de la placa.
6. Eluir las proteínas en tampón de elución
- 100 l de tampón de elución se añadió a las perlas, la placa se mueve al agitador y se agita vigorosamente durante 30 min a temperatura ambiente.
- La placa se mueve de nuevo al agitador y el eluato, que contiene la proteína recombinante purificada, se transfirieron a una placa nueva.
7. Medir las concentraciones de las proteínas purificadas
- 190 l de mezcla de reactivo de BCA se transfiere a un claro placa de 96 pocillos y 10 l de la protein solución añadida.
- Después de varias horas de incubación (típicamente 5-6 o durante la noche), se mide la absorbancia y compararlo con estándares BSA para determinar las concentraciones de cada una de las preparaciones de proteínas purificadas (Figura 2).
- Las proteínas purificadas se pueden utilizar ahora para aplicaciones posteriores a las concentraciones correspondientes (figura 3).
8. Los resultados representativos
El protocolo de purificación ofrece dos etapas de control de calidad, ejemplos de los cuales se muestran. Que son capaces de identificar y documentar los problemas potenciales en la etapa de crecimiento bacteriano (Figura 1) y más tarde después de evaluar los rendimientos de las proteínas purificadas (Figura 2). Por lo general purificar proteínas y prueba de ellos por triplicado. Esto, en combinación con los dos pasos de control de calidad, nos da confianza de que cualquier variación se observó en los ensayos funcionales se deben a la phenotyp mutantee (Figura 3) y no causado por las variaciones experimentales o purificaciones fallidos. Los rendimientos obtenidos típicamente en el intervalo desde 50 hasta 200 g y son más que suficientes para diversos ensayos funcionales.

Figura 1. Histograma de las mediciones de densidad óptica de una placa de 24 pocillos con cultivos de una noche. Tres clones de seis variantes TFIIB mutantes así como de la TFIIB tipo salvaje se han cultivado. Dos clones que llevan un plásmido que no expresa bien y con un medio de sólo sirven como controles negativos. Las mediciones de OD muestran que existen pequeñas variaciones en las tasas de crecimiento entre las distintas culturas.
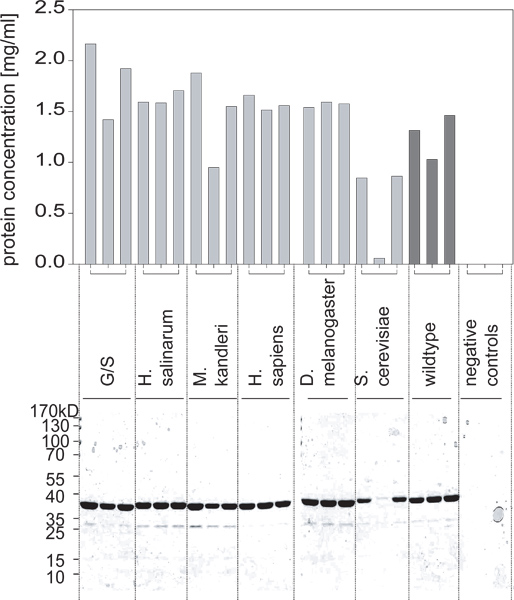
Figura 2. Rendimientos de proteína obtenidos a partir de estos cultivos como se determina mediante un ensayo BCA y se confirmó por SDS PAGE. Una de las variantes no se expresa en niveles altos. En comcombinación con la figura 1, se puede concluir que esto no era debido al crecimiento celular diferencial, pero debido a la expresión de la proteína no siendo inducido correctamente.

Figura 3. Representante resultado de un ensayo de transcripción. Se midió la actividad de estimulación de variantes TFIIB en la producción de pequeños transcritos abortivos por RNAP. Aquí, los efectos de la estimulación de una biblioteca completa de sustituciones de aminoácidos del residuo TFIIB K87 se muestran. El alto grado de reproducibilidad es confirmado por las tasas de error pequeños. Una muestra de gel que muestra el rendimiento de los tres mutantes en comparación con el tipo salvaje (WT), controles negativos (NC) y tampón de elución sólo controla se representa debajo.
Discusión
El método automatizado de purificación de la proteína recombinante descrita aquí permite la producción y purificación de un gran número de proteínas mutantes en un formato de pequeña escala bajo condiciones altamente reproducibles con una mínima intervención humana. Figuras 1 y 2 muestran los resultados de los controles sistemáticos de calidad y ejemplos de la proteínas purificadas. Figura 3 muestra que los factores de transcripción purificados usados en este ejemplo realizar de una manera altamente reproducible en ensayos funcionales.
A pesar de que el procedimiento fue desarrollado para la purificación de archaeal TFIIB, es ampliamente aplicable para la purificación de proteínas etiquetadas por afinidad. El uso de tales protocolos de purificación automatizados por lo tanto será significativamente facilitar el análisis bioquímico de proteínas recombinantes y por lo tanto mejorar nuestra comprensión de las interacciones proteína-proteína en una escala que es difícil de conseguir manualmente.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por una subvención Wellcome Project (078043/Z/05/Z) para ROJW
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Overnight Express Media TB instantánea | Merck Chemicals Ltd | 71491-4 | |
| FastBreak | Promega Ltd. | V8573 | |
| Lysonase Reactivo bioprocesamiento / ml 1 | Merck Chemicals Ltd | 71230 | |
| Antiespumante 204 | Sigma-Aldrich Company Ltd | A6426 | |
| MagneHis Ni-Partículas | Promega | V8565 | |
| Imidazol | Sigma-Aldrich Company Ltd | 56750 | |
| Trizma base | Sigma-Aldrich Compcualquier Ltd. | 93362 | |
| NaCl | VWR | 27810.295 | |
| Ácido bicinconínico determinación de proteínas | Sigma-Aldrich Company Ltd | BCA1-1KT | |
| Deep Well Plate 2,2 ml Square Wells PP 10 UDS | Anachem Ltd | 1810-00 | |
| Microplaca 96 MicroWell poliestireno de fondo plano de 12 mangas no se trata de 5 unidades cada claro 0,4 ml de volumen y 128 mm x 86 mm Thermo Scientific Nunc | Fisher Scientific Ltd. | DIS-984-090m | |
| Microplaca Azul | VWR | NUNC367001 | |
| 24-Bueno Bloques RB (24) | Qiagen | 19583 | |
| Hidrocloruro de guanidina | VWR | ALFAA13543.0B | |
| Aguja lavable para TheOnyx | Aviso GmbH | 8152-317001 | |
| Reactivo Rack para perlas magnéticas | Aviso GmbH | 8152-035003 | |
| Lector de Placas Synergy HT | BioTek | 4200-000043 | |
| Robotic TheOnyx Plataforma 44OH/150/100 | Aviso GmbH | 8145-050046 | |
| Agitador de microplacas Variomag Teleshaker | Inheco | 3800047 | |
| De 96 pocillos Tipo de imán A | Qiagen | 36915 |
Referencias
- Weinzierl, R. O. The nucleotide addition cycle of RNA polymerase is controlled by two molecular hinges in the Bridge Helix domain. BMC Biol. 8, 1741-7007 (2010).
- Nottebaum, S., Tan, L., Trzaska, D., Carney, H. C., Weinzierl, R. O. The RNA polymerase factory: a robotic in vitro assembly platform for high-throughput production of recombinant protein complexes. Nucleic Acids Res. 36, 245-252 (2008).
- Tan, L., Wiesler, S., Trzaska, D., Carney, H. C., Weinzierl, R. O. Bridge helix and trigger loop perturbations generate superactive RNA polymerases. J. Biol. 7, 40 (2008).
- Wiesler, S. C., Weinzierl, R. O. The linker domain of basal transcription factor TFIIB controls distinct recruitment and transcription stimulation functions. Nucleic Acids Res. 39, 464-474 (2011).
- Weinzierl, R. O., Wiesler, S. C. Revealing the Function of TFIIB. Transcription. , (2011).
- Bell, S. D., Magill, C. P., Jackson, S. P. Basal and regulated transcription in Archaea. Biochemical Society transactions. 29, 392-395 (2001).
- Parvin, J. D., Sharp, P. A. DNA topology and a minimal set of basal factors for transcription by RNA polymerase II. Cell. 73, 533-540 (1993).
- Tyree, C. M. Identification of a minimal set of proteins that is sufficient for accurate initiation of transcription by RNA polymerase II. Genes. 7, 1254-1265 (1993).
- Batada, N. N., Westover, K. D., Bushnell, D. A., Levitt, M., Kornberg, R. D. Diffusion of nucleoside triphosphates and role of the entry site to the RNA polymerase II active center. Proceedings of the National Academy of Sciences of the United States of America. 101, 17361-17364 (2004).
- Liu, X., Bushnell, D. A., Wang, D., Calero, G., Kornberg, R. D. Structure of an RNA Polymerase II-TFIIB Complex and the Transcription Initiation Mechanism. Science (New York, N.Y). 327, 206-209 (2010).
- Kostrewa, D. RNA polymerase II-TFIIB structure and mechanism of transcription initiation. Nature. 462, 323-330 (2010).
- Werner, F., Weinzierl, R. O. Direct modulation of RNA polymerase core functions by basal transcription factors. Molecular and cellular biology. 25, 8344-8355 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados