このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アミロイド前駆体タンパク質細胞内ドメインの精製と集約
要約
APPの細胞内ドメイン(AICD)の大規模な精製のための方法が記載されている。我々はまた、誘導する方法を説明します in vitroで AICD集約と可視化。記載されている方法は、構造的/生化学AICDの特性とその凝集分子シャペロンの効果のために有用である。
要約
アミロイド前駆体タンパク質(APP)はアルツハイマー病(AD)の発症に関連するI型膜貫通タンパク質である。 APPはAPPの細胞内ドメイン(AICD)と呼ばれる大きな細胞外ドメインおよび短い細胞質ドメインによって特徴づけられる。分泌経路を介して成熟中に、APPは、α、β、γ-セクレターゼ1と呼ばれるプロテアーゼによって切断することができる。 β、γ-セクレターゼによるAPPのシーケンシャルタンパク質分解切断は小さなタンパク質分解ペプチドと呼ばれるAβ、アミロイド形成であり、老人斑のコア成分の生産につながる。 AICDはセクレターゼ処理後も膜から遊離され、Fe65とTIP60との相互作用を介して、複数の標的遺伝子2,3の転写調節に関与する核に移行することができます。 AICDを含む、タンパク質 - タンパク質相互作用は、人身売買、加工、ホロAPPおよびそのC-TERMINの細胞機能に影響を及ぼす可能性がアルの断片。我々は最近、AICDがAD-関与する分子シャペロンubiquilin-1 4により阻害され、in vitroで集計され、このプロセスができることを示している。 Fe65 7にバインドされたときに、これらの知見と一致して、AICDは、疎水性ドメインを露出しており、本質的にin vitroで 5,6 で乱れる、しかしそれは安定な二次構造を取得します。我々はubiquilin-1は、in vitroおよび4無傷細胞における凝集防止、AICDの不適切な分子間及び分子内相互作用を防止することを提案した。ほとんどの研究は、ADの病因におけるAPPの役割に焦点を当てる一方で、このプロセスにおけるAICDの役割は明らかではありません。 AICDの発現はアポトーシス8,9シグナル伝達経路を調節するため、10のシグナリングカルシウムを調節することを誘導することが示されている。 AICDの過剰発現およびトランスジェニックマウスモデルにおけるFe65アルツハイマー病理11等を誘発し、最近AICDがブラジャーで検出されている適切な抗原検索技術12を使用するときにウェスタンブロッティングによりライセートインチAICDの、構造的、生化学的、および生物物理学的研究を促進するために、我々は非常に純粋なAICDタンパク質の組換えを大量に生成するための手順を開発しました。我々は、さらに原子間力顕微鏡によるAICDと分析の in vitro熱凝集に誘導する方法を説明します。記載されている方法は、生化学生物物理学、構造AICDの特性評価およびAICD凝集分子シャペロンの効果のために有用である。
プロトコル
1。組換えAPP細胞内ドメイン(AICD)の発現
- 変換E.大腸菌ベクターpGEX-4T-1(GE Healthcare社)にクローニングされたヒトAICD(残APPの649から695まで、神経アイソナンバリング)とBL21を痛める。このベクターは、グルタチオン-S-トランスフェラーゼ(GST)との融合タンパク質のC末端部分としてAICD発現するであろう。このベクターは、GST部分の除去を容易にするために、トロンビン切断配列をコードしている。をpGEX-4T-1にAICDクローニングの詳細は、私たちの前の刊行物4に記載されています。
- 単一コロニーから、アンピシリン(100μg/ ml)を含むLB液体培地10mlを接種し、激しく振とうしながら37℃で一晩インキュベートする。
- 翌朝、一晩培養した培養液5mlで1リットルフラスコに400mlのLB /アンピシリンに接種。
- 精力的な600nmでの光学密度まで振っ0.6から0.4に到達していると37℃でインキュベートする。これは、通常2〜2.5時間かかります。
- イソプロピル-β-D-チオガラクトピラノシド(IPTG)を0.4mMのを追加することによって、GST-AICDの発現を誘導する。活発で5時間振とうしながら37℃でインキュベートする。
- 4℃で15分間6000 xgで細胞を遠心℃に細胞ペレットは、手順のこの時点では、数ヶ月のために-80℃で保存することができます。
2。 GST-AICDの精製
- 次のように50mlの溶解緩衝液を準備します1mMジチオスレイトール、1mMのエチレンジアミン四酢酸(EDTA)、0.1%トリトン-X100、1mMフェニルメチルスルホニルフルオリド(PMSF)、コンプリートプロテアーゼ阻害剤カクテル(ロシュ·ダイアグノスティックス)と、リン酸緩衝生理食塩水。氷上で冷却する。
- 上の雪解け細菌ペレット(以前凍結した場合)氷。
この時点では、すべてのステップが℃で分解を制限するために4時に実行されていることが重要です。すべてのチューブ、バッファ、および他の試薬はあらかじめ冷却する必要があります。フレンチプレスまたは溶解のための乳化剤を使用している場合は、これらも同様に予め冷却する必要があります。
- 徹底的に溶解緩衝液20mlに、細菌ペレットを再懸濁します。氷上の10mlのピペットを用いてボルテックスと摩の組み合わせは、ペレットを完全に再懸濁を保証します。
- 4℃30,000 psiまで予冷乳化剤を通じて再懸濁した細菌細胞( 例えば 、Avestin EmulsiFlex-C3)やフランス語圧力セルを渡します。乳化剤二度目を通してライセートを渡します。あらかじめ冷却し、50 mlチューブにライセートを収集します。
これら2つの楽器の主な利点は、試料の加熱を最小限に抑えることです。超音波処理の一般的に使用される技術は、超音波プローブの先端にかなりの熱を発生し、組換えタンパク質の凝集が発生することがあります。
- 30分間、15,000×gでライセートを遠心分離します。予冷50 mlチューブに上清を分離しておく。
- グルタチオン - アガロース(Sigma-Aldrich社製)の50%スラリーの500μlを添加する。 4℃で30分間回転させます50mMトリスpH7.8、0.1%トリトン-X100、0.5mMのジチオスレイトール、10mMの還元型グルタチオン:サンプルは回転している間、新鮮な溶出緩衝液を作る。
室温で実施されているプロトコルの唯一のステップは、溶出ステップである。したがって、溶出緩衝液は室温に保たれている。溶出緩衝液は、新鮮な準備されるべきである。
- 緩衝生理食塩水(90から130μm)の粗いフィルター(エバーグリーン·サイエンティフィック)と使い捨て5 "ポリスチレンクロマトグラフィーカラムにライセートとスラリーを注ぐ。カラムを洗浄5回はリン酸3mlで。
- カラムの底部にフタをし、室温の溶出バッファー500μlを添加する。の上部のキャップを閉めカラム、室温で5分間回転させます。冷やした1.5 mlのマイクロチューブに溶出液を集める。溶出をさらに2回(1.5ミリリットル総溶出液)を繰り返します。
- リン酸塩の4リットルで10,000分子量カットオフ透析膜( 例えば 、サーモサイエンティフィックスライドインアナライザの透析カセット)に溶出液を透析は4℃で一晩緩衝生理食塩水リン酸塩の付加的な4リットルに対して透析は4℃緩衝食塩水℃で1時間、次の日のために。
- 透析カセットからタンパク質を除去し、GST-AICDの収率を決定するためにタンパク質定量アッセイを行う。文化の400ミリリットルからの典型的な精製は、10〜20 mg / mlの濃度でタンパク質の精製> 20 mgの利回りになります。 -80℃で200μlのアリコートと凍結にアリコートタンパク質を℃に
3。 GST-AICDとAICDの精製のトロンビン切断
- 雪解け200精製したGST-AICDのμlと1 U /μlのthromb20μlを追加37インチで一晩インキュベート℃、
トロンビンの品質と純度は、メーカー間でかなり異なり、汚染の重要な原因となることができます。私たちは、GEヘルスケア(試薬の表を参照)からトロンビンを使用しています。一晩インキュベートした後、融合タンパク質の> 95%が( 図1B)を切断する必要があります。
- トロンビンとの一晩の開裂した後、解放されたAICDの一部が凝集を受け、溶液が濁って見える可能性が高い。 4℃で30分、20,000 xgで遠心分離することによって集約された材料をクリア予め冷却マイクロチューブに上清を取り除きます。
- それぞれ、GSTとトロンビンを除去するために50パーセントグルタチオン - アガローススラリーおよび50μlの50パーセントのp-アミノベンズアミジン - アガローススラリーの50μlを添加する。室温で5分間回転とともにインキュベートする。
- 堆積物に簡単にアガロースビーズを遠心し、新しいチューブに上清を除去する。トンを抽出グルタチオン - アガロースを持つ彼は、GST 4回以上。のp-アミノベンズアミジン - アガロースを持つ単一の抽出はトロンビン20Uのを除去するのに十分である。
- 精製AICD5μlの上のタンパク質定量アッセイを行う。 400ミリリットルの培養物からの典型的な収率は0.2から0.5 mg / mlの濃度で50から100μgのです。高い利回りは、GST-AICDの大きなボリュームを切断することにより可能です。
精製AICDは生化学/生物物理学的特性評価のために新たに調製しなければならない。未使用の材料は捨てられるべきです。これは、サンプルを凍結乾燥し、バッファ6の小さいボリュームに再懸濁することによりAICDを集中させることも可能です。検出した場合AICDブロッティング(フィルタトラップまたはドットブロットアッセイした後など)、PimplikarとSuryanarayana 12で説明したように、膜上の抗原検索を実行する必要がある必要があります。
4。原子間力顕微鏡(AFM)用AICD集約
- 希釈は新鮮pでAICDに調製hosphateは、15μlの最終体積で0.1 mg / mlの濃度に緩衝生理食塩水。この時点で、種々の化合物および/またはタンパク質は、それらがAICDの凝集を阻害するかどうかを判断するために添加してもよい。例えば、私たちはubiquilin-1のモル濃度は、このアッセイ4 AICDの凝集を防ぐことが示されている。
また、このようなフィルタトラップアッセイおよび光散乱4などの生化学的実験の集計大きな反応ボリュームへの可能性があります。我々は、成功は1μMという低濃度に希釈AICDと400μlの同じ大きさの反応混合物にフィルタトラップアッセイを実施いたしました。
- 48時間エッペンドルフサーモミキサーで800 rpmで振とうしながら43℃でサンプルをインキュベートすることにより、熱凝集を誘導する。この温度は4,13モデルシャペロン基板クエン酸合成酵素の熱凝集を調べるシャペロンアッセイに基づいて選ば れました。
熱凝集がネイティブから分子間の凝集体の形成をもたらす非ネイティブ構造(リッチ通常βシートである)への蛋白質の構造変化を誘導する一般的な方法です。熱凝集はまた、不適切な分子間相互作用(その結果、熱凝集を遅らせるか、または防ぐ)を形成することから、疎水性セグメントを遮蔽する分子シャペロンの機能を調べるために使われる。
- 脱イオン水で20倍にサンプルを希釈し、新たに切断されたマイカ上に2μlをスポット。一晩デシケータに試料を乾燥させてください。それは経験的にイメージングのための最適な希釈を決定する必要があるでしょう、そして、その結果、10に至るまでいくつかの希釈 - 100倍は賢明であろう。
- モード14タッピングAFMの動作を使用して、集約AICDを視覚化します。使用カンチレバーは2nmの名目先端半径を持つ金コーティングマイクロシャープ窒化レバー(MSNL、ブルカー)です。典型的なタッピング振幅DURるイメージングは、カンチレバーの共振周波数(30〜50 kHz)を10〜20 nmである。
我々は、さまざまなタンパク質凝集体の画質とコントラストが印加された力と実験の期間に依存していることがわかった。先端によってサンプル摂動を最小限に抑えるために、我々は95%以上のセットポイント比を保ったまま、5〜10分に各サンプルのスキャンを制限することにより、比較的低い印加された力を維持していた。画像処理はWSxMソフトウェア(ナノテック)で行った。標準的な画像処理は平面減算と平坦で構成されていた。私たちの研究所では、 "自作"商業の走査型プローブ顕微鏡制御システム(ナノテック)に接続AFMの15を使用しています 。
5。代表的な結果
発現およびGST-AICDの相対的な富を図1Aに示されています。溶解後、融合タンパク質の大部分は可溶性画分に存在しているので、inclusiから抽出遺体には必要ありません。グルタチオンアガロースカラムから溶出した物質は、> 95%純粋である。 図1に示すように製造においては、カラムから溶出されたタンパク質の濃度は14.5 mg / mlであり、収率は22ミリグラム(400ミリリットルの開始培養物からの)であった。トロンビン20 Uで一晩、この準備の200μlの切断は、融合タンパク質( 図1B)のほぼ100%切断をもたらした。 ( "開裂"レーン、 図1Bを参照)クーマシーブルー染色によって検出可能ではないこととして使用されるトロンビンの量が十分に低い。トロンビンとGSTの除去は材料の一部が失われる結果、しかしそれは、0.35 mg / mlの濃度でAICDの70μgのこの準備で収率で> 90%の純度であった。 図1Cは AICDの集約のためのフローチャートを示しているとその後の分析。 AFMによって撮像AICD集計は一般的に回転楕円体/非晶質であり、サイズの範囲は50〜100nm( 図1D、F)から。集約された材料はシャペロンubiquilin-1の等モル量の凝集反応( 図1E)4に追加されたときに検出されない。
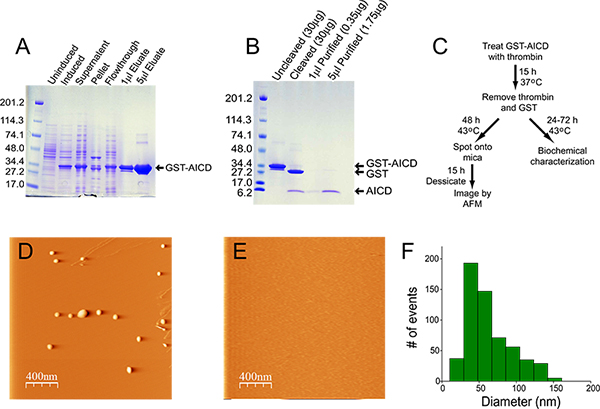
図1。 AICDの精製および集約。精製プロセスの各ステップで収集されたサンプルの)クマシーブルー染色。非誘導および誘導されたサンプルについては、総菌20μlをゲル上で泳動した。上清画分については、溶解液(20ミリリットルの総量から)の5μlをゲル上で泳動した。ペレット画分については、ペレットを溶解緩衝液20mlに再懸濁し、この材料5μlの°Cの前にゲルにロードする4℃で30分間水浴ソニケーターで超音波処理した。フロースルーは、5μlをゲル上で泳動した。ゲルにロードし、溶出液の量が示されている。 B)が切断されていないと切断されたGST-AICD(2μl)を、1と5&mのクマシーブルー染色したゲルは、U;リットル精製AICD。 AICD浄化、集計、分析のC)フローチャート。熱的に集約不在(D)と分子シャペロンubiquilin-1の存在下(E)にAICDのA、D、E)代表AFM像。 F)はAICD凝集体の粒度分布のヒストグラム。
ディスカッション
このプロトコルでは、構造生物物理、生化学的解析のための高純度AICDを取得するための手順を説明してきました。この手順では、洗練されたクロマトグラフ装置を必要とするため、ほとんどの研究室にアクセス可能であることはありません。他のグループは、構造的/生化学分析のために、GST-AICD 17から19を含め、AICD 5-7,16を精製しました。以前のプロトコルの欠点は貧しいAICD...
開示事項
特別な利害関係は宣言されません。
謝辞
著者らは、cDNAのアプリのための博士ホイ鄭(ベイラー医科大学)に感謝したいと思います。この作品は、NIHの助成R21AG031948(DB、JMB)、F30AG030878(ESS)R01DK073394(AFO)、生物医学研究のためのジョン·シーリー·メモリアル基金基金(AFO)、ジャン℃、ウィリアム·D·ウィリス脳神経情報研究基金によって資金を供給された(ESS)を表示します。 JMBはトランスレーショナル研究奨学生プログラムにおける学者とテキサスメディカルブランチクロード·E·ペッパー古いアメリカ人はインディペンデンスセンターの大学のメンバー(NIHのグラントそれぞれUL1RR029876およびP30-AG-024832、でサポートされている)です。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| をpGEX-4T-1 | GEヘルスケア | 28-9545-49 | |
| トロンビン | GEヘルスケア | 27-0846-01 | |
| アンピシリン | フィッシャー·サイエンティフィック | BP1760 | |
| ブラッドフォードタンパク質アッセイ試薬 | バイオ·ラッド | 500-0002 | |
| クマシーブルー | バイオ·ラッド | 161-0786 | |
| IPTG(イソプロピル-β-Dチオガラクトピラノシド) | シグマアルドリッチ | I6758 | |
| グルタチオン - アガロース | シグマアルドリッチ | G4510 | |
| のp-アミノベンズアミジン - アガロース | シグマアルドリッチ | A7155 | |
| 完全プロテアーゼインヒビターカクテル | ロッシュ | 11836170001 | |
| スライド-A-アナライザの透析カセット | サーモサイエンティフィック | 66380 | |
| クロマトグラフィーカラム | エバーグリーン·サイエンティフィック | 208-3367-050 | |
| 乳化剤 | Avestin株式会社 | EmulsiFlex-C3 | 非常にお勧め |
| エッペンドルフサーモ | エッペンドルフ | 022670107 | |
| 雲母ディスク | テッドペラ | 50から12 | |
| AFMのカンチレバー | ブルカー | MSNL-10 | |
| WSxMソフトウェア | ナノテック | N / A | 金曜日eeのダウンロード |
参考文献
- De Strooper, B., Vassar, R., Golde, T. The secretases: enzymes with therapeutic potential in Alzheimer disease. Nature reviews. Neurology. 6, 99-107 (2010).
- Chang, K. A., Suh, Y. H. Possible roles of amyloid intracellular domain of amyloid precursor protein. BMB reports. 43, 656-663 (2010).
- McLoughlin, D. M., Miller, C. C. The FE65 proteins and Alzheimer's disease. J. Neurosci. Res. 86, 744-754 (2008).
- Stieren, E. S. Ubiquilin-1 is a molecular chaperone for the amyloid precursor protein. J. Biol. Chem. 286, 35689-35698 (2011).
- Ramelot, T. A., Nicholson, L. K. Phosphorylation-induced structural changes in the amyloid precursor protein cytoplasmic tail detected by NMR. J. Mol. Biol. 307, 871-884 (2001).
- Ramelot, T. A., Gentile, L. N. Transient structure of the amyloid precursor protein cytoplasmic tail indicates preordering of structure for binding to cytosolic factors. Biochem. 39, 2714-2725 (2000).
- Radzimanowski, J. Structure of the intracellular domain of the amyloid precursor protein in complex with Fe65-PTB2. EMBO Rep. 9, 1134-1140 (2008).
- Ohkawara, T., Nagase, H., Koh, C. S., Nakayama, K. The amyloid precursor protein intracellular domain alters gene expression and induces neuron-specific apoptosis. Gene. 475, 1-9 (2011).
- von Rotz, R. C. The APP intracellular domain forms nuclear multiprotein complexes and regulates the transcription of its own precursor. J. Cell Sci. 117, 4435-4448 (2004).
- Hamid, R. Amyloid precursor protein intracellular domain modulates cellular calcium homeostasis and ATP content. J. Neurochem. 102, 1264-1275 (2007).
- Ghosal, K., Stathopoulos, A., Pimplikar, S. W. APP intracellular domain impairs adult neurogenesis in transgenic mice by inducing neuroinflammation. PLoS ONE. 5, e11866 (2010).
- Pimplikar, S. W., Suryanarayana, A. Detection of APP intracellular domain in brain tissue. Met. Molecul. Biol. 670, 85-91 (2011).
- Buchner, J., Grallert, H., Jakob, U. Analysis of chaperone function using citrate synthase as nonnative substrate protein. Met. Enzymol. 290, 323-338 (1998).
- Hansma, H. G. Recent advances in atomic force microscopy of DNA. Scanning. 15, 296-299 (1993).
- Valbuena, A. Quasi-simultaneous imaging/pulling analysis of single polyprotein molecules by atomic force microscopy. Rev. Sci. Instrum. 78, 113707 (2007).
- Radzimanowski, J., Beyreuther, K., Sinning, I., Wild, K. Overproduction, purification, crystallization and preliminary X-ray analysis of human Fe65-PTB2 in complex with the amyloid precursor protein intracellular domain. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 64, 409-412 (2008).
- Chen, T. Y., Liu, P. H., Ruan, C. T., Chiu, L., Kung, F. L. The intracellular domain of amyloid precursor protein interacts with flotillin-1, a lipid raft protein. Biochem. Biophys. Res. Commun. 342, 266-272 (2006).
- Kim, M. Y. Regulation of Notch1 signaling by the APP intracellular domain facilitates degradation of the Notch1 intracellular domain and RBP-Jk. J. Cell Sci. 124, 1831-1843 (2011).
- Lazarov, O. Axonal transport, amyloid precursor protein, kinesin-1, and the processing apparatus: revisited. J. Neurosci. 25, 2386-2395 (2005).
- Kakuda, N. Equimolar production of amyloid beta-protein and amyloid precursor protein intracellular domain from beta-carboxyl-terminal fragment by gamma-secretase. J Biol. Chem. 281, 14776-14786 (2006).
- Gosal, W. S., Myers, S. L., Radford, S. E., Thomson, N. H. Amyloid under the atomic force microscope. Protein Pept. Lett. 13, 261-270 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved