このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ハートの患者固有のモデリング:心室繊維配向の推定
要約
パーソナライズされたモデリングのための患者の心臓形状の体内画像から心室繊維配向を推定するための方法論が説明されています。通常の使用およびイヌの心を失敗実行方法論の検証は、臨床的に観察可能なレベルで推定し、取得した繊維配向の間に有意な差がないことがあることを示している。
要約
心臓治療をパーソナライズすることを目的と心臓(DYS)関数の患者固有のシミュレーションは、臨床的に心筋の繊維の向きを取得するためのin vivoイメージング技術の存在しないことによって妨げられている。このプロジェクトの目的は、患者の心臓形状の体内画像から心臓の繊維の向きを推定するための方法論を開発することでした。心室ジオメトリーと繊維配向の正確な表現は、アトラスと呼ばれ、高解像度のex vivoでの構造的磁気共鳴(MR)と、通常の人間の心の拡散テンソル(DT)のMR画像から、それぞれ再建された。患者の心臓の心室ジオメトリは生体コンピュータ断層撮影(CT)画像でから、半自動セグメンテーションを経由して 、抽出した。画像変換アルゴリズムを使用して、アトラス心室ジオメトリーは、患者のそれと一致するように変形した。最後に、変形場はアトラス繊維orientatに適用されたイオン患者繊維配向の推定値を求める。繊維上の見積りの精度は通常の6と3障害のある犬の心を用いて評価した。獲得したと推定繊維配向の傾斜角度との間の平均の差の絶対値は15.4°であった。プロジェクトから得られた臨床的に観察level.The新しい洞察と見積もられ、取得された繊維配向の間に有意な差がないことが示された洞調律および心室頻拍中の心室興奮マップと擬似心電図の計算シミュレーションは、開発のための道を開く電気生理学的介入についてのパーソナライズされた診断の医師と意思決定を支援することができ、心臓の患者固有のモデル。
概要
計算論的アプローチは、健康と疾患における心臓の機能の理解の進歩の中心になりつつあります。電気生理学および電気機械技術の最先端の全心臓モデルは現在、通常の心室伝播、不整脈、除細動、電気機械結合、および心臓再同期1などの現象の広い範囲を勉強するために使用されている。しかし、臨床環境で直接適用可能であることが計算論的アプローチのために、それはモデルが患者に特化したものが、モデルが特定のアーキテクチャと、患者の疾患のある心臓の電気生理学的または電気機械的特性に基づいている必要がありますつまりことが不可欠です。そのようなモデルを用いたシミュレーションは、それによって劇的に心臓医療2-4改善、電気生理学的な介入だけでなく、予防のために高度にパーソナライズされた決定に到達するために医師を支援するでしょう。
内容は、 "現実的な心臓モデルの>作成は繊維配向は、心臓に電気伝播とひずみ分布の方向を決定し、患者の心臓の形状と繊維構造の取得を必要とし、したがって、それらを取得することは心臓のモデリング5,6に不可欠です。で医用イメージングの最近の進歩は、それが今では磁気共鳴イメージング(MRI)やコンピューター断層撮影(CT)技術を用いて高分解能で生体内での患者の心、そのような梗塞などincludingstructural改造、の幾何学的形状を得ることが可能ではありません。ただし、特定の設置生体内での患者の心臓の繊維構造体を取得するための実用的な方法。拡散テンソル(DT)のMRI検査7,8、そのまま心臓の繊維の向きを取得する唯一の手法では、9特定の制限のため、生体内で広く利用可能ではありません。簡単な説明臨床の現場にDTMRIを翻訳する前の努力がelsewhを見つけることができるのERE 2。このような繊維配向のルールベースの割り当てなどの方法論がDTMRIに代わるものを提供していますが、これらの方法論は、特定の重大な制限2、10を持っています。したがって、in vivoで心臓繊維構造を取得することが困難で、現在臨床現場での電気生理学的および電気機械心臓シミュレーションの適用を妨げる。本研究の目的は、直接、このニーズに対応することでした。私たちは、心臓の心室繊維配向が正確に心臓やアトラスは、ジオメトリと繊維配向可能です心臓部であるアトラスのジオメトリに対して予測することができるという仮説を立てた。したがって、我々は、in vivoで心臓繊維の向きを推定するための方法論を開発するために従来技術の状態を使用し、ノーマルと失敗イヌ心室2に仮説を検証した。当社繊維見積もり手法の中心的な考え方は、similaritieを利用することである唯一のジオメトリ情報が提供されている(ターゲット)の心のおおよその繊維構造するために、さまざまな心の間でジオメトリを基準に、繊維配向、のs。私達の見積もり手法の中心には、大変形微分同相メトリックマッピング(LDDMM)11と、主成分(PPD)の2、12の保存を使用して、アトラスの繊維配向のモーフィングを使用して、ターゲットジオメトリを持つアトラスジオメトリの登録です。diffeomorphicpropertyはそれによってintegrityof解剖学的構造を維持するアトラスは、変形中に"foldover"自体をしないことを保証LDDMM、の図1は、我々の方法の処理パイプラインを示しています。プロトコルテキストセクション§1推定例の患者のために行うことができますどのように実証することにより、パイプラインのさまざまなコンポーネントについて説明します。 図1のブロックのいくつかの中の数字は、対応するを参照してください。セクションの下のサブセクション§プロトコルテキストの1。
我々は、計算的に地域の電気活性化マップと同様に擬似心電図(擬似心電図)をシミュレートすることにより、推定誤差を定量化し、心臓電気生理学のこのエラーonsimulationsの効果を測定することにより、提案手法の性能を評価した。人間の心の使用不能に起因する、性能評価は、13から15までの先行研究から利用可能なイヌの心臓を用いて行った。推定誤差は傾斜角度16、角度測定がepicardialsurfaceに平行にカットされperformedon組織切片の組織学アールのfollowingthe伝統によって算出した。 anglebetween繊維方向および心外膜接平面がgenerallysmall 17、18であるので、その傾斜角を使用して完全にfiberdirectionを記述する上で情報の損失は軽微であります。 comput用モデルで以前に19,20、および心臓組織が 確立数学的手法と実験データ21から25に基づいて表現されて報告されているようにationalシミュレーション、画像ベースのモデルが構築されました。洞調律は、S1-S2ペーシングプロトコル27でプルキンエネットワーク26、および心室頻拍、由来の複製活性化によるシミュレーションを行った。擬似心電図は28を計算し、平均絶対偏差(MAD)メトリック29を用いて比較した。
プロトコル
1。繊維配向推定
- 1ミリメートル3の解像度で、拡張期に正常な成人の人間の心の構造的MRIやDTMRI画像を取得する。フィッティングによりアトラス構造画像から心室心筋を抽出し、ImageJを使用して、各短軸スライスに対して、スライスで心外膜と心内膜の境界( 図2Aおよび図2B)に沿って配置されたランドマーク点のセットを介してスプラインを閉じた。画像内のすべての10 番目のスライスのために手動でランドマーク点の配置を行う。直線DTMRI画像( 図2C)のDTSの主固有ベクトルを計算することによって、アトラス心臓の繊維方向をMATLAB.Reconstruct使用して、手動で特定された点を補間することにより、残りのスライスのための画期的なポイントを取得します。
- 生体心臓CTやMRI で使用して拡張期にある患者の心臓の形状の画像を取得する。偵察アトラスが構築された方法( 図3Aおよび図3B)と同様に画像から患者の心臓のジオメトリを構造体。患者画像面内分解能が1mm 2であることを前にこのような復興に再サンプリングする必要があります。同様に、ランドマークが手動でピックアップされているため、スライスの数、および面外挿の間隔はセグメント化された患者の心臓の画像が1mmのスライス厚を持つように調整する必要があります。
- 二段階で患者ジオメトリイメージに合わせてアトラス心室画像を変形。最初のステップでは、13の観光スポット付近の点の集合に基づいてアフィン変換を実行:左心室(LV)尖、基部に2右心室(RV)の挿入ポイントを、ベースと頂点の間に2つのRVの挿入ポイントの途中、と2均等基地でRVおよびLV心外膜輪郭を分割ポイント、ベースと頂点の間の中間の4つのセット( 図4A& 図4B)。第二段階では、変形はアフィン変換アトラスは、大変形微分同相写像メトリック(LDDMM)( 図4C)を使用して 、患者ジオメトリに適合するように、さらに心室。
- モーフアフィンマッチングとLDDMM変換の変形場の変換行列に応じて画像のボクセルと再配向DTSの再ポジショニングによってアトラスのDTMRIイメージ。主方向の保全(PPD)メソッドを使用してDTSの再配向を実行します。
- DTS( 図5)の主固有ベクトルを計算することによって、モーフィングアトラスDTMRIイメージから患者繊維配向の推定値を得る。
2。推定誤差の測定
- 312.5×312.5×800μmの3の解像度で、通常の6と3障害のある犬の心の ex vivoでの構造的なMRとDTMR画像を取得する。ここでは、心臓FAIルアーは210分-1でtachypacing 3週間続いバンドル分岐左のラジオ波焼灼経由の犬歯で生成されるべきである。
- セグメント同様にイヌの心から人間アトラスの心臓に心室を、§1.1で説明されるように。 〜9心7( 図6)のように、犬の心を失敗してから1〜6心として正常なイヌの心から分割し、それらのセグメント化された心室を示す。
- アトラス( 図7)のような心の2から6までのそれぞれを用いて、心臓1の心室繊維配向の異なる5つの推定値を得る。
- アトラス( 図8)のような心1を使用して失敗した心室のそれぞれについて、繊維の向きを推定する。
- θC-θA | |、ここで、θcとθの傾斜角が推定される推定繊維配向の各セット内のforeachデータポイントは、のように推定誤差を計算dは、それぞれ、その時点で繊維配向を取得しました。
- 推定された繊維配向の各セット内の各データポイントは、thevector内積によって3次元(3D)でbetweenestimatedと繊維方向を取得した鋭角を計算します。
3。シミュレーション上の推定誤差の影響の測定
- 心臓1から、心臓1(モデル1と呼ぶ)、および5推定繊維配向データセット(モデル2から6)と5のDTMRI獲得した繊維配向を持つものを6モデルを構築する。3心不全のそれぞれについて、ジオメトリは、DTMRI獲得した繊維配向と推定繊維配向を持つもう1つずつ、合計2つの心室のモデルを構築する。ここでは、メッシュの平均エッジ長さの点で計算モデルの空間分解能は、600程度である必要があります。モデル9から7としてDTMRI獲得した繊維で心不全モデルを示し、estimat持つものモデル10〜12.Inモデルとしてedの繊維は、支配方程式と、心臓組織を記述するためにモノドメイン表記を使用します。
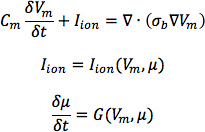
V mは膜電位であり、C m は膜特定の容量であり、 ここで、b は Potse ら 30で説明したようにbidomain伝導率テンソルから計算されるバルク伝導率テンソルσと私はイオンと、現在の膜貫通の密度であり、今度は、V mとmembrane.For C mを越えてイオンフラックスのダイナミクスを記述する状態変数μのセットに依存している、1μF / cm 2の値を使用します。正常イヌ心臓モデルでiを σについては、longitudiを使用0.34 S / mで、それぞれ0.06 S / mの外部および横伝導度の値。イヌ心室筋細胞のグリーンスタイン·ウィンズロウイオンモデルでL 経度を表しています。 30%( 図9)でイヌ心不全心室モデルでの電気伝導度を下げます。
- ソフトウェアパッケージCARP(CardioSolv、LLC)は、すべてのモデルでシミュレーションを洞調律を使用。 S1-S2ペーシング·プロトコルを使用して6失敗モデルでリエントラント心室頻拍(VT)を誘導する。 S2は納品後2秒間持続性VTの活性を得るために、S1とS2の間のタイミングを選択してください。 VTが任意のS1-S2のタイミングのために誘導されない場合は、VTが誘発されるまで、( 図10)70%まで伝導率を減少させる。
- 各シミュレーションのために、心を周囲の等方性浴で2点間の細胞外電位の差をとることにより、擬似心電図を計算します。分離した心臓の基地の近くに2ポイントを配置図10に示すように、それらを結ぶ線は、中隔のベース頂面に対して垂直になるようには18センチ。推定された繊維配向を持つ各シミュレーションでは、MADとしてメトリックを計算する
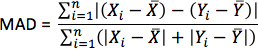
Xは推定繊維配向を用いたシミュレーションのECG波形であり、Yは、取得した繊維配向のシミュレーションをthecorrespondingのECG波形であり、XはXの平均値であり、Yは、Yの平均値であり、Nはxの長さですとY。
結果
図11は 、ACはノーマルと失敗の心の中だけでなく、推定DTMRI由来の繊維配向の合理化された視覚化を表示します。定性検査は、推定された繊維配向がDTMRI由来のものとよく合っていることを示しています。パネルDは心臓1の幾何学的に重ね、示し、正常な心 'の傾斜角度の誤差の分布は、すべての5つの推計値を平均。パネルEは心臓1の幾何学的に重ね、心 'の傾斜角度を失敗?...
ディスカッション
本研究ではDTMRIの非存在下では、正常および失敗心室の心筋の繊維配向が心臓電気生理学のシミュレーションで使用するためにそれらのジオメトリの体内画像から推定することができる、ことを定量的に示しています。提案された方法論は 、in vivo CTデータ内に示したが、それが直接患者繊維配向を獲得する能力の欠如に対処する、心室ジオメトリーの in vivoでのMR <...
開示事項
特別な利害関係は宣言されません。
謝辞
我々は博士に感謝します。レイモンウィンズロー、エリオット·マクベイ、 および ex vivo のデータセットonline.Thisリサーチを提供するためのジョンズ·ホプキンス大学のパトリック·ヘルムは、保健助成金の国立研究所R01-HL082729、国立科学財団助成CBET-0933029によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| LDDMM | ジョンズ·ホプキンス大学 | http://cis.jhu.edu/software/lddmm-volume/index.php | |
| MATLAB | The MathWorks、Inc。社 | R2011b | http://www.mathworks.com/products/matlab/ |
| ImageJの | 国立衛生研究所 | http://rsbweb.nih.gov/ij/ | |
| タランチュラ | CAEソフトウェアソリューション | http://www.meshing.at/Spiderhome/Tarantula.html | |
| CARP | CardioSolv | http://cardiosolv.com/ | |
| 犬の画像 | ジョンズ·ホプキンス大学 | http://www.ccbm.jhu.edu/research/DTMRIDS.php |
参考文献
- Trayanova, N. Whole Heart Modeling: Applications to Cardiac Electrophysiology and Electromechanics. Circulation Research. 108, 113-128 .
- Vadakkumpadan, F., Arevalo, H., Ceritoglu, C., Miller, M., Trayanova, N. Image-Based Estimation of Ventricular Fiber Orientations for Personalized Modeling of Cardiac Electrophysiology. IEEE Transactions on Medical Imaging. 31 (5), 1051-1060 .
- Vadakkumpadan, F., Gurev, V., Constantino, J., Arevalo, H., Trayanova, N., Kerckhoffs, R. Modeling of Whole-Heart Electrophysiology and Mechanics: Towards Patient-Specific Simulations. Patient-Specific Modeling of the Cardiovascular System: Technology-Driven Personalized Medicine. , 145-165 (2010).
- Buxton, A. E., Lee, K. L., DiCarlo, L., Gold, M. R., Greer, G. S., Prystowsky, E. N., O'Toole, M. F., Tang, A., Fisher, J. D., Coromilas, J., Talajic, M., Hafley, G. Electrophysiologic testing to identify patients with coronary artery disease who are at risk for sudden death. Multicenter Unsustained Tachycardia Trial Investigators. The New England Journal of Medicine. 342 (26), 1937-1945 (2000).
- Wei, D., Okazaki, O., Harumi, K., Harasawa, E., Hosaka, H. Comparative simulation of excitation and body surface electrocardiogram with isotropic and anisotropic computer heart models. IEEE Transactions on Biomedical Engineering. 42 (4), 343-357 (1995).
- Leon, L. J., Horacek, B. M. Computer model of excitation and recovery in the anisotropic myocardium. II. Excitation in the simplified left ventricle. Journal of Electrocardiology. 24 (1), 17-31 (1991).
- Rohmer, D., Sitek, A., Gullberg, G. T. Reconstruction and Visualization of Fiber and Laminar Structure in the Normal Human Heart from Ex Vivo Diffusion Tensor Magnetic Resonance Imaging (DTMRI) Data. Investigative Radiology. 42 (11), 777-789 (2007).
- Daubert, J. P., Zareba, W., Hall, W. J., Schuger, C., Corsello, A., Leon, A. R., Andrews, M. L., McNitt, S., Huang, D. T., Moss, A. J., Investigators, M. I. S. Predictive value of ventricular arrhythmia inducibility for subsequent ventricular tachycardia or ventricular fibrillation in Multicenter Automatic Defibrillator Implantation Trial (MADIT) II patients. Journal of Americal College of Cardiology. 47 (1), 98-107 (2006).
- Sosnovik, D. E., Wang, R., Dai, G., Reese, T. G., Wedeen, V. J. Diffusion MR tractography of the heart. Journal of Cardiovascular Magnetic Resonance. 11 (1), 47-61 (2009).
- Sundar, H., Shen, D., Biros, G., Litt, H., Davatzikos, C. Estimating myocardial fiber orientations by template warping. Proc. IEEE International Symposium on Biomedical Imaging. , 73-76 (2006).
- Beg, M. F., Helm, P. A., McVeigh, E., Miller, M. I., Winslow, R. L. Computational Cardiac Anatomy Using MRI. Magnetic Resonance in Medicine. 52 (5), 1167-1174 (2004).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial Transformations of Diffusion Tensor Magnetic Resonance Images. IEEE Transactions on Medical Imaging. 20, 1131-1139 (2001).
- Helm, P. A., Younes, L., Beg, M. F., Ennis, D. B., Leclercq, C., Faris, O. P., McVeigh, E., Kass, D., Miller, M. I., Winslow, R. L. Evidence of Structural Remodeling in the Dyssynchronous Failing Heart. Circulation Research. 98, 125-132 (2006).
- Helm, P., Beg, M. F., Miller, M., Winslow, R. Measuring and mapping cardiac fiber and laminar architecture using diffusion tensor MR imaging. Annals of the New York Academy of Sciences. 1047, 296-307 (2005).
- Helm, P. A., Tseng, H. -. J., Younes, L., McVeigh, E. R., Winslow, R. L. Ex vivo 3D diffusion tensor imaging and quantification of cardiac laminar structure. Magnetic Resonance in Imaging. 54, 850-859 (2005).
- Scollan, D. F., Holmes, A., Winslow, R., Forder, J. Histological validation of myocardial microstructure obtained from diffusion tensor magnetic resonance imaging. American Journal of Physiology - Heart and Circulatory Physiology. 275 (6), H2308-H2318 (1998).
- Lombaert, H., Peyrat, J., Croisille, P., Rapacchi, S., Fanton, L., Cheriet, F., Clarysse, P., Magnin, I., Delingette, H., Ayache, N. Human Atlas of the Cardiac Fiber Architecture: Study on a Healthy Population. IEEE Transactions on Medical Imaging. 31 (7), 1436-1447 (2012).
- Streeter, D. D. . Gross morphology and fiber geometry of the heart. , (1979).
- Vadakkumpadan, F., Rantner, L. J., Tice, B., Boyle, P., Prassl, A. J., Vigmond, E., Plank, G., Trayanova, N. Image-Based Models of Cardiac Structure with Applications in Arrhythmia and Defibrillation Studies. Journal of Electrocardiology. 42, 151.e1-151.e10 (2009).
- Plank, G., Zhou, L., Greenstein, J. L., Plank, G., Zhou, L., Greenstein, J. L., Cortassa, S., Winslow, R. L., O'Rourke, B., Trayanova, N. A. From mitochondrial ion channels to arrhythmias in the heart: computational techniques to bridge the spatio-temporal scales. Philosophical Transactions Series A, Mathematical, Physical, and Engineering Sciences. 366 (1879), 3381-3409 (2008).
- Roberts, D. E., Scher, A. M. Effect of tissue anisotropy on extracellular potential fields in canine myocardium in situ. Circulation Research. 50, 342-351 (1982).
- Greenstein, J., Wu, R., Po, S., Tomaselli, G. F., Winslow, R. L. Role of the Calcium-Independent Transient Outward Current I(to1) in Shaping Action Potential Morphology and Duration. Circulation Research. 87, 1026-1033 (2000).
- Winslow, R., Rice, J., Jafri, S., Marbán, E., O'Rourke, B. Mechanisms of altered excitation-contraction coupling in canine tachycardia-induced heart failure, II: model studies. Circulation Research. 84 (5), 571-586 (1999).
- Akar, F., Nass, R., Hahn, S., Cingolani, E., Shah, M., Hesketh, G., DiSilvestre, D., Tunin, R., Kass, D., Tomaselli, G. Dynamic Changes in Conduction Velocity and Gap Junction Properties During Development of Pacing-Induced Heart Failure. American Journal of Physiology - Heart and Circulatory Physiology. 293 (2), H1223-H1230 (2007).
- Gurev, V., Constantino, J., Rice, J. J., Trayanova, N. Distribution of Electromechanical Delay in the Ventricles:Insights from a 3D Electromechanical Model of the Heart. Biophysical Journal. 99 (3), 745-754 .
- Ten Tusscher, K. H. W. J., Hren, R., Panfilov, A. V. Organization of Ventricular Fibrillation in the Human Heart. Circulation Research. 100 (12), e87-e101 (2007).
- Gima, K., Rudy, Y. Ionic Current Basis of Electrocardiographic Waveforms. Circulation Research. 90, 889-896 (2002).
- Gerstenfeld, E., Dixit, S., Callans, D., Rajawat, Y., Rho, R., Marchlinski, F. Quantitative comparison of spontaneous and paced 12-lead electrocardiogram during right ventricular outflow tract ventricular tachycardia. Journal of Americal College of Cardiology. 41 (11), 2046-2053 (2003).
- Potse, M., Dube, B., Richer, J., Vinet, A., Gulrajani, R. M. A comparison of monodomain and bidomain reaction-diffusion models for action potential propagation in the human heart. IEEE Transactions on Biomedical Engineering. 53 (12), 2425-2435 (2006).
- Peyrat, J. -. M., Sermesant, M., Pennec, X., Delingette, H., Chenyang, X., McVeigh, E. R., Ayache, N. A Computational Framework for the Statistical Analysis of Cardiac Diffusion Tensors: Application to a Small Database of Canine Hearts. IEEE Transactions on Medical Imaging. 26, 1500-1514 (2007).
- Chen, J., Song, S. -. K., Liu, W., McLean, M., Allen, S. J., Tan, J., Wickline, S. A., Yu, X. Remodeling of cardiac fiber structure after infarction in rats quantified with diffusion tensor MRI. American Journal of Physiology - Heart and Circulatory Physiology. 285 (3), H946-H954 (2003).
- Stecker, E. C., Chugh, S. S. Prediction of sudden cardiac death: next steps in pursuit of effective methodology. Journal of Interventional Cardiac Electrophysiolog. 31 (2), 101-107 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved