Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Patienten-spezifischer Modellierung des Herz: Schätzung der Ventrikuläre Faserorientierungen
In diesem Artikel
Zusammenfassung
Eine Methodik zur ventrikulären Faserorientierung in vivo-Bilder des Patienten Herzen Geometrien für personalisierte Modellierung abzuschätzen beschrieben. Validierung der Methodik unter Verwendung von normalen und andernfalls caninen Herzen zeigen, dass, dass es keine signifikanten Unterschiede zwischen geschätzten und erworbenen Faserorientierungen in einer klinisch beobachtbaren Ebene.
Zusammenfassung
Patientenspezifische Simulationen des Herzens (dys) Funktion bei Personalisierung Herztherapie gerichtet sind durch die Abwesenheit von in-vivo-Bildgebung für klinisch Erfassen myokardialen Faserorientierungen behindert. Das Ziel dieses Projektes war es, eine Methodik zur kardialen Faserorientierung in vivo-Bilder des Patienten Herzen Geometrien schätzen zu entwickeln. Eine genaue Darstellung der Geometrie und ventrikulären Faserorientierungen rekonstruiert jeweils von hochauflösenden ex vivo strukturellen Magnetresonanz (MR) und Diffusionstensors (DT) MR-Bilder eines normalen menschlichen Herzens, bezeichnet als Atlas. Ventrikelgeometrie Herzen eines Patienten gewonnen wurde, über halbautomatischen Segmentierung, einer In-vivo-Computertomographie (CT) Bild. Mit Bildumwandlungsalgorithmen wurde der Atlas Ventrikelgeometrie verformt, dass der Patient entsprechen. Schließlich wurde die Verformungsfeld dem Atlas Faser aufgebracht orientatIonen, um eine Schätzung des Patienten Faserorientierungen erhalten. Die Genauigkeit der Faser Schätzungen wurde anhand sechs normale und drei andernfalls canine Herzen. Die mittlere absolute Differenz zwischen Neigungswinkeln von erworbenen und geschätzt Faserorientierungen betrug 15,4 °. Computersimulationen ventrikuläre Aktivierung Karten und pseudo-EKGs im Sinusrhythmus und ventrikuläre Tachykardie angegeben, dass es keine signifikanten Unterschiede zwischen geschätzten und erwarb Faserorientierungen an einer klinisch beobachtbaren level.The neue Erkenntnisse aus dem Projekt erhalten wird den Weg für die Entwicklung von ebnen Patienten-spezifischen Modellen des Herzens, die Ärzte in der personalisierten Diagnostik und Entscheidungen über elektrophysiologische Eingriffe helfen kann.
Einleitung
Die rechnerische Ansatz wird immer von zentraler Bedeutung für die Weiterentwicklung des Verständnisses der Funktion des Herzens in Gesundheit und Krankheit. State-of-the-art ganzen Herzen Modellen der Elektrophysiologie und Elektromechanik werden derzeit verwendet, um eine breite Palette von Phänomenen, wie normale ventrikuläre Ausbreitung, Arrhythmie, Defibrillation, elektromechanischen Kopplung und kardialen Resynchronisationstherapie 1 studieren. Jedoch zur rechnerischen Ansatz unmittelbar in der klinischen Umgebung, ist es unerlässlich, dass die Modelle patientenspezifischen, dh die Modelle an der spezifischen Architektur und elektrophysiologische oder elektromechanischen Eigenschaften des Patienten erkrankten Herzens beruhen muss sein. Simulation mit solchen Modellen wird die Mediziner auf sehr persönliche Entscheidungen für elektrophysiologische Eingriffe sowie Prophylaxe ankommen, dadurch drastisch verbessern kardiale Gesundheit 2-4.
Inhalt "> Erstellung von realistischen Herz Modellen erfordert die Erfassung der Geometrie und Faserstruktur eines Patienten Herz. Fiber Orientierungen bestimmen Richtungen elektrische Ausbreitung und Dehnungsverteilung im Herzen, und deshalb Erwerb ihnen ist wichtig, Herz Modellierung 5, 6. Mit jüngsten Fortschritte in der medizinischen Bildgebung, ist es nun möglich, die Geometrie des Herzens eines Patienten, includingstructural Remodelling wie Infarkt, in vivo mit hoher Auflösung unter Verwendung der Kernspintomographie (MRI) und Computertomographie (CT)-Technologien erhalten. Jedoch gibt es keinen praktische Methode zum Erfassen Faserstruktur Herz eines Patienten in vivo. Diffusion Tensor (DT) MRT 7, 8, die einzige Technik, um Faserorientierungen des intakten Herzens zu machen, ist nicht weit verbreitet in vivo aufgrund bestimmter Grenzen 9. Eine kurze Beschreibung der die bisherigen Bemühungen um DTMRI der klinischen Einstellung übersetzen kann elsewh gefunden werdenere 2. Obwohl Methoden wie regelbasierte Zuordnung der Faserorientierungen Alternativen zu DTMRI anbieten, haben diese Methoden bestimmte schwerwiegende Einschränkungen 2, 10. So Schwierigkeiten beim Erwerb Herz Faserstruktur in vivo derzeit behindern die Anwendung von elektrophysiologischen und elektromechanische Herz Simulationen im klinischen Umfeld. Das Ziel dieser Untersuchung war es, direkt an dieses Bedürfnis.Wir nahmen an, dass ventrikuläre Faserorientierungen eines Herzens exakt vorgegebenen die Geometrie des Herzens und einem Atlas, wobei der Atlas ist ein Herz, deren Geometrie und Faserorientierungen stehen vorhergesagt werden. Dementsprechend haben wir modernste Techniken, um eine Methodik zur Abschätzung der kardialen Faserorientierungen in vivo zu entwickeln, und testeten die Hypothese, in normalen und andernfalls canine Ventrikel 2. Die zentrale Idee unserer Faser Schätzung Methodik ist similaritie nutzens in Faserorientierungen, bezogen auf Geometrie, zwischen verschiedenen Herzen, um ungefähre der Faserstruktur eines (Ziel-) Herzen, für die nur die Geometrie Informationen verfügbar sind. Im Herzen unserer Einschätzung Methodik ist die Registrierung des atlas Geometrie mit der Soll-Geometrie mit großen Verformungen diffeomorph metrischen Mapping (LDDMM) 11, und das Morphing von atlas Faserorientierungen mit Erhalt der Hauptkomponenten (PPD) 2, 12. Die diffeomorphicproperty der LDDMM garantiert, dass der Atlas nicht "foldover" selbst während der Verformung und damit die Erhaltung der integrityof anatomischen Strukturen. Abbildung 1 die Verarbeitungs-Pipeline unserer Methodik veranschaulicht. Das Protokoll Textteil § 1 beschreibt die verschiedenen Komponenten der Rohrleitung durch den Nachweis, wie die Schätzung für ein Beispiel Patienten durchgeführt werden kann. Die Zahlen in einige der Blöcke in 1 beziehen sich auf die entsprechendeUnterabschnitte gemäß § § 1 des Protokolls Text.
Wir untersuchten die Leistung der vorgeschlagenen Methodik durch die Quantifizierung der Schätzfehler, und Messen der Auswirkung dieses Fehlers onsimulations der Elektrophysiologie des Herzens, indem rechnerisch simuliert lokale elektrische Ansteuerung Karten sowie Pseudo-Elektrokardiogramm (pseudo-EKGs). Aufgrund der Nichtverfügbarkeit der menschlichen Herzen, wurde die Leistungsbewertung unter Verwendung canine Herzen Verfügung aus früheren Studien 13-15. Der Schätzfehler wurde mittels Neigungswinkeln 16, followingthe Tradition der Histologie, wo Winkelmessungen sind performedon Gewebeschnitten, die geschnitten parallel zur epicardialsurface berechnet. Da die angleBetween die Faserrichtung und epikardialen Tangentialebene generallysmall 17, 18, der Informationsverlust bei der Beschreibung eines fiberdirection vollständig mit ihr Neigungswinkel ist unerheblich. Für die computationale Simulationen bildbasierten Modelle wurden gebaut wie zuvor berichtet 19, 20, und Herzgewebe in den Modellen wurde basierend auf festgelegten mathematischen Techniken und experimentellen Daten von 21 bis 25 repräsentiert. Sinusrhythmus wurde simuliert durch die Replikation aktiviert, die aus der Purkinje-Netzwerk 26 und ventrikuläre Tachykardie, von einem S1-S2 Stimulation Protokoll 27. Pseudo-EKGs wurden 28 berechnet und verglichen mit der mittlere absolute Abweichung (MAD) metrisch 29.
Protokoll
Ein. Faserorientierungen Schätzung
- Erwerben strukturelle MRT und DTMRI Bilder von einem normalen erwachsenen menschlichen Herzens in Diastole, bei einer Auflösung von 1 mm 3. Verwendung ImageJ, extrahieren die ventrikuläre Myokard aus dem Atlas strukturellen Bildes durch Verschraubung, für jeden kurzen Achse Scheibe, geschlossen Splines durch eine Reihe von Punkten entlang der Landmarke epikardialen und endokardialen Grenzen in der Scheibe (2A & 2B) angeordnet sind. Führen Sie die Platzierung der Wahrzeichen Punkte manuell für jede 10 th Slice im Bild. Besorgen Sie sich die Wahrzeichen Punkte für die restlichen Scheiben durch lineare Interpolation die manuell identifizierten Punkten mit MATLAB.Reconstruct die Faserorientierung des Atlas Herzen durch die Berechnung der primären Eigenvektoren der DTs im DTMRI Bild (Abbildung 2C).
- Erwerben Sie ein Bild von der Geometrie des Patienten Herz in der Diastole mit in vivo Herz-CT oder MRT. Reconstruct den Patienten Herzgeometrie aus dem Bild ähnlich der Art und Weise der Atlas gebaut (3A & 3B) wurde. Der Patient Bild sollte vor der Rekonstruktion werden, dass die in-plane Auflösung 1 mm 2 ist neu abgetastet. Ebenso muss die Anzahl der Scheiben, für die Sehenswürdigkeiten manuell kommissioniert werden, und das Intervall von Out-of-Plane-Interpolation so eingestellt werden, dass das segmentierte Patienten Herzen Bild eine Schichtdicke von 1 mm hat.
- Deform der Atlas ventrikuläre Bild entsprechend den Patienten Geometrie Bild in zwei Schritten. Im ersten Schritt, Durchführen einer affinen Transformation auf einem Satz von dreizehn Landmarken Punkten: der linke Ventrikel (LV) der Spitze, die beiden rechten ventrikulären (RV) Einfügepunkte an der Basis, die zwei RV Einfügepunkte Mitte zwischen Basis und der Spitze, und vier Sätze von zwei Punkten, die gleichmäßig aufzuteilen RV und LV epikardialen Konturen an der Basis, und auf halbem Weg zwischen Basis und Spitze (4A & Abbildung 4B). Im zweiten Schritt, der affine verformen Ventrikel-transformierten Atlas weiter, um den Patienten Geometrie entsprechen, unter Verwendung Großdeformationstransformation diffeomorph Metrik Mapping (LDDMM) (4C).
- Morph die DTMRI Bild des Atlas durch Neupositionierung des Bildes Voxel und Neuausrichtung der DTs nach der Transformationsmatrix der affine Matching und die Verformung Bereich der LDDMM Transformation. Führen Sie die Neuorientierung der DTS über die Erhaltung der Hauptrichtungen (PPD)-Methode.
- Besorgen Sie sich die Schätzung der Patienten Faserorientierungen aus dem morphed atlas DTMRI Bild durch Berechnung der primären Eigenvektor der DTS (Abbildung 5).
2. Messung der Schätzfehler
- Erwerben ex vivo strukturelle MR und DTMR Bilder von sechs normale und drei andernfalls canine Herzen, bei einer Auflösung von 312,5 × 312,5 × 800 um 3. Hier Herzen faiKöder sollte in den Eckzähnen via Radiofrequenz-Ablation des Linksschenkelblock von 3 Wochen tachypacing bei 210 min -1 folgt erzeugt werden.
- Segment die Ventrikel von den Hunden Herzen ähnlich dem menschlichen atlas Herz, wie in § 1.1 beschrieben. Bezeichnen Ventrikel segmentierte von normalen Hunden Herzen als hearts 1 bis 6, und die segmentierte aus der Nichtbeachtung canine Herzen als Herz 7 bis 9 (Abbildung 6).
- Erhalten fünf verschiedenen Schätzungen der ventrikulären Faserorientierungen des Herzens 1 mit jeweils hearts 2 bis 6 als Atlas (Abbildung 7).
- Schätzen Faserorientierungen für jede der andernfalls Ventrikel mit Herz 1 als Atlas (Abbildung 8).
- Foreach Datenpunkt jeder Satz von geschätzten Faserorientierungen, berechnen die Schätzfehler als | θ c-θ a |, wobei θ c und θ a sind die Neigungswinkel der veranschlagte eind erworbenen Faserorientierungen an diesem Punkt sind.
- Für jeden Datenpunkt in jedem Satz von geschätzten Faserorientierungen, berechnen die spitzen Winkel betweenestimated und erworbenen Faserrichtungen in drei Dimensionen (3D) mittels thevector Skalarprodukts.
3. Messung der Auswirkungen der Schätzfehler auf Simulationen
- Von Herzen 1, konstruieren sechs Modelle, eines mit den DTMRI erworbenen Faserorientierungen des Herzens 1 (bezeichnet als Modell 1) und fünf mit den fünf geschätzten Faserorientierungen Datensätze (Modelle 2 bis 6). Für jede der drei Herzinsuffizienz Geometrien, bauen ventrikuläres zwei Modelle, eines mit den DTMRI erworbenen Faserorientierungen und der andere mit den geschätzten Faserorientierungen. Hier ist die räumliche Auflösung der Modelle, in Bezug auf die mittlere Kantenlänge der Maschen berechnet, sollte etwa 600 um betragen. Bezeichnen die Herzinsuffizienz Modelle mit DTMRI erworbenen Fasern als Modelle 7 bis 9, und die mit geschätztened Fasern als Modelle 10 bis 12.In die Modelle verwenden Monodomäne Darstellung zur Herzgewebe beschreiben, mit bestimmenden Gleichungen:
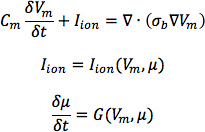
wobei σ b die Masse-Leitfähigkeit, die aus den Tensor bidomain Leitfähigkeit Tensoren berechnet wird, wie durch 30 Potse et al beschrieben ist, V m die Transmembranpotential, C m ist die Membran spezifische Kapazität, und I-Ion ist die Dichte des transmembranen Strom, was wiederum hängt von V m und einer Reihe von Zustandsvariablen μ beschreibt die Dynamik der Ionenströme über die membrane.For C m, mit einem Wert von 1 μ F / cm 2. Für σ i im normalen Hundeherz Modelle verwenden Längsinterne und Querleitfähigkeit Werte von 0,34 S / m und 0,06 S / m sind. Stellen l lon von den Greenstein-Winslow ionischen Modelle der Hund Ventrikelmyocyten. Verringern Sie die elektrische Leitfähigkeit in canine Herzinsuffizienz ventrikuläre Modelle von 30% (Abbildung 9).
- Mit dem Software-Paket CARP (CardioSolv, LLC), simulieren Sinusrhythmus mit allen Modellen. Induzieren einspringenden ventrikuläre Tachykardie (VT) in den sechs andernfalls Modelle unter Verwendung eines S1-S2 Pacing-Protokoll. Wählen das Timing zwischen S1 und S2 auf aufrechterhalten VT Aktivität für 2 Sekunden zu erhalten, nachdem S2 Lieferung. Wenn VT ist nicht für jeden S1-S2 Zeitpunkt induziert, verringern die Leitfähigkeit um bis zu 70% bis VT induziert wurde (Abbildung 10).
- Für jede Simulation, Berechnung Pseudo-EKGs, indem die Differenz der extrazellulären Potentiale zwischen zwei Punkten in einem isotropen Bad Umgebung die Herzen. Zeigen die zwei Punkte in der Nähe der Basis des Herzens abgetrenntvon 18 cm, so dass die Verbindungslinie zwischen ihnen senkrecht zu der Basis-Ebene des Scheitels Septum wie in Abbildung 10 dargestellt. Für jede Simulation mit geschätzten Faserorientierungen, berechnen Sie die MAD Metrik
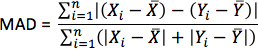
wobei X der EKG-Wellenform der Simulation mit geschätzten Faserorientierungen ist, Y die EKG-Wellenform von thecorresponding Simulation mit erworbenen Faserorientierungen ist, X der Mittelwert von X ist, Y ist der Mittelwert von Y, und n die Länge von X und Y.
Ergebnisse
Abbildung 11 zeigt AC gestrafft Visualisierungen geschätzt sowie DTMRI-derived Faserorientierungen in normalen und versagenden Herzen. Qualitative Untersuchung zeigt, dass die geschätzten Faserorientierungen genau über DTMRI-derived diejenigen. Tafel D zeigt, überlagert von der Geometrie des Herzens 1, die Verteilung der Fehler im normalen Herzen 'Neigungswinkeln, gemittelt über alle fünf Schätzungen. Tafel E zeigt die mittlere Verteilung der Fehler im versagenden Herzen 'Neigungswinkel, ...
Diskussion
Diese Untersuchung zeigt quantitativ, daß in der Abwesenheit von DTMRI, myokardialer Faserorientierungen von normalen und andernfalls Ventrikel von in-vivo-Bilder ihrer Geometrien zur Verwendung in der Herz-Elektrophysiologie Simulationen kann abgeschätzt werden. Die vorgeschlagene Methodik wird in vivo CT-Daten gezeigt, aber es ist gleichermaßen für in vivo MR-Bilder von ventrikulären Geometrie, sie den Mangel an Fähigkeit, direkt zu erwerben Patienten Faserorientierungen. Es ist somit ...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Drs. Raimond Winslow, Elliot McVeigh und Patrick Helm an der Johns Hopkins University für die Bereitstellung der ex vivo Datensätze online.This Forschung wurde von den National Institutes of Health grant R01-HL082729 und National Science Foundation CBET-0.933.029 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| LDDMM | Johns Hopkins University | http://cis.jhu.edu/software/lddmm-volume/index.php | |
| MATLAB | Mathworks, Inc. | R2011b | http://www.mathworks.com/products/matlab/ |
| ImageJ | National Institutes of Health | http://rsbweb.nih.gov/ij/ | |
| Tarantel | CAE Software Solutions | http://www.meshing.at/Spiderhome/Tarantula.html | |
| CARP | CardioSolv | http://cardiosolv.com/ | |
| Canine Bilder | Johns Hopkins University | http://www.ccbm.jhu.edu/research/DTMRIDS.php |
Referenzen
- Trayanova, N. Whole Heart Modeling: Applications to Cardiac Electrophysiology and Electromechanics. Circulation Research. 108, 113-128 .
- Vadakkumpadan, F., Arevalo, H., Ceritoglu, C., Miller, M., Trayanova, N. Image-Based Estimation of Ventricular Fiber Orientations for Personalized Modeling of Cardiac Electrophysiology. IEEE Transactions on Medical Imaging. 31 (5), 1051-1060 .
- Vadakkumpadan, F., Gurev, V., Constantino, J., Arevalo, H., Trayanova, N., Kerckhoffs, R. Modeling of Whole-Heart Electrophysiology and Mechanics: Towards Patient-Specific Simulations. Patient-Specific Modeling of the Cardiovascular System: Technology-Driven Personalized Medicine. , 145-165 (2010).
- Buxton, A. E., Lee, K. L., DiCarlo, L., Gold, M. R., Greer, G. S., Prystowsky, E. N., O'Toole, M. F., Tang, A., Fisher, J. D., Coromilas, J., Talajic, M., Hafley, G. Electrophysiologic testing to identify patients with coronary artery disease who are at risk for sudden death. Multicenter Unsustained Tachycardia Trial Investigators. The New England Journal of Medicine. 342 (26), 1937-1945 (2000).
- Wei, D., Okazaki, O., Harumi, K., Harasawa, E., Hosaka, H. Comparative simulation of excitation and body surface electrocardiogram with isotropic and anisotropic computer heart models. IEEE Transactions on Biomedical Engineering. 42 (4), 343-357 (1995).
- Leon, L. J., Horacek, B. M. Computer model of excitation and recovery in the anisotropic myocardium. II. Excitation in the simplified left ventricle. Journal of Electrocardiology. 24 (1), 17-31 (1991).
- Rohmer, D., Sitek, A., Gullberg, G. T. Reconstruction and Visualization of Fiber and Laminar Structure in the Normal Human Heart from Ex Vivo Diffusion Tensor Magnetic Resonance Imaging (DTMRI) Data. Investigative Radiology. 42 (11), 777-789 (2007).
- Daubert, J. P., Zareba, W., Hall, W. J., Schuger, C., Corsello, A., Leon, A. R., Andrews, M. L., McNitt, S., Huang, D. T., Moss, A. J., Investigators, M. I. S. Predictive value of ventricular arrhythmia inducibility for subsequent ventricular tachycardia or ventricular fibrillation in Multicenter Automatic Defibrillator Implantation Trial (MADIT) II patients. Journal of Americal College of Cardiology. 47 (1), 98-107 (2006).
- Sosnovik, D. E., Wang, R., Dai, G., Reese, T. G., Wedeen, V. J. Diffusion MR tractography of the heart. Journal of Cardiovascular Magnetic Resonance. 11 (1), 47-61 (2009).
- Sundar, H., Shen, D., Biros, G., Litt, H., Davatzikos, C. Estimating myocardial fiber orientations by template warping. Proc. IEEE International Symposium on Biomedical Imaging. , 73-76 (2006).
- Beg, M. F., Helm, P. A., McVeigh, E., Miller, M. I., Winslow, R. L. Computational Cardiac Anatomy Using MRI. Magnetic Resonance in Medicine. 52 (5), 1167-1174 (2004).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial Transformations of Diffusion Tensor Magnetic Resonance Images. IEEE Transactions on Medical Imaging. 20, 1131-1139 (2001).
- Helm, P. A., Younes, L., Beg, M. F., Ennis, D. B., Leclercq, C., Faris, O. P., McVeigh, E., Kass, D., Miller, M. I., Winslow, R. L. Evidence of Structural Remodeling in the Dyssynchronous Failing Heart. Circulation Research. 98, 125-132 (2006).
- Helm, P., Beg, M. F., Miller, M., Winslow, R. Measuring and mapping cardiac fiber and laminar architecture using diffusion tensor MR imaging. Annals of the New York Academy of Sciences. 1047, 296-307 (2005).
- Helm, P. A., Tseng, H. -. J., Younes, L., McVeigh, E. R., Winslow, R. L. Ex vivo 3D diffusion tensor imaging and quantification of cardiac laminar structure. Magnetic Resonance in Imaging. 54, 850-859 (2005).
- Scollan, D. F., Holmes, A., Winslow, R., Forder, J. Histological validation of myocardial microstructure obtained from diffusion tensor magnetic resonance imaging. American Journal of Physiology - Heart and Circulatory Physiology. 275 (6), H2308-H2318 (1998).
- Lombaert, H., Peyrat, J., Croisille, P., Rapacchi, S., Fanton, L., Cheriet, F., Clarysse, P., Magnin, I., Delingette, H., Ayache, N. Human Atlas of the Cardiac Fiber Architecture: Study on a Healthy Population. IEEE Transactions on Medical Imaging. 31 (7), 1436-1447 (2012).
- Streeter, D. D. . Gross morphology and fiber geometry of the heart. , (1979).
- Vadakkumpadan, F., Rantner, L. J., Tice, B., Boyle, P., Prassl, A. J., Vigmond, E., Plank, G., Trayanova, N. Image-Based Models of Cardiac Structure with Applications in Arrhythmia and Defibrillation Studies. Journal of Electrocardiology. 42, 151.e1-151.e10 (2009).
- Plank, G., Zhou, L., Greenstein, J. L., Plank, G., Zhou, L., Greenstein, J. L., Cortassa, S., Winslow, R. L., O'Rourke, B., Trayanova, N. A. From mitochondrial ion channels to arrhythmias in the heart: computational techniques to bridge the spatio-temporal scales. Philosophical Transactions Series A, Mathematical, Physical, and Engineering Sciences. 366 (1879), 3381-3409 (2008).
- Roberts, D. E., Scher, A. M. Effect of tissue anisotropy on extracellular potential fields in canine myocardium in situ. Circulation Research. 50, 342-351 (1982).
- Greenstein, J., Wu, R., Po, S., Tomaselli, G. F., Winslow, R. L. Role of the Calcium-Independent Transient Outward Current I(to1) in Shaping Action Potential Morphology and Duration. Circulation Research. 87, 1026-1033 (2000).
- Winslow, R., Rice, J., Jafri, S., Marbán, E., O'Rourke, B. Mechanisms of altered excitation-contraction coupling in canine tachycardia-induced heart failure, II: model studies. Circulation Research. 84 (5), 571-586 (1999).
- Akar, F., Nass, R., Hahn, S., Cingolani, E., Shah, M., Hesketh, G., DiSilvestre, D., Tunin, R., Kass, D., Tomaselli, G. Dynamic Changes in Conduction Velocity and Gap Junction Properties During Development of Pacing-Induced Heart Failure. American Journal of Physiology - Heart and Circulatory Physiology. 293 (2), H1223-H1230 (2007).
- Gurev, V., Constantino, J., Rice, J. J., Trayanova, N. Distribution of Electromechanical Delay in the Ventricles:Insights from a 3D Electromechanical Model of the Heart. Biophysical Journal. 99 (3), 745-754 .
- Ten Tusscher, K. H. W. J., Hren, R., Panfilov, A. V. Organization of Ventricular Fibrillation in the Human Heart. Circulation Research. 100 (12), e87-e101 (2007).
- Gima, K., Rudy, Y. Ionic Current Basis of Electrocardiographic Waveforms. Circulation Research. 90, 889-896 (2002).
- Gerstenfeld, E., Dixit, S., Callans, D., Rajawat, Y., Rho, R., Marchlinski, F. Quantitative comparison of spontaneous and paced 12-lead electrocardiogram during right ventricular outflow tract ventricular tachycardia. Journal of Americal College of Cardiology. 41 (11), 2046-2053 (2003).
- Potse, M., Dube, B., Richer, J., Vinet, A., Gulrajani, R. M. A comparison of monodomain and bidomain reaction-diffusion models for action potential propagation in the human heart. IEEE Transactions on Biomedical Engineering. 53 (12), 2425-2435 (2006).
- Peyrat, J. -. M., Sermesant, M., Pennec, X., Delingette, H., Chenyang, X., McVeigh, E. R., Ayache, N. A Computational Framework for the Statistical Analysis of Cardiac Diffusion Tensors: Application to a Small Database of Canine Hearts. IEEE Transactions on Medical Imaging. 26, 1500-1514 (2007).
- Chen, J., Song, S. -. K., Liu, W., McLean, M., Allen, S. J., Tan, J., Wickline, S. A., Yu, X. Remodeling of cardiac fiber structure after infarction in rats quantified with diffusion tensor MRI. American Journal of Physiology - Heart and Circulatory Physiology. 285 (3), H946-H954 (2003).
- Stecker, E. C., Chugh, S. S. Prediction of sudden cardiac death: next steps in pursuit of effective methodology. Journal of Interventional Cardiac Electrophysiolog. 31 (2), 101-107 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten