Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Пациент конкретного моделирования сердца: оценка ориентации волокон Желудочковая
В этой статье
Резюме
Методология оценки ориентации волокон желудочков с в естественных изображений пациента геометрии сердца для персонализированной моделирования описаны. Проверка осуществляется с использованием методологии и отсутствии нормального собачьего сердца продемонстрировать, что нет никаких существенных различий между оценивается и приобрел ориентации волокон в клинически наблюдаемые уровне.
Аннотация
Пациент конкретного моделирования сердца (дисфункция) функции, направленные на персонализации терапии сердечной мешает отсутствие в технологии визуализации естественных условиях для приобретения клинических инфарктом ориентации волокон. Цель этого проекта заключалась в разработке методологии оценки сердечной ориентации волокон в естественных условиях из фотографий пациентов геометрии сердца. Точное представление о геометрии желудочков и волокон ориентации была реконструирована, соответственно, с высоким разрешением бывших естественных условиях структурной магнитного резонанса (МР) и тензора диффузии (DT) МРТ нормального человеческого сердца, называют атлас. Желудочковая геометрии сердца пациента был извлечен, с помощью полуавтоматической сегментации, от в естественных условиях компьютерной томографии (КТ) изображения. Использование алгоритмов преобразования изображения, геометрия атлас желудочка была деформирована, совпадающее с пациентом. Наконец, деформация поля был применен к атласу волокна orientatионы, чтобы получить оценку пациента ориентации волокон. Точность оценки волокна оценивали с помощью шести нормальных и три отсутствии собачьего сердца. Средняя абсолютная разница между углами наклона приобрел и приблизительно ориентации волокон составляла 15,4 °. Вычислительного моделирования желудочковой активации карты и псевдо-ЭКГ с синусовым ритмом и желудочковой тахикардии указал, что нет никаких существенных различий между оценивается и приобрел ориентации волокон в клинически наблюдаемые level.The новые идеи получены из проекта проложит путь для развития Пациент конкретные модели сердца, которая может помочь врачам в диагностике и персонализированные решения, касающиеся электрофизиологических вмешательства.
Введение
Вычислительный подход становится центральным в развитие понимания функции сердца в норме и патологии. Государство-оф-искусство целого сердца моделей электрофизиологии и электромеханика в настоящее время используются для изучения широкого круга явлений, таких как нормальное распространение желудочка, аритмия, дефибрилляции, электромеханической связи и сердечной ресинхронизации 1. Тем не менее, для вычислительного подхода к их непосредственного применения в клинических условиях, крайне важно, что модели, будьте терпеливы конкретные, т.е. модель должна быть основана на определенной архитектуры и электрофизиологические или электромеханические свойства больное сердце пациента. Моделирование с такими моделями, поможет врачам, чтобы прийти к высоко персонализированные решения для электрофизиологических вмешательств, а также профилактика, тем самым значительно улучшая сердечную здравоохранения 2-4.
Содержание "> создание реалистичных моделей требует сердечного приобретение геометрию и структуру волокна больного сердца. Волоконно ориентации определяют направления электрического распространения и распределения деформаций в сердце, и поэтому их приобретение необходимо для моделирования сердечной 5, 6. С последних достижений в области медицинской визуализации, то теперь возможно получить геометрию пациента сердце, includingstructural ремоделирования миокарда, таких как, в естественных условиях с высоким разрешением использованием магнитно-резонансной томографии (МРТ) и компьютерной томографии (КТ) технологий. Тем не менее, нет никаких Практический метод для приобретения волокнистой структуры пациента сердца в естественных условиях. тензора диффузии (DT) МРТ 7, 8, единственный метод получить волокно ориентации нетронутым сердцем, не является широко доступной в естественных условиях в связи с определенными ограничениями 9. Краткое описание из предыдущих усилий, чтобы перевести DTMRI в клинических условиях может быть найдено elsewhпрежде чем 2. Хотя такие методологии, как на основе правил назначения волоконно ориентации предложить альтернативу DTMRI, эти методики имеют ряд серьезных ограничений 2, 10. Таким образом, трудности в приобретении сердечного волокнистой структуры в естественных условиях в настоящее время препятствуют применению электрофизиологических и электромеханических сердечной моделирования в клинических условиях. Целью данного исследования было напрямую обратиться к этой потребности.Мы предположили, что желудочковая ориентации волокон сердца можно точно предсказать, учитывая геометрию сердца и атлас, атлас, где есть сердце, геометрия и ориентация волокон доступны. Соответственно, мы использовали современные методы разработки методологии для оценки сердечной ориентации волокон в живом организме, и проверили гипотезу в нормальных и отсутствии собачьей желудочков 2. Основная идея нашей методологии оценки волокно является использование сродствахъс клетчаткой ориентации по отношению к геометрии, между различными сердца, чтобы приблизить структуру волокна (цель) сердца, для которых только геометрия информации. В основе нашей методики оценки является регистрация атлас геометрии с целевой геометрии с помощью больших деформаций диффеоморфных метрических отображения (LDDMM) 11, и морфинг атлас ориентации волокон использованием сохранении основных компонентов (PPD) 2, 12. Diffeomorphicproperty LDDMM из гарантий того, что атлас не "Foldover" себя во время деформации, тем самым сохраняя integrityof анатомические структуры. рисунке 1 показана обработка трубопровода нашей методологии. В разделе текст протокола § 1 описываются различные компоненты трубопровода, демонстрируя, как оценка может быть выполнена для примера пациента. Цифры внутри некоторых блоков на рисунке 1 обратитесь к соответствующемуподразделы в разделе § 1 текст протокола.
Мы оценили эффективность предлагаемой методики по количественной оценке ошибки, и измерение влияния этой ошибки onsimulations сердечной электрофизиологии, в вычислительном моделировании местной электрической активации карт, а также псевдо-ЭКГ (псевдо-ЭКГ). Из-за отсутствия человеческих сердец, оценка эффективности был проведен с использованием собачьего сердца доступны из предыдущих исследований, 13-15. Погрешность рассчитывается путем углами наклона 16, followingthe традиции гистологии, где угловых измерений performedon срезов тканей, которые вырезаются параллельно epicardialsurface. С anglebetween направление волокон и эпикарда касательной плоскости составляет 17 generallysmall, 18, потери информации при описании fiberdirection, полностью используя свой угол наклона невелик. Для вычислительныхРОКУ Национальная моделирования, на основе изображения модели были построены как сообщалось ранее 19, 20, и сердечная ткань в модели был представлен на основе установленных математических методов и экспериментальных данных 21-25. Синусовый ритм был смоделирован путем репликации активации, происходящих из Пуркинье сети 26 и желудочковой тахикардии, по S1-S2 стимуляции протокола 27. Псевдо-ЭКГ были вычислены 28 и сравнивали с использованием среднее абсолютное отклонение (MAD) метрику 29.
протокол
1. Оценка ориентации волокон
- Приобретать структурных МРТ и DTMRI изображения нормального взрослого человеческого сердца в диастолу, с разрешением 1 мм 3. Использование ImageJ, извлекать миокарда желудочков из атласа структурного изображения путем установки для каждой короткой оси срез, закрытые сплайны через ряд знаковых пунктов, расположенных вдоль эпикарда и эндокарда границы в срезе (рис. 2A и рис. 2В). Выполните размещения ориентир точки вручную для каждого 10-го ломтик в изображении. Получить ориентир точки для остальных ломтиками по линейной интерполяции вручную определить точки, используя MATLAB.Reconstruct волокна ориентации атлас сердца путем вычисления первичных собственных векторов ДЦ в DTMRI изображение (рис. 2).
- Получить изображение геометрии пациента сердца в диастолу использования в естественных условиях сердечного КТ или МРТ. ReconПостроим пациента геометрии сердца с изображения аналогично тому, как атлас был построен (рис. 3А и 3В). Пациент изображения должны быть повторно пробы до реконструкции, что в плоскости разрешение 1 мм 2. Кроме того, количество срезов, для которых ориентиры вручную выбрал, и интервал вне плоскости интерполяции должен быть отрегулирован так, что сегментированные изображения сердца пациента ломтик толщиной 1 мм.
- Деформировать изображение атлас желудочка в соответствии с пациентом геометрии изображения в два этапа. На первом этапе, выполнить аффинное преобразование на основе набора из тринадцати пунктов ориентиры: левого желудочка (ЛЖ) вершины, два правого желудочка (ПЖ) точки вставки в основании, два RV точки вставки на полпути между основанием и вершиной, и четыре набора из двух точек, которые равномерно делят ПЖ и ЛЖ эпикардиальных контуров на базе, и на полпути между основанием и вершиной (рис. 4а и Рис. 4б). На втором этапе, деформировать аффинно-преобразовано атлас желудочков дальнейшем в соответствии с геометрией пациента, с использованием больших деформаций диффеоморфных метрических отображения (LDDMM) (рис. 4в).
- Morph изображение DTMRI атласа путем повторного позиционирования изображения вокселей и вновь ориентироваться ДЦ в соответствии с матрицей преобразования аффинного соответствия и деформации поля LDDMM преобразования. Выполните переориентации ДЦ помощью сохранение основных направлений (PPD) методом.
- Получить оценку пациента ориентации волокна из синтезированных изображений атлас DTMRI путем вычисления первичных собственным DTS (рис. 5).
2. Измерение ошибки оценивания
- Приобретать бывших естественных условиях структурных MR и DTMR изображений шесть нормальных и три отсутствии собачьего сердца, при разрешении 312,5 × 312,5 × 800 мкм 3. Здесь сердце FAIприманки должен быть сформирован в клыках с помощью радиочастотной абляции левой ножки пучка филиала, затем 3 недели tachypacing при 210 мин -1.
- Сегмент желудочки из собачьего сердца подобно человеческому сердцу атласа, как описано в § 1.1. Обозначим желудочков сегментирован от нормального собачьего сердца, сердца от 1 до 6, и те, сегментированный от падения собачьего сердца, сердца с 7 по 9 (рис. 6).
- Получить пяти различных оценках желудочка волокна ориентации сердца 1, используя каждую из сердца от 2 до 6, как атлас (рис. 7).
- Оцените ориентации волокон для каждого из неисправного желудочков сердца использовании 1 в качестве атласа (рис. 8).
- Foreach точки данных в каждом наборе оценкам ориентации волокон, вычислить оценки ошибки, | θ C-θ |, где θ с и θ являются углы наклона приблизительног приобрела волоконно ориентации в этой точке, соответственно.
- Для каждой точки данных в каждом наборе оценкам ориентации волокон, вычислить острого угла betweenestimated и приобрела волоконно направления в трех измерениях (3D) с помощью продукта thevector точка.
3. Измерение воздействия Оценка Ошибка на симуляторы
- От сердца 1, построим шесть моделей, одна с DTMRI приобретенного волокна ориентации сердца 1 (называется модель 1), и пять с пятью оценкам волокна ориентации данных (модели от 2 до 6). Для каждой из трех сердечной недостаточности геометрий, построить две модели желудочка, один с DTMRI приобретенных ориентации волокон и других с предполагаемой ориентации волокон. При этом пространственное разрешение моделей, рассчитанная по средней длине края сетки, должна быть около 600 мкм. Обозначим модели сердечной недостаточности с DTMRI приобретенного волокна в качестве моделей от 7 до 9, а с оцеред волокон в качестве моделей от 10 до 12.In модели, использовать однодоменных представления для описания сердечной ткани, с руководящими уравнений:
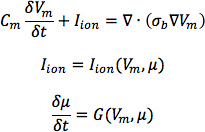
где σ б это основной тензор проводимости, которая рассчитывается исходя из bidomain тензоров проводимости, как описано Potse и др. 30; V т трансмембранный потенциал, С т удельная емкость мембраны, и я ионной плотности трансмембранного тока, которая в свою очередь зависит от V м и набор переменных состояния μ, описывающая динамику ионных потоков через membrane.For C м, используйте значение 1 μ F / см 2. Для σ я в нормальной собачьей модели сердца, использовать продольныеи поперечной проводимости значения 0,34 См / м и 0,06 См / м, соответственно. Представляете л LON на Гринштейн-Winslow ионной модели собачьей миоцитов желудочков. Уменьшение электропроводности в собачьей модели сердечной недостаточности желудочка на 30% (рис. 9).
- С помощью программного пакета CARP (CardioSolv, LLC), имитировать синусового ритма со всеми моделями. Вызвать повторно желудочковой тахикардии (ЖТ) в шести отсутствии моделей с помощью S1-S2 стимуляции протокол. Выберите времени между S1 и S2 для получения устойчивой VT деятельности в течение 2 секунд после того, как S2 доставки. Если VT не индуцируется для любого S1-S2 сроков, снижение проводимости на 70% до VT вызывали (рис. 10).
- Для каждого моделирования, расчета псевдо-ЭКГ как разность внеклеточных потенциалов между двумя точками в изотропной ванны окружающие сердце. Поместите две точки у основания сердца отделенына 18 см, так, что линия, соединяющая их перпендикулярно базовой вершиной плоскости перегородки, как показано на рисунке 10. Для каждого моделирования с оценкой ориентации волокон, вычислить MAD метрику
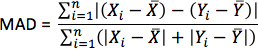
где X является ЭКГ моделирования с оценкой ориентации волокон, Y является ЭКГ из thecorresponding моделирования с приобретенной ориентации волокон, X является средним значением X, Y является средним значением Y, п-длина X и Y.
Результаты
Рисунок 11, AC отображает обтекаемой визуализации приблизительно так же как DTMRI полученного волокна ориентации в нормальных и отсутствии сердца. Качественный анализ показывает, что предполагаемое ориентации волокон выровнять хорошо с DTMRI полученных из них. Группа D показывает, ...
Обсуждение
Это исследование показывает, количественно, что, в отсутствие DTMRI, инфаркт ориентации волокон нормальных и отсутствии желудочков может быть оценена в естественных изображений их геометрии для использования в моделировании сердечной электрофизиологии. Предложенная методика пок?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим доктора. Раймонд Winslow, Эллиот Маквей, и Патрик шлем в Университете Джона Хопкинса для обеспечения бывших естественных данных online.This исследование было поддержано Национальным институтом здоровья грант R01-HL082729 и Национального научного фонда грант конбет-0933029.
Материалы
| Name | Company | Catalog Number | Comments |
| LDDMM | Университет Джонса Хопкинса | http://cis.jhu.edu/software/lddmm-volume/index.php | |
| MATLAB | MathWorks, Inc | R2011b | http://www.mathworks.com/products/matlab/ |
| ImageJ | Национальные институты здоровья | http://rsbweb.nih.gov/ij/ | |
| Тарантул | CAE Software Solutions | http://www.meshing.at/Spiderhome/Tarantula.html | |
| CARP | CardioSolv | http://cardiosolv.com/ | |
| Собаки изображений | Университет Джонса Хопкинса | http://www.ccbm.jhu.edu/research/DTMRIDS.php |
Ссылки
- Trayanova, N. Whole Heart Modeling: Applications to Cardiac Electrophysiology and Electromechanics. Circulation Research. 108, 113-128 .
- Vadakkumpadan, F., Arevalo, H., Ceritoglu, C., Miller, M., Trayanova, N. Image-Based Estimation of Ventricular Fiber Orientations for Personalized Modeling of Cardiac Electrophysiology. IEEE Transactions on Medical Imaging. 31 (5), 1051-1060 .
- Vadakkumpadan, F., Gurev, V., Constantino, J., Arevalo, H., Trayanova, N., Kerckhoffs, R. Modeling of Whole-Heart Electrophysiology and Mechanics: Towards Patient-Specific Simulations. Patient-Specific Modeling of the Cardiovascular System: Technology-Driven Personalized Medicine. , 145-165 (2010).
- Buxton, A. E., Lee, K. L., DiCarlo, L., Gold, M. R., Greer, G. S., Prystowsky, E. N., O'Toole, M. F., Tang, A., Fisher, J. D., Coromilas, J., Talajic, M., Hafley, G. Electrophysiologic testing to identify patients with coronary artery disease who are at risk for sudden death. Multicenter Unsustained Tachycardia Trial Investigators. The New England Journal of Medicine. 342 (26), 1937-1945 (2000).
- Wei, D., Okazaki, O., Harumi, K., Harasawa, E., Hosaka, H. Comparative simulation of excitation and body surface electrocardiogram with isotropic and anisotropic computer heart models. IEEE Transactions on Biomedical Engineering. 42 (4), 343-357 (1995).
- Leon, L. J., Horacek, B. M. Computer model of excitation and recovery in the anisotropic myocardium. II. Excitation in the simplified left ventricle. Journal of Electrocardiology. 24 (1), 17-31 (1991).
- Rohmer, D., Sitek, A., Gullberg, G. T. Reconstruction and Visualization of Fiber and Laminar Structure in the Normal Human Heart from Ex Vivo Diffusion Tensor Magnetic Resonance Imaging (DTMRI) Data. Investigative Radiology. 42 (11), 777-789 (2007).
- Daubert, J. P., Zareba, W., Hall, W. J., Schuger, C., Corsello, A., Leon, A. R., Andrews, M. L., McNitt, S., Huang, D. T., Moss, A. J., Investigators, M. I. S. Predictive value of ventricular arrhythmia inducibility for subsequent ventricular tachycardia or ventricular fibrillation in Multicenter Automatic Defibrillator Implantation Trial (MADIT) II patients. Journal of Americal College of Cardiology. 47 (1), 98-107 (2006).
- Sosnovik, D. E., Wang, R., Dai, G., Reese, T. G., Wedeen, V. J. Diffusion MR tractography of the heart. Journal of Cardiovascular Magnetic Resonance. 11 (1), 47-61 (2009).
- Sundar, H., Shen, D., Biros, G., Litt, H., Davatzikos, C. Estimating myocardial fiber orientations by template warping. Proc. IEEE International Symposium on Biomedical Imaging. , 73-76 (2006).
- Beg, M. F., Helm, P. A., McVeigh, E., Miller, M. I., Winslow, R. L. Computational Cardiac Anatomy Using MRI. Magnetic Resonance in Medicine. 52 (5), 1167-1174 (2004).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial Transformations of Diffusion Tensor Magnetic Resonance Images. IEEE Transactions on Medical Imaging. 20, 1131-1139 (2001).
- Helm, P. A., Younes, L., Beg, M. F., Ennis, D. B., Leclercq, C., Faris, O. P., McVeigh, E., Kass, D., Miller, M. I., Winslow, R. L. Evidence of Structural Remodeling in the Dyssynchronous Failing Heart. Circulation Research. 98, 125-132 (2006).
- Helm, P., Beg, M. F., Miller, M., Winslow, R. Measuring and mapping cardiac fiber and laminar architecture using diffusion tensor MR imaging. Annals of the New York Academy of Sciences. 1047, 296-307 (2005).
- Helm, P. A., Tseng, H. -. J., Younes, L., McVeigh, E. R., Winslow, R. L. Ex vivo 3D diffusion tensor imaging and quantification of cardiac laminar structure. Magnetic Resonance in Imaging. 54, 850-859 (2005).
- Scollan, D. F., Holmes, A., Winslow, R., Forder, J. Histological validation of myocardial microstructure obtained from diffusion tensor magnetic resonance imaging. American Journal of Physiology - Heart and Circulatory Physiology. 275 (6), H2308-H2318 (1998).
- Lombaert, H., Peyrat, J., Croisille, P., Rapacchi, S., Fanton, L., Cheriet, F., Clarysse, P., Magnin, I., Delingette, H., Ayache, N. Human Atlas of the Cardiac Fiber Architecture: Study on a Healthy Population. IEEE Transactions on Medical Imaging. 31 (7), 1436-1447 (2012).
- Streeter, D. D. . Gross morphology and fiber geometry of the heart. , (1979).
- Vadakkumpadan, F., Rantner, L. J., Tice, B., Boyle, P., Prassl, A. J., Vigmond, E., Plank, G., Trayanova, N. Image-Based Models of Cardiac Structure with Applications in Arrhythmia and Defibrillation Studies. Journal of Electrocardiology. 42, 151.e1-151.e10 (2009).
- Plank, G., Zhou, L., Greenstein, J. L., Plank, G., Zhou, L., Greenstein, J. L., Cortassa, S., Winslow, R. L., O'Rourke, B., Trayanova, N. A. From mitochondrial ion channels to arrhythmias in the heart: computational techniques to bridge the spatio-temporal scales. Philosophical Transactions Series A, Mathematical, Physical, and Engineering Sciences. 366 (1879), 3381-3409 (2008).
- Roberts, D. E., Scher, A. M. Effect of tissue anisotropy on extracellular potential fields in canine myocardium in situ. Circulation Research. 50, 342-351 (1982).
- Greenstein, J., Wu, R., Po, S., Tomaselli, G. F., Winslow, R. L. Role of the Calcium-Independent Transient Outward Current I(to1) in Shaping Action Potential Morphology and Duration. Circulation Research. 87, 1026-1033 (2000).
- Winslow, R., Rice, J., Jafri, S., Marbán, E., O'Rourke, B. Mechanisms of altered excitation-contraction coupling in canine tachycardia-induced heart failure, II: model studies. Circulation Research. 84 (5), 571-586 (1999).
- Akar, F., Nass, R., Hahn, S., Cingolani, E., Shah, M., Hesketh, G., DiSilvestre, D., Tunin, R., Kass, D., Tomaselli, G. Dynamic Changes in Conduction Velocity and Gap Junction Properties During Development of Pacing-Induced Heart Failure. American Journal of Physiology - Heart and Circulatory Physiology. 293 (2), H1223-H1230 (2007).
- Gurev, V., Constantino, J., Rice, J. J., Trayanova, N. Distribution of Electromechanical Delay in the Ventricles:Insights from a 3D Electromechanical Model of the Heart. Biophysical Journal. 99 (3), 745-754 .
- Ten Tusscher, K. H. W. J., Hren, R., Panfilov, A. V. Organization of Ventricular Fibrillation in the Human Heart. Circulation Research. 100 (12), e87-e101 (2007).
- Gima, K., Rudy, Y. Ionic Current Basis of Electrocardiographic Waveforms. Circulation Research. 90, 889-896 (2002).
- Gerstenfeld, E., Dixit, S., Callans, D., Rajawat, Y., Rho, R., Marchlinski, F. Quantitative comparison of spontaneous and paced 12-lead electrocardiogram during right ventricular outflow tract ventricular tachycardia. Journal of Americal College of Cardiology. 41 (11), 2046-2053 (2003).
- Potse, M., Dube, B., Richer, J., Vinet, A., Gulrajani, R. M. A comparison of monodomain and bidomain reaction-diffusion models for action potential propagation in the human heart. IEEE Transactions on Biomedical Engineering. 53 (12), 2425-2435 (2006).
- Peyrat, J. -. M., Sermesant, M., Pennec, X., Delingette, H., Chenyang, X., McVeigh, E. R., Ayache, N. A Computational Framework for the Statistical Analysis of Cardiac Diffusion Tensors: Application to a Small Database of Canine Hearts. IEEE Transactions on Medical Imaging. 26, 1500-1514 (2007).
- Chen, J., Song, S. -. K., Liu, W., McLean, M., Allen, S. J., Tan, J., Wickline, S. A., Yu, X. Remodeling of cardiac fiber structure after infarction in rats quantified with diffusion tensor MRI. American Journal of Physiology - Heart and Circulatory Physiology. 285 (3), H946-H954 (2003).
- Stecker, E. C., Chugh, S. S. Prediction of sudden cardiac death: next steps in pursuit of effective methodology. Journal of Interventional Cardiac Electrophysiolog. 31 (2), 101-107 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены