Method Article
Neural Circuit gravação de um Sistema Nervoso Barata Intacta
Neste Artigo
Resumo
Este artigo descreve a barata ventral do nervo espinhal dissecção e gravações extracelular do nervo Cercal e conectivos. Respostas evocadas são gerados por estimulação elétrica do nervo Cercal ou estimulação mecânica direta da Cerci.
Resumo
A preparação cordão nervoso ventral barata é um sistema tratável para experimentos Neuroetologia, modelagem de rede neural, e testar os efeitos fisiológicos de inseticidas. Este artigo descreve o âmbito da barata modalidades sensoriais que podem ser utilizados para ensaiar a forma como um sistema nervoso de insectos às perturbações ambientais. A ênfase aqui é sobre o comportamento de fuga mediada por cercos a transmissão de fibra gigante em Periplaneta americana. Esta em preparação situ requer apenas habilidade de dissecação moderada e experiência eletrofisiológica para gerar gravações reprodutíveis de atividade neuronal. Os péptidos ou outros reagentes químicos podem, então, ser aplicada directamente para o sistema nervoso, em solução com a solução salina fisiológica. Insecticidas também pode ser administrado antes de dissecção e o circuito de fuga pode servir como um indicador para o estado excitável do sistema nervoso central. Neste contexto, os ensaios aqui descritos, também seriam úteis para resquisadores interessados na regeneração de membros e da evolução do desenvolvimento do sistema nervoso para que P. americana é um organismo modelo estabelecido.
Introdução
Existem mais de 4.000 espécies de baratas, mas apenas cerca de 30 são pragas domésticas. Talvez o mais reconhecido é o misnamed barata americana Periplaneta americana que teve origem na África, e agora é encontrada em quase toda parte do planeta. Além de sua rápida velocidade de corrida e um comportamento evasivo, nos trópicos P. americana é capaz de 2,3 vôo.
As características predominantes do sistema nervoso central barata (CNS) são a sua natureza segmentada ea descentralização do controle processa 4,5. O cérebro, torácica, abdominal e gânglios são unidos por conectivos interganglionic emparelhados para formar o cordão nervoso ventral (VNC).
Os gânglios em cada segmento estão integrando centros. Eles são compostos de, uma região cortical exterior contendo células responsáveis pela barreira de permeabilidade hemato-encefálica logo abaixo deles, eo somata de neurônios originar, em que o gânglio. Estes somata pode pertencer a interneurônios, neurônios moduladores, ou neurônios motores. Eles fornecem os axônios que permanecem dentro do gânglio de origem (interneuron local) ou axônios que se projetam entre os gânglios do sistema nervoso central (interneurons interganglionic) ou que terminam em células musculares periféricos (neurônios motores). A maioria somata estão posicionados ventralmente ou ventrolaterally no córtex ganglionar 5. Os pares, conectivos interganglionic conter apenas axônios e não corpos celulares neuronais.
O neuropil de um gânglio contém células da glia (glia), folhetos axônio, feixes de axônios e dendritos, (neurites) de neurônios. O neuropil é desprovido de corpos celulares neuronais. Esta é a região dentro do gânglio onde ocorrem comunicação sináptica direta entre as células nervosas e integração de entradas.
A capacidade da barata americana P. americana para detectar e de repente responder a um predador que se aproxima (pé, hand, etc.) tem sido atribuída a um circuito de reflex que consiste em cercos a 6,7 e o sistema de fibra gigante. O cercos são um par de estruturas, sensível ao vento dos sopros localizados na extremidade do abdómen (Figura 1). Em P. americana na superfície ventral de cada cercus contém cerca de 200 filiformes (thread) cabelos que estão organizados em 14 colunas. Nove destes colunas pode ser identificado de forma consistente em animais diferentes de acordo com as propriedades de resposta da célula do receptor associado e axónios. Cada cabelo é em um soquete que permite dobrar mais facilmente em um plano que é específico da coluna. Movimento dos cabelos em uma direção ao longo de seu avião induz uma despolarização da célula receptora e uma rajada de potenciais de ação (APs) no neurônio sensorial. Movimento na direção oposta inibe qualquer APs espontâneos em curso 8. O plano de deflexão preferida e direccionamento da resposta é diferente em cada coluna. Assim, o filiforcomplexos de receptores cabelo m são responsáveis não só para detectar o movimento do ar, mas também para "codificação", na forma de pontos de acesso, a direção da qual a corrente de ar originou. O processamento desta informação por parte do CNS resulta em um "adequado" resposta de fuga 6,7. Esta especificidade funcional, colunar dos pêlos sensoriais são preservados de animal para animal.
A célula receptora de cada cabelo filiforme é responsável pela transdução do deflexão mecânica do cabelo num evento neural (resultando numa explosão ou a inibição de AP em axónios de células do receptor de 9. Os APs viajar para o gânglio abdominal do terminal (A6), através de cercal XI nervo, onde sinapse com os axônios gigantes do cordão nervoso ventral (VNC). Os axônios gigantes se acredita ser responsável pela transmissão e excitação subseqüente de neurônios motores que resulta em um comportamento de fuga 6,10,11.
O comportamento de latência of a resposta de fuga de P. norte americana é uma das mais curtas de qualquer animal 7. Latência Comportamental é o tempo entre a chegada de um estímulo de um mecanorreceptor e o início de uma resposta de fuga. Em experimentos com cinematografia de alta velocidade para gravar a tentativa de fuga de um sapo de ataque, a barata foi observada para começar sua vez longe do sapo em cerca de 40 ms (tempo de início de extensão língua para barata movimento 7,12. Usando sopros de vento controlados , a latência de comportamento pode ser reduzida a 11 mseg. Outras experiências demonstraram que uma velocidade de vento de sopro mínimo de 12 mm / ms (com uma aceleração a 600 mm / ms 2) pode evocar uma resposta de fuga, ao passo que as velocidades ainda mais baixas (3 mm / seg) causou caminhando lentamente baratas parar de se mover 12.
A forte correlação que normalmente existe entre os sistemas de fibras gigantes e comportamento de fuga tem sido bem documentada 13,14. Em instlhos, em que é necessária e suficiente para provocar um comportamento particular uma célula em particular, a célula é referido como um neurónio de comando 15,16. Interneurons Gigante (IG) no circuito de fuga vento de P. americana não são necessárias para a reflex. Os animais que têm experimentalmente cauterizado soldados ainda exibem o comportamento de fuga, portanto, esses soldados não são considerados neurônios de comando 17,18. Cortando conectivos cervicais que são rostral ao circuito sensório também influencia o comportamento, o que indica que a entrada descendente a partir do cérebro tem um efeito sobre a direcção de evacuação 19. Esses aspectos do controle fino e redundância são fundamentais para a sobrevivência do organismo e são complementadas por modulação neuroquímica via aminas biogênicas 20.
O P. preparação cordão nervoso americana tem sido um sistema modelo elegante para neuroethologists nos últimos muitas décadas começando com o trabalho pioneiro de Roeder 21. Ele permite que os alunos de gravar, exibir e analisar a atividade sensorial primário e as respostas resultantes por interneurônios gigantes para sua 22,23,24 entrada. Além de transmitir a idéia de que os circuitos neurais subjacentes identificáveis respostas comportamentais ao meio ambiente, estes exercícios devem incutir uma apreciação para as contribuições biológicas feitas por esta praga comum do agregado familiar.
Protocolo
1. Dissecação
Solução salina Barata utilizado ao longo deste protocolo tem a seguinte composição:
Solução salina Barata 36: (gramas por 100 mL)
210 mM de NaCl (1,227 g)
KCl 2,9 mM (0,0216 g)
1,8 mM de CaCl 2 (0,0265 g)
0,2 mM de NaH 2 PO 4 • 2H 2 O (0,0032 g)
1,8 mM de Na 2 HPO 4 • 7H 2 O (0,0483 g)
(PH 7,2. Ajustar o pH com NaOH 1 M ou HCl a 1 M).
- Seleccione uma barata macho do reservatório de retenção que tem cercos robusta (Figura 1). Os últimos segmentos do macho são estreitas em comparação com o sexo feminino, e que não contenham ovários e massa de ovos, os machos são mais fáceis de dissecar. Os machos de P. americana tem um par de curto pontas entre os cercos. Estas pontas não são observadas nas fêmeas.
- Corte as asas, pernas e cabeça e prender o corpo, ventral voltada para cima, para um dish forrado com elastômero de silicone.
- Com uma pinça pegar as placas ventrais e cortá-los com tesoura fina, começando na extremidade posterior e trabalhando anteriormente. Sempre mantenha os órgãos internos úmido com solução salina, enquanto tenta manter o cerci seco. Pode-se utilizar a cera ou peças de borracha para posicionar o abdómen para cima para impedir que a solução salina de molhar a cercos. Se eles não se molhar, seque-os com um pedaço de papel de seda. Empurre para o lado os órgãos internos e da substância branca (gordura corporal). A VNC é no centro do campo, corre o comprimento do abdómen e deve ser visível entre a traqueia brilhante. O cordão nervoso é translúcido e pode inicialmente ser difícil ver até que a iluminação é ajustada corretamente (Figura 2). NÃO manuseie a VNC com fórceps ou pinos de insetos, em vez disso manipulá-lo usando sondas de vidro.
- Limpar sistema de traquéias do animal da melhor forma possível a partir do cordão nervoso com uma pinça e com um par de necessidade vidro finoles, dividir com muito cuidado os conectivos VNC longitudinalmente entre A6 e A5 ou A5 e A4 gânglios (Figura 3). Berço cercos a barriga para cima e para fora do banho de solução salina com pinos de insectos encurtadas e cera ou uma cunha de elastómero de silicone que pode ser cortado para se ajustar à preparação (Figuras 4A e B). Tenha cuidado extra no último segmento abdominal para não danificar os nervos Cercal que se projetam para o gânglio (Figuras 2D e 5).
2. Gravação Extracelular
- A preparação de microscópio, e aparelho de registo dissecados deve ser configurado no interior de uma gaiola de Faraday para bloquear particularmente AC, campos eléctricos externos, que podem substituir os sinais a partir dos neurónios (Figura 6).
- Posicionar o microscópio de modo que ela é com vista a platina do microscópio. Uma vez que a preparação é colocada sobre o palco, ajustar a posição do feixe de alta intensidade do iluminadorpara melhor visualização do mesmo.
- Ligue o amplificador diferencial AC / DC para a unidade de gravação de dados integrado (detalhes sobre as configurações de hardware e software específicos foram descritos anteriormente 25). O estágio de cabeça segurando um eletrodo de sucção deve ser conectado ao amplificador. Um fio de terra de prata que tenha sido revestido com Cl - inseridos nos resultados abdómen em gravações mais estáveis. A razão é que se a solução na cavidade do corpo não se encontra em contacto com o fluido do banho no prato, o fluido associada com o eléctrodo de gravação permanece ligado à terra.
- Defina a frequência de gravação para 4 kHz. Definir a escala de tensão (eixo-y) a 500 mV (este pode ser ajustado para optimizar a visualização do traçado). Execute o software de gravação em modo contínuo ou osciloscópio para gravar a atividade neural em resposta a estímulos.
- Corte um dos conectivos VNC perto de A5 e coloque a extremidade cortada ligado a A6 em um eletrodo de sucção. Certifique-se de pull solução salina no eletrodo de sucção para cobrir o fio de prata dentro dele antes de sugar no nervo.
- Com uma pipeta de sopro de ar seco sobre os cabelos localizadas em cada cercus. Veja se estimular os cabelos na ipsilateral cercus ao conjuntivo gravado dá uma resposta diferente do contralateral. Tomar nota da amplitude das respostas e o número de espigas em um determinado intervalo de tempo durante o estimulação.
- Mova o eletrodo de sucção a um nervo Cercal para a gravação. Para obter um melhor ajuste, mude para uma ponta do eletrodo com uma abertura menor, se necessário.
- Corte o nervo perto do Cercal a A6 e, em seguida, sugar o nervo levando à cercus. Deve haver queima espontânea de potenciais de ação. Agora, soprar ar sobre o cercus e anotar as respostas.
3. Estimular eletricamente os nervos sensoriais para determinar Recrutamento
- Altere o software de gravação de modo a varrer para que ele grava traços (100-500 msec.) cada vez que um estímulo é acionado.
- Ligue o eléctrodo estimulante para a saída do estimulador.
- Conecte o cabo de estimulador com os dois terminais mini-gancho ou clipes.
- Ligue a saída de disparo BNC do estimulador para a entrada de disparo na unidade de gravação.
- Os seguintes parâmetros de estimulação deve evocar uma resposta: Duração: 0,3 s; Atraso: 10 ms; Freqüência: 1 Hz; Tensão: ajustar conforme necessário para obter um sinal nas gravações (pouco mais de limite e ser capaz de obter uma resposta máxima). Não há nenhuma razão para ir a tensões muito mais altas que o limite máximo para o recrutamento como de alta tensão pode ser prejudicial para o nervo.
- Corte o nervo Cercal como distal possível, para que a raiz do nervo longo pode ser puxado para o eletrodo de sucção estimulante (Figura 7, cabeça de seta). O conjuntivo entre A6 e A5 ou outro segmento mais anterior pode ser usado.
- Coloque o eletrodo de sucção de gravação para que você possa puvou-se um conectivo corte para o eletrodo. Certifique-se de puxar alguma solução salina para os eletrodos de sucção para cobrir o fio de prata dentro dele antes de sugar nos nervos. Certifique-se o eletrodo estimulando também é fundamentada no banho de solução salina (no abdômen perto A3 é ideal).
- Entregar uma série de estímulos individuais de aumento da tensão até que um potencial de ação é exibida na tela. Deve-se fazer um registro da tensão estimulante mínimo e duração de recrutar uma resposta. Aumentar a intensidade até que uma resposta sináptica nas conectivos é observada. O grande pico (APs extracelulares) dos axônios gigantes aparece em primeiro lugar, em seguida, outro menor de AP também podem ser observadas.
Resultados
Estimulação dos cabelos na cerci por um sopro de ar faz com que as descargas de neurônios sensoriais primários que podem ser gravados utilizando eletrodos de sucção extracelulares ligados tanto para conectivos entre gânglios abdominal ou o próprio nervo Cercal (Figura 8). Amplitudes de Spike gravados a partir das duas regiões são da ordem de vários micro-volts para milivolts. Por causa da integração sensorial no gânglio do número de picos observados no potencial de ação composto ou como picos individuais gravados a partir do nervo Cercal é notavelmente maior do que o observado nas gravações dos conectivos. No entanto, note também que há substancialmente menos ruído na gravação no conjuntivo devido ao selo mais apertado entre o eletrodo eo tecido nervoso.
Ao soprar o ar para os grandes picos Cerci pode ser observado nas conectivos (Figura 8A). Usando este método estimulante, gravações entre A3 e A4 típico ly mostram um grande pico característico do interneurônio gigante (s). Gravar a partir de um nervo Cercal, enquanto esfregando fisicamente o cerci com uma pinça produziu uma forte busto de atividade (Figura 8B 1). Em outra gravação, duas baforadas de ar cada produziu uma resposta rápida rebentando no nervo Cercal (Figura 8B 2). Ao estimular eletricamente o nervo Cercal com um eletrodo de sucção e de gravação no conjuntivo entre A3 e A4, pode-se observar um limite na estimulação de respostas evocadas (Figura 8C 1). A estimulação elétrica do nervo Cercal provoca claramente uma resposta em conectivos que pode ser quantificada para estudos de manipulação com agentes farmacológicos ou envolve o meio ambiente local, como a temperatura (Figura 8C 2).
fig1.jpg "/>
Americana Figura 1. Periplaneta com cerci intacta.
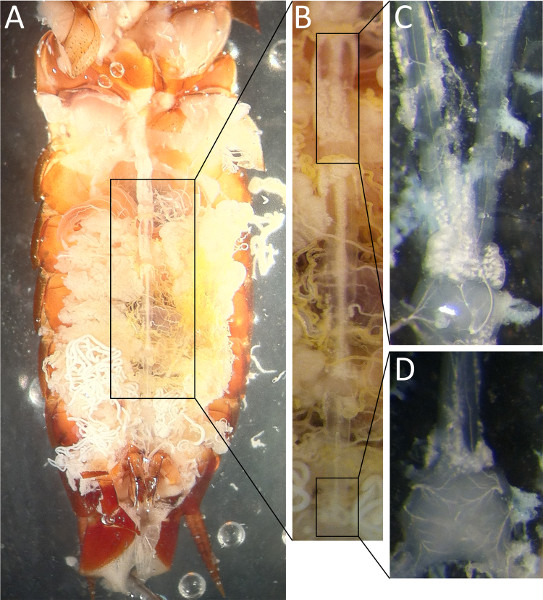
Figura 2. Vista ventral do cordão nervoso barata como visto com a cutícula ventral removido (A). Uma vista ampliada do segmento esboçado pelas setas é visto em (B). Em (C) os conectivos foram derramados entre A4 e A3 com uma sonda de vidro. A 6 ª gânglio abdominal é mostrado em (D) com os dois nervos Cercal deixando na extremidade caudal.
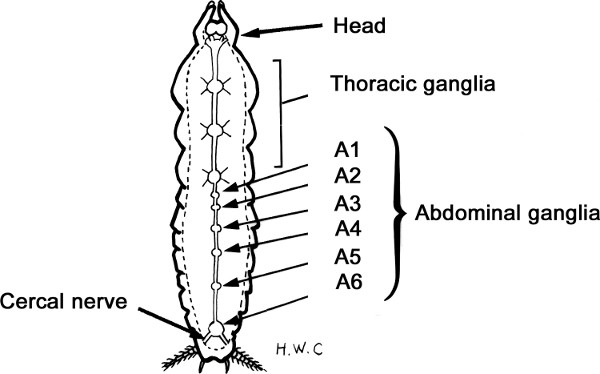
Figura 3. Esquemática vista ventral do cordão nervoso barata.
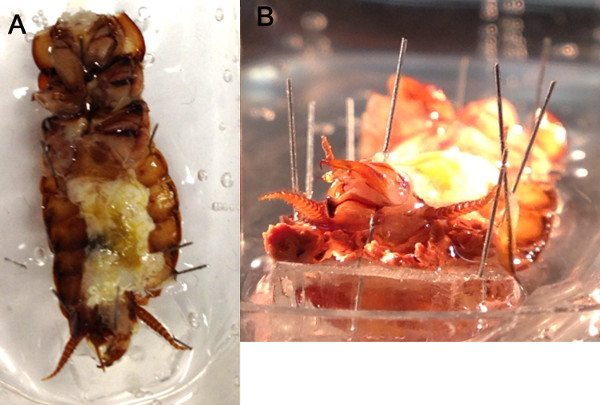
Figura 4. Os cercos são posicionados para cima do banho de solução salina. No abdômen abertas podem ser inundadas com solução salina (A) com a extremidade caudal da barata ser elevada com um pequeno pedaço em forma de cunha de elastômero de silicone, a fim de manter o cerci fora do banho (B).
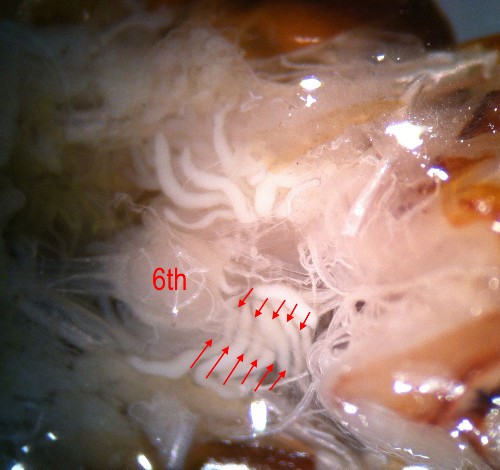
Figura 5. O gânglio abdominal 6 º com o nervo Cercal (delineado por setas).

Figura 6. O equipamento configurado. Clique aqui para ver larfigura ger.

Figura 7. Estimulante e eletrodo de registro configurado.
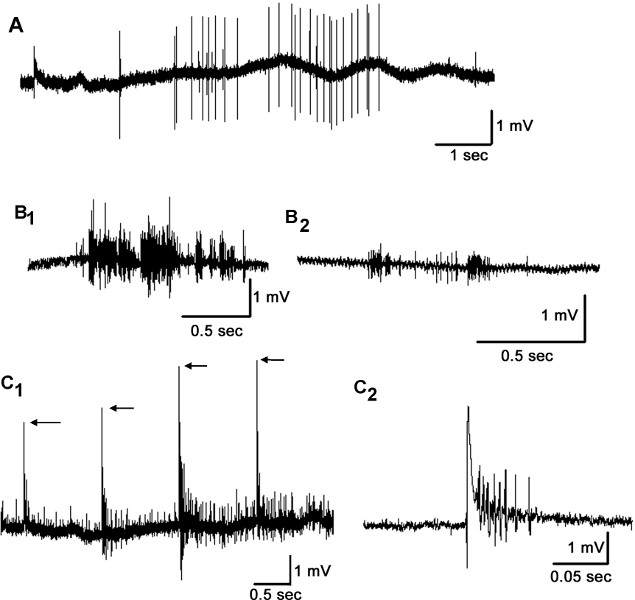
Figura 8. Gravações Neurais dos conectivos e nervo do Cercal com vários procedimentos de estimulação. Gravar com um eletrodo de sucção dos conectivos entre A3 e A4, enquanto soprando ar na Cerci (A). Gravar a partir de neurônios Cercal primárias com um eletrodo de sucção enquanto fisicamente esfregando (B 1) ou o fornecimento de sopros de ar (B 2) resulta em rajadas rápidas de atividade no nervo Cercal. Eletricamente estimulando o nervo Cercal produz respostas em conectivos ( C 1). Notar o aumento gradual da intensidade da estimulação (as setas indicam a amplitude do artefacto de estimulação) e a intensidade das seguintes respostas evocadas. A estimulação elétrica do nervo Cercal fornece um meio relativamente mais controladas de estimular o nervo Cercal para a consistência na estimulação para quantificar as respostas (c 2).
Discussão
Uma das razões para as técnicas exibindo para esta preparação clássica é que o sistema cerci foi e ainda é uma área ativa de pesquisa na abordagem de questões de desenvolvimento de circuitos neurais, bem como questões relacionadas com a reparação e regeneração sináptica 26-31. Qualquer um dos métodos de actividade de evocar no cordão nervoso ventral barata pode ser usado para examinar os efeitos de agentes farmacológicos ou de insecticidas na função do sistema nervoso. Estas experiências são feitas simplesmente por dissolução de produtos químicos neuroactivos em solução salina. Depois de trocar esta solução com o meio banho normal, mudanças na atividade evocada ou espontâneo pode ser observado durante a gravação de conectivos ou um nervo motor para dar uma leitura consistente do efeito da substância química em função do SNC.
Como em todos os experimentos neurofisiológicos um problema comum é o ruído elétrico. Provavelmente, o fator mais importante na qualidade de sinal para esses preparativos is a vedação do eléctrodo de sucção sobre o tecido nervoso. Um selo apertado que não chamar completamente no nervo Cercal ou conjuntivo é o ideal. Gravações também pode ser feita com eléctrodos de gancho duplos colocados sob o cordão nervoso e isolamento do VNC com uma mistura de óleo mineral e vaselina. A mistura pode ser carregada para uma seringa e expelido em torno do cabo de nervo 32. Também dissecação cuidadosa é tão crítico como aqui em qualquer preparação do SNC. Alguns podem achar que é mais fácil de acessar o CNS dissecando a cutícula dorsal. Enquanto isto reduz a possibilidade de danificar o cabo nervoso ventral pode ser mais difícil de remover todas as vísceras utilizando esta abordagem.
Não é descrito aqui, mas esta preparação é passível de gravação intracelular nos interneurónios gigantes 32,33. O cordão nervoso inteiro também pode ser removido para acomodar vários gravação e estimulantes eletrodos simultaneamente. Na verdade exploração do lobo antenal, bo cogumelody, e outras estruturas anteriores do sistema nervoso central ainda está em andamento 34-35. Enquanto a barata CNS continua a lançar luz sobre investigação neurobiológica moderno esta preparação especial é simples o suficiente para ser usado em laboratórios acadêmicos de graduação.
Divulgações
Os autores declaram que não há conflitos de interesse.
Agradecimentos
Agradecemos Hyewon Cooper para ilustrações.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Sylgard | Dow Corning | 182 silicone kit | 182 silicone elastomer kit |
| NaCl | Sigma-Aldrich | S7653 | |
| KCl | Sigma-Aldrich | P9333 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| NaH2PO4•2H2O | Sigma-Aldrich | 71505 | |
| Na2HPO4•7H2O | Sigma-Aldrich | S9390 | |
| NaOH | Sigma-Aldrich | 221465 | To adjust pH |
| HCl | Sigma-Aldrich | H1758 | To adjust pH |
| Material Name | |||
| Dissecting tools | World Precision Instruments | assortment | |
| Insect Pins | Fine Science Tools, Inc | 26001-60 | |
| Dissecting microscope | World Precision Instruments | PZMIII-BS | |
| Glass electrodes | Sigma-Aldrich | CLS7095B5X | Box of 200, suction electrodes |
| Micromanipulator | World Precision Instruments | MD4-M3-R | Can fix for base or on a metal rod |
| Silver wire (10/1,000 inch) | A-M Systems | 782500 | |
| Computer | any company | ||
| AC/DC differential amplifier | A-M Systems | Model 3000 | |
| PowerLab 26T |  AD Instruments AD Instruments | 27T | |
| Head stage |  AD Instruments AD Instruments | Comes with AC/DC amplifier | |
| LabChart7 |  AD Instruments AD Instruments | ||
| Electrical leads | any company | ||
| Glass tools | make yourself | For manipulating nerves | |
| Cable and connectors | any company | ||
| Pipettes with bulbs | Fisher Scientific | 13-711-7 | Box of 500 |
| Beakers | any company | ||
| Wax or modeling clay | any company or local stores | ||
| Stimulator | Grass Instruments | SD9 or S88 | |
| Plastic tip for suction electrode | local hardware store (Watt's brand) | ¼ inch OD x 0.170 inch ID | Cut in small pieces. Pull out over a flame and cut back the tip to the correct size. |
Referências
- Full, R. J., Tu, M. S. Mechanics of a rapid running insect: two-, four- and six-legged locomotion. J. Exp. Biol. 156, 215-231 (1991).
- Ritzmann, R. E., Tobias, M. L., Fourtner, C. R. Flight activity initiated via giant interneurons of the cockroach: Evidence for bifunctional trigger interneurons. Science. 210, 443-445 (1980).
- Libersat, F., Camhi, J. M. Control of cercal position during flight in the cockroach: a mechanism for regulating sensory feedback. J. Exp. Biol. 136, 483-488 (1988).
- Ganihar, D., Libersat, F., Wendler, G., Cambi, J. M. Wind-evoked evasive responses in flying cockroaches. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology. 175, 49-65 (1994).
- Pipa, R. a. D., F, . The American Cockroach. , 175-216 (1981).
- Westin, J., Langberg, J. J., Camhi, J. M. Responses of giant interneurons of the cockroach; Periplaneta americana to wind puffs of different directions and velocities. Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology. 121, 307-324 (1977).
- Camhi, J. M., Tom, W., Volman, S. The escape behavior of the cockroach Periplaneta americana. J. Comp. Physiol. A Neuroethol. Sens. Neural Physiol. 128, 203-212 (1978).
- Nicklaus, R. Die Erregung einzelner Fadenhaare von Periplaneta americana in Abhängigkeit von der Grösse und Richtung der Auslenkung. Z. Vgl. Physiol. 50, 331-362 (1965).
- Westin, J. Responses to wind recorded from the cercal nerve of the cockroach Periplaneta americana. J. Comp. Physiol. A Neuroethol. Sens. Neural Physiol. 133, 97-102 (1979).
- Ritzmann, R. E. . Neural Mechanisms of Startle Behavior. , 93-131 (1984).
- Ritzmann, R. E., Pollack, A. J. Identification of thoracic interneurons that mediate giant interneuron-to-motor pathways in the cockroach. J. Comp. Physiol. A Neuroethol. Sens. Neural Physiol. 159, 639-654 (1986).
- Plummer, M. R., Camhi, J. M. Discrimination of sensory signals from noise in the escape system of the cockroach - the role of wind acceleration. J. Comp. Physiol. 142, 347-357 (1981).
- Bullock, T. H. . Neural Mechanisms of Startle Behavior. , 1-14 (1984).
- Pollack, A. J., Ritzmann, R. E., Watson, J. T. Dual pathways for tactile sensory information to thoracic interneurons in the cockroach. J. Neurobiol. 26, 33-46 (1995).
- Atwood, H. L., Wiersma, C. A. Command interneurons in the crayfish central nervous system. J. Exp. Biol. 46, 249-261 (1967).
- Olson, G. C., Krasne, F. B. The crayfish lateral giants as command neurons for escape behavior. Brain Res. 214, 89-100 (1981).
- Comer, C. M. Analyzing cockroach escape behavior with lesions of individual giant interneurons. Brain Res. 335, 342-346 (1985).
- Comer, C. M., Dowd, J. P., Stubblefield, G. T. Escape responses following elimination of the giant interneuron pathway in the cockroach, Periplaneta americana. Brain Res. 445, 370-375 (1988).
- Keegan, A. P., Comer, C. M. The wind-elicited escape response of cockroaches (Periplaneta americana) is influenced by lesions rostral to the escape circuit. Brain Res. 620, 310-316 (1993).
- Casagrand, J. L., Ritzmann, R. E. Biogenic amines modulate synaptic transmission between identified giant interneurons and thoracic interneurons in the escape system of the cockroach. J. Neurobiol. 23, 644-655 (1992).
- Roeder, K. D. Organization of the ascending giant fiber system in the cockroach, Periplaneta americana. J. Exp. Zool. 108, 243-261 (1948).
- Ramos, R. L., Moiseff, A., Brumberg, J. C. Utility and versatility of extracellular recordings from the cockroach for neurophysiological instruction and demonstration. J. Undergrad. Neurosci. Educ. 5, (2007).
- Oakley, B., Schafer, R. Experimental neurobiology. , (1978).
- Welsh, J. H., Smith, R. I., Kammer, A. E. . Laboratory exercises in invertebrate physiology. , (1968).
- Leksrisawat, B., Cooper, A. S., Gilberts, A. B., Cooper, R. L. Muscle receptor organs in the crayfish abdomen: a student laboratory exercise in proprioception. J. Vis. Exp. (45), e2323 (2010).
- Bacon, J. P., Blagburn, J. M. Ectopic sensory neurons in mutant cockroaches compete with normal cells for central targets. Development. 115, 773-784 (1992).
- Blagburn, J. M. Co-factors and co-repressors of Engrailed: expression in the central nervous system and cerci of the cockroach, Periplaneta americana. Cell Tiss. Res. 327, 177-187 (2007).
- Blagburn, J. M., Gibbon, C. R., Bacon, J. P. Expression of engrailed in an array of identified sensory neurons: comparison with position, axonal arborization, and synaptic connectivity. J. Neurobiol. 28, 493-505 (1995).
- Booth, D., Marie, B., Domenici, P., Blagburn, J. M., Bacon, J. P. Transcriptional control of behavior: engrailed knock-out changes cockroach escape trajectories. J. Neurosci. 29, 7181-7190 (2009).
- Schrader, S., Horseman, G., Cokl, A. Directional sensitivity of wind-sensitive giant interneurons in the cave cricket Troglophilus neglectus. J. Exp. Zool. 292, 73-81 (2002).
- Libersat, F., Goldstein, R. S., Camhi, J. M. Nonsynaptic regulation of sensory activity during movement in cockroaches. Proc. Natl. Acad. Sci. U.S.A. 84, 8150-8154 (1987).
- Stern, M., Ediger, V. L., Gibbon, C. R., Blagburn, J. M., Bacon, J. P. Regeneration of cercal filiform hair sensory neurons in the first-instar cockroach restores escape behavior. J. Neurobiol. 33, 439-458 (1997).
- Blagburn, J. M. Synaptic specificity in the first instar cockroach: patterns of monosynaptic input from filiform hair afferents to giant interneurons. J. Comp. Physiol A. 166, 133-142 (1989).
- Watanabe, H., Ai, H., Yokohari, F. Spatio-temporal activity patterns of odor-induced synchronized potentials revealed by voltage-sensitive dye imaging and intracellular recording in the antennal lobe of the cockroach. Front. Sys. Neurosci. (6), 55 (2012).
- Nishino, H., et al. Visual and olfactory input segregation in the mushroom body calyces in a basal neopteran, the American cockroach. Arthropod Struct. Dev. 41, 3-16 (2012).
- Elia, A. J., Gardner, D. R. Long-term effects of DDT on the behavior and central nervous system activity in Periplaneta americana. Pestic. Biochem. Physiol. 21, 326-335 (1984).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados