Method Article
Ottimizzazione e utilizzo di
In questo articolo
Riepilogo
Produzione di proteine transitoria nelle piante di Nicotiana sulla base di infiltrazione sottovuoto con Agrobacteria trasportando i vettori di lancio (Tobacco Mosaic Virus-based) è un approccio rapido ed economico per la produzione di antigeni e proteine terapeutiche. Abbiamo semplificato la procedura e migliorato l'accumulo di destinazione ottimizzando le condizioni di coltivazione batteri, selezionando specie ospite e co-introduzione di silenziamento dell'RNA soppressori.
Abstract
Produzione di proteine transiente mediata da Agrobacterium in piante è un metodo promettente per produrre antigeni e proteine terapeutiche entro un breve periodo di tempo. Tuttavia, questa tecnologia è solo cominciando ad essere applicate alla produzione come molti ostacoli tecnologici su larga scala per scalare vengono ora superati. Qui, dimostriamo un metodo semplice e riproducibile per la produzione su scala industriale di proteine transitorio basato su vuoto infiltrazione di piante di Nicotiana con Agrobacteria trasportano vettori di lancio. Ottimizzazione della coltivazione Agrobacterium in AB mezzo permette diluizione diretta della coltura batterica in acqua Milli-Q, semplificando il processo di infiltrazione. Tra le tre specie testate di Nicotiana, N. excelsiana (N. benthamiana × N. excelsior) è stato selezionato come host più promettente a causa della facilità di infiltrazione, elevato livello di giornalista produzione di proteine, e circa due-fvecchio maggiore produzione di biomassa in condizioni ambientali controllate. Induzione di Agrobacterium ospitare pBID4-GFP (virus del mosaico del tabacco-based) con prodotti chimici quali acetosyringone e monosaccharide ha avuto alcun effetto sul livello di produzione di proteine. Pianta infiltrandosi sotto 50 a 100 mbar per 30 o 60 secondi provocato circa il 95% infiltrazione dei tessuti foglia della pianta. Infiltrazione con ceppo di laboratorio Agrobacterium GV3101 ha mostrato la più alta produzione di proteine rispetto al Agrobacteria ceppi di laboratorio LBA4404 e C58C1 e wild-type Agrobacteria ceppi at6, AT10, at77 e A4. Co-espressione di un silenziamento dell'RNA virale soppressore p23 e p19, in N. benthamiana portato ad un accumulo precedente e un aumento della produzione (15-25%) di proteine bersaglio (emoagglutinina virus dell'influenza).
Introduzione
Le piante sono ormai riconosciuto come una piattaforma sicura, affidabile, scalabile ed economica per la produzione di biofarmaci ricombinanti eterologhi e proteine industriali 1-3 e avere importanti vantaggi rispetto ai sistemi di espressione delle cellule microbiche e animali 4. Le piante sono in grado di esprimere le proteine ripiegate correttamente con modificazioni post-traslazionali, tra cui gli anticorpi multimerici assemblati 5-7. Diverse proteine farmaceutiche ricombinanti derivati da piante sono in fase di valutazione clinica 8. Questi includono i vaccini paziente-specifici ricombinanti idiotipo (scFv) per il trattamento del linfoma non-Hodgkin 9, pandemia a base di emoagglutinina e stagionali candidati vaccino influenzale 10,11 (Cummings et al., Presentato al vaccino), anti-antigene di superficie Streptococcus I / anticorpo II per il trattamento della carie dentale 12, e l'insulina umana per il trattamento del diabete 13. Inoltre, reco umanaglucocerebrosidasi mbinant per la terapia enzimatica sostitutiva nei pazienti con malattia di Gaucher è stato approvato in Israele e negli Stati Uniti ed è previsto nell'ambito del programma di accesso allargato al di fuori degli Stati Uniti 14,15.
Proteine eterologhe possono essere prodotti in modo stabile trasformato (transgenici o transplastomic) o transitoriamente piante trasformate. Produzione di proteine Transient offre diversi vantaggi rispetto alla produzione in piante transgeniche, incluse breve periodo di tempo per ottenere espressione e di accumulo 16, e può essere realizzata introducendo vettori binari batteriche o vettori virali vegetali ricombinante nei tessuti vegetali 4. Il sistema più avanzato espressione transiente è basato sull'uso di «vettori di lancio 'che combinano componenti di virus vegetali e plasmidi binari, e sono forniti da agroinfiltration 17,18. Agroinfiltration di un vettore lancio basato su virus del mosaico del tabacco (TMV) è stata applicata con successo al laboratorioscala per la produzione di antigeni vaccinali contro gli agenti patogeni come il virus del papilloma umano 19, Yersinia pestis 20, influenza virus A 21,22, Bacillus anthracis 23, e il virus del vaiolo 24 in N. benthamiana lascia. mediata da Agrobacterium espressione transiente è anche un metodo promettente per la produzione simultanea di più proteine 2,25-27. Ad esempio, i sistemi di espressione transiente vegetali sono stati utilizzati per produrre anticorpi ricombinanti tumore-specifici 28,29, un anticorpo ricombinante glicosilata contro il fattore di crescita epidermico 30, e un anticorpo monoclonale specifico per antrace antigene protettivo 31,32. Co-infiltrazione di Nicotiana benthamiana piante con un gene target e un soppressore dei risultati silenziamento genico in una maggiore espressione della proteina bersaglio 33,34.
Agroinfiltration è un metodo comune per introdu uniformementebatteri cendo che ospitano un gene di interesse in pianta tessuti 35-37. Vacuum infiltrazione di Agrobacterium per l'espressione genica transiente in pianta intatta foglie è un metodo rapido, scalabile, e utile per la produzione di proteine estranee, senza la necessità di generare piante transgeniche 38-41. Durante agroinfiltration vuoto, le piante sono capovolte a testa in giù e parti aeree immersi in sospensione Agrobacterium. Poi viene applicato il vuoto causando gas da evacuare dagli spazi intercellulari foglia attraverso gli stomi. Rapid ri-pressurizzazione seguente rilascio dei risultati vuoto nell'infusione della sospensione Agrobacterium nella foglia. A seguito di vuoto infiltrazione di Agrobacteria, le piante vengono ulteriormente coltivate e di espressione obiettivo è monitorato. I più alti livelli di espressione di destinazione vengono tipicamente osservati 2-3 giorni dopo l'infiltrazione (dpi) con un vettore binario e 4-7 dpi con un vettore di lancio, dopo che il livello di espressione tipicamente diminuises 17,18,42-45. Agrobacterium tumefaciens è il veicolo più utilizzato per la consegna di un gene di interesse in un impianto per la produzione di proteine. Agroinfiltration funziona particolarmente bene in N. benthamiana ma relativamente poco nella maggior parte delle altre piante, tra cui Arabidopsis thaliana 46.
In questo studio, abbiamo sviluppato un metodo semplice, efficiente ed economico per la produzione di proteine transitoria in 5-6 settimane di età N. benthamiana utilizzando A. tumefaciens infiltrazione. Il principale inconveniente di scala industriale della tecnica agroinfiltration è centrifugazione di batteri raccolti e risospensione del pellet batterico in terreno contenente 4'-idrossi-3 ', 5'-dimethoxyacetophenone (acetosyringone), monosaccaridi, e 2 - (N-morfolino) -etansolfonico acido (MES) tampone per l'induzione dei geni Vir. Siamo stati in grado di superare questi problemi, ottimizzando l'Agrobacterium crescita AB medio (minimo) seguita da direttamente diluendo in acqua Milli-Q e controllando la durata e condizioni di infiltrazione. Abbiamo anche confrontato obiettivo di produzione di proteine nella wild-type specie ospite tabacco N. e N. benthamiana excelsior, nonché in ibrido N. excelsiana.
Protocollo
1. Pianta che cresce
Per la successiva agroinfiltration abbiamo valutato due wild-type Nicotiana specie (N. benthamiana e N. Excelsior) e un ibrido (N. excelsiana) coltivate idroponicamente in lana di roccia in strutture al coperto.
- Immergere lastre di lana di roccia in una soluzione fertilizzante per le piante.
- Seminare semi di wild-type N. benthamiana, N. excelsior e N. excelsiana (ibrido di N. benthamiana × N. excelsior) sui nutrienti bagnato superficie di lana di roccia.
- Crescere le piante dai semi in condizioni controllate (24 ° C e 40-65% di umidità relativa) e un fotoperiodo lungo giorno (14 ore di luce e 10 ore scuro, con illuminazione di 130-150 μE m -2 s -1) per 4-5 settimane per N. e N. benthamiana excelsiana, e 5-6 settimane per N. excelsior.
2. Costruzione di vettori per Agroinfiltratione
- Inserire un gene reporter sintetico (la proteina fluorescente verde [GFP]), full-length emoagglutinina (HA) del ceppo A/California/04/2009 del virus dell'influenza (HAC1), e re-ingegnerizzato lichenasi enzima (LicKM) 18 separatamente in il lancio vettore pBID4 18 (vector-based TMV) per ottenere pBID4-GFP, pBID4-HAC1 e pBID4-LicKM, rispettivamente, 18,32,41,47.
- Introdurre 10-50 ng di pBID4 trasportare GFP o HAC1 in cellule elettrocompetenti di A. tumefaciens ceppo GV3101 e LicKM in cellule elettrocompetenti di A. tumefaciens ceppi GV3101, C58C1, GLA4404, AT06, AT10, At77 e A4 con il elettroporatore gene MicroPulser.
- Utilizzare il Agrobacteria trasformata per esperimenti di infiltrazione, se non diversamente indicato.
3. Aspirare Infiltrazione di Agrobacterium in Nicotiana Piante
- Crescere A. tumefaciens ceppi overnight (O / N) in mezzo LB, med YEBium o AB medie completato con 50 mg / L di kanamicina a 28 ° C in agitazione a 200-250 rpm.
- Diluire Agrobacteria in acqua Milli-Q di densità ottica a 600 nm (A 600) di 0,5 o centrifuga tumefaciens cellule coltivate in LB o YEB o AB a 4.000 × g per 10 min a 4 ° C, risospendere in mezzo ad induzione (sale 1x MS, MES 10 mM, 200 mM acetosyringone, 2% di saccarosio [MMA]) A 600 di 0,5, e agitare a temperatura ambiente per 1-3 hr, se non diversamente specificato.
- Infiltrarsi piante in una camera a vuoto immergendo tessuti aeree della pianta Nicotiana in sospensione Agrobacterium e applicando un vuoto 50-400 mbar per 30 o 60 secondi. L'infiltrazione ottimale viene normalmente applicato a 50-100 mbar per 60 sec.
- Una volta eliminato il sottovuoto, togliere piante dalla camera sotto vuoto, lavare in acqua, e crescere per 5-7 giorni nelle stesse condizioni di crescita utilizzate per la crescita di pre-infiltrazione.
- Per testare l'efficaciadi sostanze chimiche che inducono Agrobacterium gene vir, diverse concentrazioni di acetosyringone (0, 100, 200 o 400 mM) sono stati aggiunti al Agrobacteria sospesa in tampone infiltrazione (1x MS, MES 10 mM, 2% di glucosio). Per l'effetto di monosaccaride sull'induzione di geni vir, diverse percentuali di glucosio (0, 1, 2 o 4%) sono stati aggiunti a Agrobacteria sospesa nel buffer infiltrazione (1x MS, MES 10 mM, 200 mM acetosyringone). N. piante benthamiana sono stati infiltrati come già detto in fasi 3.3 e 3.4).
- Laboratorio Agrobacterium ceppi GV3101, C58C1 e LBA4404 e wild-type ceppi A4, AT06, AT10, e At77 ospitare il vettore pBID4-LicKM sono stati diluiti in acqua Milli-Q A 600 del 0.5. N. piante benthamiana sono stati infiltrati con ogni sforzo particolare per quanto detto sopra in passi 3.3 e 3.4.
4. Procedura Co-agroinfiltration per il silenziamento soppressore Viral
- Mix i Milli-Q-diluita di acqua Agrobacterium GV3101 culture che trasportano il gene GFP e virale silenziamento soppressore p19 di pomodoro virus del rachitismo cespuglioso (TBSV) a 1:1, 2:1, 3:01 e 4:01 rapporti. Infiltrati N. benthamiana piante come descritto sopra.
- Infiltrati N. piante benthamiana con una miscela di due Milli-Q-diluita di acqua Agrobacterium GV3101 culture: il primo porta il plasmide pBID4-HAC1 e la seconda trasporta uno dei soppressori di silenziamento - p19 di TBSV o p23 di Citrus tristeza virus, in plasmide pCassp ( pCassp19) e nel PGR plasmide binario sotto il promotore 35S (PGR-P23), rispettivamente, in rapporto 4:1.
5. Western Blot analisi
- Raccogliere campioni di foglie casuali da N. benthamiana, N. excelsior o N. piante excelsiana a 4-7 dpi e polverizzare in azoto liquido a una polvere finissima.
- Aggiungere tre volumi di tampone PBS 1x contenente 0,5% TritonX-100 per ciascun campione.
- Agitare delicatamente i campioni estratti per 15 min a 4 ° C.
- Centrifugare l'estratto per 5 minuti e raccogliere proteine totali solubile in una provetta pulita Eppendorf.
- Diluire gli estratti di una diluizione appropriata (1:50 1:100) in tampone di estrazione 1x PBS, e aggiungere 5 × tampone campione (250 mM Tris-HCl [pH 6,8], il 10% SDS, 0.5% blu di bromofenolo, 50% glicerolo v / v, e DTT 500 mm) per una finale 1 × concentrazione.
- Campioni bollire per 5 min.
- Proteine separate del 10% SDS-PAGE, trasferiscono sulla membrana di trasferimento Immobilon-P, e bloccano con 0,5% I-block.
- Controllo GFP usando policlonale di coniglio anti-GFP antisiero a 1/5.000 e HAC1 mediante anticorpo monoclonale anti-poli-istidina mouse 1:1000 in soluzione bloccante per 1 ora.
- Dopo marcatura anticorpo primario, lavare le membrane tre volte per 10 minuti ciascuno con 1 × PBST-20 e incubare con perossidasi di rafano (HRP)-coniugato anticorpo anti-coniglio a 1/5.000 o un HRP-coniugatod anticorpo anti-topo a 1:10.000 per 1 ora, per la GFP e la rilevazione HAC1, rispettivamente.
- Elaborare Western blot utilizzando il substrato SuperSignal Ovest Pico Chemiluminescent.
- Utilizzare il Software GeneTools analizzare intensità della banda della proteina e avere la quantità calibrata band.
Produzione di proteine: (calibrato quantità x diluizione del campione) / quantità di campione caricato) x 4 = mg / kg.
Equazione: Produzione di proteine (P), quantità calibrata (C), diluizione del campione (D) e la quantità di campione caricato (S).
6. Zymogram Assay
- N. Raccogliere pBID4-LicKM-infiltrati benthamiana campioni di tessuto casuale.
- Estrarre proteine usando gli stessi metodi descritti sopra per analisi Western blot e quindi analizzare del 10% SDS-PAGE con 0.1% lichenan incluso nel gel.
- Dopo l'elettroforesi, lavare i gel due volte per 10 minuti ciascuno in tampone di lavaggio (100 mM Tris-HCl [pH 8,0] e 0,1% Triton X-100) E poi incubare in tampone di lavaggio a 65 ° C per 1 ora.
- Dopo l'incubazione, scartare il tampone di lavaggio e macchiare i gel con 0,5% Congo Red per 5 min a temperatura ambiente.
- Sciacquare i gel in acqua Milli-Q per tre volte per 10 minuti ciascuno, e aggiungere 1 M NaCl per visualizzare l'attività lichenasi. La proteina lichenasi batterico purificato è stato utilizzato come controllo positivo per l'attività enzimatica.
7. GFP Imaging
- Eseguire il rilevamento visivo di fluorescenza GFP in piante intere transitoriamente trasformate usando una lampada UV di lunghezza d'onda a mano.
- Fotografia transitoriamente trasformato piante con una macchina fotografica digitale attraverso un giallo 8, ES 52 filtro (tempo di esposizione, 15 sec).
- Ottenere immagini da analisi Western blot utilizzando il software GeneSnap su un GeneGnome e quantificare i risultati utilizzando il software GeneTools, con una curva di calibrazione basato sullo standard GFP purificata.
- Quantificare proteina HAC1 utilizzando una curva di calibrazione basato sulla depurazioneed HAC standard di proteine dal ceppo A/Indonesia/05/05 del virus dell'influenza.
- Calcolare i valori medi di 3-4 replicati per tutti gli esperimenti.
Risultati
Requisiti nutrizionali per la crescita delle piante. L'uso di idroponica mezzo di crescita delle piante (Rockwool) e la soluzione nutritiva garantisce uniformità di N. la crescita benthamiana ed elimina le complessità (meccanica, di regolamentazione e di efficienza) associati con l'utilizzo di terreno per la coltivazione delle piante. Siamo cresciuti N. benthamiana su lastre di lana di roccia imbevuti di fertilizzanti disponibili in commercio per determinare le condizioni ottimali per la crescita delle piante e l'accumulo di biomassa. Abbiamo osservato 95-100% germinazione dei semi. Si deve notare che incluso il fosforo è fondamentale per raggiungere la germinazione, perché abbiamo scoperto che soluzione nutritiva carente di fosforo non è riuscito a sostenere la germinazione e la crescita di N. semi benthamiana (Figura 1A).
Effetti della crescita Agrobacterium e supporti infiltrazione per la salute e la produzione di proteine vegetali. Abbiamo testato diverse condizioni di supporto per ottimizzare l'efficienza di tegli tecnica agroinfiltration per la produzione su larga scala. Batteri (A. tumefaciens ceppo GV3101) ospitano il costrutto pBID4-GFP sono state coltivate O / N in diverse condizioni di supporto (YEB, LB o AB), e sia centrifugate e risospese in terreno di induzione (MMA) (contenente 1 × Murashige & Skoog [MS] Basal Salt Miscela, 10 mM MES pH 5,6, 20 g / L di saccarosio e 200 pM acetosyringone) o diluito in acqua Milli-Q per A 600 di 0,5 prima di utilizzare per pianta infiltrazione. Abbiamo osservato che vuoto infiltrazione di piante con batteri diluito in acqua ha portato alla produzione di proteine paragonabili a quelli ottenuti con qualsiasi mezzo infiltrazione nelle precedenti relazioni 42,48. In contrasto, l'infiltrazione con Agrobacteria diluito coltivato in YEB o LB supporti provocato completo appassimento di N. benthamiana lascia in meno di 24 ore dopo l'infiltrazione, mentre Agrobacteria diluiti cresciuti in AB medio non ha avuto effetto sulla salute delle piante infiltrati (datuna non mostrato). Come illustrato nella Figura 1B, piante infiltrato con culture tumefaciens coltivate in YEB, LB o AB supporti e diluito con acqua Milli-Q (1:5, A 600 di 0,6-0,8 o 1:10 Un 600 di 0,3-0,4) mostrava sintomi e mostravano una produzione media GFP del 1645, 1520 e 1839, rispettivamente. Agrobacteria centrifugato e ri-sospeso in mezzo ad induzione (MMA) non hanno mostrato sintomi e nessuna differenza significativa nella produzione di proteine rispetto al Agrobacteria direttamente diluito in acqua Milli-Q ( 1671 ± 102 e 1667 ± 131 mg / kg, rispettivamente). Pertanto, acqua Milli-Q è raccomandato per diluire culture tumefaciens per impianti infiltrazione ed è stato utilizzato di routine nei nostri esperimenti successivi per ottenere un A 600 di 0,5.
Effetti della densità cellulare sospensione Agrobacterium e naturalmente il tempo sull'espressione bersaglio. Abbiamo poi esaminato se la densità delle cellule battericheinfluisce sull'efficienza di infiltrazione e livelli di espressione di destinazione. A questo scopo, abbiamo valutato quattro diverse densità di sospensione delle cellule di Agrobacterium che trasportano pBID4-GFP, A 600 di 1,0, 0,5, 0,1 e 0,05. A seguito di infiltrazione, N. piante benthamiana sono stati monitorati per lo sviluppo sintomo visibile e durata d'espressione bersaglio di raccolta di campioni a 4, 7 e 10 dpi. A 4 dpi, abbiamo osservato differenze notevoli nella fluorescenza GFP tra le piante infiltrati con differenti densità di sospensione cellulare di Agrobacterium (senza espressione GFP è stato osservato in 600 di 0,05). Alle 7 dpi, fluorescenza GFP è stata simile nelle piante infiltrati a densità sospensione cella di un 600 1.0, 0.5 e 0.1, ma era più bassa nelle piante infiltrati in un A 600 di 0.05. Come mostrato nella Figura 1C, questi dati sono stati confermati mediante Western blot analisi di campioni prelevati a 4 dpi, mostra bassissima produzione di proteine in A 600 0,05 (5 mg / kg) e massima in A 600 di 1,0 (1739 mg / kg). Alle 7 dpi, piante non hanno mostrato differenze significative nella produzione GFP stimato in un 600 di 1,0, 0,5 e 0,1 (1.662, 1.870 e 1.890, rispettivamente), mentre A 600 di 0.05 ha mostrato produzione GFP inferiore (1.199 mg / kg). Al contrario, a 10 dpi differenze nella produzione GFP sono stati osservati tra piante infiltrati con una delle quattro densità di sospensione cellulare (1.218, 1.181, 1.197 e 1.304).
Infiltrazione con ceppi alternative di Agrobacterium. Per aumentare la diversità dei ceppi di Agrobacterium disponibile per la produzione di proteine transitoria, abbiamo testato wild-type isolati. Questi ceppi, isolati dalla corona-fiele di ospiti naturali, sono stati gentilmente forniti dal Dr. Gelvin (Purdue University, West Lafayette, Indiana). Per esaminare la loro utilità nella produzione di proteine transitoria, abbiamo infiltrati N. benthamiana con i seguenti ceppi Carrying pBID4-LicKM 18: A. rhizogenes (A4) e A. tumefaciens wild-type Nester ceppi A348, A208, A281 e (nome AT6, AT10, e At77, rispettivamente), così come ceppi di laboratorio ingegnerizzati di A. tumefaciens GV3101, C58C1, e LBA4404. Le foglie infiltrati sono stati raccolti a 7 dpi e il livello di espressione LicKM è stato stimato mediante Western blot. Come mostrato in Figura 2A, il più alto livello di produzione LicKM può essere raggiunto con i ceppi GV3101, A4 e LBA4404 (~ 1.750 ± 163, 1650 ± 26 e 1450 ± 117 mg / kg, rispettivamente), con lievi differenze; il più basso livello di espressione (~ 900 ± 102 mg / kg) con C58C1; e la produzione intermedia con AT6, AT10 e At77 (~ 1.250 ± 19, 1100 ± 42 e 1200 ± 111 mg / kg, rispettivamente). L'attività enzimatica è stata dimostrata utilizzando lichenasi saggio Zymogram. Figura 2B mostra che lichenasi prodotta nei tessuti vegetali infiltrate utilizzando uno deiCeppi di Agrobacterium era enzimaticamente attiva. Si dovrebbe anche notare che le piante di N. benthamiana infiltrate con ceppi A4 e At77 ha mostrato sintomi patologici (arresto della crescita, picciolo allungamento e curling, e foglia di curling), mentre con AT10 ceppo i sintomi sono stati lievi. Senza sintomi sono stati osservati in N. benthamiana piante infiltrati con ceppo di laboratorio GV3101 (Figura 2C).
Infiltrazione di specie alternative Nicotiana. Abbiamo confrontato i tassi di produzione di biomassa e la produzione di proteine in due specie del genere Nicotiana (N. benthamiana e N. excelsior), e in una specie ibrida, N. wild-type excelsiana (N. benthamiana × N. excelsior). Delle specie testate, N. benthamiana, un host ampiamente usato per la produzione di proteine transitoria utilizzando sistemi di espressione Agrobacterium basati o su base virale 2,34,49, raggiunge la prontezza infiltrazione entro 4-5 settimane di germinazione. Il periodo di crescita necessaria per generare il livello ottimale della biomassa è anche 4-5 settimane per N. excelsiana ma è più lungo (6-7 settimane) per N. excelsior. Inoltre, gli internodi vegetali sono relativamente brevi per N. excelsior rispetto ad altre specie di Nicotiana.
Inoltre, abbiamo osservato che l'infiltrazione sotto vuoto di N. e N. benthamiana excelsiana a 50-250 mbar per 60 sec è altamente efficiente per agroinfiltration di foglie intere, mentre N. excelsior è difficile infiltrarsi per il minore tettuccio e coriacee foglie, anche quando il vuoto è stato applicato tre volte per 1 minuto ciascuno in presenza di tensioattivi non ionici come Sillwet-77 o S240. Inoltre, il tasso di germinazione di N. excelsiana e N. semi Excelsior era ~ 40-50%; al fine di aumentare il tasso di germinazione al 90-100%, semi devono essere trattati con 10% Bleach per 1 ora prima della semina. Alle stesse condizioni di crescita, la massima biomassa foglio che può essere generata da N. excelsiana è circa due volte superiore rispetto a N. benthamiana (Tabella 1).
Produzione di proteine è stata esaminata in N. benthamiana, N. excelsior e N. excelsiana infiltrato con il ceppo Agrobacterium GV3101 ospitare pBID4-GFP. Accumulo GFP è stata valutata in 7 dpi in foglie intere infiltrate utilizzando la luce UV seguita da analisi Western Blot. Figura 3A mostra anche la distribuzione di GFP in N. benthamiana e N. excelsiana e la distribuzione irregolare in N. excelsior (a causa di una difficoltà di infiltrare una zona foglia di N. excelsior). Figura 3B mostra il livello di produzione GFP stimato da illuminazione luce UV in foglie infiltrati raccolti dalle tre specie di Nicotiana a 7 dpi. L'accumulo GFPlivello mento era più alto in N. benthamiana (~ 2,23 g / kg) rispetto a N. excelsiana e N. excelsior (~ 1,89 e 1,54 g / kg, rispettivamente). Il basso livello di produzione di proteine in N. excelsior è causa di infiltrazioni e distribuzione di GFP accumulato nella foglia raccolto irregolare.
Abbiamo osservato che le foglie superiori direttamente esposti alla luce spesso mostrano i primi e più alti livelli di accumulo GFP transitoria (2-4 dpi) di foglie sotto il baldacchino. Tuttavia, nei nostri studi, l'accumulo GFP è stato il più alto a 7 dpi ed è stato distribuito in modo uniforme in tutta la maggior parte delle foglie, tranne in uninfiltrated foglie appena crescenti che mostrano nessun accumulo GFP.
Effetti della pressione di vuoto e durata sulla produzione di proteine transitoria. Vacuum infiltrazione aumenta significativamente i livelli di espressione transiente confronto alla pressione applicata mediante iniezione mano con una siringa senza ago 42. L'applicazione di unavuoto provoca gas per evacuare dalle foglie attraverso gli stomi pianta sommersa. Quando il vuoto è rotto e la pressione aumenta rapidamente, la sospensione di Agrobacterium è guidato in foglie di sostituire i gas evacuati 50.
Per testare l'effetto della pressione di vuoto sulle foglie di N. benthamiana, abbiamo infiltrato le piante con il ceppo Agrobacterium GV3101 ospitare pBID4-GFP sotto varie pressioni di vuoto (50-400 mbar) per 30 o 60 secondi. È stato dimostrato che il vuoto forte (inferiore a 50 mbar) applicato per 30 o 60 risultati sec danni meccanici di foglie infiltrati, con conseguente avvizzimento tessuto e morte pianta, subito dopo l'infiltrazione (24-48). D'altra parte, l'applicazione del vuoto lieve (400 mbar) risultati in infiltrazione di solo il 50% della superficie del foglio e una diminuzione del livello di produzione di GFP (303 ± 90 mg / kg) (Figura 4A). È importante sottolineare che abbiamo osservato differenze nella produzione di GFP sotto i 50, 100 e 200 mbar (1651 ± 107, 1.688 ± 40, 1594 ± 26 mg / kg, rispettivamente) (Figura 4A) e da lieve a nessuno, ripercussioni negative sulla salute delle piante quando le pressioni di vuoto 50-200 mbar stati applicati per 30 o 60 sec. Pertanto, 50-100 mbar di pressione di vuoto è consigliato per gli esperimenti di infiltrazione.
L'effetto della durata del vuoto sull'espressione bersaglio è stata valutata mediante infiltrazione per piano di N. piante benthamiana ogni ora con un A 600 di 0,5 di GV3101 ospitare pBID4 -. GFP per 8 ore nella stessa cultura Agrobacterium Figura 4B mostra che il livello di produzione GFP era simile a tutti i tempi point fino a 8 ore, suggerendo che su questo periodo di tempo Agrobacterium mantiene la sua capacità di lanciare un DNA a singolo filamento.
Effetto di induzione chimica sulla produzione di proteine. Alcuni metaboliti vegetali fenolici e zuccheri possono indgeni di virulenza UCE di A. tumefaciens 1,52. Di conseguenza, molti prodotti chimici e monosaccharaides sono stati segnalati per aumentare la produzione di proteine transitoria in diverse specie vegetali. Acetosyringone è più comunemente aggiunta a colture di A. tumefaciens per indurre l'operone vir prima agroinfiltration 40,53-57.
Abbiamo valutato l'effetto di diverse concentrazioni di acetosyringone (0, 100, 200 e 400 micron) e di glucosio (0-4%) su transitoria produzione della proteina GFP in N. benthamiana infiltrato con il ceppo Agrobacterium GV3101 ospitare pBID4 - GFP. A questo scopo, abbiamo ri-sospeso cellule Agrobacterium nei media induzione MMA contenenti diverse concentrazioni di acetosyringone e glucosio per 1-3 ore prima di infiltrazione. Secondo i risultati di entrambi osservazione visiva (dati non mostrati) e Western blot (Figura 4C), nessuna delle concentrazioni testatedi questi composti indotto un significativo aumento della fluorescenza GFP o produzione di proteine rispetto al controllo in cui i media induzione non contenevano acetosyringone o glucosio.
Effetto della co-infiltrazione di un soppressore tacere sulla produzione transitoria di GFP e HAC1 geni in N. benthamiana lascia. È stato precedentemente dimostrato che la co-espressione di un soppressore silenziamento (p19 di pomodoro virus del rachitismo cespuglioso [TBSV]) interferisce con silenziamento genico post-trascrizionale (PTGS), con conseguente maggiore produzione di proteine reporter 34.
Abbiamo valutato l'effetto della co-infiltrazione di N. benthamiana con il vettore di lancio che porta il gene reporter GFP (pBID4-GFP) e P19. Prima di infiltrazione, un A 600 di 0,5 diluizioni di A. culture tumefaciens GV3101 ospitano pBID4-GFP e P19 sono stati, rispettivamente, mescolati a rapporti di 01:01, 02:01, 03:01 e 04:01. Checkione del soppressore silenziamento era controllata dal promotore del virus del mosaico del cavolfiore 35S. Come indicato dai risultati delle analisi Western blot a 7 dpi (Figura 5A), la presenza di p19 non aumentare o diminuire la produzione di GFP in N. benthamiana, in qualsiasi rapporto delle due sospensioni tumefaciens.
Abbiamo anche confrontato gli effetti di due geni soppressori di silenziamento virali - p23and p19 - sulla prevenzione di PTGS per HAC1. Culture di Agrobacterium trasportano il vettore lancio pBID4-HAC1 (H1N1 A/California/04/2009) e uno dei due plasmidi silenziamento soppressori virali sono stati diluiti ad un A 600 di 0,5, mescolati rispettivamente ad un rapporto di 4:1, e co-infiltrato in 4-5-settimana vecchio N. benthamiana. Una sospensione di A. tumefaciens che trasportano pBID4 - HAC1 solo era infiltrato come controllo. I campioni di foglie infiltrati sono stati raccolti dal 3 all'8 dpi. L'esperimento è stato repeato tre volte e livelli medi di espressione HAC1 determinati mediante Western Blot.
Come mostrato nella Figura 5B, co-infiltrazione di N. benthamiana con p23 o p19 provocato (642 ± 157 e 764 ± 108 mg / kg, rispettivamente), un incremento della produzione HAC1 rispetto all'utilizzo senza soppressore silenziamento (circa il 15-25%, rispettivamente) a 6 dpi. Questo suggerisce che p23 e p19 sono efficienti nel nostro sistema. Tuttavia, va notato che l'accumulo di HAC1 accade un giorno prima, quando pBID4-HAC1 stato co-infiltrato con p19. Pertanto, i nostri risultati dimostrano che gli effetti del silenziamento soppressore p19 su HAC1 e accumulo GFP sono differenti, suggerendo valorizzazione selettiva di espressione e / o la stabilità di alcune proteine in N. transitoria benthamiana.
Abbiamo anche osservato che sia in presenza che in assenza di un soppressore silenziamento il livello della proteina prod HAC1uzione cominciò a declinare a 7 dpi. Ciò indica che i tempi del declino della produzione di proteine transitoria in N. benthamiana infiltrati con il lancio vettore è specifico della destinazione.
La banca di cellule di Agrobacterium ospitare il lancio vettore è stato valutato ogni anno per stabilità gene bersaglio, Agrobacterium vitalità e il livello di accumulo di proteine. Lo stock di glicerolo della banca di cellule del ceppo GV3101 trasformato con pBID4-HAC1 che è stato conservato a -80 ° C ha dimostrato di essere molto stabile per più di tre anni senza cambiamenti nel livello della produzione di proteine transitoria N. infiltrato piante benthamiana. figura 5C dimostra che la produzione di proteine HAC1 stimata mediante Western blotting negli anni 2010, 2011, 2012 e 2013 è stato 670, 685, 566 e 683 mg / kg, rispettivamente. La produzione media HAC1 in N. piante benthamiana era 651 ± 49,4 mg / kg.
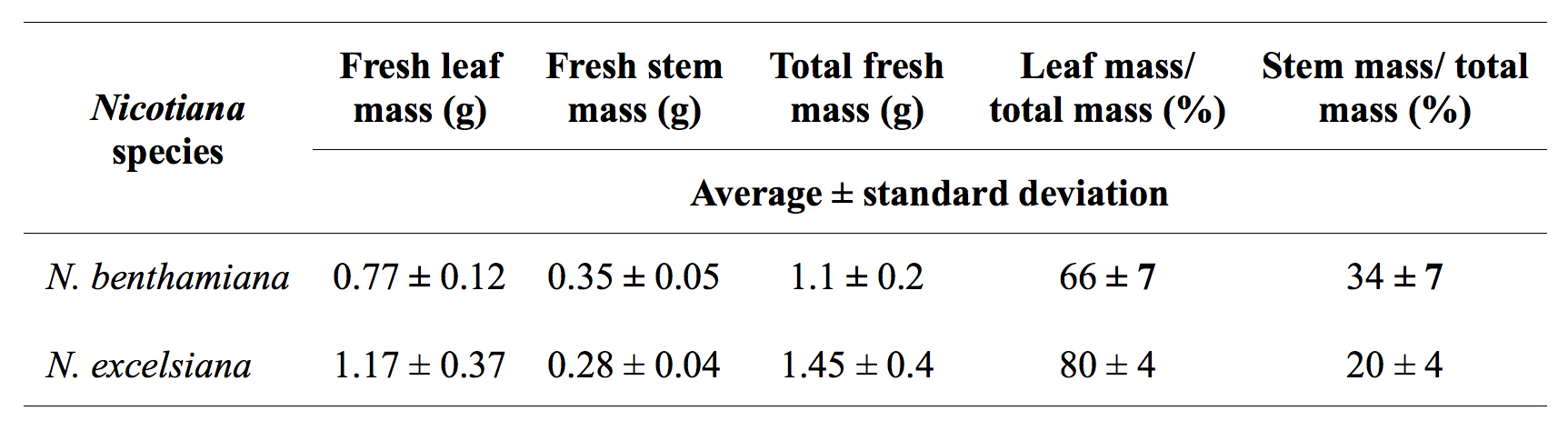
Tabella 1. Confronto di N. benthamiana e N. pianta excelsiana produzione di biomassa.
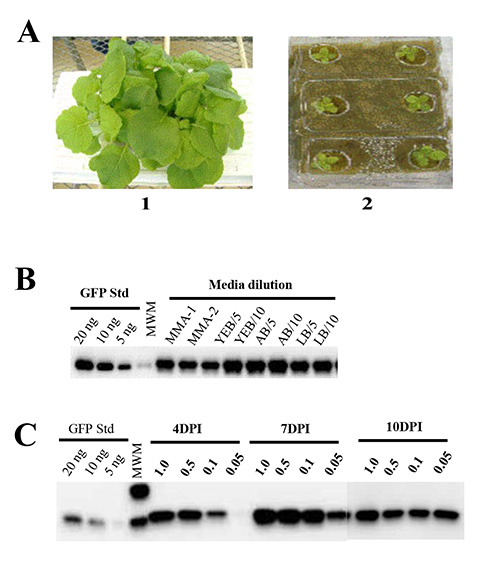
Figura 1. Analisi Western blot dell'espressione genica transiente in N. benthamiana. (A) di sei settimane di età N. benthamiana 1) piante che crescono in una soluzione di concime contenente 4,8% di fosforo e 2) le piante che crescono in una soluzione contenente fertilizzante 0% di fosforo. Venticinque microgrammi di peso foglia fresca equivalente è stato caricato per corsia. (B) Confronto della produzione di GFP in impianti di vuoto infiltrato con pBID4-GFP ospitare Agrobacterium GV3101 colture coltivate in tre diversi media: YEB, AB e LB. Culture GV3101 coltivate O / N in YEB o supporti LB sono stati centrifugati a bassa velocità e risospese in terreno di induzione (MMA) (corsie: MMA-1 e MMA-2, rispettivamente), o coltivate O / N in YEB, LB o Media AB e direttamente diluito a 1:5 o 1:10 con acqua Milli-Q (corsie: YEB / 5 e YEB/10, LB / 5 e LB/10; AB / 5 e AB/10) (C) di confronto. espressione di GFP a 4, 7 e 10 dpi seguenti infiltrazione sotto vuoto con differenti concentrazioni (A 600 di 1,0, 0,5, 0,1 e 0,05) di A. tumefaciens ceppo GV3101 portando pBID4-GFP.
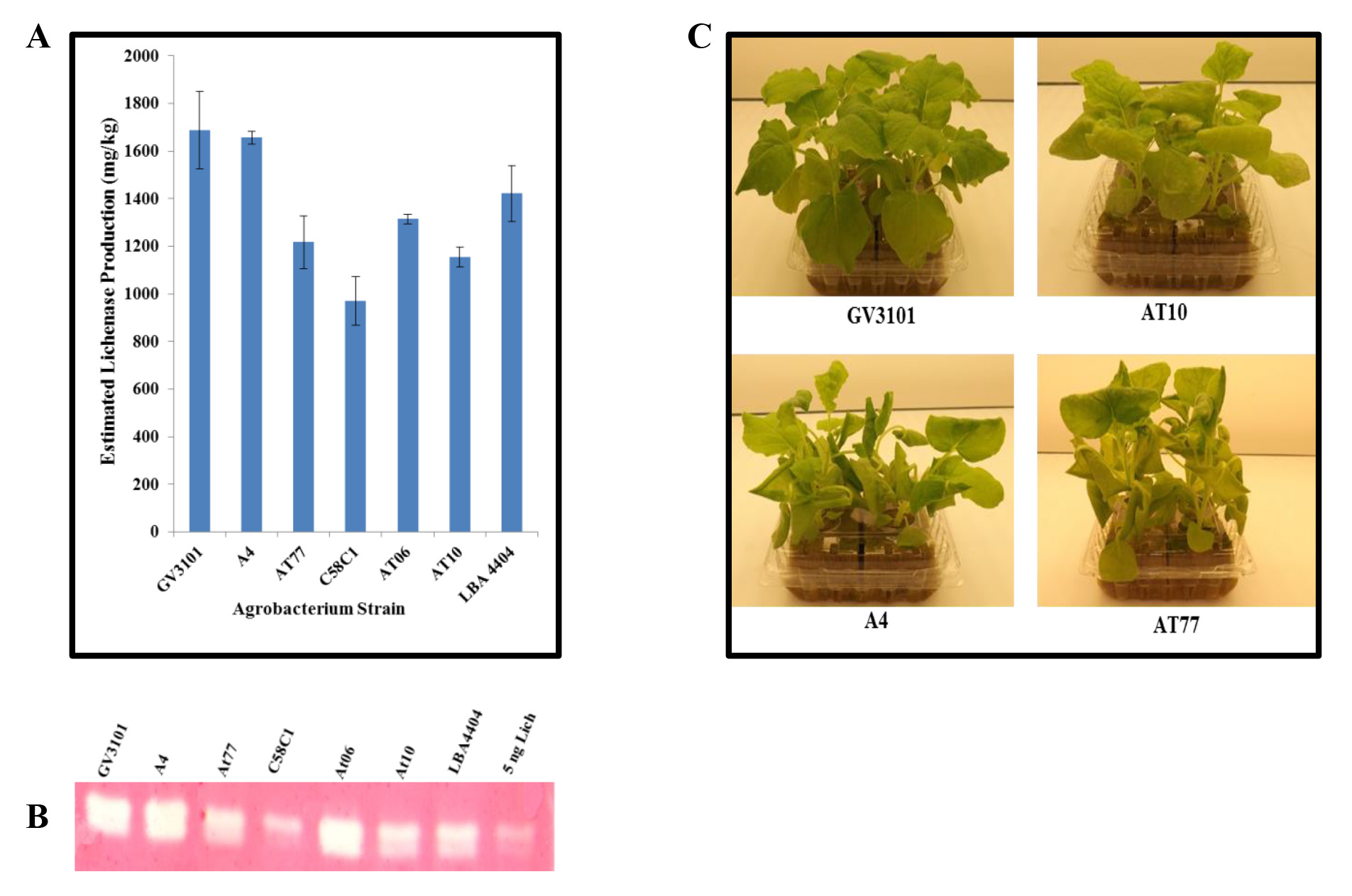
Figura 2. Confronto della produzione lichenasi transitori e attività seguente infiltrazione sotto vuoto di N. impianti benthamiana con diffeaffitto ceppi di Agrobacteria. Culture di ceppi Agrobacteria (GV3101, A4, At77, C58C1, AT6, AT10 e LBA4404) ospitano il vettore di lancio pBID4-LicKM sono stati infiltrati singolarmente in foglie di N. benthamiana. Foglie infiltrati sono stati raccolti a 7 dpi. (A) lichenasi produzione quantificata mediante Western blotting. (B) test Zymogram dimostrando produzione lichenasi attraverso l'attività enzimatica. (C) Effetto di Agrobacterium (wild-type A4, AT10, At77 e ceppo di laboratorio GV3101) infiltrazione su N. fitosanitaria benthamiana a 7 dpi. Venticinque microgrammi di peso foglia fresca equivalente è stato caricato per corsia.
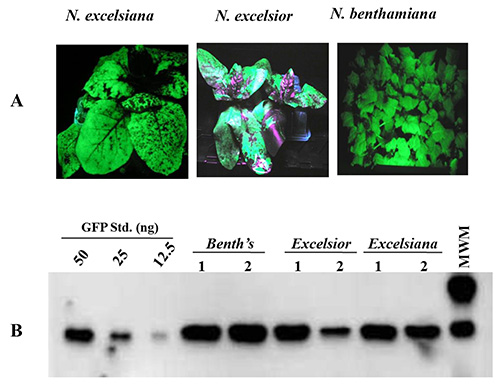
Figura 3. Transient espressione GFP in foglie di N. benthamiana, N. excelsiana e N. excelsior alle 7 dpi dopo l'infiltrazione di vuoto con A. tumefaciens ospitare il lancio vettore pBID4 - GFP. (A) l'esame visivo di espressione GFP sotto luce UV. (B) Western blot di accumulazione GFP.
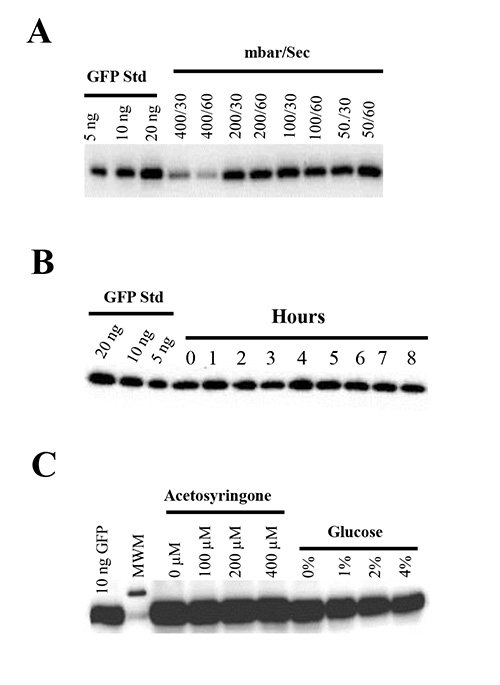
Figura 4. (A) Effetti della depressione sui espressione GFP transitoria e salute delle piante. N. piante benthamiana sono stati infiltrati con pBID4 -. GFP sotto pressioni di vuoto di 400, 200, 100 o 50 mbar, al momento in possesso di vuoto di 30 o 60 secondi (B) Stabilità e infettività di A. tumefaciens in N. benthamiana infiltrato con Agrobacterium GV3101 ospitare pBID4-GFP coltivata in AB medio e diluito ad una A 600 del 0.5. Agroinfiltration stata eseguita infiltrandosi per piano di N. piante benthamiana ogni ora nella stessa cultura diluito Agrobacterium (corsie 0-8). (C) Effetto di diverse concentrazioni di acetosyringone e glucosio sull'espressione transiente di GFP. Il ceppo Agrobacterium GV3101 ospitare pBID4 - GFP è stato coltivato O / N in mezzi YEB, centrifugato e risospeso ad un A 600 di 0,5 sia in MMA contenente 2% di glucosio con acetosyringone a 0, 100, 200 o 400 mM, o in MMA contenente 200 pM acetosyringone con glucosio a 0, 1, 2 o 4%. Le sospensioni tumefaciens sono state mantenute per 3 ore a temperatura ambiente prima di infiltrazione.
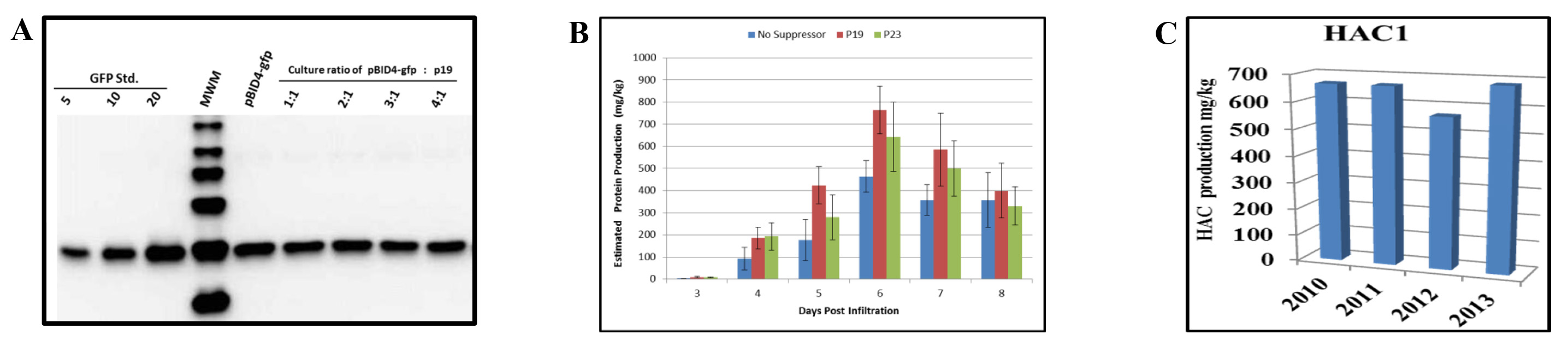
Figura 5. Effetti di soppressori di silenziamento sulla produzione di proteine transitoria in N. benthamiana lascia. (A) Western blot di proteine GFP in seguito co-infiltrazione di pBID4-GFP e P19 a rapporti diversi. I campioni raccolti alle 7 dpi (25 mg di peso foglia fresca equivalente è stato caricato per corsia). (B) Una cultura di Agrobacterium portando pBID4-HAC1 individualmente mescolati ad un rapporto di 4:1, con una cultura che porta la p19 o p23 silenziamento soppressore plasmidi. Le combinazioni risultanti delle culture tumefaciens sono stati vuoto infiltrati nelle piante. Tessuti infiltrati di HAC1 stati raccolti giornaliera fino a 8 dpi per la proteina ricombinante quantificazione. (C) Stabilità della banca di cellule Agrobacterium. Le piante sono state infiltrate con la stessa produzione della banca di cellule Agrobacterium ogni anno per valutare l'accumulo di proteine. Cinquanta microgrammi di peso foglia fresca equivalente è stato caricato per corsia. Cliccare qui per vedere una versione più grande del secoloè figura.
Discussione
In questo studio, abbiamo sviluppato un semplice protocollo agroinfiltration per la produzione di proteine transitoria di routine in specie di Nicotiana selezionati utilizzando ceppi tumefaciens che portano il lancio vettore. Inoltre, abbiamo identificato le condizioni ottimali per raggiungere il massimo livello di produzione della proteina ricombinante nel nostro sistema di espressione transiente pianta.
Vacuum infiltrazione della A. tumefaciens ceppo diluito GV3101 ospitare i pBID4 vettore di lancio in N. benthamiana, N. excelsiana e N. excelsior portato a livelli più elevati di produzione di proteine bersaglio entro 7 dpi rispetto ad altre specie vegetali, come Pisum sativum infiltrata con GV3101 ospitare Alfalfa mosaic virus - o Cucumber mosaic virus-vettori basati esprimono il gene reporter GFP sotto il promotore 35S 41, o Lactuca sativa, Solanum Lycopersicum e Arabidopsis thaliana infiltrati con il ceppo C58C1 di A. tumefaciens che portano la beta-glucuronidasi giornalista gene 57. N. e N. benthamiana excelsiana erano facili da aspirare infiltrarsi a 50 mbar per 30-60 secondi, con il 90-95% di efficienza infiltrazione. Il restante 5-10% della superficie del foglio non è stato infiltrato causa di qualche fluttuazione di foglie sulla superficie della sospensione Agrobacterium durante l'applicazione del vuoto. Dal lancio vettore ha la capacità di movimento 18 cellula-cellula, accumulo di proteine transitorio si verifica in foglie intere nonché piccioli a 7 dpi. A 10 dpi, la produzione stimata GFP era leggermente inferiore in quanto il vettore di espressione pBID4 è in grado di muoversi da una cella all'altra, ma non per spostare sistemica 18; Pertanto, le foglie di nuova produzione non contengono il vettore e non contribuiscono alla produzione di destinazione. Inoltre, la degradazione della proteina ricombinante nel tempo may contribuire a ridurre il livello di proteine a 10 dpi. I nostri risultati hanno mostrato che l'infiltrazione del A. alti livelli tumefaciens ceppo GV3101 mediate di produzione di proteine transitoria in N. benthamiana. Inoltre, proteina bersaglio può essere progettato come fusioni N-terminale, C-terminale o interne alla lichenasi (LicKM), β-1 ,3-1 ,4-glucanasi, che è un enzima termostabile da Clostridium thermocellum e conferisce stabilità termica a molti di destinazione proteina di fusione 18. Infiltrazione di N. benthamiana con A. tumefaciens ceppi wild-type (AT6, AT10 e at77) ospitano il gene di interesse suscitato sintomi lievi o gravi: foglia di curling, picciolo allungamento, e curling. Senza sintomi patologici sono stati osservati in N. benthamiana infiltrato con la GV3101 ceppo di laboratorio ospitare vuoto pBID4 vettore, mentre alcuni geni inseriti in pBID4 e trasformate in laboratorio ceppi GV3101, C58C1 o LBA4404 suscitato reazioni necrotiche miti e fogliaclorosi / ingiallimento sintomi nelle regioni infiltrati di foglie. I sintomi necrotici causati da wild-type Agrobacterium o ceppi disarmati in solanacee sono stati segnalati in precedenza 56,57. La risposta necrotico potrebbe derivare da fattori di virulenza del sistema di secrezione di tipo III, proteine batteriche trasferite alla cellula vegetale dal sistema di secrezione di tipo IV, e / o sensibilità alla flagellin 58-60. Abbiamo trovato che la produzione di proteine eterologhe transitorio può anche suscitare patogenicità e una risposta ipersensibile in pianta infiltrato foglie. Molti ricercatori hanno riferito che agroinfiltration di diverse specie di piante con piante vettori binari prodotti fino a 5-20 volte più alti livelli di produzione di proteine transitoria rispetto agli impianti stabilmente trasformate 28,57. I nostri dati mostrano che N. benthamiana infiltrato con GV3101 ospitare pBID4-GFP transitoriamente espressi alti livelli di GFP, che è simile al rendimento GFP riportato perN. benthamiana infiltrato con Agrobacteria portando il vettore virale Pich-GFPSYS (fino al 80% delle proteine totali solubili) 44. Agroinfiltration utilizzando il nostro lancio vettore provocato alta produzione della proteina LicKM termostabile, 50 volte superiore a quella osservata utilizzando un plasmide standard binario 18.
Per testare l'infettività A. tumefaciens e la stabilità del lancio vettore, abbiamo infiltrate per piano di N. benthamiana ogni ora per un massimo di 8 ore utilizzando la stessa Milli-Q cultura diluito con acqua del GV3101 ospitare plasmide pBID4-GFP. I nostri dati hanno mostrato che il ceppo GV3101 è efficacemente infettivo per almeno 8 ore e pBID4 (il lancio vettore) è molto stabile durante la 8 ore di lungo infiltrazione.
Stock di glicerolo di tensione GV3101 ospitare il vettore di lancio pBID4-HAC1 (banca di cellule), conservato a -80 ° C ha dimostrato di essere molto stabile per tre anni senza variazioni di prote transitoriain produzione negli impianti di infiltrati.
N. benthamiana piante coltivate in condizioni ottimali e tra 35 e 42 giorni dopo la semina erano ottimali per il vuoto espressione genica transiente infiltrazione mediata 40. Piante giovani (3-4 settimane) non possono essere infiltrati completamente a causa delle foglie che galleggiano sulla superficie sospensione cellulare e danni ai tessuti dagli effetti meccanici di applicazione di un vuoto. Negli impianti più vecchi di 45 giorni, N. benthamiana bullonatura palco, sotto le condizioni di luce ottimali utilizzati, il livello di espressione transiente è basso.
Composti a basso peso molecolare fenolici (acetosyringone) e monosaccharaides (glucosio) sono noti per indurre i geni vir in A. tumefaciens 55,61. Inoltre, infiltrazione di N. benthamiana con il vettore pCAMBIA binario (GFP) in presenza di acetosyringone alle concentrazioni di 50-600 mM hanno mostrato di aumentare leggermente transitoriaespressione genica 40. Abbiamo studiato l'effetto di diverse concentrazioni di acetosyringone e glucosio nel nostro sistema con l'aggiunta di questi composti a culture GV3101 ospitano pBID4-GFP in MMA per 3 ore, e abbiamo trovato nessuna differenza di espressione GFP. È interessante notare che, culture GV3101 ospitano pBID4-GFP e diluito in acqua Milli-Q per un A 600 di 0,5 e infiltrati senza l'induzione gene vir espresso le stesse quantità di GFP come quelli infiltrati con le culture indotte. Il A. Agrobacterium gene vir (s) potrebbe potenzialmente essere indotta da composti vegetali fenolici (acetosyringone e acido sinapinic) e monosaccharaides vegetali (glucosio e fruttosio) presenti nel tessuto fogliare. Pertanto, ipotizziamo che i livelli simili di espressione GFP in presenza o assenza di induttori esogeni gene vir possono essere il risultato dell'effetto di citoplasmatici vir induttori gene presente durante la replicazione del lancio vettore GFP che esprimono in cellule vegetali.
Wild-tipo N. benthamiana è stato usato come modello host per la produzione di proteine transitorio 49. Tuttavia, relativamente bassa resa in biomassa s 'N. benthamiana ostacola la sua applicazione per la produzione su larga scala di proteine ricombinanti. L'host ottimale dovrebbe combinare un alto livello di espressione transiente, facile crescita in una serra, e sia suscettibile di Agrobacterium infiltrazione 2. Per selezionare un host alternativo, abbiamo infiltrati due diverse specie di Nicotiana (N. benthamiana e N. excelsior) wild-type e un ibrido N. excelsiana (N. benthamiana × N. excelsior) con la A. tumefaciens ceppo GV3101 ospitare il plasmide pBID4-GFP. Tra queste tre specie, il livello di espressione GFP era leggermente superiore in N. benthamiana. N. piante Excelsior hanno mostrato difficoltà a agroinfiltration vuoto a causa delle loro foglie coriacee, e N. excelsianaprodotto circa due volte più biomassa nelle stesse condizioni di crescita. La produzione transitoria di GFP a 7 dpi è relativamente simile in N. e N. benthamiana excelsiana. Pertanto, N. excelsiana può essere una serie più adatto per la produzione di proteine ricombinanti.
Produzione di proteine transiente mediata da Agrobacterium è limitato dal PTGS 26, che può essere superata mediante co-espressione di silenziamento genico soppressori di origine virus vegetale 62. Produzione di proteine Transient è stato precedentemente dimostrato essere migliorata 50 volte in presenza della proteina p19 di TBSV, che inibisce PTGS nei tessuti infiltrati 34. Nel nostro studio, abbiamo valutato l'effetto di due soppressori di silenziamento virali (p19 e p23) separatamente co-infiltrati con il vettore di lancio pBID4-HAC1. Il co-infiltrazione di questi soppressori di silenziamento sembrava avere poca influenza sulla espressione transiente di HAC1, con solo un leggero aumento HAC1accumulo di proteine (15-25%) in presenza di co-p23 o p19 infiltrato. Per influenzare positivamente la produzione di proteine, soppressori di silenziamento può essere necessario appositamente selezionati per essere efficace per le specie vegetali bersaglio e vettore virale 63. TMV elicasi ha un soppressore dell'attività del silenziamento dell'RNA 64,65. I nostri dati confermano questa osservazione come co-infiltrazione di p23 o p19 con pBID4-HAC1 comportato alcun aumento di GFP o un leggero aumento della produzione di proteine HAC1 transitoria.
In conclusione, abbiamo modificato e ottimizzato pianta e condizioni di crescita tumefaciens e migliorato l'efficienza di infiltrazione sotto vuoto. Questa tecnologia ci ha permesso di crescere e infiltrarsi centinaia di chilogrammi di materiale vegetale in poche ore. Abbiamo automatizzato con successo la pianta tecnica espressione transitoria per la produzione di vaccini high-throughput a bilance industriali sotto current Good Manufacturing Practices (cGMP) condizioni. Per ulteriori informazioni about automazione ed utilizzazione transitoria sistema di produzione di proteine per la produzione di proteine ricombinanti, inclusa candidati vaccini subunità, in condizioni di cGMP, si rimanda al sito www.fhcmb.org/ .
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal Fraunhofer USA Center for Molecular Biotechnology, iBio, Inc. e la Defense Advanced Research Projects Agency (sovvenzione # HDTRA1-07-C-0054). Gli autori riconoscono i doni generosi di Drs. Stanton Gelvin di Biological Science Dept., Purdue University (Agrobacterium tumefaciens ceppi) e Wayne Fitzmaurice di Large Scale Biology Corp. (N. semi excelsiana), così come Jennifer Nicholson di US Nicotiana Collection, North Carolina State University (N. semi Excelsior ). Gli autori ringraziano Margaret Shillingford e Christopher Hull per la fornitura di impianti e un'eccellente assistenza tecnica. Gli autori ringraziano anche Drs. Stephen Streatfield e Natasha Kushnir per l'assistenza editoriale.
Materiali
| Name | Company | Catalog Number | Comments |
| Nicotiana benthamiana | Tobacco Germplasm Collection, Crop Science Dept., North Carolina State University | PI 555478 TW16 | Infiltration |
| Nicotiana excelsior | Tobacco Germplasm Collection, Crop Science Dept., North Carolina State University | PI 555685 TW47 | Infiltration |
| Nicotiana excelsiana | Dr. Wayne Fitzmaurice, Large Scale Biology Corporation, Vacaville, CA | LSBC EBA 042304.02 | Infiltration |
| Vacuum skid | Abbas, Ashland, MA | Custom made | Plant infiltration |
| Rockwool | Grodan Inc., Ontario, Canada | AO 50/40 | Hydroponic media for growing plant |
| 2-(N-Morpholino) ethanesulfonic acid | Acros Organics, Thermo Fisher Scientific, NJ | 172595000 | Buffer |
| Murashige & Skoog salt (MS salt) | Phyto Technology Lab | M524 | Tissue culture media |
| Acetosyringone | Sigma-Aldrich, St. Louis, MO | D134406-5G | Agrobacterium induction |
| Immobilon-P transfer membrane | Millipore, Billerica, MA | IPVH00010 | Western blotting |
| I-block | Applied Biosystems, Foster City, CA | T2015 | Western blotting |
| Rabbit polyclonal anti-GFP antiserum | Washington Biotechnology, Baltimore, MD | Western blotting | |
| Mouse anti–poly-histidine monoclonal antibody | Qiagen GmbH, Hilden | 34670 | Western blotting |
| Horseradish peroxidase-conjugated anti-rabbit antibody | Jackson ImmunoResearch, West Grove, PA | 111-035-003 | Western blotting |
| Horseradish peroxidase-conjugated anti-mouse antibody | Jackson ImmunoResearch, West Grove, PA | 115-035-003 | Western blotting |
| SuperSignal® West Pico chemiluminescent substrate | Thermo Scientific Pierce, Rockford, IL | 34078 | Western blotting |
| Lichenan (1-3: 1-4-beta-D-glucan) | Megazyme, Bray, Co. Wicklow, Ireland | P-LICHN | Lichenase Activity |
| Congo Red | Sigma-Aldrich, St. Louis, MO | C6277 | Gel staining |
| Digital camera | Olympus, Center Valley, PA | C-8080 | Chemiluminescence imaging |
| GeneGnome | Syngene, Frederick, MD | Chemiluminescence imaging | |
| GFP standard | Made in house | Chemiluminescence imaging | |
| Plant fertilizer solution | Griffin Greenhouse Nursery Supplies, Newark, DE | 67-23-20 | Plant growing |
| Lichenase Standard | Purified in house | Western blotting | |
| MicroPulser Electroporator | BioRad, Hercules, CA | 165-2100 | Agrobacterium transformation |
Riferimenti
- Ma, J. K., Drake, P. M., Christou, P. The production of recombinant pharmaceutical proteins in plants. Nature Reviews Genetics. 4, 794-805 (2003).
- Sheludko, Y. V., Sindarovska, Y. R., et al. Comparison of several Nicotiana species as hosts for high-scale agrobacterium-mediated transient expression. Biotechnology and Bioengineering. 96, 608-614 (2007).
- Mett, V., Farrance, C. E., Green, B. J., Yusibov, V. Plants as biofactories. Biologicals. 36, 354-358 (2008).
- Yusibov, V., Rabindran, S. Recent progress in the development of plant derived vaccines. Expert Review of Vaccines. 7, 1173-1183 (2008).
- Stoger, E., Sack, M., Fischer, R., Christou, P. Plantibodies: Applications, advantages and bottlenecks. Current Opinion in Biotechnology. 13, 161-166 (2002).
- Mahmoud, K. Recombinant Protein Production: Strategic Technology and a Vital Research Tool. Research Journal of Cell and Molecular Biology. 1, 9-22 (2007).
- Rai, M. P. H. Expression systems for production of heterologous proteins. Current Science. 80, 1121-1128 (2001).
- Yusibov, V., Streatfield, S. J., Kushnir, N. Clinical development of plant-produced recombinant pharmaceuticals: vaccines, antibodies and beyond. Human Vaccines. 7, 313-321 (2011).
- McCormick, A. A., Reddy, S., et al. Plant-produced idiotype vaccines for the treatment of non-Hodgkin's lymphoma: Safety and immunogenicity in a phase I clinical study. Proceedings of the National Academy of Sciences of the United States of America. 105, 10131-10136 (2008).
- Medicago Inc, . . , (2013).
- Medicago Inc, . . , (2013).
- Planet Biotechnology Inc, . . , (2013).
- Sys Genetics, S. e. m. B. i. o. . , (2013).
- Protalix, . , (2013).
- Protalix, . , (2013).
- Plesha, M. A., Huang, T. -. K., et al. Optimization of the bioprocessing conditions for scale-up of transient production of a heterologous protein in plants using a chemically inducible viral amplicon expression system). Biotechnology Progress. 25, 722-734 (2009).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Magnification - A new platform for expressing recombinant vaccines in plants. Vaccine. 23, 2042-2048 (2005).
- Musiychuk, K., Stephenson, N., et al. A launch vector for the production of vaccine antigens in plants. Influenza and Other Respiratory Viruses. 1, 19-25 (2007).
- Massa, S., Franconi, R., et al. Anticancer activity of plant-produced HPV16 E7 vaccine. Vaccine. 25, 3018-3021 (2007).
- Mett, V., Lyons, J., et al. A plant-produced plague vaccine candidate confers protection to monkeys. Vaccine. 25, 3014-3017 (2007).
- Mett, V., Musiychuck, K., et al. A plant-produced influenza subunit vaccine protects ferrets against virus challenge. Influenza and Other Respiratory Viruses. 2, 33-40 (2008).
- Shoji, Y., Chichester, J. A., et al. Plant expressed HA as a seasonal influenza vaccine candidate. Vaccine. 26, 2930-2934 (2008).
- Chichester, J. A., Musiychuk, K., et al. Immunogenicity of a subunit vaccine against Bacillus anthracis. Vaccine. 25, 3111-3114 (2007).
- Golovkin, M., Spitsin, S., et al. Smallpox subunit vaccine produced in Planta confers protection in mice. Proceedings of the National Academy of Sciences of the United States of America. 104, 6864-6869 (2007).
- Porta, C., Lomonossoff, G. Use of viral replicons for the expression of genes in plants. Molecular Biotechnology. 5, 209-221 (1996).
- Johansen, L. K., Carrington, J. C. Silencing on the spot: induction and suppression of RNA silencing in the Agrobacterium-mediated transient expression system. Plant Physiology. 126, 930-938 (2001).
- Vézina, L. P., Faye, L., et al. Transient co-expression for fast and high-yield production of antibodies with human-like N-glycans in plants. Plant Biotechnology Journal. 7, 442-455 (2009).
- Vaquero, C., Sack, M., et al. Transient expression of a tumor-specific single-chain fragment and a chimeric antibody in tobacco leaves. Proceedings of the National Academy of Sciences of the United States of America. 96, 11128-11133 (1999).
- Galeffi, P., Lombardi, A., et al. Expression of single-chain antibodies in transgenic plants. Vaccine. 23, 1823-1827 (2005).
- Rodríguez, M., Ramírez, N. I., et al. Transient expression in tobacco leaves of an aglycosylated recombinant antibody against the epidermal growth factor receptor. Biotechnology and Bioengineering. 89, 188-194 (2004).
- Hull, A., Criscuolo, C. J., et al. plant-produced monoclonal antibody for the treatment of anthrax. Vaccine. 23, 2082-2086 (2005).
- Roy, G., Weisburg, S., Rabindran, S., Yusibov, V. A novel two-component Tobacco mosaic virus-based vector system for high-level expression of multiple therapeutic proteins including a human monoclonal antibody in plants. Virology. 405, 93-99 (2010).
- Silhavy, D., Molnar, A., et al. A viral protein suppresses RNA silencing and binds silencing-generated, 21-to 25-nucleotide double-stranded RNAs. EMBO Journal. 21, 3070-3080 (2002).
- Voinnet, O., Rivas, S., Mestre, P., Baulcombe, D. An enhanced transient expression system in plants based on suppression of gene silencing by the p19 protein of tomato bushy stunt virus. Plant Journal. 33, 949-956 (2003).
- Bechtold, N., Pelletier, G. In planta Agrobacterium-mediated transformation of adult Arabidopsis thaliana plants by vacuum infiltration. Methods in Molecular Biology. 82, 259-266 (1998).
- Bechtold, N., Ellis, J., Pelletier, G. In planta Agrobacterium mediated gene transfer by infiltration of adult Arabidopsis thaliana plants. C. R. Academy of Science Paris, Life Sciences. 316, 1194-1199 (1993).
- Tague, B., Mantis, J. In planta Agrobacterium-mediated transformation by vacuum infiltration. Methods in Molecular Biology. 323, 223-215 (2006).
- Fischer, R., Vaquero-Martin, C., et al. Towards molecular farming in the future: transient protein expression in plants. Biotechnology and Applied Biochemistry. 30, 113-116 (1999).
- Horn, M. E., Woodard, S. L., Howard, J. A. Plant molecular farming: systems and products. Plant Cell Reports. 22, 711-720 (2004).
- Wydro, M., Kozubek, E., Lehmann, P. Optimization of transient Agrobacterium-mediated gene expression system in leaves of Nicotiana benthamiana. Acta Biochimica Polonica. 35, 289-298 (2006).
- Green, B. J., Fujiki, M., et al. Transient protein expression in three Pisum sativum (green pea) varieties. Biotechnology Journal. 4, 1-8 (2009).
- Kapila, J., DeRycke, R., Van Montagu, M., Angenon, G. An Agrobacterium-mediated transient gene expression system for intact leaves. Plant Science. 122, 108-101 (1997).
- Yang, Y., Li, R., Qi, M. In vivo analysis of plant promoters and transcription factors by agroinfiltration of tobacco leaves. Plant Journal. 22, 543-551 (2000).
- Marillonnet, S., Thoeringer, C., Kandzia, R., Klimyuk, V., Gleba, Y. Systemic Agrobacterium tumefaciens-mediated transfection of viral replicons for efficient transient expression in plants. Nature Biotechnology. 23, 718-723 (2005).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants. Current Opinion in Biotechnology. 18, 134-141 (2007).
- Goodin, M. M., Zaitlin, D., Naidu, R. A., Lommel, S. A. Nicotiana benthamiana: Its history and future as a model for plant-pathogen interactions. Molecular Plant-Microbe Interactions. 21, 1015-1026 (2008).
- Shoji, Y., Bi, H., et al. Plant-derived hemagglutinin protects ferrets against challenge infection with the A/Indonesia/05/05 strain of avian influenza. Vaccine. 27, 1087-1092 (2009).
- Llave, C., Kasshau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97, 13401-13406 (2000).
- McCormick, A. A., Kumagai, M. H., et al. Rapid production of specific vaccines for lymphoma by expression of the tumor-derived single-chain Fv epitopes in tobacco plants. Proceedings of the National Academy of Sciences of the United States of America. 96, 703-708 (1999).
- Simmons, C. W., VanderGheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102, 965-970 (2009).
- Ankenbauer, R. G., Nester, E. W. Sugar-mediated induction of Agrobacterium tumefaciens virulence genes: structural specificity and activities of monosaccharides. Journal of Bacteriology. 172, 6442-6446 (1990).
- Cangelosi, G. A., Ankenbauer, R. G., Nester, E. W. Sugars induce the Agrobacterium virulence genes through a periplasmic binding protein and a transmembrane signal protein. Proceedings of the National Academy of Sciences of the United States of America. 87, 6708-6712 (1990).
- Stachel, S. E., Nester, E. W., Zambryski, P. C. A plant cell factor induces Agrobacterium tumefaciens vir gene expression. Proceedings of the National Academy of Sciences of the United States of America. 83, 379-383 (1986).
- Rogowsky, P. M., Close, T. J., Chimera, J. A., Shaw, J. J., Kado, C. I. Regulation of the vir genes of Agrobacterium tumefaciens plasmid pTiC58. Journal of Bacteriology. 169, 5101-5112 (1987).
- Hiei, Y., Ohta, S., Komari, T., Kumashiro, T. Efficient transformation of rice (Oryza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA. Plant Journal. 6, 271-282 (1994).
- Vander Hoorn, J. A. L., Laurent, F., Roth, R., De Wit, P. J. G. M. Agroinfiltration is a versatile tool that facilitates comparative analyses of Avr9/cf-9-induced and Avr4/Cf-4-induced necrosis. Molecular Plant-Microbe Interactions. 13, 439-446 (2000).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assay of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3, 259-273 (2005).
- Salmond, G. P. C. Secretion of extracellular virulence factors by plant pathogenic bacteria. Annual Review of Phytopathology. 32, 181-200 (1994).
- Felix, G., Duran, J. D., Volko, S., Boller, T. Plants have a sensitive perception system for the most conserved domain of bacterial flagellin. Plant Journal. 18, 265-276 (1999).
- Goodner, B., Hinkle, G., et al. Genome sequence of the plant pathogen and biotechnology agent Agrobacterium tumefaciens C58. Science. 294, 2323-2328 (2001).
- Lee, Y. -. W., Jin, S., Sims, W. -. S., Nester, E. W. Genetic evidence for direct sensing of phenolic compounds by the vir A protein of Agrobacterium tumefaciens. Proceedings of the National Academy of Sciences of the United States of America. 92, 12245-12249 (1995).
- Voinnet, O., Pinto, Y. M., Baulcombe, D. C. Suppression of gene silencing: a general strategy used by diverse DNA and RNA viruses. Proceedings of the National Academy of Sciences of the United States of America. 96, 14147-14152 (1999).
- Voinnet, O. RNA silencing as a plant immune system against viruses. Trends in Genetics. 17, 449-459 (2001).
- Ding, X. S., Liu, J., et al. The Tobacco mosaic virus 126-kDa protein associated with virus replication and movement suppresses RNA silencing. Molecular Plant-Microbe Interactions. 17, 583-592 (2004).
- Harries, P. A., Palanichelvam, K., Bhat, S., Nelson, R. S. Tobacco mosaic virus 126-kDa protein increases the susceptibility of Nicotiana tabacum to other viruses and its dosage affects virus-induced gene silencing. Molecular Plant-Microbe Interactions. 21, 1539-1548 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon