Method Article
行動するミツバチの二つの神経の処理段階での同時長期レコーディング
要約
2異なる脳neuropilesまたは2つの異なる解剖学的管から同時に細胞外の長期的な記録は、ミツバチに設立された。これらの録音は、単一のニューロンでだけでなく、行動する動物でのアンサンブルのレベルで異なる脳領域間での神経処理の時間的な側面の調査を可能にする。
要約
哺乳類や昆虫の両方における神経情報が異なる上位と下位の脳センターで処理されます。これらのセンターは、収束し、フィードフォワードおよびフィードバック配線を含む発散解剖学的な接続を介して接続されている。さらに、同じ起源の情報が部分的に異なる、時には同じ脳の領域へと並列経路を介して送信されます。これらの配線戦略、特にお互いに自分の時間的依存関係の進化の恩恵だけでなく、計算上の利点を理解するためには、高い時間分解能で同じ準備で別の管またはneuropilesの単一ニューロンへの同時アクセスを持っていることが必要である。ここでは、2以降のneuropiles 1、触角葉(AL)は、まず嗅覚処理段階とキノコ体(MB)、高次の統合センターINVOでマルチユニット活動を記録するためにユニークな細胞外の長期的なアクセスを実証することによってミツバチに集中学習および記憶形成、又はMBとALを接続する2つの平行な神経管2にLVED。後者の例として選択した、完全に説明される。支持ビデオフレキシブルマルチチャンネルワイヤ電極の構成と永久挿入が実証される。マイクロワイヤ電極チャネルの対の差動増幅を大幅にノイズを低減し、信号源は、電極先端の位置と密接に関連していることを検証する。使用するワイヤ電極の機械的柔軟性は、従来の余分およびin vivo記録技術における細胞内に比べて明らかな利点である、日まで多くの時間にわたって安定した侵略的な長期的な録音を可能にする。
概要
ミツバチだけでなく、他のほとんどの昆虫は重く嗅覚に依存しています。とりわけ彼らは向き、交尾、同種との通信、および採餌のための嗅覚を使用しています。そのほかには、嗅覚系を精緻フローラルの匂い刺激に関連した行動を学習するの豊かなレパートリーに貢献しています。 (5 -口コミ3を参照)これらの動作は容易に制御された実験条件下で研究することができる。彼らの"ミニ頭脳」(cp. 6)神経細胞の比較的小さな数字でミツバチ神経活動の監視中に嗅覚コーディングや学習を研究するのに適したモデル生物になります。
昆虫だけでなく、哺乳動物の嗅覚系は、(レビューのために7,8を参照)を大幅に類似の組織を示している。ミツバチにアンテナ10,11に沿ってsensillaeに位置し約80,000受容ニューロン9は neurに環境匂い刺激を翻訳onal信号。嗅覚受容ニューロンからの軸索は、脊椎動物の嗅球に匹敵する糸球体の組織を持っている触角葉(Al)を、支配する。 ALは、約4,000局所介在ニューロン(LN) によって相互に接続約164の糸球体を含む(総説については12を参照されたい)。特にミツバチでは、LNSは斑状の横方向の接続を提供し、異なる部分集団は、元素及びconfigural嗅覚符号13,14性質を有することがことが最近示された。 ALは、内側と外側触角葉管(m-及びL-ALTを生じさせる腹と背側半葉に細分されることが示された。以前はm-および内側 - と横触角葉のprotocerebral用L-APTと呼ばれる管内15から17)。ここでは昆虫の脳の統一命名法のための最近の努力によって導入された新しい道の専門用語は、18を使用します。両方のALTは(L-およびM-ALT)410(L-ALT)、または510(M-ALT)uniglomerular projeいずれかを組み合わせてctionニューロン(PN)、それぞれ15,16,19。両方の管のPNには、最近(レビューのために17,20参照 )、平行2のコードの臭いに示されており、両方の管は、シナプスケニヨン細胞(KC)、キノコ体(MB)は、プリンシパルニューロンと発散接続を形成する。 23 -各MBは約172,000 KCの21が含まれています。 MBは、刺激の統合、学習、および記憶形成に関与することが知られている。のVerticaまたはα-ローブと水平またはベータローブ22,24:KCののAXOの樹状突起は、主に2つの出力領域を有し、花柄(キノコの茎)を形成する。 MBの出力は、約400外因性ニューロン(JA)24に収束する。嗅覚の情報処理を担当するが、ほとんど垂直のローブ22の腹側面を支配するENS。最近では、この領域に記録されたENには、臭気報酬の関連付け25をコードすることが示されている。
としての時間的29 -昆虫だけでなく、脊椎動物の嗅覚系内pectsは、潜在的なコーディングの原則26のような重要かつ重要な側面となっている。同時に、高時間分解能での異なるサイトから複数のニューロンを記録することができるために、我々は蜂の嗅覚系で異なる標的領域に導入され、カスタマイズされたマルチチャンネルワイヤ電極を用いた二重マルチユニット記録技術を確立しました。このアプローチは、単一のニューロンと、パラレル嗅覚経路、デュアル嗅覚経路2または別のその後のneuropils 1間の神経細胞の集団のレベルでミツバチの嗅覚系で時間的処理を分析し、比較することを可能にします。最近、電極の異なる構成を使用して、ローカスト嗅覚系30で同様の実験的なアプローチを背景不変の臭気認識31のための時空間コード化メカニズムを解析することができました。目当方、確立されたデュアル録音が同時に神経活動プロファイルに関する空間情報を収集できます。
カルシウムイメージングから得た広い空間サンプリングに比べてこの方法は、2スポットから録音することができます。しかしながら、カルシウムイメージング技術と比較して利点は、従来のCCD撮像又は2光子イメージング取得のいずれかによって提供することができない活動電位の記録の高い時間精度である。ここで説明する細胞外電極は、恒久的に移植された電極のドリフトを回避し、脳や頭部カプセルと比較して固定されている。これはシャープな細胞内の電極の使用量に比べて明らかな利点である。細胞内記録とカルシウムイメージングと比較したもう一つの利点は、何時間から日までの範囲の拡張、神経観測時間である。これは、学習と記憶形成の神経相関を調査するための重要な前提条件である。マルチのその他の利点単位記録はさらなる議論の項に概説されています。
この方法論の概要では、カスタム設計ワイヤ電極の製造手順は、32,33とミツバチの脳内の長期的なマルチユニットレコーディングに適してから適応、表示されます。さらに、これらのタイプの電極が永久的に多くの刺激プロトコルを可能にするために長期間にわたって同時にL-及びm-ALTを記録するためにミツバチ嗅覚系内の2つの異なる記録部位に注入する方法の一例が示されている2。記録位置の確認のために記録部位の染色後の記録可視化のための例とプロトコルを提供する。
プロトコル
1。電極の構築(図1)
- 商業用多チャンネルアンプシステム1,2,25の電極インターフェースボードに合う電極アダプタの製造。
- 18ピンコネクタベースに接着小さなプレキシガラスのプレートを使用してください。
- プレキシガラス板にネジ止め3の別々のはんだ付けラグへの絶縁電線の3短い断片( 図1 A1〜A3)とベースを接続します。
- ガラスキャピラリを簡単に移動することができ、ネジで所定の位置に保持することがここでプレキシプレートに溝( 図1 B1)を挿入します。
- minutienピンを使用して5ミリメートル程度ガラスキャピラリーを拡張します。
- 安定化とサポートを保証するminutienピンとガラスキャピラリーに沿って微細電極ワイヤを取り付けます。
- マルチチャンネルマイクロワイヤー生産(Ryuichy岡田32,33から採用)
- スパン3マイクロワイヤ(ポリウレタンコーティングされた銅線、15それらは互いに隣り合って配置されているような方法( 図1のB2)中のミクロン直径)。
- (電極先端)( 図1、B3)、それらを一緒に接着する部分の配線に沿って低融点歯科用ワックスの薄膜(50°C)を広めるために12 Vのはんだ付けの針を使用してください。このセクションでは、電極アダプタとマイクロワイヤを接続するために後で使用されるように、気が動転数センチ(電極端)のまま。
- マルチチャンネルマイクロワイヤーは、電極アダプタに接続する
- ホルダーからガラスキャピラリを取り外し、電極先端にminutienピンで固定して下さい。マイクロ電極(Figure1のB3)に平行な位置にそれを持って来る。
- 低融点歯科用ワックスを使用してminutienピンに電極チップを接着し、(小さ な矢印が1 B3図 )minutienピンからと電極端で2〜3センチ突き出し、先端に微小電極をカット。
- キャピラリーSLスリップightly裏面電極アダプタに。 ( 図1〜B4)、それを修正するためにネジを使用してください。
- 断熱材( 図1、B4)の溶融を確実にするために周りに360℃の温度ではんだ付けガンを用いて、はんだ付けラグに3線の緩い端を半田付けします。はんだ付けした後、十分な電気的接触(〜300オーム)があることを確認してください。
- ヘッドステージの電極インタフェースボードに電極(マスター)の1をマウントし、別々のアダプタの他のマルチチャネル電極(スレーブ)を固定します。マスター電極( 図1のC1)にスレーブのチャンネルに接続します。さらに、マスター電極ベースを参照するだけでなく、筋肉の電極(図1 C2)を半田付けします。
2。ビー準備(図2)
これらの記載された実験では、無脊椎動物の動物であるミツバチ( ミツバチ )したがって、使用のための具体的な倫理的な許可を必要としない、使用されています。
- 他人34,35によって示されるように、朝のハイブの入り口にミツバチ飼料収穫機(Aにミツバチ ) をキャッチします。
- 固定化(5から10分)まで砕いた氷の上でミツバチを冷却し、頭部が露出するようにします( 図2のA)で、標準的なプレキシグラスホルダーや金属管に1を修正。頭の動きを最小限に抑えるために低融点歯科用ワックス(〜50°C)を使用し、複眼や首の基礎を中心にホルダーに丁寧に頭を固定します。
- 鞭毛に触れることなく頭部カプセル( 図2のB)にアンテナのSCAPIを固定するために、低融点ワックスを使用してください。アンテナの鞭毛が前方指摘される必要がある。ミツバチが自由に口吻を動かすことができることを確認してください。
- 頭の上に邪魔されずに表示してアクセスを確保するために、頭部カプセルを剃る。
- saturatiまで、30%スクロース溶液で蜂フィード脳組織と動物のよい実行可能性( 図2のC)の十分な湿潤を確保するために。
- 垂直方向、水平方向複眼と触角拠点上だけでなく、単眼の下の境界線に沿って慎重に切開を行い、キューティクルの緩み個( 図2 D)を外します。
- 丁寧に下咽頭腺を取っておくと、クリアな視界と挿入( 図2E、2F)を電極に前脳へのアクセスを確保するため気管を削除します。
3。電極の挿入
図2に示す例の場合、一方の電極は、L-ALTは、m-ALT 2に照準他方を目指して配置されている。特定のランドマークを使用して、他の標的領域は、例えばALおよびMB出力領域1について、同様に可能である。
- (関心のある領域にマイクロマニピュレータを使用して電極を配置する図2Gおよび3A)。 M-頭の中の場所を内側MBの垂直葉からALとの間の電極を対象とする。内外側頭の中のPNの分岐点より上に挿入部位を確認してください。約180ミクロン( 図2E)の深さに脳内に電極を突出している。電極垂直ローブと、ALの真ん中の側面との間に仮想線の中央に横方向の大脳(LH)は、以下のL-ALTのPN記録場所のため。約300μm( 図2E)の深さに電極を挿入します
- キューティクルの小さなカットを通じて同複眼に参照(銀線、約25μm径)を挿入します。横単眼下の筋肉の投影領域内に別の銀線を挿入します。注:必要に応じて、ハチの学習動作は、私が関与している筋肉のM17を、記録することにより、高い時間精度で監視することができます25で説明したようにハチ36の口吻拡張応答(PER)をn個。
- しっかりと脳と頭部カプセル内の電極を固定するため、乾燥から脳を防ぐことができます2成分のシリコン( 図2H)で脳上記空間全体をカバーしています。注:録音は日 まで時間持続することができ、ミツバチは、たとえば古典的条件付け手順( 図2H)の間に記録され、異なる匂いの大きなパネルで刺激することができます。
4。データ収集と前処理
- 次の要件を満たす適切な収集ソフトウェアを使用します。分25 kHzでサンプリングレートを;アナログ1,25または電極チャンネル間のデジタル2クロス分化;バンドは、スパイクイベントを抽出するために、8000 Hzまで300Hzのからフィルタを通す。
- TEMPL例えば、単一のユニット活動を抽出するために使用可能なスパイクソーティングソフトウェアを使用Spike2ソフトウェア( 図3)に含まれるマッチング技術を食べた。
- さらなる分析のために( 図4)または主成分分析(PCA)のための集団ベクトルを算出する( 図5)は、市販のソフトウェアを用いて臭気応答を平均し、単一のユニットを計算するために、抽出された単位のタイムスタンプを使用する。さらに、単一のユニットと人口応答待ち時間を分析するために、最近の出版物1,2,25を比較してください。
5。相対電極位置の可視化(図4)
- 5%のいずれかの溶液に電極チップを浸しアレクサは、Alexaの記録前実験と0.5 M塩化カリウム溶液に溶解させた488ヒドラジド568または5%ヒドラジド。
- 実験の後、慎重に電極と覆うシリコンを外し、蜂リンゲル液で脳をすすぎ、腺や気管を取り外し、tetramethylrhodamiの小さな結晶を挿入するNデキストランまたは順行のALTにラベルを付けるために、ALに1.0Mの酢酸カリウムで解決5%溶液を挿入します。暗闇の中で次の手順を実行します。
- 色素が取り込まれ、別の30〜45分間蜂リンゲル液で3回脳を洗浄する前に、その軸索管(30〜45分)( 図4A)に沿って投射ニューロンにより輸送することができます。
- 固定化するまで氷上に蜂を冷却し、慎重に頭部カプセルから脳を削除します。 4%ホルムアルデヒドを含む0.1 M PBS溶液中ですすぐことによって脳を固定し、4℃で一晩それを維持
- 0.1のPBS(10分ごと)に脳を2回洗浄する前に、少なくとも12時間待ってください。
- (昇順アルコールシリーズで脱水する前に、トリトンX-100 0.1 M PBSで希釈した0.2%、30%、50%、70%、90%、95%、3×100%エタノール、20分間、20分間、脳の3回洗う各ステップ)。
- 顕微鏡スライドとSにサリチル酸メチルで脱水脳を埋め込むカバースライドでそれをEAL。
- 共焦点レーザー走査顕微鏡を使用し、高調波複合プランアポクロマート対物レンズ(10×0.4 NA液浸)を使用して、すべての2-5ミクロンの光学セクションとしての脳をスキャンします。 tetramethylrhodaminデキストランおよび電極位置のために488nmの波長に対して568 nmの波長を用いて組織を励起。
- 再構築ソフトウェアで3Dで画像スタックから染色された脳構造と電極の経路を再構築する( 例えば 。AMIRAやフィジー)( 図4)。
結果
「この議定書は、個々のミツバチ内の2つの異なる処理段階での同時録画を可能にし、さらに例えば経由で学習と記憶の基本的なメカニズムをテストすることができます。、拘束されたミツバチの中エアコンPER。 "これは、神経処理の時間的な側面を分析するための前提条件である。この方法は、蜂の嗅覚系の神経回路網を解明するために、異なる科学的アプローチのために容易に適応可能である。例えば、この方法は、ミツバチのデュアル嗅覚経路、L-及びm-ALTのPN( 図5)内のPNの一時的な処理を分析するために(i)が使用される。 図5Aに同時にM-ALTのPNで記録されたL-ALT PNの1例は10トライアル平均として与えられ、カラーコード化された熱プロットとして5異なる臭気濃度の点での応答の強さと待ち時間を示している。 11リットルと13ミリアンペアと7ミツバチの平均LTのPN( 図5B、5C)は 、応答の強度並びに反応潜時の両方が、ある程度まで、付臭剤濃度を反映していることを示している。増加の付臭剤濃度との反応潜時は( 図5B、5C)が減少しつつ、この例でのPNは、その応答の強さを増加させる。この結果は、かなり限られ、分析匂い物質に対してのみ有効ですが、それでも、AL 37の最近の計算モデルと一致している。ハチのALにおける臭気濃度符号化は非線形計算の基礎となる符号化または他の特性は依然として将来的に分析する必要が根底にあるかどうか。さらに、この方法は、(ii)の二つの連続処理段階、およびAL-MB-出力( 図6)で集団活動に時間的な側面を比較するために使用することができる。主成分分析(PCA)は、臭気計算が長くなることを示しており、一方、ENにおけるPNレベルでの全体の臭気プレゼンテーションを長持ちセットのオンとオフだけ臭気は人口活性( 図6)で表されていましたね。 PNの活動はまだ(cp. 動画1)を開発したとき、それによって、EN人口はの時点ですでに最大活性に達した。
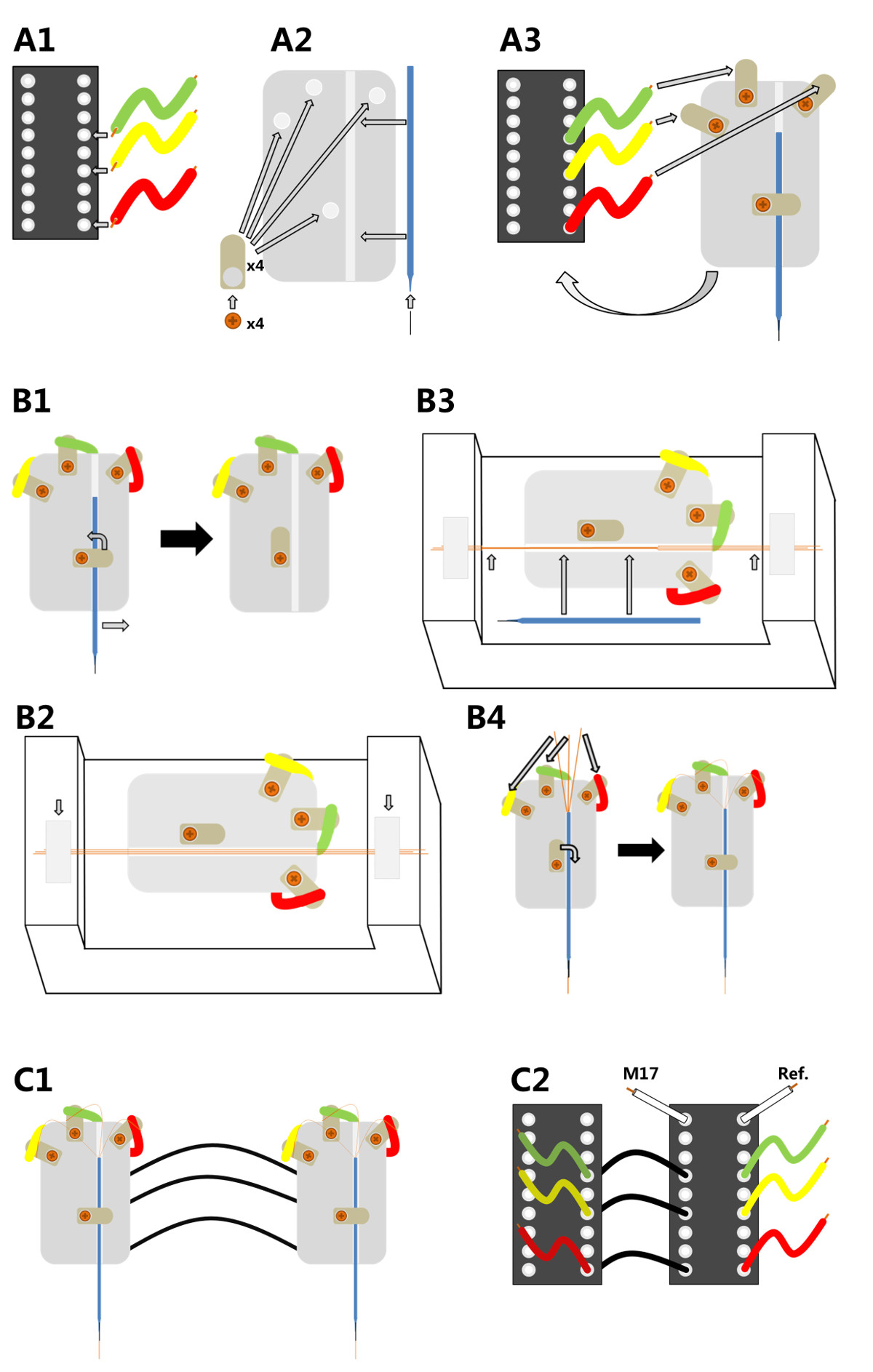
。。。図1 3チャンネルのマイクロワイヤ電極の製造A1)は、3つのワイヤの末端が位置11、13及び16におけるICピンコネクタに半田付けされているA2)フォーはんだラグは、プレキシガラス、プラスチック基板にねじ止めされ; minutienピンは、その後、プラスチック板に取り付けられたガラスキャピラリの先端に挿入される。A3)は、プラスチック板をICピンコネクタの上面に接着され、各ワイヤの自由端が上部はんだ付けの一方にはんだ付けされているラグ。 <細い銅線を電極ホルダを装備する強い> B1)は、毛細血管をもう一度取り出すことがあります。B2)ホルダーのベースは、カスタムで修正されているデバイスを揃えるた。三つ銅マイクロワイヤは、B3)平行マイクロワイヤは、歯科用ワックスと一緒に接着されており、キャピラリ場所(長い矢印)に戻され、各端部で溝に沿って整列し、粘着テープで固定されている; (短い矢印)が接着されたマイクロワイヤは、次いで、歯科用ワックスと毛細管に取り付けられ、その端部が切断される。B4)銅線の三緩い端部はと電気的に接触させること、従って3つのトップはんだラグに半田付けされているICピンコネクタC1)二つの完全に組み立てられた電極は、単一のヘッドステージで使用するために相互に接続することができる。C2)は、この目的のために、一方の電極(左、スレーブ)のピンは、右(他方の電極に絶縁電線を介して接続されているマスト)小胞体、ヘッドステージに接続されており;ヘッドステージ接続される電極はまた、筋肉(M17)および基準電極(参照)からの入力を収集することができる。
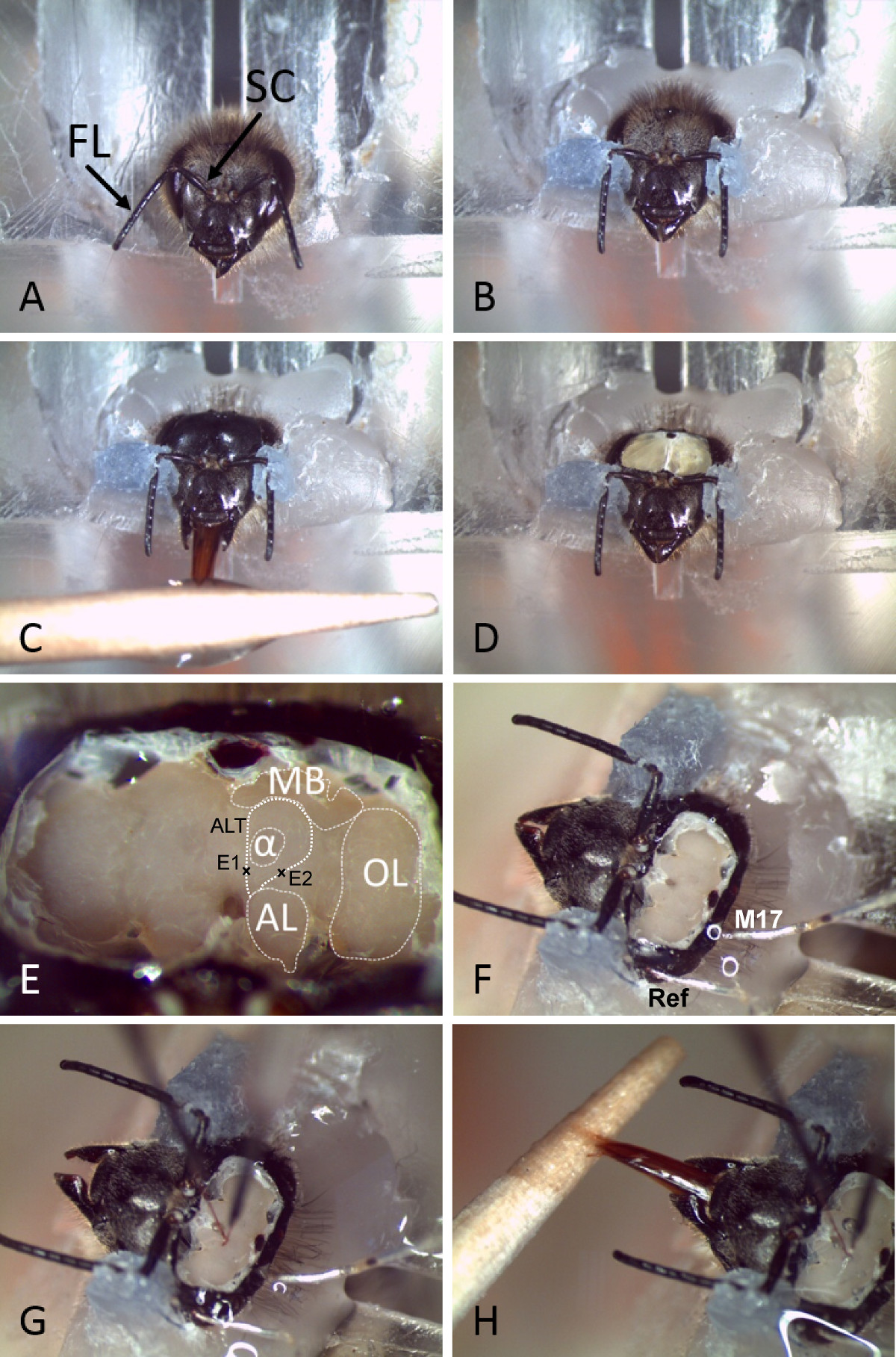
図2。準備とハチの脳内への永久電極挿入。A)蜂氷上で固定化後プレキシグラスホルダーに挿入されている。鞭毛(FL)とScapus(SC)とのアンテナ示されています。B)の頭や触角が歯科用ワックスを使用して固定されている。C)頭部カプセルを剃毛し、ハチは砂糖水が供給される。D)頭部カプセルを開いた。 E)は、脳の上部から腺および気管を除去した後、異なるneuropilesおよび主要なランドマークを容易に区別することができる。のALTの軌道は一緒に示されている電極が挿入されているマーク。 (MB:キノコ体、他:触角葉、OL:光葉、α:アルファローブまたは垂直葉、ALT:触角葉管、E1:M-頭の中の録音のための電極挿入側、E2:L-ALTのための電極挿入側録音)。F)リファレンス(REF)と筋肉の電極(M17)がキューティクルや複眼に少し穴に頭部カプセルに挿入されます。G)のワイヤ電極を適切な場所で脳内に挿入されます。H)した後、二成分シリコンを用いた所定の位置に電極を固定し、ミツバチが依然としてPERを示している( 例えば 、砂糖水を使用して)調整することができる。
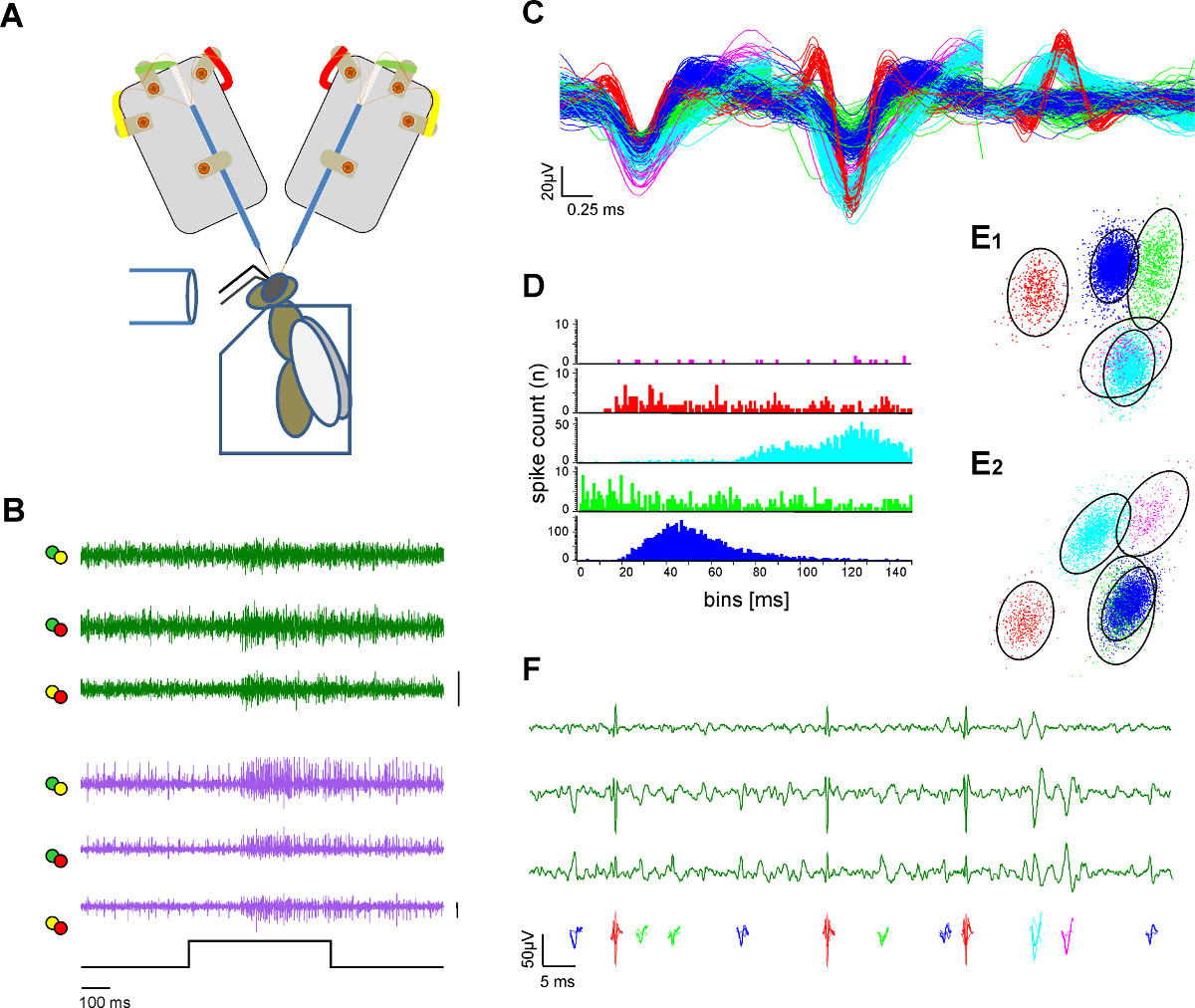
2神経管と単一のユニット抽出(スパイクソーティング)。Aの図3。細胞外記録 )模式図。ハチは、プレキシグラスホルダーに固定されている。匂い刺激は、ガラス管を介して提供される。二つの電極シャンクが露出蜂の脳から記録している。B)の濃度で水溶液中の蜂蜜の500ミリ匂い刺激に両方の管に興奮応答を示すL-およびm-ALTのPN(緑と紫のトレース)からの同時録音33℃での1:100スパイクは、単一活動電位がソートされ、色分けされている手順をソートした後)50μVC:それぞれがAのバー内の電極のはんだ付けラグから色分けされたラベルと区別チャンネルを表す線をプロットした。ソートされたユニットのオーバーレイは波形の分離を示しています。D)のスパイク間隔ヒストグラムは、適切なスパイクソーティングの証としてソートユニットの分離品質を示しています。ユニットの耐火期間内にスパイクが存在しないことに注意してください。E)に 2つのビュー(E1、E2)から互いにソート単位の距離を示している主成分分析とソート部の3次元クラスタリング。円はカラーコード化されたユニットが1管内記録から3チャンネルの倍率で見える活動電位を示している)空間で、SDに似ており、主成分空間Fのクラスタの重要な差別化を示し、2.5倍マハラノビス距離を示す。 こちらをクリックしてくださいこの図の拡大版を表示します。

図4。記録後の可視化と記録位置の3次元再構成。前外側の最大強度の位置合わせで、Z軸に沿ってオルソスライスのA)の投影図とMBおよびLHに対するAlから突出uniglomerular投射ニューロンの逆行埋め戻し。細胞内のトレーサーMicroruby(tetramethylrhodaminデキストラン)を記録実験の後、ALに挿入した。アレクサとの2つの電極の染色から最大強度の位置合わせで、Z軸に沿ったオルトスライスのAL証明適切PN染色。B)は投影図の内部ステンド糸球体は、M-ALT(E1、矢印の電極配置を示す488ヒドラジド)およびl-ALT(E2、矢印)。トレーサーアレクサヒドラジド488は、周囲の組織電極に移動し、電極挿入部位を染色する。注、アラバマ州の著名な染色は表面的な加工品である。C)染色された標的細胞の3次元再構成(PNS)と、A、B(右側から電極挿入部位)を一緒にミツバチの嗅覚システムの概略図と(左L-およびm-ALT軌跡の表示のある側)。唯一uniglomer、注意してくださいウラルのPN管が示されている。 :触角神経、他:触角葉、LH:横ホーン、MB:キノコ体、E1、E2:電極挿入部位、M-ALT:内側触角葉管、L-ALT:横触角葉管、C:尾、 R:吻側、M:中間、L:横この図の拡大版を表示するには、こちらをクリックしてください。

図5。デュアル嗅覚経路内の臭気濃度符号化の例。A)熱プロットは、単一のL-ALT(緑)の応答を示しており、単一のM-ALT PN(紫)は匂い物質に反応して、個々のミツバチから同時に取得臭気濃度の増加にヘキサナール(1から1:100まで10 -6)。各行は10トライアルSTIMの平均であるulation。発火率は差し引か自発的活動に関連して発火率である相対強度の変化として示されている。B)7を記録ミツバチから11リットルと13メートル、頭の中のPNの人口反応潜時。各ハチの両方で管からのPNを同時に記録した。集団応答待ち時間は、両方の管からPNの内の臭気濃度の増加と共に減少する待ち時間を示す。 99ミリ秒でのアンテナの匂い応答開始はelectroantennogramsを経由して記録し、PN応答待ち時間から差し引かれる。最低濃度応答での待ち時間の測定のために余りに弱く、そのため、除外された。Cに注意してください)人口は、応答の強さが増加している臭気濃度が増加すると、Bの場合と同様のPNから発火率の応答。 L-ALTは強い応答の強さを示しています。 Bにおいては、Cの平均およびSDを示す。

図6ミツバチの嗅覚経路に沿って二次の処理段階における人口活性を比較するデータは、1 -ヘキサノール、2 -オクタノンで刺激した20匹の動物で記録した。A)各行が一つの突起の偽色コード化された平均発火率を表す。 1 - ヘキサノール10臭い反復にわたって計算されたニューロン(PN)。臭気のプレゼンテーションは、時間0から始まり、3秒間続いた。、B、A)と同様に同じ番組)が、キノコ体外因性ニューロン(JA)のために。 Aに示すマトリクス)を、1 - ヘキサノールによる匂い刺激中のPN集団ベクトルと見なすことができる。我々は、2 -オクタノンで匂い刺激中に集団ベクトルの同じ種類を計算し、時間次元を維持する主成分分析(PCA)における両方のベクターを使用した。C)最初の3つの主成分(PC1、2および3)であった触角葉出力に、PNアンサンブル活動の臭気の分離を説明するために、互いに対してプロット。匂いの発症までの時間は黒でマークされています。 1 - ヘキサノールを用いた刺激の3秒の間に活性が青色で表示されている。 2 - オクタノールによる刺激時の活動は、赤で表示されている。さらに、我々は1 - ヘキサノールのセット(水色)と2 - octanonen(ピンク)の匂いの後に活動の1.5秒(ポスト)を示す。 PNアンサンブルのレベルで、非常に明確な軌道を想起させる、両方の匂いが「定点」長持ち全体匂い刺激期間に定住ことに注意してください。臭気がオフセットした後にのみ軌道が匂い刺激せずに、バックベースラインの活動に移行します。D)と同じ分析はキノコ体の出力でのアクティビティを表すENアンサンブルのレベルで行われていた。 PN活性と比較臭気が少なく明確な軌道を呼び起こす。さらに「固定点」観測できない。最初は匂い誘起軌道INTE臭気はまだ存在するが、ベースライン活性にrmingle。オフセットだけ臭いは、追加の軌跡を誘発。
映画の1。時間PN-人口ベクトル(左)とEN人口ベクトルの主成分分析後に軌道を誘発され、臭気の評価、解決、アッパー部分は最初の3つの主要コンポーネント(PC1が含まれる(右図6 CPを。)。図2及び図3)は、互いに対してプロットした。下のパネルは、経時的にPC1、2,3の評価を示す。匂い刺激は灰色のバーでマークされている。すべてのパネルが同期された。 contraintuitiveのようですが、それ以前の1で議論されて含まれる層の接続性と特性によって説明できる現象は、ENの人口の活動は、PNの人口アクティビティの前にわずかに始まることに注意してください。
ディスカッション
この記事では、カスタム設計されたマルチチャンネルマイクロワイヤ電極の製造および使用方法を示しています。記載された電極は、単一のユニットと(詳細は1,2,25を参照)、単一の試料内での待ち時間の測定値と異なるニューロンと異なるneuropilsの他の時間応答特性のために特に便利です人口活性の両方を記録するのに適している。さらに我々は永久に日まで時間持続ミツバチの振る舞いに、安定した長期的な録音を可能にするために、マイクロワイヤ電極を実装する方法が示されている。
細胞外のマルチユニット記録は、空間情報と組み合わせ、高い時間分解能を達成するための有利なツールとなりました。我々の場合において、これらの神経路は、平行又は2つの異なるneuropils 1のいずれかである。複数のニューロンが並列に単一ニューロンレベルで、高時間分解能で記録し、分析することができる。マルチユニット記録41 -イングスは、最初の昆虫39に、後に哺乳類38で適用された。実質的な進展は、細胞外多チャンネル記録技術42,43の開発·改良を達成した。これは、例えば、新たな電極44または新規のスパイク45を選別し、クラスタリングアルゴリズムの開発を含む。 48 -細胞外多単位記録技術の一般的な方法は、46に記載されている。この動画に示される自己内蔵の電極は、さらに、電極あたりのマイクロワイヤを追加することによって適合させることができる、マイクロワイヤは、先端の間の測定可能な一定の距離を得るためにねじられ得る。両方の手順は、しかし、柔軟性が低下し、電極の厚さの増加につながる。
一般的にスズメガ、イナゴやゴキブリ40,49のようなはるかに大きな昆虫細胞外記録用に使用されるシリコンプローブに比べて- 51記載のマイクロワイヤ電極は、可撓性小さく、潜在的な脳の動きに容易に対応でき、従って、確実にはるかに広い行動レパートリーを示すミツバチやアリのような小さな社会性昆虫で使用することができる。記載されたマイクロワイヤは、ラウンド柔軟で小さく、目標は長く勉強している場合は明らかな利点で、周囲の組織への、したがって害が少ないながら、ほとんどのシリコンプローブは、その挿通チャンネルに沿って軸索と神経組織を切断する構造のような鋭いシャンクを持っている無傷で行動する動物での短期可塑性。マイクロワイヤ電極の別の利点は、その低コスト製造及び取り扱いが容易である。代わりに、慎重に高価なシリコーンプローブを洗浄の電極線を新たに、したがって、輻輳の欠如の問題を前に、脳への挿入および切断される。さらに、それはどちらか異なるneuropiles 1○内に挿入同じ製剤内の複数のマイクロワイヤ電極を使用することが可能であるRトラクト2我々はここに示したよう。このアプローチは、異なる神経処理レベルでの応答潜時との相互作用のような時間的な側面を分析し、比較することが特に有利である。
我々は細胞外記録された信号は、 それ自体が一つの細胞活性を反映していないという事実を認識しています。それは、常に電極チップの周りの電圧活性の化合物である。信号源を特定するために、一方の電極内で隣接する二つのマイクロワイヤーチャネルの差が常に計算されます。このように単一ユニット活動を抽出するために使用されるスパイク信号のソースは、常に1つまたは容易に識別可能なスパイク波形が得られる他の電極チャネルのいずれかに非常に近かった。遠くからの信号は、近隣neuropilsの筋活動や活動のように、比較可能な形や振幅を想起させると同時に、両方の電極に到達し、この手順によって破棄されます。 Spike2のテンプレートマッチング技術を用いて、私たちは同じではありません、単一のユニット活動を得るために非常に自信を持って、単一ニューロン活動に非常に近い。しかし、スパイクソーティングの問題は、細胞内記録技術を用いることによって回避することができる。
鋭い電極やパッチピペットのいずれかでの単一細胞記録は、単一のニューロンの生理学的特性についての徹底的な知識を許す。しかし、昆虫の神経細胞とその神経突起の小さなサイズ( 例えば 。ミツバチのために、1μm未満のPN 52)のみ短期録音を管理可能である。さらに、内細胞の録音は侵襲的かもしれませんし、場合によっては時間的な制限のためのもう一つの理由である細胞に害を与える可能性があります。昆虫におけるin vivo細胞内記録はほとんど1時間を長持ちしない。シングルに識別ニューロン、腹側の不対maxilarニューロン#1(VUMmx1)からの細胞内記録マーティンハンマー53の先駆的な仕事のために十分であった時間ウィンドウ。彼はLでし報酬経路に直接インクをその活性を。アーネMauelshagen 54が細胞内に特定されキノコ体の外因性ニューロンの活性を登録して、古典的条件の間に茎外因性ニューロン#1(PE1)。彼らはケニヨン細胞の電気刺激後にLTPを見つけたとき、同じニューロンはメンツェルとマンツ55の焦点が合っていた。しかし、岡田ら56は、細胞外記録中のPE1の識別のために、細胞内で十分に特徴付けられたスパイクパターン(ダブル、トリプルスパイク)を使用することができます。両方の方法の全てを組み合わせた後、特定されたニューロンおよび細胞外の長期的な記録から細胞内記録は、将来の調査のための強力なツールになるかもしれません。
しかし、私は彼らの時間応答の関係を分析するために日までに何時間かけて異なる処理レベルで同時に複数のセル(単位)を記録するために鋭利な電極を使用して、および/あるいはプラスチックの変更ほとんど不可能だ。
62 -最初のカルシウムイメージングは、カルシウム感受性色素を用いたミツバチ57,58に近付くと匂い応答の空間パターンの分析は、59アクセス可能だった。しかしながら、多くの場合、カルシウム感受性色素は、再度ハチの寿命と分析された細胞の固有の特性を制限侵襲的な操作を介して脳組織に導入しなければならない。この問題は、遺伝的に導入されたカルシウムセンサー63,64を使用してショウジョウバエのような他のモデル生物で克服される。それらはおそらく匂い応答の時間的な特性に影響を与えるカルシウムバッファとして作用することができるように、しかし、一般的に、カルシウムセンサは、他の制限を導入することができる。カルシウムイメージングまたは計算の手法と組み合わせて同時細胞内記録は、画像の適切な時間分解能が65,66を処理することを証明することができます。しかし、画像処理自体の時間分解能は、早咲きのですR限られた。 2光子イメージングは、より高速なシーケンス68を取得することができるかもしれませんが、光収集システムは、通常は、5月20日Hzの67の時間分解能で、CCDイメージングを使用しています。しかし、増加のサンプリングレートは常に空間分解能の損失と一緒に行く。さらにミツバチで使用されるカルシウム感受性染料も取得時間69を減少させ、漂白を受ける。
昆虫における他の生理学的記録技術と比較して、当社の柔軟なマルチチャンネルマイクロワイヤ電極は、単一のユニットと蜂を振る舞うの人口神経活動への長時間アクセスを確保。
我々は、異なる記録部位間の時間的符号化態様の分析を容易に同じ動物において、異なる処理段階で、これらの2つの電極を使用する方法を実証した。ここで示す電極の建物の基本的な方法昆虫研究課題とモデルに依存して、簡単に拡張されているできるおよび/または適合させることができる。例えば、それはマルチチャネル電極を製造するために3つの単一ワイヤよりも多くを使用することが考えられる。また、記録部位の数は拡張され、二つ以上の管またはneuropilsの時間的局面を観察することが可能であることができる。私たちの願いは、この方法は多くの科学者を鼓舞し、小さな脳で洗練された神経細胞の処理の理解に積極的に貢献することである。
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
The authors would like to thank Isabelle Reus for establishment of tracing the electrode insertion side, Tobias Rosenbaum for LabView programming, Anneke Meyer for data analyzes and helpful discussions. We thank Randolf Menzel for discussion and practical help during early stage of electrode development. Furthermore we thank Brian Smith for postdoctoral association to MS-B. This work was supported by the Deutsche Forschungsgemeinschaft (DFG, SPP 1392, Ro1177/5-2) to WR.
資料
| Name | Company | Catalog Number | Comments |
| Paraffin oil | Fluka | 76235 | |
| Odors | Sigma Aldrich | ||
| PBS | pH 7.2 | ||
| 4% Formaldehyde | ThermoScientific | 28908 | Methanol free |
| Triton X | BioChemica | A1388 | |
| Methylsalicylate | Roth | 4529.1 | |
| Tetramethylrhodamin dextran, 10,000 MW (Microruby) | Invitrogen | D7162 | keep dark |
| Alexa 488 hydrazide | Invitrogen | A-10436 | keep dark |
| Alexa 568 hydrazide | Invitrogen | A-10437 | keep dark |
| Bee Ringer Solution | see 2 | ||
| Polyurethane-coated copper wire | Elektrisola | 15µm diameter & P155 insulation | |
| Dental Wax | Densply Detrey | 64103015S1 | moderate melting point |
| Dental Wax | Flexaponal | 124-202-00 | low-melting Wax |
| KWIK SIl | WPI | 03L | |
| 18 Pin Socket | Conrad Electronic | 189634-62 | |
| Hot melting glue | Conrad Electronic | 827673 | |
| soldering needle | Conrad Electronics | 830283 | 12 V |
| Soldering terminal lug | Conrad Electronic | 531901 | |
| Glaselectrodes | WPI | 1B100F-3 | |
| Minutien Pins | Fine Science Tools | 26002-20 | V2A 0.2 x 12 mm |
| switchable headstage | Tucer Davis Technologies | SH16 | |
| Headstage connection module | NPI | INT-03M | |
| Amplifier Module | NPI | PDA-2F | |
| Data Acquisition boards | National Instruments | NI-6123, Ni-6143 | |
| Acquisition Software | National Instruments | Lab View 8.2 | custom design |
| Spike-Sorting | CED | Spike 2 v7.11 | |
| Matlab | Mathworks | R2008B | |
| Micromanipulator | Leitz | manual | |
| AG-wires | WPI | AGT05100 | |
| Confocal laser scanning microscope | Leica | TCS SP2 AOBS | |
| AMIRA | Mercury Computer Systems | 2/5/2000 |
参考文献
- Strube-Bloss, M. F., Herrera-Valdez, M. a., Smith, B. H. Ensemble response in mushroom body output neurons of the honey bee outpaces spatiotemporal odor processing two synapses earlier in the antennal lobe. PLoS ONE. 7 (11), (2012).
- Brill, M. F., Rosenbaum, T., Reus, I., Kleineidam, C. J., Nawrot, M. P., Rössler, W. Parallel processing via a dual olfactory pathway in the honeybee. The Journal of neuroscience the official journal of the Society for Neuroscience. 33 (6), 2443-2456 (2013).
- Menzel, R. The honeybee as a model for understanding the basis of cognition. Nature Reviews Neuroscience. 13 (11), 758-768 (2012).
- Sandoz, J. Behavioral and neurophysiological study of olfactory perception and learning in honeybees. Frontiers in Systems Neuroscience. 5, (2011).
- Giurfa, M. Cognition with few neurons: higher-order learning in insects. Trends in Neurosciences. 36 (5), 1-10 (2013).
- Menzel, R., Giurfa, M. Cognitive architecture of a mini-brain: the honeybee. Trends in cognitive sciences. 5 (2), 62-71 (2001).
- Hildebrand, J. G., Shepherd, G. M. Mechanisms of olfactory discrimination: converging evidence for common principles across phyla. Annual Review of Neuroscience. 20, 595-631 (1997).
- Wilson, R. I., Mainen, Z. F. Early events in olfactory processing. Annu. Rev. Neurosci. 29, 163-201 (2006).
- Streinzer, M., Kelber, C., Pfabigan, S., Kleineidam, C. J., Spaethe, J. Sexual dimorphism in the olfactory system of a solitary and a eusocial bee species. The Journal of comparative neurology. 521 (12), (2013).
- Nishino, H., Nishikawa, M., Mizunami, M., Yokohari, F. Functional and topographic segregation of glomeruli revealed by local staining of antennal sensory neurons in the honeybee Apis mellifera. The Journal of comparative neurology. 515 (2), 161-180 (2009).
- Schneider, D. Elektrophysiologische Untersuchungen von Chemo- und Mechanorezeptoren der Antenne des Seidenspinners Bombyx mori L. Zeitschrift für Vergleichende Physiologie. 40 (1), 8-41 (1957).
- Menzel, R., Rybak, J. Antennal lobe of the honeybee. Handbook of brain microcircuits. , 427-432 (2011).
- Girardin, C. C., Kreissl, S., Galizia, C. G. Inhibitory connections in the honeybee antennal lobe are spatially patchy. Journal of neurophysiology. 109 (2), 332-343 (2013).
- Meyer, A., Galizia, C. G. Elemental and configural olfactory coding by antennal lobe neurons of the honeybee (Apis mellifera). Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral. 198 (2), 159-171 (2012).
- Abel, R., Rybak, J., Menzel, R. Structure and response patterns of olfactory interneurons in the honeybee, Apis mellifera. The Journal of comparative neurology. 437 (3), 363-383 (2001).
- Kirschner, S., Kleineidam, C. J., Zube, C., Rybak, J., Grünewald, B., Rössler, W. Dual olfactory pathway in the honeybee, Apis mellifera. The Journal of comparative neurology. 499 (6), 933-952 (2006).
- Galizia, C. G., Rössler, W. Parallel olfactory systems in insects: anatomy and function. Annual review of entomology. 55 (August), 399-420 .
- Ito, K., Shinomiya, K., et al. A coordinated nomenclature system for the insect brain. Neuron. 81 (4), 755-765 (2014).
- Rybak, J. The digital honey bee brain atlas. Honeybee Neurobiology and Behavior. , 125-140 (2012).
- Rössler, W., Brill, M. F. Parallel processing in the honeybee olfactory pathway: structure, function, and evolution. Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral. 199 (11), (2013).
- Mobbs, P. The brain of the honeybee Apis mellifera. I. The connections and spatial organization of the mushroom bodies. Philosophical transactions of the Royal Society of London. Series B, Biological. 298 (1091), 309-354 (1982).
- Strausfeld, N. J. Organization of the honey bee mushroom body: representation of the calyx within the vertical and gamma lobes. The Journal of comparative neurology. 450 (1), 4-33 (2002).
- Witthöft, W. Absolute Anzahl und Verteilung der Zellen im Hirn der Honigbiene. Zeitschrift für Morphologie der Tiere. 61 (1), 160-184 (1967).
- Rybak, J., Menzel, R. Anatomy of the mushroom bodies in the honey bee brain: the neuronal connections of the alpha-lobe. The Journal of Comparative Neurology. 465, 444-465 (1993).
- Strube-Bloss, M. F., Nawrot, M. P., Menzel, R. Mushroom body output neurons encode odor-reward associations. The Journal of neuroscience : the official journal of the Society for Neuroscience. (8), 3129-3140 (2011).
- Haddad, R., Lanjuin, A., Madisen, L., Zeng, H., Murthy, V. N., Uchida, N. Olfactory cortical neurons read out a relative time code in the olfactory bulb. Nature neuroscience. (May), 1-11 (2013).
- Martin, J. P., Beyerlein, A., et al. The neurobiology of insect olfaction: Sensory processing in a comparative context. Progress in neurobiology. 95 (3), 427-447 (2011).
- Nawrot, M. P. Dynamics of sensory processing in the dual olfactory pathway of the honeybee. Apidologie. 43 (3), 269-291 (2012).
- Farkhooi, F., Froese, A., Muller, E., Menzel, R., Nawrot, M. P. Cellular adaptation facilitates sparse and reliable coding in sensory pathways. PLoS computational biology. 9 (10), e1003251 (2013).
- Saha, D., Leong, K., Katta, N., Raman, B. Multi-unit recording methods to characterize neural activity in the locust (Schistocerca americana) olfactory circuits. Journal of visualized experiments JoVE. (71), (2013).
- Saha, D., Leong, K., Li, C., Peterson, S., Siegel, G., Raman, B. A spatiotemporal coding mechanism for background-invariant odor recognition. Nature neuroscience. 16 (12), 1-13 (2013).
- Mizunami, M., Okada, R., Li, Y., Strausfeld, N. J. Mushroom Bodies of the Cockroach Activity and Identities of Neurons. Journal of Comparative Neurology. 519 (July), 501-519 (1998).
- Okada, R., Ikeda, J., Mizunami, M. Sensory responses and movement-related activities in extrinsic neurons of the cockroach mushroom bodies. Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 185 (2), 115-129 (1999).
- Haehnel, M., Froese, A., Menzel, R. In vivo Ca2+ imaging of mushroom body neurons during olfactory learning in the honey bee. Journal of visualized experiments JoVE. (30), (2009).
- Felsenberg, J., Gehring, K. B., Antemann, V., Eisenhardt, D. Behavioural pharmacology in classical conditioning of the proboscis extension response in honeybees (Apis mellifera). Journal of visualized experiments JoVE. (47), (2011).
- Rehder, V. Quantification of the honeybee’s proboscis reflex by electromyographic recordings. Journal of Insect Physiology. 33 (7), 501-507 (1987).
- Serrano, E., Nowotny, T., Levi, R., Smith, B. H., Huerta, R. Gain control network conditions in early sensory coding. PLoS computational biology. 9 (7), e1003133 (2013).
- Hubel, D. H., Wiesel, T. N. Receptive fields and functional architecture of monkey striate cortex. The Journal of physiology. 195 (1), 215-243 (1968).
- Christensen, T. A., Pawlowski, V. M., Lei, H., Hildebrand, J. G. Multi-unit recordings reveal context-dependent modulation of synchrony in odor-specific neural ensembles. Nature neuroscience. 3 (9), 927-931 (2000).
- Byers, K. J. R. P., Sanders, E., Riffell, J. A. Identification of olfactory volatiles using gas chromatography-multi-unit recordings (GCMR) in the insect antennal lobe. Journal of visualized experiments JoVE. (72), e4381 (2013).
- Perez-Orive, J., Mazor, O., Turner, G. C., Cassenaer, S., Wilson, R. I., Laurent, G. Oscillations and sparsening of odor representations in the mushroom body. Science. 297 (5580), 359-365 (2002).
- Stevenson, I. H., Kording, K. P. How advances in neural recording affect data analysis. Nature. 14 (2), 139-142 (2011).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature neuroscience. 7 (5), 446-451 (2004).
- Viventi, J., Kim, D. -. H., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nature neuroscience. 14 (12), 1599-1605 (2011).
- Pouzat, C., Mazor, O., Laurent, G. Using noise signature to optimize spike-sorting and to assess neuronal classification quality. Journal of neuroscience methods. 122 (1), 43-57 (2002).
- Lewicki, M. S. A review of methods for spike sorting: the detection and classification of neural action potentials. Network. 9 (4), R53-R78 (1998).
- Quian Quiroga, R., Panzeri, S. Extracting information from neuronal populations: information theory and decoding approaches). Nature reviews. Neuroscience. 10 (3), 173-185 (2009).
- Einevoll, G. T., Franke, F., Hagen, E., Pouzat, C., Harris, K. D. Towards reliable spike-train recordings from thousands of neurons with multielectrodes. Current opinion in neurobiology. 22 (1), 11-17 (2012).
- Riffell, J. a., Lei, H., Abrell, L., Hildebrand, J. G. Neural basis of a pollinator’s buffet: olfactory specialization and learning in Manduca sexta. Science. 164 (6), 877-892 (2013).
- Bender, J. a., Pollack, A. J., Ritzmann, R. E. Neural activity in the central complex of the insect brain is linked to locomotor changes. Current biology : CB. 20 (10), 921-926 (2010).
- Perez-Orive, J., Bazhenov, M., Laurent, G. Intrinsic and circuit properties favor coincidence detection for decoding oscillatory input. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (26), 6037-6047 (2004).
- Rybak, J. . Die strukturelle Organisation der Pilzkörper und synaptische Konnektivität protocerebraler Interneuronen im Gehrin der Honigbiene, Apis mellifera.: eine licht- und elektronenmikroskopische Studie. , (1994).
- Hammer, M. An identified neuron mediates the unconditioned stimulus in associative olfactory learning in honeybees. Nature. 366, 59-63 (1993).
- Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. Journal of neurophysiology. 69, 609-625 (1993).
- Menzel, R., Manz, G. Neural plasticity of mushroom body-extrinsic neurons in the honeybee brain. The Journal of experimental biology. 208 (22), 4317-4332 (2005).
- Okada, R., Rybak, J., Manz, G., Menzel, R. Learning-related plasticity in PE1 and other mushroom body-extrinsic neurons in the honeybee brain). The Journal of neuroscience: the official journal of the Society for Neuroscience. 27 (43), 11736-11747 (2007).
- Joerges, J., Küttner, A., Galizia, C. G., Menzel, R. Representation of odours and odour mixtures visualized in the honeybee brain. Nature. 387, 285-288 (1997).
- Galizia, C. G., Joerges, J., Küttner, A., Faber, T., Menzel, R. A semi-in-vivo preparation for optical recording of the insect brain. Journal of neuroscience. 76 (1), 61-69 (1997).
- Galizia, C. G., Sachse, S., Rappert, A., Menzel, R. The glomerular code for odor representation is species specific in the honeybee Apis mellifera. Nature. 2 (5), 473-478 (1999).
- Sandoz, J. -. C. Odour-evoked responses to queen pheromone components and to plant odours using optical imaging in the antennal lobe of the honey bee drone Apis mellifera L. The Journal of experimental biology. 209 (18), 3587-3598 (2006).
- Fernandez, P. C., Locatelli, F. F., Person-Rennell, N., Deleo, G., Smith, B. H. Associative conditioning tunes transient dynamics of early olfactory processing. The Journal of neuroscience the official journal of the Society for Neuroscience. 29 (33), 10191-10202 (2009).
- Locatelli, F. F., Fernandez, P. C., et al. Nonassociative plasticity alters competitive interactions among mixture components in early olfactory processing. European Journal of Neuroscience. 37 (1), (2013).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of visualized experiments JoVE. (61), 1-7 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Genetically Encoded Functional Indicators. 72, 43-70 (2012).
- Galizia, C. G., Kimmerle, B. Physiological and morphological characterization of honeybee olfactory neurons combining electrophysiology, calcium imaging and confocal microscopy. Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology. 190 (1), 21-38 (2004).
- Helmchen, F., Waters, J. Ca2+ imaging in the mammalian brain in vivo. European journal of pharmacology. 447 (2-3), 119-129 (2002).
- Stierle, J. S., Galizia, C. G., Szyszka, P. Millisecond stimulus onset-asynchrony enhances information about components in an odor mixture. Journal of Neuroscience. 33 (14), 6060-6069 (2013).
- Haase, A., Rigosi, E., et al. In-vivo two-photon imaging of the honey bee antennal lobe. Biomedical optics express. 2 (1), 131-138 (2010).
- Becker, P. L., Fay, F. S. Photobleaching of fura-2 and its effect on determination of calcium concentrations. The American journal of physiology. 253 (4 pt 1), C613-C618 (1987).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved