Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine schnelle Methode zur Blutverarbeitung die Ausbeute an Plasma-Peptidkonzentrationen im menschlichen Blut zu erhöhen
In diesem Artikel
Zusammenfassung
Die RAPID Blutverarbeitungsverfahren kann beim Menschen eingesetzt werden und liefert höhere Peptidspiegel sowie ermöglicht die Beurteilung der richtigen molekularen Form. Daher wird dieses Verfahren ein wertvolles Werkzeug in der Peptid Forschung sein.
Zusammenfassung
Die Forschung im Bereich der Nahrungsaufnahme Regulierung gewinnt zunehmend an Bedeutung. Dazu gehört oft die Messung von Peptiden Regulierung der Nahrungsaufnahme. Für die korrekte Bestimmung der Konzentration des Peptids, sollte es während der Blutverarbeitung stabil sein. Dies ist jedoch nicht der Fall für mehrere Peptide, die durch endogene Peptidasen schnell abgebaut werden. Vor kurzem haben wir eine Blutverarbeitungsverfahren unter Verwendung von R educed Temperaturen entwickelt, A cidification, rotease P Hemmung, I sotopic exogenen Kontrollen und D ilution (RAPID) für die Verwendung in Ratten. Hier haben wir diese Technik für den Einsatz beim Menschen festgestellt und untersucht Erholung, molekulare Form und zirkulierende Konzentration der Nahrungsaufnahme regulatorischen Hormone. Die RAPID Verfahren erheblich verbessert die Erholung für 125 I-markierte Somatostatin-28 (+ 39%), Glucagon-like Peptid-1 (+ 35%), Acyl- Ghrelin und Glukagon (+ 32%), Insulin und kisspeptin (+ 29% ), nesfatin-1 (+ 28%), Leptin(+ 21%) und Peptid YY 3-36 (+ 19%) im Vergleich zu Standard - Verarbeitung (EDTA - Blut auf dem Eis, p <0,001). Hochleistungsflüssigkeitschromatographie zeigte die Elution von endogenen Acyl Ghrelin an der erwarteten Position, nachdem eine schnelle Verarbeitung, während nach Standardverarbeitungs 62% der Acyl Ghrelin abgebaut wurden in einem früheren Peak resultierende Wahrscheinlichkeit darstellt Desacyl Ghrelin. Nach dem schnellen Verarbeitung der Acyl- / Desacyl Ghrelin - Verhältnis im Blut von normalen gewichtigen Probanden betrug 1: 3 im Vergleich zu 1.23 folgende Standardverarbeitung (p = 0,03). Auch endogene kisspeptin Werte waren höher nach RAPID Vergleich zu Standardverarbeitung (+ 99%, p = 0,02). Die RAPID Blutverarbeitungsverfahren kann beim Menschen verwendet werden, ergibt höhere Peptidspiegel und ermöglicht die Beurteilung der richtigen molekularen Form.
Einleitung
Angesichts der weltweit zunehmenden Verbreitung von Fettleibigkeit 1,2, Forschung auf dem Gebiet der Nahrungsaufnahme Regulierung gewinnt zunehmend an Bedeutung. Während bisher nur ein Peptid bekannt ist , dass peripher produziert und wirkt zentral Nahrungsaufnahme zu stimulieren, nämlich Ghrelin 3, in den letzten Jahrzehnten hat sich ein breites Spektrum von Peptiden worden , die Aufnahme zu reduzieren Lebensmittel identifiziert, z. B. Leptin, Peptid YY (PYY) und auch Glucagon-like peptide-1 (GLP-1) und Insulin - 4 daher in Studien , die die Regulationsmechanismen von Hunger und Sättigung Peptidspiegel sucht werden oft beurteilt und zugleich wird angenommen , dass das Peptid untersucht ist stabil und mit hoher Ausbeute während der Plasmabildung wiedergewonnen. Doch sehr oft ist dies nicht der Fall aufgrund der schnellen endogenen Abbau nach wie vor für zB gezeigt. Ghrelin , die aus Acyl abgebaut wird Ghrelin 5 bis Desacyl. Deshalb haben wir beschrieben, vor kurzem die schnelle Methode zur Blut VorarbVerwendung von R educed Temperaturen bei Ratten singen, A cidification, rotease P Hemmung, ich sotopic 6 exogene Kontrollen und D ilution. Dieses Verfahren verbessert die Erholung für 11 von 12 Peptiden getestet und für die Bestimmung des richtigen zirkulierende molekularer Form im Vergleich zu Standardblutverarbeitung (EDTA - Blut auf Eis) erlaubt 6. Dieses Verfahren wurde in mehreren nachfolgenden Studien 7-12 zur Detektion von zirkulierenden Ghrelin sowie Corticotropin-Releasing - Faktor 13 verwendet. Daher hat das Verfahren für die Peptidforschung in Nagetieren als nützlich erwiesen. da Nagetier Studien sind jedoch nicht immer übersetzbar zu anderen Spezies, soll das Verfahren auch für die Verwendung im menschlichen Blut hergestellt werden.
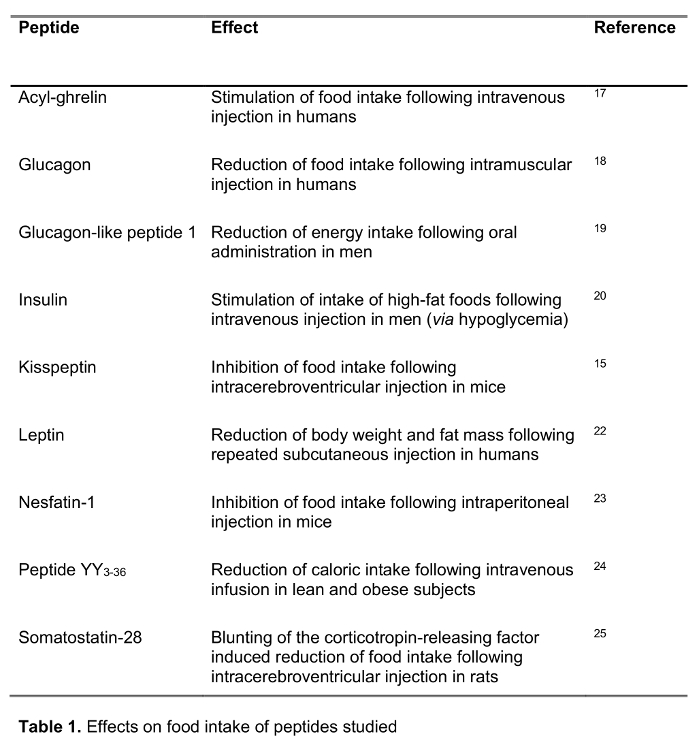
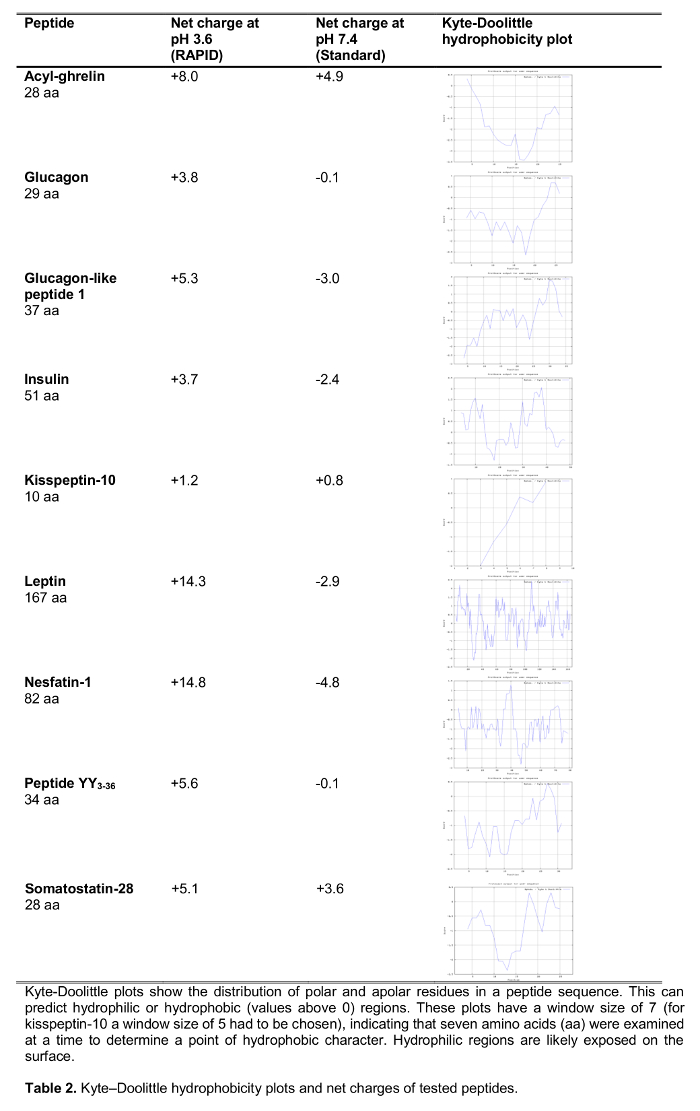
Das Ziel der vorliegenden Studie war es, die schnelle Methode zur Blutverarbeitung beim Menschen im Vergleich zu Standard - Blutverarbeitung, EDTA - Blut auf dem Eis zu testen, die weit 14 empfohlen und häufig uin der klinischen sowie Forschungs Einstellung sed. Wir testeten die Wiederherstellung einer Auswahl von 125 I-markierten Peptiden in der Regulation der Nahrungsaufnahme einschließlich etablierten Peptide beteiligt sowie neue Kandidaten vor kurzem in der Fütterung Regulierung eine Rolle zu spielen vorgeschlagen folgende Verarbeitung (Auswirkungen auf die Nahrungsaufnahme sind in Tabelle 1 gezeigt) mit beiden Methoden. Hormone wurden auch verwendet, um Peptide von unterschiedlicher Länge und Ladung (Tabelle 2) ausgewählt. Darüber hinaus für Ghrelin untersuchten wir die molekularen Form (en) nach dem Standard und schnelle Methode. Schließlich wir endogene Ghrelin (acyl und Desacyl Ghrelin) sowie kisspeptin Ebenen bewertet, ein Peptid , auch vor kurzem vorgeschlagen , eine Rolle bei der Regulation der Nahrungsaufnahme 15,16 folgenden RAPID oder Standard - Verarbeitung zu spielen. Darüber hinaus untersuchten wir auch diese Peptid - Werte in einer Population von Patienten mit einer breiten Palette von Body - Mass - Index ( im Bereich von 10,2 bis 67,6 kg / m 2) possib zu studierenle Unterschiede zu chronisch veränderte Körpergewicht bezogen.
Diagnose, Bewertung und Plan:
Die Studienteilnehmer
Alle Studienteilnehmer wurden neu Patienten im Krankenhaus (Aufnahme innerhalb von zwei Tagen nach der Aufnahme ins Krankenhaus war) der Abteilung für Psychosomatische Medizin an der Charité-Universitätsmedizin Berlin und gab informierte Zustimmung geschrieben. Um zu vermeiden, wurden keine Auswirkungen von Geschlecht nur weibliche Patienten eingeschlossen. Insgesamt 42 Probanden nahmen an dieser Studie und wurden in drei Gruppen eingeteilt: Normalgewicht (BMI 18,5 bis 25 kg / m 2, n = 12), Anorexia nervosa (BMI <17,5 kg / m 2, n = 15) und Adipositas (BMI> 30 kg / m 2, n = 15). Anorexic und adipösen Patienten warennach der Internationalen Klassifikation der Krankheiten-10 diagnostiziert und für die Gewichtszunahme (Anorexia nervosa) oder Gewichtsreduktion (Adipositas), die jeweils im Krankenhaus. Alle Normalgewicht Patienten wurden ausschließlich auf somatoforme Symptome ohne relevante somatische Störungen ins Krankenhaus. Patienten mit Magen-Darm-somatoforme Symptome oder einer Vorgeschichte von Magen-Darm-Chirurgie wurden ausgeschlossen. Ausschlusskriterien umfassten auch ein Alter <18 Jahre, aktuelle Schwangerschaft und unbehandeltem psychotischen Erkrankungen. Die Blutentnahme wurde am Tag 2 oder 3 nach Einlieferung ins Krankenhaus durchgeführt, bevor diätetischen Behandlung, um Aufnahmekörpergewicht zu erhöhen oder zu verringern, beziehungsweise. Anthropometrische Parameter wurden am selben Tag untersucht.
Protokoll
Das Protokoll wurde von der Ethikkommission für Humanforschung genehmigt (Protokollnummer EA1 / 114/10).
1. Blutverarbeitung
- Venöses Blut von 7.00 bis 08.00 Uhr nach nächtlichem Fasten aus einem Unterarm Vene und Verfahren nach Standardverfahren oder der RAPID-Methode. Weisen Sie die Themen nicht ausüben oder rauchen vor der Blutentnahme.
- Für Standard-Verarbeitung, sammeln Blut in gekühlten EDTA-enthaltenden Röhrchen und Zentrifuge innerhalb von 10 min bei 3000 × g für 10 min bei 4 ° C. Sammeln Sie den Überstand und halten bei -80 ° C bis zur weiteren Verarbeitung durch Radioimmunoassay.
- Für die schnelle Verarbeitung, sofort Blut verdünnen (innerhalb von 1 min nach der Blutentnahme) 1:10 in eiskaltem Puffer (pH 3,6), enthaltend 0,1 M Ammoniumacetat, 0,5 M NaCl und Enzyminhibitoren (Diprotin A, E-64-d, Antipain , Leupeptin, Chymostatin, 1 & mgr; g / ml). Dann Zentrifuge innerhalb von 10 min bei 3000 xg für 10 min bei 4 ° C und sammle Überstand using einer Pipette in Polypropylenröhrchen nach wie vor 6 bei Ratten beschrieben.
- Lade Chromatographie Patronen (360 mg, 55 bis 105 & mgr; m) mit 100% Acetonitril (Rate 10 ml / min), ins Gleichgewicht mit 0,1% Trifluoracetat (TFA, Rate 10 ml / min) und die Last mit dem Überstand bei einer konstanten Geschwindigkeit von 1 ml / min eine Spritzenpumpe.
- Danach waschen Kartuschen mit 3 ml 0,1% TFA (Rate 10 ml / min) und langsam mit 2 ml 70% Acetonitril, das 0,1% TFA (2 ml / min) eluiert.
- Trockene eluierten Proben unter Verwendung von Vakuum Zentrifugation und bei -80 ° C bis zur weiteren Verarbeitung durch Radioimmunoassay.
HINWEIS: Führen Sie alle Schritte in Polypropylen (RAPID - Verarbeitung) und Borosilikat (Radioimmunoassay) Rohre , die deutlich niedrigere Oberflächenbindungseigenschaften aufweisen und somit Peptidverlust für die meisten der vor 26 suchten Peptide minimieren.
2. Messungen
Hinweis: Die Schritte in diesem Abschnitt sollte in einem Labor durchgeführt werden,für die Arbeit mit radioaktiven Stoffen zertifiziert. Standard - Vorsichtsmaßnahmen für die Arbeit mit 125 I genommen werden sollte.
- Wiederherstellung von radiomarkiertem Peptides
- Erhalten Sie 125 I-radiomarkierte menschliche Peptide (z. B. Acyl-Ghrelin, GLP-1, Glukagon, Insulin, kisspeptin, Leptin, nesfatin-1, PYY 3-36 und Somatostatin-28).
- Halten Peptide in Pulverform, bis das Experiment, dann frisch verdünnt in 0,1% Essigsäure (~ 100.000 cpm pro ml).
- Für Standard-Blutverarbeitung, direkt nach der Blutentnahme in ein gekühltes EDTA enthaltenden Röhrchen, je 1 ml Blut in ein Röhrchen mit 50 ul radioaktiven Marker enthält 3000-6000 cpm (direkt gezählt, bevor das Experiment beginnt).
- Für die schnelle Verarbeitung, Übertragung 1 ml Blut aus EDTA-Blut in ein Röhrchen mit 9 ml RAPID-Puffer, enthaltend (Zusammensetzung siehe 1.3) und 500 & mgr; l radioaktiven Marker enthält 30.000-60.000 cpm. Aufgrund der 1:10 Verdünnung Einsatz 10-mal höheres Volumen an radiolabel für eine schnelle Verarbeitung.
- Danach Prozessproben wie in den Schritten 1.2 bis 1.3.2 beschrieben.
- Für die Wiederfindungsversuche, nicht trockene Proben durch Vakuum Zentrifugation und lagern nicht bei -80 ° C. Stattdessen beurteilen Gewinnung von radioaktiv markierten Peptiden direkt danach einen Gamma-Zähler verwendet wird.
- Messen Sie die gesamte Überstand in Standardproben, während in RAPID Proben 1/10 des Gesamtvolumens analysieren Vergleichbarkeit der Menge an radioaktiver Markierung verwendet zu erhalten. Zur Messung den Überstand in den Rohren in den Gamma-Zähler Einbau und die Zählungen pro Minute beurteilen
- Als 100% ige Standard, verwenden Sie zwei Proben mit 50 ul 125 I-radiomarkierten Peptid , das die Verarbeitung nicht unterziehen. Messen, die gleichzeitig mit anderen Proben, wie in 2.1.7 beschrieben.
- Führen Sie die Experiment fünf bis sechs Mal für jedes Peptid.
- High Performance Liquid Chromatography of Radiolabeled Ghrelin
- Ziehen Sie Blut in chilled EDTA-Röhrchen und je 1 ml in Röhrchen, die 200 & mgr; l radiomarkierten-acyl Ghrelin enthält 15.000-20.000 cpm (gezählt direkt bevor das Experiment beginnt) enthält.
- Für die schnelle Verarbeitung, Übertragung 1 ml Blut in ein Röhrchen mit 9 ml RAPID-Puffer (Zusammensetzung siehe 1.3) und 200 & mgr; l radiomarkierte Acyl- Ghrelin enthält 15.000-20.000 cpm.
- Danach Prozessproben wie in den Schritten 1.2 bis 1.3.2 beschrieben.
- Zur weiteren Analyse durch Umkehrphasen-HPLC, laden direkt Proben auf eine stabile Bindung C18-Säule (2,1 mm x 50 mm, 1,8 & mgr; m), äquilibriert in 17% Acetonitril in Wasser (beide mit 0,1% TFA ergänzt).
- Nach 5 min Äquilibrierung mit einem Gradienten von 17 bis 40% Acetonitril verwenden, um die Probe in 40 min (Fließgeschwindigkeit von 1 ml / min) zu eluieren.
- Sammle Fraktionen von 1 ml pro Minute und zu analysieren, die Radioaktivität eines Gamma-Zählers verwendet wird.
- In einem separaten Experiment, Last 200 ul radioaktiv markiertes Acyl Ghrelin enthält 15.000-20.000cpm auf die Säule direkt und HPLC zuführen, wie 2.2.4 bis 2.2.6 in Schritten beschrieben.
- Radioimmunoassay
- Für Radioimmunoassay, auftauen gefrorenen Stände (Standardverarbeitung) und getrocknete Pulver (RAPID-Methode) bei Raumtemperatur-Vakuum.
- Unmittelbar vor dem Radioimmunoassay, resuspendieren trockenen RAPID Proben in doppelt destilliertem H 2 O nach dem ursprünglichen Volumen von Plasma (500 ul).
- Beurteilen kisspeptin und insgesamt (einschließlich sowohl Desacyl und Acyl Ghrelin) sowie acyl Ghrelin wie zuvor beschrieben 12,27 kommerziellen Radioimmunoassays verwendet , gemäß der Herstellerprotokolle. Verwenden Sie Borosilikat-Rohre, die stabile Pelletbildung ermöglichen.
- Am ersten Tag, inkubiere die Proben mit Testpuffer und primärem Antikörper (z. B. anti-Ghrelin) in der Verdünnung durch den Hersteller für einen Zeitraum von 24 Stunden vorgesehen ist .
- Am zweiten Tag, fügen Sie die 125 I - Tracer (zB 125 I-Ghrelin), voRTEX und für einen Zeitraum von 24 Stunden inkubieren.
- Am dritten Tag, fügen Sie das Fällungsreagenz, Wirbel und Inkubation, wie vom Hersteller empfohlen. Dann Zentrifugenröhrchen bei 3.000 xg für 20 min bei 4 ° C. Entfernen Sie die Überstände und zählen Radioaktivität in den Pellets mit einem Gamma-Zähler mit
- Berechnen Desacyl Ghrelin als Differenz der gesamten minus Acyl- Ghrelin. Beurteilen Sie die Acyl / Desacyl Ghrelin Verhältnis von Acyl von Desacyl Ghrelin für jede einzelne Probe dividiert wird.
- Verarbeiten Sie alle Proben - wenn möglich - in einer Charge Variabilität zwischen den Tests zu vermeiden. Die Intra-Assay-Variabilität in dem vorliegenden Experiment war <8% für kisspeptin, <7% für insgesamt und <9% für Acyl Ghrelin.
3. Statistische Analyse
- Bestimmen Sie die Verteilung der Daten des Kolmogorov-Smirnov-Test. Express-Daten als Mittelwert ± Standardfehler des Mittelwerts (SEM).
- Beurteilen, Unterschiede zwischen zweiGruppen durch t-Test. Beurteilen Sie die Unterschiede zwischen verschiedenen Gruppen von allen paarweisen Mehrfachvergleichsverfahren (Tukey post hoc - Test) oder Zwei-Wege - ANOVA , gefolgt von Holm-Sidak Methode.
- Betrachten Sie p <0,05 signifikant und führen Analysen ein Statistik - Programm.
Ergebnisse
RAPID Blutverarbeitung erhöht die Ausbeute von 125 I-radiomarkierten Peptide im menschlichen Blut im Vergleich zu Standard - Blutverarbeitung.
Nach Standardblutverarbeitungs (EDTA Blut auf Eis), war die Rückgewinnung von radiomarkierten Peptide ~ 60% in 9/9 Peptide ( im Bereich von 48 bis 68%, 1A - K). Schnellverarbeitung , die Ausbeute in allen 125 I-markierte Peptide, nämlich in Somatostatin-28 (+ 39%, 1A),
Diskussion
Wir berichteten vor , dass die schnelle Methode zur Blutverarbeitung die Erholung für 12.11 Peptide im Vergleich zu Standardblutverarbeitung bei Ratten verbessert 6. In der vorliegenden Studie haben wir gezeigt, dass dieses Verfahren auch für die Anwendung beim Menschen geeignet ist. Im Anschluss an eine schnelle Verarbeitung, die Erholung für 9 von 9 125 I-markierten Peptiden getestet wurde verbessert im Vergleich zu Standard - Blutverarbeitung (EDTA - Blut auf Eis). Die beobachtete Verbesserun...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von Deutsche Forschungsgemeinschaft STE 1765 / 3-1 (AS) und Bundesministerium für Bildung und Forschung 03IPT614A (CG) unterstützt. Wir danken Reinhard Lommel und Petra Buße für ihre hervorragenden technischen Support sowie Karin Johansson und Christina Hentzschel für die Hilfe bei Organisation und Durchführung von anthropometrische Messungen
Materialien
| Name | Company | Catalog Number | Comments |
| Diprotin A | Peptides International, Louisville, KY, USA | IDP-4132 | |
| E-64-d | Peptides International, Louisville, KY, USA | IED-4321-v | |
| Antipain | Peptides International, Louisville, KY, USA | IAP-4062 | |
| Leupeptin | Peptides International, Louisville, KY, USA | ILP-4041 | |
| Chymostatin | Peptides International, Louisville, KY, USA | ICY-4063 | |
| Sep-Pak C18 cartridges | Waters Corporation, Milford, MA, USA | WAT051910 | 360 mg, 55-105 µm |
| Acyl-ghrelin | Millipore, Billerica, MA, USA | 9088-HK | Radioactive |
| GLP-1 | Millipore, Billerica, MA, USA | 9035-HK | Radioactive |
| Glucagon | Millipore, Billerica, MA, USA | 9030 | Radioactive |
| Insulin | Millipore, Billerica, MA, USA | 9011S | Radioactive |
| Leptin | Millipore, Billerica, MA, USA | 9081-HK | Radioactive |
| Kisspeptin-10 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-048-56 | Radioactive |
| Nesfatin-1 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-003-26 | Radioactive |
| PYY3-36 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-059-02 | Radioactive |
| Somatostatin-28 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-060-16 | Radioactive |
| ZORBAX Rapid Resolution HT SB-C18 column | Agilent Technologies, Santa Clara, CA, USA | 822700-902 | 2.1 mm x 50 mm, 1.8 µm |
| Agilent 1200 LC | Agilent Technologies, Santa Clara, CA, USA | HPLC, several components, therefore no single catalog number | |
| Kisspeptin RIA | Phoenix Pharmaceuticals, Burlingame, CA, USA | # RK-048-56 | Radioactive |
| Total ghrelin RIA | Millipore, Billerica, MA, USA | # GHRT-89HK | Radioactive |
| Active ghrelin RIA | Millipore, Billerica, MA, USA | # GHRA-88HK | Radioactive |
| SigmaStat 3.1 | Systat Software, San Jose, CA, USA | online download |
Referenzen
- Finucane, M. M., et al. National, regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants. Lancet. 377 (9765), 557-567 (2011).
- James, W. P. The epidemiology of obesity: the size of the problem. J Intern Med. 263 (4), 336-352 (2008).
- Stengel, A., Taché, Y. Gastric peptides and their regulation of hunger and satiety. Curr Gastroenterol Rep. 14 (6), 480-488 (2012).
- Hussain, S. S., Bloom, S. R. The regulation of food intake by the gut-brain axis: implications for obesity. Int J Obes (Lond). 37 (5), 625-633 (2013).
- Hosoda, H., et al. Optimum collection and storage conditions for ghrelin measurements: octanoyl modification of ghrelin is rapidly hydrolyzed to desacyl ghrelin in blood samples). Clin Chem. 50 (6), 1077-1080 (2004).
- Stengel, A., et al. The RAPID method for blood processing yields new insight in plasma concentrations and molecular forms of circulating gut peptides. Endocrinology. 150 (11), 5113-5118 (2009).
- Stengel, A., et al. Lipopolysaccharide differentially decreases plasma acyl and desacyl ghrelin levels in rats: Potential role of the circulating ghrelin-acylating enzyme GOAT. Peptides. 31 (9), 1689-1696 (2010).
- Stengel, A., et al. Cold ambient temperature reverses abdominal surgery-induced delayed gastric emptying and decreased plasma ghrelin levels in rats. Peptides. 31, 2229-2235 (2010).
- Stengel, A., et al. Central administration of pan-somatostatin agonist ODT8-SST prevents abdominal surgery-induced inhibition of circulating ghrelin, food intake and gastric emptying in rats. Neurogastroenterol Motil. 23 (7), e294-e308 (2011).
- Stengel, A., et al. Abdominal surgery inhibits circulating acyl ghrelin and ghrelin-O-acyltransferase levels in rats: role of the somatostatin receptor subtype 2. Am J Physiol Gastrointest Liver Physiol. 301, G239-G248 (2011).
- Wang, L., et al. Intravenous injection of urocortin 1 induces a CRF2 mediated increase in circulating ghrelin and glucose levels through distinct mechanisms in rats. Peptides. 39, 164-170 (2013).
- Goebel-Stengel, M., Stengel, A., Wang, L., Taché, Y. Orexigenic response to tail pinch: role of brain NPY(1) and corticotropin releasing factor receptors. Am J Physiol Regul Integr Comp Physiol. 306 (3), R164-R174 (2014).
- Goebel, M., Stengel, A., Wang, L., Reeve, J., Taché, Y. Lipopolysaccharide increases plasma levels of corticotropin-releasing hormone in rats. Neuroendocrinology. 93 (3), 165-173 (2011).
- Banfi, G., Salvagno, G. L., Lippi, G. The role of ethylenediamine tetraacetic acid (EDTA) as in vitro anticoagulant for diagnostic purposes. Clin Chem Lab Med. 45 (5), 565-576 (2007).
- Stengel, A., Wang, L., Goebel-Stengel, M., Taché, Y. Centrally injected kisspeptin reduces food intake by increasing meal intervals in mice. Neuroreport. 22 (5), 253-257 (2011).
- De Bond, J. A., Smith, J. T. Kisspeptin and energy balance in reproduction. Reproduction. 147 (3), R53-R63 (2014).
- Wren, A. M., et al. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab. 86 (12), 5992 (2001).
- Schulman, J. L., Carleton, J. L., Whitney, G., Whitehorn, J. C. Effect of glucagon on food intake and body weight in man. J Appl Physiol. 11 (3), 419-421 (1957).
- Steinert, R. E., Poller, B., Castelli, M. C., Drewe, J., Beglinger, C. Oral administration of glucagon-like peptide 1 or peptide YY 3-36 affects food intake in healthy male subjects. Am J Clin Nutr. 92 (4), 810-817 (2010).
- Dewan, S., et al. Effects of insulin-induced hypoglycaemia on energy intake and food choice at a subsequent test meal. Diabetes Metab Res Rev. 20 (5), 405-410 (2004).
- Schlogl, M., et al. Increased 24-hour ad libitum food intake is associated with lower plasma irisin concentrations the following morning in adult humans. Appetite. 90, 154-159 (2015).
- Heymsfield, S. B., et al. Recombinant leptin for weight loss in obese and lean adults: a randomized, controlled, dose-escalation trial. JAMA. 282 (16), 1568-1575 (1999).
- Shimizu, H., et al. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 150, 662-671 (2009).
- Batterham, R. L., et al. Inhibition of food intake in obese subjects by peptide YY3-36. N Engl J Med. 349 (10), 941-948 (2003).
- Shibasaki, T., et al. Antagonistic effect of somatostatin on corticotropin-releasing factor-induced anorexia in the rat. Life Sci. 42 (3), 329-334 (1988).
- Goebel-Stengel, M., Stengel, A., Taché, Y., Reeve, J. R. The importance of using the optimal plasticware and glassware in studies involving peptides. Anal Biochem. 414 (1), 38-46 (2011).
- Smets, E. M., et al. Decreased plasma levels of metastin in early pregnancy are associated with small for gestational age neonates. Prenat Diagn. 28 (4), 299-303 (2008).
- Kojima, M., et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 402 (6762), 656-660 (1999).
- Stengel, A., Yin Taché, Y., Yang, the Gastric X/A-like Cell as Possible Dual Regulator of Food Intake. J Neurogastroenterol Motil. 18 (2), 138-149 (2012).
- Inhoff, T., et al. Desacyl ghrelin inhibits the orexigenic effect of peripherally injected ghrelin in rats. Peptides. 29, 2159-2168 (2008).
- Hirayama, H., et al. Contrasting effects of ghrelin and des-acyl ghrelin on the lumbo-sacral defecation center and regulation of colorectal motility in rats. Neurogastroenterol Motil. 22 (10), 1124-1131 (2011).
- Horikoshi, Y., et al. Dramatic elevation of plasma metastin concentrations in human pregnancy: metastin as a novel placenta-derived hormone in humans. J Clin Endocrinol Metab. 88 (2), 914-919 (2003).
- Yang, Y. U., Xiong, X. Y., Yang, L. I., Xie, L., Huang, H. Testing of kisspeptin levels in girls with idiopathic central precocious puberty and its significance. Exp Ther Med. 9 (6), 2369-2373 (2015).
- Hosoda, H., Kojima, M., Matsuo, H., Kangawa, K. Ghrelin and des-acyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue. Biochem Biophys Res Commun. 279 (3), 909-913 (2000).
- Raff, H. Total and active ghrelin in developing rats during hypoxia. Endocrine. 21 (2), 159-161 (2003).
- Evans, M. J., Livesey, J. H., Ellis, M. J., Yandle, T. G. Effect of anticoagulants and storage temperatures on stability of plasma and serum hormones. Clin Biochem. 34 (2), 107-112 (2001).
- Nabuchi, Y., Fujiwara, E., Kuboniwa, H., Asoh, Y., Ushio, H. The stability and degradation pathway of recombinant human parathyroid hormone: deamidation of asparaginyl residue and peptide bond cleavage at aspartyl and asparaginyl residues. Pharm Res. 14 (12), 1685-1690 (1997).
- White, A., Handler, P., Smith, E. L. . Principles of Biochemistry. , (1973).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten