Method Article
Un protocollo dettagliato per caratterizzare la linea cellulare murina C1498 e il suo modello associato leucemia mouse
In questo articolo
Riepilogo
Questo manoscritto fornisce una procedura tecnica che può essere utilizzato per caratterizzare colture cellulari C1498 in vitro e la leucemia acuta indotta nei topi dopo l'iniezione. Fenotipiche e funzionali analisi vengono eseguite utilizzando citometria a flusso, microscopia a immunofluorescenza, citochimica e maggio-Grünwald Giemsa.
Abstract
L'iniezione endovenosa di C1498 cellule in topi singenici o congenic è stata eseguita dal 1941. Queste iniezioni provocare lo sviluppo di leucemia acuta. Tuttavia, la natura di questa malattia non è stato ben documentato in letteratura. Qui, forniamo un protocollo tecnico per caratterizzare cellule C1498 in vitro e per determinare la natura della leucemia indotta in vivo. La prima parte di questa procedura è focalizzata sulla determinazione del lineage ematopoietiche e la fase di differenziazione delle cellule C1498 coltivate. Per ottenere questo, multi-parametrica colorazione citometria di flusso è utilizzato per rilevare marcatori cellulari ematopoietiche. immunofluorescenza, citochimica e colorazione May-Grünwald Giemsa vengono eseguiti per valutare l'espressione di mieloperossidasi, l'attività di esterasi e morfologia cellulare, rispettivamente. La seconda parte di questo protocollo è dedicata a descrivere la malattia leucemia che è indotta invivo. Quest'ultimo può essere ottenuto determinando le frequenze di cellule leucemiche e insiti nel sangue, organi ematopoietici (ad esempio, midollo osseo e milza) e tessuti non linfoidi (ad esempio il fegato e polmoni) utilizzando colorazione specifica e citometria a flusso analisi. La natura della leucemia viene poi confermata con May-Grünwald Giemsa colorazione e colorazione per esterasi specifiche nel midollo osseo. Qui, vi presentiamo i risultati che sono stati ottenuti utilizzando questo protocollo nei topi C1498- e PBS-iniettati di pari età.
Introduzione
leucemia mieloide acuta (LMA) è caratterizzata dalla proliferazione incontrollata di cellule mieloidi ematopoietiche che sono bloccati in diversi stadi di maturazione. Questo disregolazione può influenzare il granulociti, monociti, eritrocitaria o percorsi di differenziazione megaryocytic 1. cellule AML si accumulano nel midollo osseo, con conseguente compromissione emopoiesi, che si traduce in trombocitopenia, linfopenia e anemia. Le cellule leucemiche anche invadere il sangue e gli organi non linfoidi.
Il modello C1498 del mouse è stato utilizzato per decenni come modello per la leucemia acuta poiché le cellule tumorali sono stati isolati da un leucemico 10 mesi C57BL / 6 (H-2 b) topo femmina nel 1941. La letteratura descrive l'invasione nel sangue , gli organi ematopoietici (ad esempio, i milza e nei linfonodi) e gli organi non ematopoietici (ad esempio, il fegato, i polmoni, ovaie e reni) da parte delle cellule C1498 altamente proliferative dopo che sono stati iniettati attraverso un aendovenosa, sottocutanea o via intraperitoneale in topi suscettibili 2-4. Tuttavia, questo modello di topo è stato segnalato per indurre sia granulocitica 2,5 o 6 mielomonocitica leucemia. Più recentemente, uno studio pubblicato nel 2002 ha descritto questo tipo di cancro, come la leucemia cellule murine NKT 7. Così, letteratura differisce circa la natura di questa linea cellulare C1498 e leucemia associato induce nei topi. Queste discrepanze sono dovute principalmente alla mancanza di dettagliate e aggiornate informazioni pubblicate sulle cellule e la malattia leucemica in generale, perché molti studi sono stati effettuati nel 1950 - '70.
Qui forniamo un protocollo dettagliato per descrivere come caratterizzare cellule C1498 e analizzare la natura della malattia leucemica che è indotta dalla loro iniezione endovenosa in topi. La prima sezione di questo protocollo è dedicato ad una descrizione di cellule C1498 che sono stati coltivati in vitro. contro fluorescentecorpi diretti contro la superficie e marcatori ematopoietici intracellulari sono stati usati per determinare il loro fenotipo mediante citometria a flusso. La presenza di mieloperossidasi è stata valutata utilizzando la microscopia di immunofluorescenza, la loro stirpe ematopoietico e differenziazione fase sono stati valutati utilizzando citochimica per valutare l'attività di esterasi, ed è stata effettuata maggio-Grünwald Giemsa. Le cellule C1498 sono state iniettate in topi, e la malattia leucemia acuta che è stata indotta è descritto nella seconda sezione di questo manoscritto. Le stesse tecniche sono stati usati per determinare le frequenze ed i fenotipi di cellule leucemiche e inerenti nel midollo osseo, sangue periferico, la milza e gli organi non ematopoietici (il fegato e polmoni).
Questo protocollo è altamente riproducibile, ed i dati presentati qui aiuterà i ricercatori a valutare gli effetti di nuove strategie terapeutiche. Questo modello leucemia del mouse è già stato utilizzato per testare immunoterapia avvicina unnd diversi farmaci chemioterapici cancro 8,9. La loro efficacia è stata valutata determinando l'evoluzione del carico tumorale e il tasso di sopravvivenza. Questo protocollo può essere utilizzato per fornire ulteriori informazioni sulla distribuzione e la sussistenza delle popolazioni di cellule ematopoietiche leucemiche e altri durante il trattamento.
Protocollo
stabulazione degli animali e tutte le procedure sperimentali sono state approvate dal Comitato Etico cura degli animali locali, CEEA.NPDC (accordo no.512012), e tutti gli esperimenti sono stati eseguiti in conformità con le linee guida francesi ed europei per la cura e l'uso di animali da laboratorio.
1. Caratterizzazione in vitro della linea cellulare C1498
- In coltura in vitro di cellule C1498
- Preparare RPMI completo (Roswell Park Memorial Institute) 1640 aggiungendo 50 ml di siero fetale bovino (FBS), 5 ml di penicillina (100 U / ml) -streptomycin (100 mcg / ml), 500 ml di 50 mM β-mercaptoetanolo , 5 ml di N-2 hydroxyethylpiperazine-N-2-etan-solfonico (HEPES), 5 ml di aminoacidi non essenziali e 5 ml di piruvato di sodio e 500 ml di terreno RPMI.
- Far crescere la linea cellulare C1498 in RPMI completo. Raccogliere le cellule in sospensione pipettando, e trasferire le cellule in una provetta da 50 ml. Centrifugare a 350 xg per 10 min, e rimuovere la supernatant.
- Aggiungere 20 ml di soluzione salina tamponata con fosfato (PBS) (1x) soluzione, centrifugare a 350 xg per 10 minuti e rimuovere il surnatante.
- Risospendere le cellule in 10 ml di Fluorescence Activated cellulare Sorter tampone (FAC) (2,5 g di albumina sierica bovina BSA in polvere () e 2 ml di acido etilendiamminotetraacetico) soluzione 0,5 M (EDTA in 500 ml di soluzione PBS). Contare le cellule utilizzando una cella Thoma contando camera dopo colorazione delle cellule con trypan blu.
- La caratterizzazione fenotipica della linea cellulare C1498 con immunostaining e citometria a flusso di analisi
- colorazione della superficie cellulare
- Preparare tampone FAC.
- Regolare le cellule raccolte in tampone FAC a 10 7 cellule / ml e dispensare 10 6 cellule (in 100 ml) per ogni esperimento colorazione in citometria a flusso tubi.
- Etichettare le cellule con 100 ml di seguenti anticorpi o loro controlli isotipo associati diluiti in tampone FAC:
- Moduloarkers di precursori e cellule differenziate, etichettare le cellule con anti-CD11b / anti-CD18 (1), anti-Ly-6G (1), anti-CD19, anti-B220 (2), anti-NK1.1, anti- CD49b, anti-CD4 (1), anti-CD8 (2), anti-CD3 (3), anti-CD21 / 35, anti-CD115 e anti-TCRVβ anticorpi.
- Per ematopoietiche cellule staminali / progenitrici marcatori, utilizzare una combinazione di anti-CD34 / anti-CD117 / anti-Sca-1, anti-CD150 / anti-CD117 / anti-Sca-1, anti-CD117 / anti-CD127 o anti- CD16 anticorpi / 32-biotina solo.
- Per i marcatori di funzioni cellulari (ad esempio, l'adesione, la presentazione dell'antigene, molecole co-stimolatorie e recettori), macchiare le cellule con anti-CD18 (2) / anti-CD11a, anti-MHC di classe I, anti-MHC di classe II, anti- CD31, anti-CD44, anti-CD80-biotina, anti-CD86 e anti-CD274 anticorpi.
- Incubare tutto il flusso citometria provette a 4 ° C per 30 min.
- Lavare le cellule due volte con l'aggiunta di 2 ml di tampone FACS ciascuna provetta, centrifugare a 350 xg per 5 min, e rimuovere il surnatante.
- Aggiungere 100 ml di tampone FAC a ciascuna provetta e procedere alla colorazione secondario con l'aggiunta di 100 ml di streptavidina fluorescente (1/100 in tampone FAC per una diluizione finale di 1/200) per gli anticorpi biotinilato-coniugati. Incubare le provette a 4 ° C per 30 min.
- Lavare le cellule due volte come segue: aggiungere 2 ml di tampone FAC a ciascuna provetta, centrifugare le provette a 350 xg per 5 minuti e rimuovere il surnatante pipettando.
- Risospendere le cellule in 500 microlitri di PBS freddo e posizionare le cellule in ghiaccio, mantenendole al buio utilizzando un foglio di alluminio per coprire i tubi. Analizzare i risultati utilizzando un citometro 10.
- colorazione intracellulare
- Preparare tampone di fissaggio aggiungendo 125 ml di una soluzione al 4% paraformaldeide (PFA) a 375 ml di soluzione PBS.
NOTA: Per preparare 500 ml di 4% PFA, calore 400 ml di soluzione PBS a circa 60 ° C su una piastra di agitazione in una cappa ventilata. Aggiungere 20 g di polvere di PFA, ed aumentare il pHfinché la PFA è sciolto. Lasciare che la soluzione per il raffreddamento, regolare il pH a 6.9, e portare il volume a 500 ml con PBS. - Preparare il buffer permeabilizzante aggiungendo 0,5 g di saponina e 0,5 g di BSA a 500 ml di soluzione PBS.
- Regolare le cellule raccolte in tampone FAC a 10 7 cellule / ml e distribuire 10 6 delle cellule (100 ml) per ogni esperimento colorazione in citometria a flusso tubi. Centrifugare le cellule a 350 xg per 5 min, e rimuovere il surnatante.
- Fissare le cellule in 200 ml di soluzione 1% PFA e incubare per 10 min a 4 ° C.
- Aggiungere 2 ml di tampone permeabilizzante a ciascuna provetta, centrifugare le provette a 350 xg per 5 minuti e rimuovere il surnatante pipettando. Aggiungere 100 ml di permeabilizzante buffer per ogni provetta.
- Etichetta le cellule con 100 microlitri dei seguenti anticorpi o loro controlli isotipo corrispondenti dopo averli diluendo in permeabilizzante buffer: anti-CD3 (2) / anti-CD8 (1), anti-CD3 (3) / aNTI-CD4 (2), anti-CD107b e anti-CD3 (3) / anti-TCRVβ.
- Incubare le cellule a 4 ° C per 30 min.
- Lavare le cellule due volte con l'aggiunta di 2 ml di permeabilizzante buffer per ciascuna provetta. Centrifugare le provette a 350 xg per 5 minuti e rimuovere il surnatante.
- Aggiungere 100 ml di permeabilizzante buffer per le cellule. Procedere alla colorazione secondario con l'aggiunta di 100 ml di streptavidina fluorescente diluito in permeabilizzante buffer per anticorpi biotinilati-coniugati. Incubare le provette a 4 ° C per 30 min.
- Aggiungere 2 ml di permeabilizzante buffer per ciascuna provetta, centrifugare le provette a 350 xg per 5 minuti e rimuovere il surnatante. Ripetere questo passaggio ancora una volta.
- Risospendere le cellule in 500 microlitri di PBS freddo, e quindi posizionare le cellule in ghiaccio al buio. Analizzare i risultati utilizzando un citofluorimetro 10.
- Preparare tampone di fissaggio aggiungendo 125 ml di una soluzione al 4% paraformaldeide (PFA) a 375 ml di soluzione PBS.
- colorazione della superficie cellulare
- Preparazione di una sospensione cellulare su vetrini per microscopia
- Lavare 10 6 dell'HAcellule rvested C1498 (ottenuto nel passaggio 1.1.4) con 5 ml di FAC freddo tampone due volte, e diluire le cellule in 1 ml di tampone FAC freddo. Mettere i tubi in ghiaccio.
- Collocare i vetrini in camere monouso con schede di filtro pre-attached e mettere questi in un citocentrifuga.
- Aggiungere 100 ml di tampone FAC per ogni carta da camera e filtro, e girare per 2 min a 4,52 x g.
- Aggiungere 100 microlitri di cellule per ogni carta camera e filtro, e far girare le cellule a 4.52 xg per 2 min.
- Rimuovere con attenzione le diapositive dalle camere e aria asciugare i vetrini prima di colorazione con mieloperossidasi (passo 1,4), esterasi (passo 1.5) o maggio-Grünwald Giemsa (passo 1,6).
- colorazione mieloperossidasi per immunofluorescenza
- Fissare le cellule sui vetrini immergendo i vetrini in un metanolo freddo: acetone (1: 1) soluzione per 2 minuti, e poi aria asciugare i vetrini.
- Per limitare il liquido alla superficie del vetrino contenente le cellule, disegnare un ciicona circolare intorno alle cellule utilizzando una penna idrorepellente.
- Lavare le cellule in 200 microlitri di soluzione di PBS freddo per 10 min.
- Bloccare le cellule in 200 ml di 3% BSA / PBS contenente 10 ml di siero normale di asino e 10 ug / ml di purificati anti-CD16 / 32 anticorpi.
- Applicare 200 microlitri della mieloperossidasi anti-topo (diluito a 20 ug / ml in 3% BSA / PBS). Incubare le cellule O / N a 4 ° C in una camera umida.
- Lavare le cellule con 200 ml di freddo 0,1% BSA / PBS.
- Applicare 200 ml di anticorpi IgG anti-capra diluito a 1/250 nel 3% BSA / PBS. Incubare le cellule per 2 ore a temperatura ambiente in una camera umida.
- Lavare le cellule 3 volte con 200 ml di 0,1% BSA / PBS e due volte in PBS freddo.
- Stain i nuclei delle cellule con 200 ml di Hoechst diluito a 1 / 1.000 in PBS (ad una concentrazione finale di 1 mg / ml) per 2 minuti a temperatura ambiente.
- Lavare i vetrini con acqua e lasciare asciugare prima di mounting. Applicare una goccia di mezzo di montaggio 1 alle celle, posizionare un bordo di una copertura in vetro sul vetrino, e con attenzione abbassarlo sulle cellule usando pinze. Premere leggermente sul coperchio di vetro per eliminare eventuali bolle d'aria.
- esterase cytochemistry
Nota: Pre-caldi tutti i reagenti a RT.- preparazione fissativo
- Per preparare la soluzione di citrato-acetone-formaldeide (CAF), aggiungere 2,5 ml di soluzione di citrato, 6,5 mi di acetone e 0,8 ml di formaldeide al 37% ad una bottiglia di vetro. Mescolare delicatamente e conservare a 4 ° C.
- Naftolo AS-D cloroacetato esterasi (CAE) saggio di attività
- acqua deionizzata calda a 37 ° C.
- In un tubo da 50 ml, aggiungere 1 ml di soluzione di nitrito di sodio per 1 ml di soluzione colorante. Mescolare delicatamente e lasciare riposare per 2 minuti. Aggiungere 40 ml di acqua deionizzata pre-riscaldato, 5 ml di pH 6,3 tampone concentrato e 1 ml di soluzione di naftolo AS-D cloroacetato. Mescolare e trasferire in una vaschetta Coplin.
- Fissare le cellule su ladiapositive (vedere paragrafo 1.3) per 30 sec con la soluzione CAF (vedi punto 1.5.1.1), e lavare i vetrini per 45 secondi con acqua deionizzata.
- Trasferire i vetrini nella soluzione che è stata preparata nel passaggio 1.5.2.2, e incubare i campioni a 37 ° C per 30 minuti in una camera umida protetta dalla luce.
- Essiccare i vetrini e poi lavare via immersione in acqua deionizzata per 2 min.
- Controcolorare le cellule aggiungendo alcune gocce di soluzione ematossilina e incubando per 1 min.
- Lavare i vetrini con acqua neutra (pH 7) e lasciarli asciugare. Applicare una goccia di mezzo di montaggio 2 alle cellule, posizionare un bordo di una copertura in vetro sul vetrino e con attenzione abbassarlo sulle cellule usando pinze. Premere leggermente sul coperchio di vetro per eliminare eventuali bolle d'aria.
- Alpha-naftil butirrato esterasi (NBE) saggio di attività
- soluzione butirrato α-naftil Riscaldare a 37 ° C prima dell'uso.
- Diluire una compressa di nit di sodiorito a 6,25 ml di acqua deionizzata.
- In un tubo da 50 ml, aggiungere 1,5 ml di una soluzione tablet nitrito di sodio e 1,5 ml di una soluzione di pararosanilina. Mescolare delicatamente e lasciare riposare la soluzione per 5 min. Integrare la soluzione con 40 ml di soluzione tampone fosfato. Portare a pH 6 con l'aggiunta di cura 10 N NaOH goccia a goccia. Aggiungere 5 ml della soluzione butirrato α-naftil, miscelare l'intera soluzione, e trasferirlo in una vaschetta Coplin.
- Fissare le cellule su vetrini per 10 secondi utilizzando la soluzione CAF a RT e sciacquare per 45 sec con acqua deionizzata.
- Trasferire i vetrini in vaso Coplin contenente la soluzione che è stata preparata nel passaggio 1.5.3.2 e incubare insieme per 1 ora a 37 ° C in una camera umida mentre protettivo dalla luce.
- Risciacquare i vetrini per 2 min in acqua neutra (pH 7) e aria secca.
- Controcolorare le cellule con soluzione di blu di metilene aggiungendo alcune gocce sul vetrino e incubare per 4 min.
- Immergere i vetrini in Deioacqua sciuto per 2 minuti e lasciare asciugare all'aria. Per montare le diapositive, applicare una goccia di mezzo di montaggio 2 alle cellule, posizionare un bordo del coprioggetti sul vetrino, e con attenzione abbassarlo sulle cellule usando pinze. Premere leggermente sul coperchio di vetro per eliminare eventuali bolle d'aria.
- preparazione fissativo
- May-Grünwald Giemsa (MGG) colorazione
- Colorare le cellule (preparati nella sezione 1.3), immergendo i vetrini in una vaschetta Coplin contenente soluzione maggio-Grünwald per 3 min.
- Trasferire i vetrini in una vaschetta Coplin contenente la soluzione tampone pH 6,8 per 1 min.
- Colorare le diapositive mettendoli in una vaschetta Coplin contenente la soluzione Giemsa R (diluito a 1/20 in pH della soluzione 6,8 buffer) per 10 minuti. Lavare i vetrini con acqua neutra (pH 7) per 10 secondi.
- Scolare e aria asciugare le diapositive. Montare le diapositive mediante l'applicazione di una goccia di mezzo di montaggio 2 sulle cellule. Inserire un bordo del coprioggetti sul vetrino ed abbassare sualle cellule con pinze. Premere leggermente sul coperchio di vetro per eliminare eventuali bolle d'aria.
2. In Vivo Sviluppo e caratterizzazione di leucemia acuta
NOTA: quattro settimane di età topi C57BL / 6J-Ly5.1 congenic femminili sono stati mantenuti in condizioni esenti da organismi patogeni specifici (ad esempio, in un ambiente sterile). I topi sono stati iniettati quando erano tra 5 e 6 settimane.
- L'iniezione endovenosa con cellule C1498
- Raccogliere le cellule C1498 in coltura in sospensione pipettando. Trasferire le cellule in una provetta da centrifuga da 50 ml e 350 xg per 10 min. Lavare le cellule in 10 ml di PBS freddo due volte, e preparare una sospensione cellulare di 10 7 cellule / ml in PBS. Posizionare la sospensione cellulare in ghiaccio prima di eseguire l'iniezione.
- Posizionare il mouse in un dispositivo di immobilizzazione ed eseguire l'iniezione in condizioni sterili in una cappa a flusso laminare.
- Utilizzare un ago 29G con una siringa per iniettare le cellule nelvena della coda. Afferrare la coda all'estremità distale, e disinfettare con una garza imbevuta di etanolo al 70%. Controllare per essere sicuri che non vi siano bolle d'aria nella siringa, e poi iniettare lentamente 100 ml di sospensione cellulare C1498 (10 6 celle) nella vena della coda.
- Dopo l'iniezione, rimuovere l'ago dalla coda, e controllare qualsiasi sanguinamento facendo pressione con una garza sterile al sito di iniezione. Rispedire l'animale verso la sua gabbia, e controllare attentamente la sua salute nel corso dei prossimi giorni e ore.
- Retro raccolta del sangue orbitale
- Monitorare il comportamento dei topi PBS- e C1498-iniettati per i segni della malattia leucemica (ad esempio, piloerezione, l'isolamento dal gruppo, e la riduzione o assenza di movimenti nella gabbia).
NOTA: Questo si verifica di solito tra i 17 a 19 giorni dopo che le cellule vengono iniettate. - Eseguire retrò raccolta del sangue orbitale poco prima di eutanasia (vedere il punto 2.2.7) in condizioni sterili in un flusso laminarecappuccio e sotto una lampada di riscaldamento per impedire ipotermia.
- Per l'anestesia, usare ketamina a 150 mg / kg e xilazina a 10 mg / kg. Preparare la soluzione anestetica diluendo 1,5 ml di ketamina e 0,5 ml di xilazina in 18 ml di soluzione PBS.
- Anestetizzare il controllo e topi leucemiche. Procedere con una iniezione intraperitoneale di 200 microlitri della soluzione di anestetico per 10 g di mouse utilizzando un ago 26G e una siringa da 1 ml. Controllare la perdita del riflesso pedale per confermare l'anestesia.
- Inserire un tubo capillare nel canto mediale dell'occhio. Il sangue salirà dal seno orbitale nel tubo capillare. Controllare il sanguinamento applicando delicatamente pressione sulla occhio con una garza sterile.
NOTA: Un volume di 100 a 200 ml di sangue può essere raccolto utilizzando questa tecnica. - Raccogliere il sangue in una provetta EDTA, e memorizzare il campione sul ghiaccio prima isolare le cellule mononucleate.
- Euthanize il mouse utilizzando dislocazione cervicale, eprocede ad isolare gli organi (sezione 2.3).
- Monitorare il comportamento dei topi PBS- e C1498-iniettati per i segni della malattia leucemica (ad esempio, piloerezione, l'isolamento dal gruppo, e la riduzione o assenza di movimenti nella gabbia).
- Organi e cellule isolamento
- isolamento organi
- Posizionare il mouse eutanasia sul dorso su una scheda di plastica e utilizzare aghi per appuntare i piedi degli animali per facilitare l'isolamento di organi. Disinfettare il mouse utilizzando etanolo al 70% prima di eseguire un'incisione.
- Utilizzando forbici sterili, eseguire una incisione ventrale dalla pelle addominale al collo. Tagliare attraverso la parete addominale per accedere al fegato. Tagliare attraverso la gabbia toracica e il diaframma per accedere ai polmoni. Spostare l'intestino a lato e rimuovere la milza con le forbici e pinze sterili.
- Per isolare il midollo osseo, tagliare le gambe in cima femori sopra il giunto usando forbici sterili. Staccare la tibia dal femore tirando delicatamente, e togliere la pelle ed i muscoli dalle ossa con pinze e forbici.
- Posizionare ogni organo e tessuto osseo in un tubo da 50 ml contenente PBS freddo, e disporli sul ghiaccio.
- Isolamento di cellule provenienti da organi
- Pesare la milza prima di interrompere le cellule. Meccanicamente interrompere la milza, polmoni e fegato da loro pressione attraverso un colino 70 micron utilizzando un stantuffo della siringa in un tubo da 50 ml, e raccogliere le cellule in 30 ml di PBS freddo.
- Per raccogliere le cellule del midollo osseo, mettere i femore e tibia in un piatto Petri sul ghiaccio, tagliare le estremità usando forbici sterili, e lavare il midollo osseo inserendo un ago 26G attaccato ad una siringa da 10 ml contenente 5 ml di PBS freddo.
- Frantumare le cellule del midollo osseo facendo passare la sospensione cellulare attraverso l'ago / siringa e filtrare la sospensione cellulare attraverso un filtro 70 micron in un tubo da 50 ml.
- Centrifugare tutte le provette contenenti ciascuno degli organi e le cellule del midollo osseo a 350 xg per 10 min. Eliminare il supernatante e risospendere le cellule raccolte dal polmoni e midollo osseo in 2 ml di tampone di lisi (1x) e la cellas isolato dal fegato e milza in 5 ml di tampone di lisi (1x) pipettando delicatamente la miscela su e giù. Riempire i tubi a 50 ml con PBS freddo.
- Centrifugare le cellule a 350 xg per 10 min. Risospendere le cellule in tampone FAC per l'analisi citometria di flusso o per preparare le cellule per la microscopia. Contare le cellule utilizzando una camera di conteggio delle cellule Thoma dopo di loro colorazione con trypan blu.
- isolamento organi
- Cellulare di superficie colorazione di cellule isolate da organi di citometria a flusso
- In un tubo di citometria a flusso, etichetta 10 6 cellule che sono stati isolati da organi con 10 mg / ml di purificati anti-CD16 / 32 anticorpi in 100 ml di tampone FAC.
- Per 10 6 cellule di midollo osseo, aggiungere 100 ml dei seguenti anticorpi o combinazioni di anticorpi e loro controlli isotipo corrispondenti diluiti in tampone FACs: anti-CD11b / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-B220 (1) /anti-CD45.2/anti-CD19, anti-CD115 / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-CD45.2, anti-Ly6G (2), anti-CD11b, anti-CD115 o da soli per le impostazioni di compensazione anti-CD19.
- Per splenociti, aggiungere 100 ml dei seguenti anticorpi e loro controlli isotipo corrispondenti diluiti in tampone FAC: una combinazione di anti-CD11b / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-B220 (1 ) /anti-CD45.2/anti-CD19, anti-CD45.2, anti-Ly6G (2), anti-CD11b o anti-CD19 per le impostazioni di compensazione.
- Per cellule polmonari ed epatiche, aggiungere 100 ml di anticorpi anti-CD45.2 e il suo controllo isotipo corrispondente diluito 1/100 in tampone FAC.
- Incubare tutte le soluzioni di cellule per 30 minuti a 4 ° C.
- Lavare le cellule con l'aggiunta di 2 ml di tampone FAC a ciascuna provetta. Centrifugare le provette per 5 min a 350 xg e scartando il surnatante pipettando. Ripetere questo passaggio ancora una volta.
- Risospendere le cellule marcate in 500 ml di PBS freddo. Mantenere le cellule in ghiaccio e al riparo dalla luce prima di eseguire citometria a flusso per ACquisizione e l'analisi 10.
- L'isolamento di cellule mononucleate del sangue e immunofluorescenza colorazione per il flusso di analisi di citometria
- Prima di avviare il protocollo, pre-riscaldare la soluzione di separazione a RT.
- Trasferire il campione di sangue (100 a 200 microlitri, ottenuto dalla fase 2.2) in una provetta, e aggiungere PBS / soluzione 1 mM EDTA finché il volume della soluzione è di 500 microlitri. strato cautela 500 ml di soluzione sotto separare la soluzione contenente il sangue usando un ago 30G e una siringa da 1 ml. Non mescolare il sangue e la soluzione di separazione.
- Centrifugare le provette a 800 xg (senza freno) per 20 minuti a RT. Dopo la centrifugazione, raccogliere l'anello cellulare (lo strato bianco opaco) con una pipetta. Trasferire le cellule in una provetta.
NOTA: Lo strato opaco bianco contiene linfociti e monociti e appare tra lo strato inferiore - la soluzione di separazione - e lo strato superiore. - Aggiungere 1 mldi soluzione di PBS e centrifugare la provetta a 350 xg per 10 min. Risospendere le cellule in 600 ml di tampone FAC.
- Aggiungere 10 ug / ml di purificati anti-CD16 / 32 anticorpi e distribuire 100 microlitri della sospensione cellulare in sei tubi separati (100 ml ciascuna).
- Etichetta le cellule con 100 ml di i seguenti anticorpi o loro controlli isotipo associati diluiti in tampone FACs: una combinazione di anti-CD3 (1) / anti-B220 (1) /anti-CD45.2 e anti-Ly6C / anti-CD115 /anti-CD45.2 o anti-CD45.2 e solo per le impostazioni di compensazione anti-CD115.
- Incubare tutte le provette a 4 ° C per 30 min.
- Lavare le cellule con l'aggiunta di 2 ml di tampone FAC a ciascuna provetta, e quindi centrifugare le provette per 10 minuti a 350 xg, e scartare il surnatante con una pipetta.
- Risospendere le cellule marcate in 500 ml PBS freddo. Mantenere le cellule in ghiaccio e al riparo dalla luce prima di eseguire citometria a flusso acquisizione e l'analisi 10.
- Preparazione di sospensioni cellulari di midollo osseo su vetrini per microscopia
- Seguire i passaggi descritti nella sezione 1.3, ma al punto 1.3.1, utilizzare 10 5 cellule del midollo osseo, e al punto 1.3.4, far girare le cellule in ciascuna camera a 72.26 xg per 10 min.
- saggi di attività esterasi utilizzando cellule del midollo osseo
- Per eseguire i test esterasi Citochimica midollo osseo, procedere da 1,5 a passi 1.5.3.7.
- May-Grünwald Giemsa colorazione delle cellule del midollo osseo
- Per colorare le cellule del midollo osseo, seguire il protocollo descritto nella sezione 1.6, ma al punto 1.6.1, incubare i vetrini in soluzione maggio-Grünwald per 5 min.
Risultati
A caratterizzare il modello C1498 del mouse, si è proceduto con due fasi principali. Innanzitutto, le cellule C1498 sono stati caratterizzati per determinare la loro ematopoietiche lineage e maturazione fase in vitro (Figura 1). Queste cellule sono state iniettate in topi congenic, e la natura della malattia leucemica indotta è stata valutata per determinare caratteristiche differenti: infiltrazione di cellule leucemiche, il loro fenotipo, la quantificazione delle cellule ematopoietiche (mature e progenitori / precursori) nel midollo osseo, le frequenze di C1498 cellule e cellule ematopoietiche mature nel sangue e una valutazione di gonfiore organo (nella milza, fegato e polmoni) e composizione cellulare.
Per caratterizzare i fenotipi di cellule C1498 in vitro, le cellule sono state marcate con anticorpi diretti contro molecole che sono espresse da precursori emopoietici e cellule mature (Tabella 1), ei risultati sono stati analizzati utilizzando cytomet flussory. Le cellule C1498 sono stati positivi per l'espressione superficie cellulare di Mac-1 (CD11b / CD18) (~ 7%), B220 (> 25%), e sono visualizzati espressione intracellulare di CD3ε, T-cellule recettore catene (TCR) Vβ e Mac -3 (figure 2A e B). Le celle sono risultati negativi per i marcatori di superficie cellulare Ly6G, Ly6C, CD115, CD21 / CD35, CD19, CD3, CD4, CD8, NK1.1, e pan-NK molecole e per l'espressione intracellulare di CD4 e CD8 (dati non riportati) . Sono stati poi esaminati per i marcatori di cellule staminali ematopoietiche e progenitori (Tabella 1). Essi sono stati anche negativi per l'espressione della superficie delle cellule del CD117, CD34, Sca-1, CD150 e CD16 / 32 (dati non riportati). Queste cellule leucemiche sono stati poi sottoposti a test per determinare l'espressione di adesione, presentazione dell'antigene e molecole co-stimolatore. Le cellule espressi i marcatori di superficie LFA-1 (CD11a / CD18), CD44, CD31 (PECAM-1), e H-2D B e sono risultati negativi per MHC di classe II, CD80, CD86 e CD274 (dati non riportati). C1498 cellule Therefore espresso sia mieloide (Mac-1, Mac-3) e marcatori linfoidi (B220, CD3, TCR).
Per caratterizzare meglio il loro lignaggio ematopoietico, espressione mieloperossidasi è stata valutata utilizzando la microscopia di immunofluorescenza. Tutte le cellule erano positive per la mieloperossidasi, che ha verificato la loro origine mieloide (Figura 3A). La maggior parte delle cellule anche macchiato positivo per esterasi α-naftil butirrato (Figura 3B, pannello di sinistra), e alcuni di loro macchiato per le naftolo AS-D cloroacetato esterasi (frecce nere) (Figura 3B, pannello di destra). I risultati indicano che le cellule contengono miscele di cellule monociti e granulocitari. Dopo il maggio-Grünwald Giemsa colorazione è stata eseguita, le cellule C1498 sono state osservate per visualizzare una morfologia blast-come con un elevato rapporto nucleo-citoplasmatica, da 3 a 5 nucleoli nel nucleo, un alone perinucleare, numerosi vacuoli e un citoplasma basofile (Figura 3C ). thnoi, la linea cellulare C1498 è composta da monoblasti e mieloblasti.
Le cellule C1498 (CD45.2 +) sono stati poi iniettata per via endovenosa in CD45.1 + topi. I topi ha ceduto 17 a 19 giorni dopo le cellule sono state iniettate. Questi topi sono stati sacrificati in modo che il loro tipo di leucemia potrebbe essere analizzato prima di morire a causa della malattia. I topi di controllo, che sono stati iniettati con PBS, sono stati analizzati negli stessi punti di tempo per il confronto. I topi C1498 cellule iniettate visualizzata massiva infiltrazione di cellule C1498 nel loro midollo osseo, come dimostrato dalla comparsa blast-simili delle cellule dopo May-Grünwald Giemsa è stato eseguito (Figura 4A). Essi hanno inoltre conservato la loro monociti e fenotipi granulocitari (Figura 4B e C), dimostrando un accumulo di cellule monoblastiche e mieloblastiche che è caratteristica della leucemia mielomonocitica acuta.
Da fareetermine se midollari numeri cellule ematopoietiche sono state inferiori a seguito dell'invasione cellule leucemiche, CD45.2 + C1498 cellule, B linfocitica, monociti e le popolazioni granulocitari (compresi i progenitori, i precursori e cellule mature), sono stati quantificati con immunofluorescenza colorazione e il flusso multi-parametrica citometria. cellule leucemiche rappresentati da 16 a 36% delle cellule ematopoietiche (dati non mostrati). Gli altri tipi di cellule sono stati tutti presenti in numero significativamente più bassi nei topi C1498-iniettati che nei topi PBS-iniettati (per 5 volte, in media, per i sottoinsiemi di cellule B, media per le cellule granulocitari e 3 volte in media 4 volte su per sottoinsiemi monociti) (Figura 5A a C).
Un'indagine delle frequenze di cellule mononucleari in campioni di sangue leucemiche e mouse di controllo ha mostrato di contenere una percentuale comparabile di linfociti (Figura 6A), ma una maggiore frequenza di monociticae cellule leucemiche. Queste caratteristiche sono rappresentative della leucemia mielomonocitica acuta 11 (figura 6B).
Tra le altre caratteristiche di leucemia mielomonocitica acuta 12, i topi C1498-iniettati presentati con fegati gonfi (epatomegalia), polmoni e milza (splenomegalia) (Figura 7a). Varie frequenze di cellule CD45.2 + C1498 sono stati rilevati in questi organi usando immunofluorescenza colorazione e citometria a flusso (Figura 7B). Come splenomegalia può derivare da un numero elevato di monociti infiltrati, abbiamo anche stimato le proporzioni delle popolazioni della milza. Il numero di cellule nel B linfocitica, monocitica e frazioni cellulari granulocitari erano significativamente più grande, con una media di 2 volte, 2,5 volte e 3 volte, rispettivamente, nella milza leucemiche che in milza controllo (Figura 7c).
thin-page = "1"> 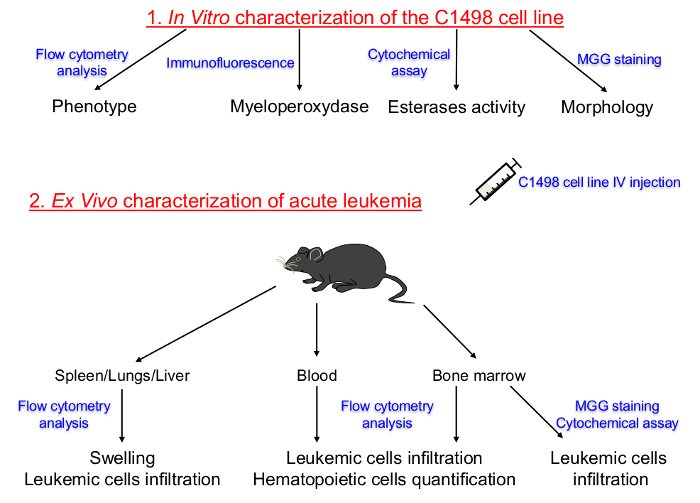
Figura 1. Rappresentazione schematica del protocollo Set Up per Caratterizzare in vitro coltivate C1498 linee cellulari e in descrizioni vivo di leucemia acuta. Il lignaggio ematopoietiche e la fase di differenziazione delle cellule C1498 tessuti in coltura sono stati prima determinata. cellule C1498 sono state iniettate in topi congenic per indurre lo sviluppo di leucemia acuta. L'isolamento di midollo osseo, sangue periferico, milza, fegato e tessuti del polmone è stato effettuato per determinare le frequenze, fenotipi e cambiamenti morfologici dopo che le cellule infiltrazione C1498. IV: MGG endovenosa:. May-Grünwald Giemsa Cliccate qui per vedere una versione più grande di questa figura.
annuncio / 54270 / 54270fig2.jpg "/>
Figura 2. Analisi fenotipica delle cellule C1498 dopo coltura in vitro. Flusso rappresentante citometria dot plots e istogrammi di superficie delle cellule (A) e intracellulare (B) C1498-espresso molecole che sono stati associati con ematopoietiche differenziazione delle cellule mature sono mostrati. cellule C1498 sono state raccolte da culture, lavate ed etichettati utilizzando anticorpi fluorescenti che erano specifiche per la superficie delle cellule CD11b, CD18 e marcatori B220 o loro controlli isotipo. Per la colorazione intracellulare, le cellule sono state fissate, permeabilizzate ed etichettati utilizzando anticorpi diretti contro Mac-3, CD3ε, e un epitopo comune del TCR (T-Cell Receptor) catena Vβ o loro controlli isotipo. Le analisi sono state eseguite utilizzando gating con cellule vive. Si prega di cliccare qui per vedere una versione più grande di questa figura.
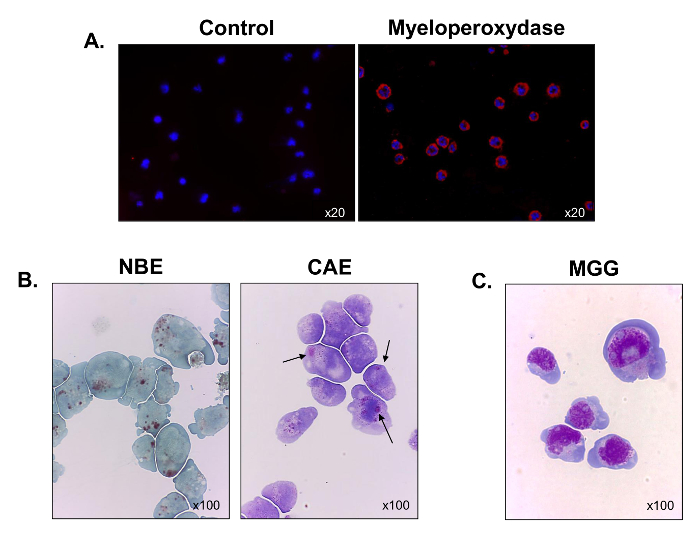
Figura 3. Caratterizzazione funzionale e morfologica delle cellule in coltura C1498. Cellule C1498 sono state raccolte da culture e centrifugate su vetrini per la microscopia. (A) di colorazione per l'espressione mieloperossidasi è stata effettuata utilizzando immunofluorescenza. (B) reazioni citochimici sono stati usati per analizzare l'esterasi α-naftil butirrato (NBE) e naftolo AS-D cloroacetato esterasi (CAE) attività in cellule C1498. Le cellule sono state considerati positivi per ciascuna etichetta quando marrone e rosso-viola, grandi granuli citoplasmatici, rispettivamente, sono stati osservati. (C) May-Grünwald Giemsa (MGG) colorazione C1498 cellule. Per ogni esperimento colorazione, l'ingrandimento dell'obiettivo microscopio è indicato. Ogni immagine rappresentativa tre esperimenti separati.large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
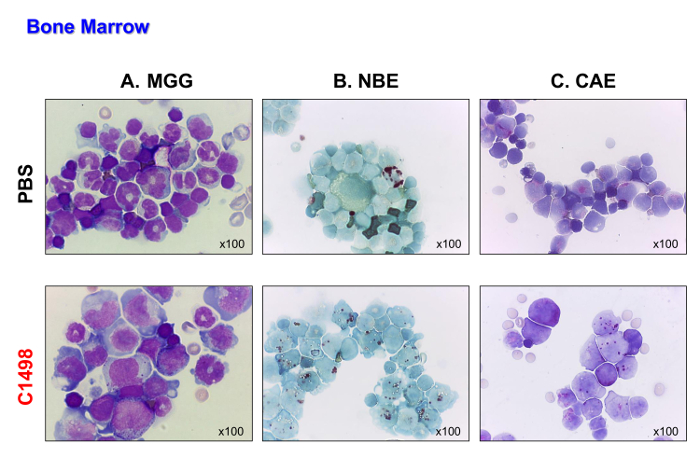
Figura 4. I topi di midollo osseo Morfologie in PBS- e C1498-iniettato. Cellule del midollo osseo sono stati isolati da PBS- e topi cellule iniettate C1498 e centrifugati su vetrini per la microscopia. (A) May-Grünwald Giemsa (MGG) colorazione. (B ) esterasi α-naftil butirrato (NBE) e naftolo (C) AS-D funzioni cloroacetato esterasi (CAE) sono stati valutati utilizzando citochimica. Nel pannello A, la band (immaturi) o segmentati neutrofili (maturi) sono meno visibili nel midollo osseo dei topi C1498-iniettati rispetto ai topi PBS-iniettati. Pannello B e C indicano che c'era un accumulo di cellule monocitiche e granulocitari nel midollo osseo leucemico rispetto ai numeri osservati nel controllo midollo osseo. Tuttianalisi al microscopio sono state eseguite utilizzando un obiettivo di ingrandimento 100X. Cliccate qui per vedere una versione più grande di questa figura.
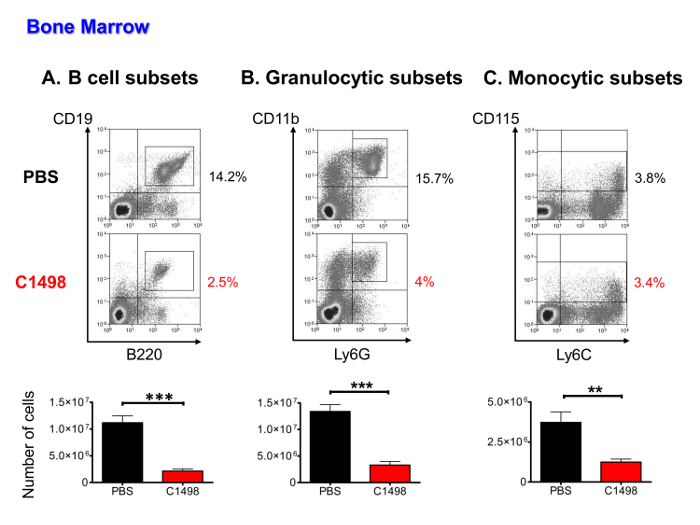
Figura 5. I topi analisi quantitativa delle popolazioni midollari in PBS- e C1498-iniettato. Cellule del midollo osseo sono stati isolati da PBS- e topi cellule iniettate C1498 e stimati dopo il conteggio delle cellule è stata eseguita. Le frequenze delle varie popolazioni cellulari sono stati determinati dopo immunostaining e il flusso delle cellule gated vivo analisi di citometria a. (A) I sottoinsiemi di cellule B inclusa + cellule CD19 + B220 a fasi, dalla cellule pro-B a maturare linfociti B (B), le cellule granulocitari nel CD3 - e CD11b + Ly6G + lignaggi, che comprendeva un precursori. ND granulociti immaturi e maturi (C) I sottoinsiemi monociti sono stati definiti come CD3 - CD115 + e inclusi cellule nel progenitrici di maturare fasi monociti. n = 7 topi / gruppo, ei dati sono presentati come istogrammi mostrano le medie ± SEM. ***, P <0,0001 e **, p <0,01, test di t-di Student spaiato confrontando PBS- e topi C1498-iniettati. Fai clic qui per vedere una versione più grande di questa figura.
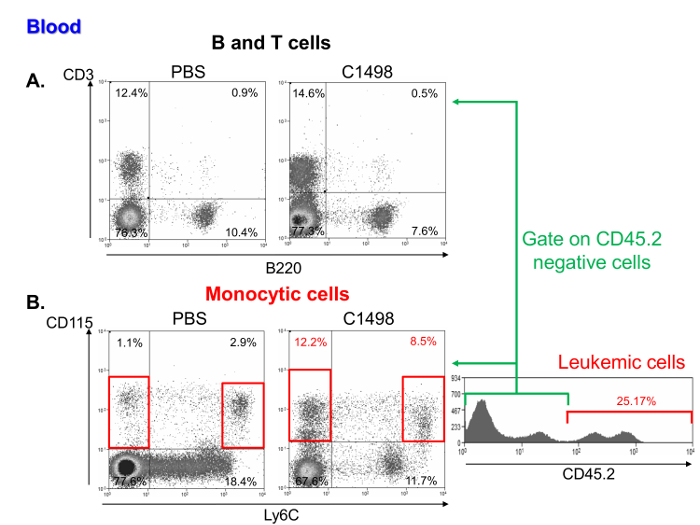
Figura 6. Analisi del sangue di mononucleari sottopopolazioni cellulari in PBS- e topi C1498-iniettato. Flusso rappresentante citometria punti appezzamenti di (A) T e B percentuali linfociti, che sono stati, rispettivamente, definiti come le cellule CD3 + + e B220 in PBS- e C1498 cellule iniettate. topi (B) frequenze di cella monocitica in C1498 leucemica e controllo (PBS) i topi sono stati determinati analizzando CD115 + Ly6C - e CD115 + Ly6C alte cellule. L'analisi è stata eseguita da gating cellule vive. Per confrontare i topi leucemici e controllo, CD45.2 + sono stati esclusi C1498 cellule. Clicca qui per vedere una versione più grande di questa figura.
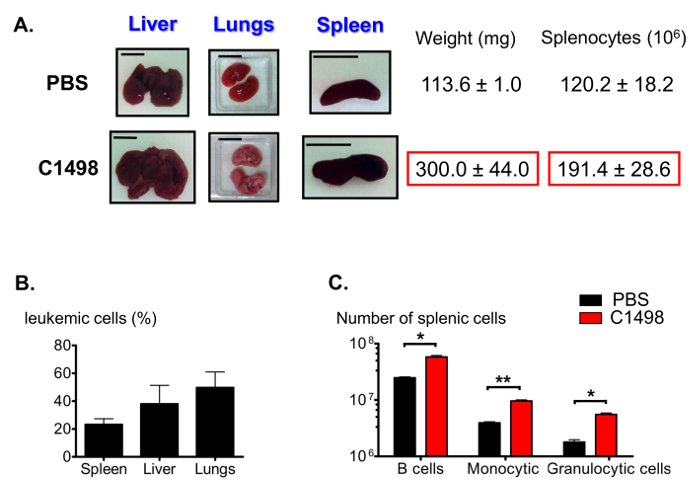
Figura 7. Stima della splenici popolazioni leucemiche e topi di controllo. (A) fotografie rappresentativi di fegato, polmone e della milza gonfiore nei topi leucemica rispetto ai topi di controllo. Milze sono stati raccolti e pesati, e splenociti sono stati contati dopo interruzione del tessuto. (B) Istogramma che rappresenta le frequenze di cellule leucemiche in difforgani erenti dopo immunocolorazione è stata effettuata per le cellule CD45.2 + ei risultati sono stati analizzati mediante citometria a flusso. (C) stima della milza B, il numero di cellule granulocitari e monociti dopo immunostaining e citometria a flusso di analisi gating sono stati eseguiti per identificare vivo CD19 + B220 + , CD3 - CD11b + Ly6G +, CD3 - CD11b + Ly6C - e CD3 - alte cellule CD11b + Ly6C. Le barre di scala indicati per i polmoni, milza e fegato indicano 1 cm. .. n = 5 - 8 topi / gruppo, ed i dati sono rappresentati in istogrammi come mezzo ± SEM *, p <0,05; **, p = 0,0033 topi, t-test di Student spaiato confrontando PBS- e C1498-iniettato prega clicca qui per vedere una versione più grande di questa figura.
| Tipo di cella | Membrana o intracellulari Molecole |
| Precursori e cellule mature | |
| Le cellule NK | NK1.1 +, pan-NK + |
| cellule NKT | NK1.1 +, pan-NK +, TCR vBeta + (8.2), CD3 + |
| linfociti T | TCR vBeta +, CD3 +, CD4 +, CD8 + |
| cellule B precursori e linfociti B | B220 +, CD19 +, CD21 / 35 + |
| precursori granulocitari e granulociti | Ly6G +, Mac-1 +, CD11b + |
| precursori monociti e monociti / macrofagi | CD11b +, Mac-1 +, Mac-3 +, CD21 / 35 +, CD115 +, Ly6Chi |
| progenitori | |
| progenitori multipotenti | CD117 + Sca-1+ CD34 + (Lin- CD150-) |
| progenitori multipotenti linfoidi-innescato | CD117hi Sca-1hi CD127 + (Lin-) |
| progenitori linfoidi comuni | CD117lo Sca-1LO CD127 + (Lin-) |
| progenitori mieloidi comuni | CD16 / CD117 + 32lo CD34int (Lin- Sca-1-) |
| progenitori granulociti-macrofagi | CD16 / CD117 + 32hi CD34hi (Lin- Sca-1-) |
| progenitori megacariociti-eritroide | CD16 / CD117 + 32lo CD34lo (Lin- Sca-1-) |
| Le cellule staminali ematopoietiche | CD117 + Sca-1 + CD150 + (Lin- CD34-) |
Tabella 1. Marcatori di linee cellulari ematopoietiche e la differenziazione.
CD: cluster di differenziazione; Lin: marcatori di cellule mature; Lo:bassa espressione; Max: elevata espressione; int: espressione intermedio; NK: cellule killer naturali; TCR: recettore delle cellule T.
Discussione
In studi precedenti, la linea cellulare C1498 è stato descritto come un induttore di granulocitica acuta 5, mielomonocitica 6 o 7 NKT leucemia a cellule. Tuttavia, i dati dimostrativi in letteratura erano assenti o incompleti. Il protocollo qui presentata utilizza tecniche diverse, come la citometria a flusso, immunofluorescenza, MGG colorazione e saggi citochimiche, per caratterizzare le cellule in coltura e C1498 per determinare la natura della leucemia che è indotta nei topi dopo che sono stati iniettati.
Quando abbiamo phenotyped in cellule C1498 vitro in coltura dopo immunostaining e citometria a flusso sono state eseguite le analisi, abbiamo osservato alcune limitazioni, perché queste cellule hanno espresso alcuni marcatori di superficie delle cellule ematopoietiche che sono stati precedentemente descritti in letteratura 6,7. In accordo con i nostri risultati, Labelle et al., Non ha rispettato l'espressione di superficie delle cellule del maturo TCR sulle cellule C1498 con cytomet flussory colorazione. Tuttavia, li hanno considerati come una linea di cellule NKT dopo aver rilevato CD3ε e TCRVβ8.2 mRNA 7. Abbiamo anche osservato l'espressione intracellulare di catene TCRVβ e molecole CD3ε nella maggior parte delle cellule (> 70%), ma le loro linee ematopoietiche non è stato possibile determinare perché c'era anche concomitante espressione intracellulare del Mac-3 molecola.
Mieloperossidasi, MGG colorazione e valutazioni per analizzare esterasi funzionali utilizzando cytochemistry dimostrato che la linea cellulare C1498 ha avuto un'origine mieloide e era composto da monoblasti e mieloblasti. Questi risultati erano in accordo con la percentuale di cellule Mac-3 + che sono stati ottenuti in citometria a flusso colorazione. Sebbene non quantitativa, questi passaggi rappresentano esperimenti chiave da eseguire. In effetti, essi rimangono, fino ad ora, i migliori metodi esistenti per la caratterizzazione del lignaggio e la differenziazione fase di cellule ematopoietiche che esprimono no o Fmarcatori fenotipici specifici Ew.
Citometria a flusso colorazione è stato utile per dimostrare lo sviluppo di leucemia acuta nei topi congenic dopo C1498 cellule sono state iniettate per via endovenosa. I CD45.2 + C1498 cellule che si infiltrarono nel sangue periferico e vari organi sono stati isolati, e le loro frequenze sono state determinate. La quantificazione è stata effettuata anche per analizzare midollare intrinseca e le cellule della milza dopo immunofenotipizzazione. Sono stati rilevati Limitazioni quando il fenotipo cellulare C1498 è stata esaminata in organi come espressi alcuni marcatori ematopoietici (solo alcuni di loro erano B220 +). Per definire la natura della leucemia acuta osservato, May-Grünwald Giemsa e un'analisi delle attività di monocitica e esterasi granulocitari state eseguite utilizzando midollo osseo. I risultati hanno mostrato che le cellule C1498 conservato la loro morfologia e la funzione mieloblastica e monoblastica, rivelando l'insorgenza della leucemia mielomonocitica.
In considerazione delle fasi critiche descritte in questo protocollo, particolare attenzione dovrebbe essere data a pH durante l'esecuzione di reazioni citochimiche e MGG colorazione perché gli errori di pH possono portare a interpretazioni non corrette dei risultati. Per esempio, α-naftil butirrato esterasi attività è specifica per le cellule monocitiche solo a pH di 6,0 perché granulociti e linfociti possono macchiare positivo per questo test a valori di pH superiori. Fissarsi le cellule non è raccomandato prima di eseguire MGG colorazione, e ci ha mostrato che solo la fissazione CAF ha fornito risultati soddisfacenti durante l'esecuzione di esterasi reazioni citochimiche utilizzando C1498 cellule. Per preservare l'espressione della molecola CD115 e la sua individuazione mediante citometria a flusso, tutti i campioni (cellule esempio, sangue, midollo osseo e milza) deve essere mantenuto in ghiaccio durante la procedura. Se nessuna colorazione si osserva in citometria a flusso o / e immunofluorescenza, il riferimento degli anticorpi, loro immagazzinamento reencomi e le loro diluizioni devono essere controllati. I riferimenti indicati nella tabella materiali / attrezzature sono state selezionate per le applicazioni citometria di flusso o di immunofluorescenza. Le primarie / anticorpi secondari o loro fluorofori coniugati potrebbero aver perso la loro attività a causa di stoccaggio inadeguato (ad esempio, l'esposizione alla luce o al calore), la diluizione improprio, vasta di congelamento / scongelamento o l'uso di tamponi contaminati. Eseguire controlli positivi per garantire che funzionino correttamente. Usa il mouse midollo osseo o cellule della milza-derivati che sono noti per esprimere le proteine di interesse. Per evitare di fondo e marcatura non specifica, fare in modo che le cellule vengono lavate correttamente e mantenuti a elevata umidità (per immunofluorescenza) e che gli anticorpi sono diluiti secondo le istruzioni. Utilizzare la stessa concentrazione e diluizione per l'anticorpo di controllo isotipo e l'anticorpo primario per determinare con precisione il livello di fondo nel campione. Per gli esperimenti esterasi citochimica, lareagenti possono essere testati utilizzando vetrini di controllo positivi e negativi, che contengono il mouse purificato granulocitica della milza (Ly6G +) e monocitica (+ CD115), le cellule.
La procedura descritta in questo studio ha dimostrato che molte delle caratteristiche leucemici osservati nei topi dopo l'iniezione di cellule C1498 condiviso caratteristiche comuni con umana leucemia mielomonocitica acuta 11,12. Le cellule leucemiche invase comportato una riduzione di mature e immature (progenitori e precursori) cellule ematopoietiche midollari. cellule C1498 sono presenti a frequenza elevata (> 20%) nel sangue periferico, come lo sono le cellule monociti. Epatomegalia e splenomegalia sono stati osservati per derivare dalla infiltrazione di cellule leucemiche, e aumenti significativi linfociti B e delle cellule mieloidi sono state osservate anche per accompagnare splenomegalia. Trombocitopenia è stata osservata anche quando i numeri delle piastrine del sangue sono stati stimati utilizzando un analizzatore ematologico.
E 'stato spettacolon, con esperimenti in vitro, che C1498 cellule inibiscono la normale emopoiesi murina secernendo fattori solubili 13. In diversi modelli murini di tumore, le cellule mieloidi immature (tra cui monociti e cellule granulocitari) hanno anche dimostrato di migrare dal midollo osseo alla milza, dove inibiscono l'attivazione delle cellule T specifiche anti-tumorale e la proliferazione 14. Pertanto, la riduzione in cellule ematopoietiche che è stato osservato nel midollo osseo potrebbe essere il risultato di una carenza sia in ematopoiesi e / o dal loro emigrazione. Quest'ultimo meccanismo potrebbe spiegare la presenza di monocitosi nel sangue periferico o l'osservazione di frazioni mieloidi ingrandita nella milza. E 'anche ipotizzabile che queste cellule avrebbero potuto essere derivato dal miglioramento della emopoiesi della milza. Infatti, in condizioni stazionarie, alcuni sottoinsiemi di cellule B della milza sono stati identificati come precursori di linfociti maturi B 15. Inoltre, in condizioni infiammatorie, medLe cellule staminali midollare e progenitori hanno dimostrato di trasferirsi alla milza per indurre la produzione di monociti maturi 16. Questo protocollo non ci permette di trarre conclusioni per quanto riguarda i meccanismi che sono coinvolti nello sviluppo della leucemia, e saggi funzionali nonché molecolari supplementari dovrebbero essere impiegate per farlo. Tuttavia, questi dati includono informazioni dettagliate sulle caratteristiche cliniche della leucemia mielomonocitica acuta e aiuteranno i ricercatori a valutare e comprendere gli effetti dei nuovi agenti terapeutici.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
The authors would like to acknowledge the "Ligue Nationale contre le Cancer" (Comité du Septentrion), the SIRIC ONCOLille (Grant INCa-DGOS-INSERM 6041) and the Institut pour la Recherche sur le Cancer de Lille (IRCL) for supporting this work. They would like to thank Delphine Taillieu and the animal facility staff for housing the mice and maintaining their welfare. We also thank Raphaëlle Caillerez and Nathalie Jouy for their respective help in microscopy and flow cytometry.
Materiali
| Name | Company | Catalog Number | Comments |
| C1498 cell line | ATCC | TIB 49 | |
| C57BL/6J-Ly5.1 | Charles River | B6.SJL-Ptprc a Pep3 b/BoyCrl | |
| Cells culture reagents | |||
| 2-Mercaptoethanol, Gibco | ThermoFisher Scientific | 21985 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | 10270 | |
| HEPES, Gibco (1 M) | ThermoFisher Scientific | 15630 | |
| Non-Essential Amino Acids Solution, Gibco | ThermoFisher Scientific | 11140 | |
| Penicillin-Streptomycin, Gibco | ThermoFisher Scientific | 15140 | |
| RPMI 1640 Medium (Gibco, GlutaMAX Supplement) | ThermoFisher Scientific | 61870 | |
| Sodium Pyruvate, Gibco (100 mM) | ThermoFisher Scientific | 11360 | |
| Flow cytometry staining reagents | |||
| anti-mouse B220 APC (1) | ebiosciences | 17-0452 | clone RA3-6B2, final dilution 1/100 |
| anti-mouse B220 biotin (2) | ebiosciences | 13-0452 | clone RA3-6B2, 1/400 |
| anti-mouse CD3 eFluor450 (1) | ebiosciences | 48-0032 | clone 17A2, 1/100 |
| anti-mouse CD3 PE (2) | BD biosciences | 555275 | clone 17A2, 1/100 |
| anti-mouse CD3 PE-Cy5 (3) | ebiosciences | 15-0031 | clone 145-2C11, 1/100 |
| anti-mouse CD4 APC (1) | ebiosciences | 17-0041 | clone GK1.5, 1/500 |
| anti-mouse CD4 PE (2) | ebiosciences | 12-0041 | clone GK1.5, 1/200 |
| anti-mouse CD8 biotin (1) | ebiosciences | 13-0081 | clone 53-6.7, 1/100 |
| anti-mouse CD8 eFluor450 (2) | ebiosciences | 48-0081 | clone 53-6.7, 1/500 |
| anti-mouse CD11a biotin | ebiosciences | 13-0111 | clone M17/4, 1/100 |
| anti-mouse CD11b PE | ebiosciences | 12-0112 | clone M1/70, 1/200 |
| anti-mouse CD16/32 biotin | ebiosciences | 13-0161 | clone 93, 1/400 |
| purified anti-mouse CD16/32 (FcR blocking) | BD biosciences | 553141 | clone 2.4G2 |
| anti-mouse CD18 biotin (1) | ebiosciences | 13-0181 | clone M18/2, 1/100 |
| anti-mouse CD18 FITC (2) | ebiosciences | 11-0181 | clone M18/2, 1/50 |
| anti-mouse CD19 PE | ebiosciences | 12-0193 | clone 1D3, 1/200 |
| anti-mouse CD21/35 PE | ebiosciences | 12-0211 | clone 8D9, 1/50 |
| anti-mouse CD31 PE | ebiosciences | 12-0311 | clone 390, 1/100 |
| anti-mouse CD34 eFluor660 | ebiosciences | 50-0341 | clone RAM34, 1/20 |
| anti-mouse CD44 PE | BD biosciences | 553134 | clone IM7, 1/50 |
| anti-mouse CD45.2 FITC | ebiosciences | 11-0454 | clone 104, 1/100 |
| anti-mouse CD49b/Pan NK PE | BD biosciences | 553858 | clone DX5, 1/50 |
| anti-mouse CD80 biotin | ebiosciences | 13-0801 | clone 16-10A1, 1/200 |
| anti-mouse CD86 biotin | ebiosciences | 13-0862 | clone GL1, 1/200 |
| anti-mouse CD107b (Mac-3) PE | ebiosciences | 12-5989 | clone M3/84, 1/40 |
| anti-mouse CD115 PE | ebiosciences | 12-1152 | clone AFS98, 1/100 |
| anti-mouse CD117 eFluor450 | ebiosciences | 48-1171 | clone 2B8, 1/100 |
| anti-mouse CD127 PE | ebiosciences | 12-1271 | clone A7R34, 1/100 |
| anti-mouse CD150 APC | ebiosciences | 17-1501 | clone 9D1, 1/20 |
| anti-mouse CD274 (PD-L1) biotin | ebiosciences | 13-5982 | clone MIH5, 1/200 |
| anti-mouse Ly-6A/E (Sca-1) PE | ebiosciences | 12-5981 | clone D7, 1/100 |
| anti-mouse Ly-6C APC | ebiosciences | 17-5932 | clone HK1.4, 1/200 |
| anti-mouse Ly-6G (Gr-1) biotin (1) | ebiosciences | 13-5931 | clone RB6-8C5, 1/400 |
| anti-mouse Ly-6G FITC (2) | ebiosciences | 11-9668 | clone 1A8, 1/50 |
| anti-mouse MHC class I (H-2Db) biotin | ebiosciences | 13-5999 | clone 28-14-8, 1/50 |
| anti-mouse MHC class II (I-A/I-E) PE-Cy5 | ebiosciences | 15-5321 | clone M5/114.15.2, 1/1000 |
| anti-mouse NK1.1 PE | BD biosciences | 557391 | clone PK136, 1/50 |
| anti-mouse TCRVb FITC | BD biosciences | 553170 | clone H57-597, 1/50 |
| streptavidin PE-Cy5 | ebiosciences | 15-4317 | 1/200 |
| Immunofluorescence staining reagents | |||
| Anti-mouse myeloperoxidase (heavy chain antibody) | Santa Cruz Biotechnology | sc-16129 | 1/10 (20 µg/ml) |
| anti-goat IgG (Texas Red coupled antibody) | Jackson Immunoresearch | 705-076-147 | 1/250 |
| Normal donkey serum | Jackson Immunoresearch | 017-000-001 | |
| Hoechst solution | BD Biosciences | 561908 | 1/1000 |
| Mounting medium 1 (Fluoromount) | Sigma-Aldrich | F4680 | |
| Acetone | VWR | 20066 | |
| Methanol | Merck Millipore | 106009 | |
| Esterase cytochemical staining reagents | |||
| Naphtol AS-D chloroacetate solution | Sigma-Aldrich | 911 | |
| Dye solution (Fast Red Violet LB Base solution) | Sigma-Aldrich | 912 | |
| pH6.3 buffer concentrate (TRIZMAL) | Sigma-Aldrich | 913 | |
| Sodium nitrite solution | Sigma-Aldrich | 914 | |
| Citrate solution | Sigma-Aldrich | 915 | |
| Hematoxylin solution | Sigma-Aldrich | GHS3 | |
| Acetone | VWR | 20066 | |
| Formaldehyde solution, 37% | Sigma-Aldrich | F1635 | |
| α-naphthyl butyrate solution | Sigma-Aldrich | 1801 | |
| Phosphate buffer solution | Sigma-Aldrich | 1805 | |
| Sodium nitrite Tablet | Sigma-Aldrich | 1809 | |
| Pararosaniline solution | Sigma-Aldrich | 1804 | |
| Methylene blue solution | Sigma-Aldrich | 1808 | 1/10 |
| mounting medium 2 (Clearmount) | Invitrogen | 00-8010 | |
| May-Grünwald Giemsa staining reagents | |||
| May-Grünwald solution | RAL Diagnostics | 320070 | |
| Giemsa R solution | RAL Diagnostics | 320310 | 1/20 |
| pH 6.8 buffer solution | RAL Diagnostics | 330368 | |
| Others materials, reagents and equipment | |||
| Ketamine 1000 (100 mg/mL) | VIRBAC | 3597132111010 | |
| Xylazine SEDAXYLAN (20 mg/mL) | CEVA | ||
| Bovin albumin serum (BSA) powder | ThermoFisher Scientific | BP671 | |
| PBS solution (1x concentrate) | ThermoFisher Scientific | 14190 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Saponin | Sigma-Aldrich | 47036 | |
| Ultra Pure 0.5 M EDTA solution, pH 8.0 | ThermoFisher Scientific | 15575 | |
| Separating solution (Pancoll Mouse) | PANBIOTECH | P04-64100 | |
| Lysis buffer (Red Blood Cells Lysing Buffer) (10X) | BD Biosciences | 555899 | 1/10 |
| NaOH 10N | ThermoFisher Scientific | SS267 | |
| Trypan blue solution (0.4 %) | ThermoFisher Scientific | 15250-061 | 1/2 |
| 50 mL tube (Falcon) | Fisher Scientific | 14-432-22 | |
| 70µm Cell Strainer (Falcon) | Corning Life Sciences | 352350 | |
| Chamber & filter card (EZ Cytofunnel Shandon) | Thermo Scientific | A78710003 | |
| Microscope Cover Glasses, 24x24mm | Knittel Glass | VD1 2424 Y100 | |
| Slides (Starfrost - ground edges 90) | Knittel Glass | VS1137# 077FKB | |
| EDTA Tube | Greiner Bio-One | 454034 | |
| Pasteur Pipette 150MM (capillary tube) | Fisherbrand | 1154-6963 | |
| 26G needle | Terumo | NN-2613R | |
| insulin syringe and needle 29G | Terumo | BS05M2913 | |
| 30G needle | Becton & Dickinson | 304000 | |
| Flow cytometry tubes (blue) | Beckman Coulter | 2523749 | |
| Water-repellent pen (Dakopen) | Dako | S200230 | |
| Sharp sterile scissors | Nessi-care | SCI-01 | |
| Sterile forceps | Dominique Dutscher | 956506 | |
| Thoma cell counting chamber | VWR | 631-0397 | |
| Petri Dishes (Fisherbrand Plastic) | ThermoFisher Scientific | S33580A | |
| Microcentrifuge tube (1.5 mL) | ThermoFisher Scientific | 05-408-129 | |
| Cylindrical Restrainer 15-30 gm | Stoelting | 51338 | |
| Shandon Cytospin 3 Cytocentrifuge | ThermoFisher Scientific | ||
| 10 mL syringe | Terumo | SS-10L | |
| 1 mL syringe | Terumo | SS-01T | |
| Ethanol | Merck | 1.08543 | |
| Sterile gauze sponges | URGO | 501580 |
Riferimenti
- Forthun, R. B., Hinrichs, C., Dowling, T. H., Bruserud, &. #. 2. 1. 6. ;., Selheim, F. The past, present and future subclassification of patients with acute myeloid leukemia. Curr. Pharm. Biotechnol. 17 (1), 6-19 (2016).
- Goldie, H., Butler, C. H., Anderson, M. M., Maxwell, M. C., Hahn, P. F. Growth characteristics of free C1498 (granulocytic leukemia) tumor cells in the peritoneal fluid and the blood of C57 mice. Cancer Res. 13 (2), 125-129 (1953).
- Tanaka, K. K., Roberts, E. Biological studies of E.L.4 lymphoma and C Leukemia in susceptible (C57BL) and resistant (B10.D2) mice. Cancer Res. 24 (1498), 1785-1797 (1964).
- Law, L. W. Characterization of an influence affecting growth of transplantable leukemias in mice. Cancer Res. 4, 257-260 (1944).
- Graham, J. D., McMahon Welch, C., Patchen, M. L. Studies of an implanted murine myelogenous leukemia C1498. Ohio J. Sci. 75 (4), 202-208 (1975).
- Boyer, M. W., Orchard, P. J., Gorden, K. B., Anderson, P. M., Mclvor, R. S., Blazar, B. R. Dependency on intercellular adhesion molecule recognition and local interleukin-2 provision in generation of an in vivo CD8+ T-cell immune response to murine myeloid leukemia. Blood. 85 (9), 2498-2506 (1995).
- Labelle, J. L., Truitt, R. L. Characterization of a murine NKT cell tumor previously described as an acute myelogenous leukemia. Leuk. Lymphoma. 43 (8), 1637-1644 (2002).
- Bradner, W. T., Pindell, M. H. Myeloid leukemia as a screen for cancer chemotherapeutic agents. Cancer Res. 26 (4), 375-390 (1966).
- Lin, J. M., Li, B., Rimmer, E., VanRoey, M., Jooss, K. Enhancement of the anti-tumor efficacy of a GM-CSF-secreting tumor cell immunotherapy in preclinical models by cytosine arabinoside. Exp. Hematol. 36 (3), 319-329 (2008).
- Robinson, J. P. . Handbook of Flow Cytometry Methods. , (1993).
- Xu, Y., McKenna, R. W., Wilson, K. S., Karandikar, N. J., Schultz, R. A., Kroft, S. H. Immunophenotypic identification of acute myeloid leukemia with monocytic differentiation. Leukemia. 20 (7), 1321-1324 (2006).
- Hassan, K., Qureshi, M., Shafi, S., Ikram, N., Akhtar, M. J. Acute myeloid leukemia-FAB classification and its correlation with clinico-haematological features. J. Pak. Med. Assoc. 43 (10), 200-203 (1993).
- Quesenberry, P. J., Rappeport, J. M., Fountebouni, A., Sullivan, R., Zuckerman, K., Ryan, M. Inhibition of normal murine hematopoiesis by leukemic cells. N.Engl.J. Med. 299 (2), 71-75 (1978).
- Youn, J. I., Nagaraj, S., Collazo, M., Gabrilovich, D. I. Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol. 181 (8), 5791-5802 (2008).
- Loder, F., et al. B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals. J. Exp. Med. 190 (1), 75-89 (1999).
- Robbins, C. S., et al. Extramedullary hematopoiesis generates Ly-6C(high) monocytes that infiltrate atherosclerotic lesions. Circulation. 125 (2), 364-374 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon