Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение плотности водных стекол при криогенных температурах
* Эти авторы внесли равный вклад
В этой статье
Резюме
Описан протокол для определения плотности стеклообразной фазы от микропик-литровых капель водных смесей при криогенных температурах.
Аннотация
Мы демонстрируем способ определения температуры криогенной температуры стеклообразной фазы в водных смесях и других образцов, которые требуют быстрого охлаждения, для получения желаемой температуры криогенной температуры. Отложения микролитера до пиколитра охлаждают путем выведения в смесь жидкого азот-аргона (N 2 -Ar). Криогенную температурную фазу капли оценивают с использованием визуального анализа, который коррелирует с измерениями дифракции рентгеновских лучей. Плотность жидкой смеси N 2 -Ar регулируют добавлением N 2 или Ar до тех пор, пока капля не станет нейтрально плавающей. Плотность этой смеси и, следовательно, капли определяют с использованием испытательной массы и принципа Архимеда. При надлежащем уходе при каплеобразовании управление газом над жидкой криогенной смесью для минимизации обледенения и регулярное перемешивание криогенной смеси для предотвращения расслоения плотности и разделения фаз, плотность с точностью <0,5% капель до 50 пл можетЛегко определить. Измерения на водных криопротекторных смесях дают представление о криопротекторном действии и дают количественные данные для облегчения термического сокращения в биологической криоконсервации.
Введение
Физические свойства воды и водных смесей в их различных фазах представляют фундаментальный интерес и важны для понимания биологических систем in vivo и in vitro . В современной криобиологии и биологической криоконсервации стекловидные или аморфные фазы водных криопротекторных смесей представляют особый интерес 1 , 2 . Зарождение и рост кристаллов льда могут разрушить клетки и ткани и способствовать денатурации и агрегации белка, поэтому криоконсервационные протоколы, которые остекловывают растворитель, становятся все более популярными. В биомолекулярной кристаллографии кристаллизация растворителя в каналах между биомолекулами разрушает кристаллические решетки и деградирует дифракционные свойства. Витрификация достигается за счет сочетания быстрого охлаждения, обезвоживания и добавления криопротективных растворов, таких как глицерин, этиленгликоль, полиэтиленгликоли (ПЭГ),Спирты и соли.
Витрификация ограничивает кристаллизацию и рост льда, но не устраняет все повреждения, связанные с охлаждением. Например, кристаллическая мозаичность (мера распределения ориентаций кристаллографической плоскости) обычно увеличивается в 10-100 раз, когда кристаллы белка охлаждают в остеклованном состоянии 3 , а скорости выдержки после таяния остеклованных сперматозоидов и ооцитов широко варьируются ,
Одним из механизмов повреждения является дифференциальное сжатие растворителя и окружающего материала при охлаждении 3 , 4 , 5 . Равновесные концентрации растворителя и растворенного вещества в кристалле, клетке или ткани зависят от температуры, а растворитель плюс раствор и окружающий материал могут сжиматься в разных количествах. Быстрое охлаждение может препятствовать перераспределению растворителя и растворенного вещества до стеклования, а дифференциальные контракты Может привести к большим, неоднородным, неравновесным напряжениям, которые вызывают повреждение образца.
Таким образом, рациональные подходы к уменьшению ущерба, вызванного охлаждением, могут быть полезны из-за знания температурно-зависимых плотностей жидких и остеклованных водных смесей. При концентрациях растворенных веществ, превышающих 50% массы растворенного вещества до массы раствора (мас. / Мас.), Большинство водных смесей криопротекторов можно остекловывать со умеренными скоростями охлаждения 10 К / с или менее, что позволяет производить измерения плотности и плотности с использованием больших образцов стекловидного тела 6 . Плотность можно затем определить по принципу Архимеда, измеряя кажущуюся массу образца при суспендировании в жидком криогене, таком как азот. Однако при уменьшении концентрации растворенного вещества скорости охлаждения, необходимые для остекловывания, быстро возрастают. Скорости охлаждения для водных смесей глицерина увеличиваются от <10 К / с при 50% массы растворенного вещества в г до объема раствора в мл (мас. / Об.) До> 1000 K / с при 25% мас. / Об.Ass = "xref"> 7. Передача тепла становится ограниченной границей, поэтому для достижения больших скоростей охлаждения требуются меньшие и меньшие образцы 8 .
Измерения плотности чистой стекловидной воды и льда были достигнуты путем осаждения капель микрометрического диаметра (объем фемтолитера) в вакууме на поверхность с криогенным охлаждением, чтобы создать макроскопический образец (грамм-масса). Плотность этого образца определяли путем криофлотации в жидкой смеси азот-аргон, в которой плотность криогенной жидкости регулировалась до тех пор, пока образец не стал нейтрально плавучим 9 . Однако генерация больших выборок из большого количества небольших капель таким образом, чтобы минимизировать объем пустот - важный источник ошибок при предыдущих измерениях фазы стекловидной фазы - нетривиальна. Для водных смесей дифференциальное испарение компонентов раствора во время аэрозолизации и осаждения в вакууме может привести кСущественная неопределенность в депонированных концентрациях.
Мы разработали метод, основанный на криофлотации, который позволяет точно определять плотность водных смесей с использованием отдельных капель до 50 пЛ 10 . Эти капли могут быстро охлаждаться при сохранении их первоначальных концентраций, а их криогенное температурное состояние (остеклованное или кристаллическое) можно оценить, используя простой визуальный анализ, который коррелирует с измерениями рентгеновской дифракции. Этот способ широко применим к водным и неводным смесям и может быть распространен на множество биологических образцов, включая клетки ( например , стебель и яйцо), образцы тканей и кристаллы белка, имеющие низкотемпературные плотности от 0,8 до 1,4 г / мл.
протокол
ПРЕДОСТЕРЕЖЕНИЕ: Перед использованием проконсультируйтесь со всеми листами данных о безопасности материалов (MSDS). При использовании сжатых газов используйте все соответствующие меры безопасности, включая соответствующие калиброванные регуляторы и клапаны для работы с газом, а также одобренные газовые трубки. Контакт с жидкими криогенами может привести к сильному обморожению и некрозу. Используйте соответствующие средства индивидуальной защиты (щиток для лица, перчатки, лабораторное покрытие, штаны полной длины, туфли с закрытыми носками), все из которых должны быть непроницаемыми для жидкого азота. При использовании жидких криогенных реагентов останьтесь стоять и обеспечить беспрепятственный выход из устройства. Помните об опасности удушья при использовании сжатых газов и жидких криогенных веществ и работайте в хорошо проветриваемом помещении с адекватным подпиточным воздухом (вытяжной шкаф или помещение с высокой вентиляционной способностью).
1. Получение водных растворов для измерения плотности
ПРИМЕЧАНИЕ. Поскольку весы более легко измеряются с высокой точностью, чем объемКонцентрации растворов измеряют в единицах массы. Все плотности и температуры плавления или кипения принимают атмосферное давление ~ 100 кПа. Следующие этапы описывают получение 35% мас. / Мас. Раствора глицерина. Такую же процедуру можно использовать и для других концентраций и растворенных веществ.
- Для каждого типа растворенного вещества и интересующей концентрации грубо оценивайте требуемую массу растворенного вещества, чтобы получить желаемую конечную концентрацию ( например , между 25 мас.% И 100 мас.%) Для общего объема раствора, V tot = 10 мл раствора , Например, для 35% мас. / Мас. Раствора глицерина ( ρ s = 1,26 г / мл) масса растворенного вещества, m s :

Где x - массовая доля растворенного вещества (0,35), а ρ w = 1 г / мл - плотность воды. - Поместите 15 мл центрифужную пробирку (или другой объемно-калиброванный водонепроницаемый контейнер) на сковородкуАналитического микробаланса. Распределите желаемую массу растворенного вещества / криопротектора ( например , 3,77 г глицерина для 35% мас. / Мас. Раствора) в трубку и запишите фактическую массу растворенного вещества.
- Добавьте деионизированную воду высокой чистоты (> 18 МОм), чтобы довести общую массу до 10,0 г
- Встряхните контейнер в течение 30 с (для жидких растворов) или 5 минут (для твердых растворов), пока раствор не будет оптически однородным.
- Измерьте и запишите окончательную массу раствора. Уплотните контейнер воздухонепроницаемым колпачком и храните его при постоянной температуре (293-298 K).
2. Подготовка пробной охлаждающей камеры
- Поместите экспериментальную установку, описанную ниже, в корпус и пропустите сухой воздух (> 5% относительной влажности (rh)) в корпус.
ПРИМЕЧАНИЕ. Корпус может представлять собой простую металлическую раму с верхним и трехсторонним уплотнением с прозрачным пластиковым листом и с доступом к экспериментам через четвертую сторону, покрытую гибким пластиковым листом. носитьЛицевые экраны и покрытие всего тела, чтобы минимизировать влажность, введенную экспериментатором. Конденсация влаги и образование льда могут мешать измерению плотности криогенной плотности несколькими способами, и поэтому ее необходимо минимизировать. - Поместите диск из неопренового каучука на дно стеклянной колбы Dewar объемом 4,5 л, чтобы защитить колбу Дьюара от повреждений.
- Осторожно вставьте в колбу медь с высокой теплопроводностью (полый цилиндр с закрытым дном) до упора на резиновый диск. Отрегулируйте стойки, выступающие наружу от камеры к стенкам Дьюара, чтобы камера была центрирована и не имела склонности к скале.
ПРИМЕЧАНИЕ. В колбе Дьюара будет содержаться жидкий азот, а в медной камере с меньшим объемом будет находиться жидкая смесь N 2 -Ar. Жидкий азот обеспечивает термальную ванну, которая поддерживает камеру меди и ее содержимое при постоянной температуре 77 К и уменьшает потери кипения и испарения в камере. Камера' s малый диаметр подавляет поверхностные волны, которые могут мешать измерениям плавучести, и помогает изолировать жидкость внутри камеры от мороза и льда, образовавшихся в другом месте устройства. - Вставьте выход газовой трубки с сухим газом N 2, протекающим со скоростью ~ 2 л / мин до дна медной камеры, и продуйте камеру влажного воздуха.
- Медленно заливайте жидкий азот в колбу Дьюара, вне медной камеры, позволяя время для выкипания азота.
ПРИМЕЧАНИЕ. Конечный уровень заполнения после прекращения кипения должен находиться в пределах приблизительно 4 см от верхней части медной камеры. - Накройте наружную часть колбы Дьюар кольцевой изоляционной крышкой. Снимите сухую трубку продувки газа N 2 из медной камеры и вставьте в соответствующее отверстие в крышке.
ПРИМЕЧАНИЕ. Сочетание газа N 2 от кипячения в колбе Дьюара и от продувочного потока вытесняет любой влажный воздух и предотвращает его конденсацию и кристаллизацию.N холодных поверхностей. - Медленно влейте жидкий азот в медную камеру. Окончательный уровень заполнения после прекращения кипения должен находиться в пределах приблизительно 4 см от верхней части медной камеры.
- Поместите тонкий, оптически прозрачный пластиковый лист над центральным отверстием или вентилятором в крышке и уменьшите расход газа N 2 до ~ 0,2 л / мин, оставив небольшое избыточное давление газа N 2 в газовых пространствах над криогенными жидкостями.
ПРИМЕЧАНИЕ. До тех пор, пока в Дьюаре и в камере присутствуют криогенные жидкости, продолжайте регулировать расход газа N 2 по мере необходимости для поддержания этого избыточного давления и предотвращения попадания влаги в Дьюар и формование льда.
3. Определение объема и плотности тестовой массы при Т = 298 К и Т = 77 К
- Определите кажущуюся массу тестовой массы из PTFE ~ 1 г, ~ 0,4 мл ( таблица материалов ) на воздухе при T = 298 К, разместив ее на кастрюлеКалиброванного аналитического микробаланса.
- Определить объем V (298 K) испытательной массы при T = 298 K с использованием газового пикнометра или измерения размеров с помощью суппортов. При использовании измерений размеров испытательная масса должна иметь простую точную форму (без сужающихся или закругленных углов), а объем сквозного отверстия (для линии подвески) должен определяться.
- Рассчитайте массу m испытательной массы, скорректировав измеренную кажущуюся массу для плавучей силы, создаваемой воздухом, в соответствии со следующим:
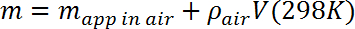
Где ρ воздух = 1,23 г / л (~ 0,1% коррекция). - Поместите микробаланс на устойчивую платформу примерно на 10 см выше колбы Дьюара и проверьте его калибровку. Приостановить испытательную массу, используя линию моноволокна длиной 2 мил (50 мкм), нанизанную на крючок на нижней стороне микробаланса (предназначен для измерения массы подвески) и throuGh - отверстие в испытательной массе. Определите кажущуюся массу в воздухе и сравните с измерением на шаге 3.3, исправляя по мере необходимости массу линии.
- Определите объем V (77 K) испытуемой массы при T = 77 K, измеряя ее кажущуюся массу в чистом жидком азоте, m app в LN2 . Опустите тестовую массу в жидкий азот внутри медной камеры до полного погружения. Когда кипение прекратилось, измерьте кажущуюся массу.
ПРИМЕЧАНИЕ. Если жидкий азот в медной камере находится в состоянии покоя, а воздушные потоки между микробалансом и поверхностью жидкости минимальны, эту массу можно измерить более чем на ± 0,0002 g. - Оцените плавучую силу на погруженной части линии и убедитесь, что она мала по сравнению с ошибками измерения.
- Рассчитайте объем и плотность испытуемой массы при 77 К, используя известную массу m и измеренную кажущуюся массу в LN2 при 77 K, m app iN LN2, в соответствии со следующим:

Где ρ LN2 ( (77 K) = 0,807 г / мл.
4. Получение исходной жидкой смеси N 2 -Ar
- Газ потока Ar со скоростью потока ~ 2 л / мин через спиральную трубку до ее выхода. Поместите спиральную трубку сверху верхних распорок, которые стабилизируют положение медной камеры, чуть выше уровня жидкого азота и ниже верхней поверхности Дьюара. Холодные N 2 и газ Ar будут накапливаться над криогенными жидкостями, а теплопроводность, конвекция и радиация охладят трубу и газообразный газ.
- После того, как спиральная трубка остынет в течение 5 мин, поместите выходное отверстие трубки в медную камеру, по крайней мере, на 10 см ниже поверхности жидкого азота. Затем накройте Дьюара кольцевой крышкой и прозрачным листом.
- Отрегулируйте расход потока Ar до тех пор, пока пузырьки Ar не повысятсяОт выхода трубки до верхней поверхности жидкого азота. Затем уменьшите расход до тех пор, пока пузырьки не будут образовываться на выходе, но растворятся или разжижаются непосредственно перед разрушением поверхности жидкого азота.
ПРИМЕЧАНИЕ. По мере увеличения концентрации Ar в медной камере, периодически корректируйте расход потока Ar по мере необходимости для поддержания образования пузырьков. Если расход потока Ar слишком низок, Ar может замерзнуть внутри трубки и заблокировать поток. - Добавьте жидкий азот, если необходимо, чтобы поддерживать его уровень в окружающем Дьюаре. Удалите лед, когда он накапливается на холодных поверхностях.
- Периодически смешивайте жидкость, вставив тонкий ( например , 35 мкм) круглый лист из медной фольги, прикрепленный к тонкой изолирующей трубе в медной камере, и медленно перемещайте ее вверх и вниз, как поршень. Это уменьшит градиенты концентрации и тенденцию к кристаллизации Ar из раствора.
5. Измерение и регулировка плотности исходного N 2 -Ar Mixры
- Рассчитайте плотность мишени для смеси N 2 -Ar, оценивая плотность T = 77 K измеряемого образца, например , измерения при более высоких концентрациях неводного компонента образца.
- Прикрепите испытательную массу, используя линию моноволокна, к крюку на нижней стороне измерительной камеры для измерения баланса, измерьте ее кажущуюся массу на воздухе и подтвердите согласие с измерением на шаге 3.1.
- Смешайте раствор N 2 -Ar для устранения градиентов концентрации и плотности, как на этапе 4.5.
- Предварительно проведите испытательную массу до Т = 77 К, опустив ее в жидкий азот вне медной камеры. Поднимите тестовую массу в холодный слой газообразного азота над жидким азотом, дождитесь, пока остаточный жидкий азот испарится с испытуемой массы, а затем опустите холодную, сухую испытуемую массу в смесь N 2 -Ar до полного погружения и В пределах 2 см от поверхности жидкости.
- После исчезновения каких-либо кипящих и поверхностных волн измерьте кажущуюся массу испытуемой массы. Рассчитайте плотность раствора с использованием его истинной массы m и T = 77 K объем V (77K) из шага 3.7 в соответствии со следующим:
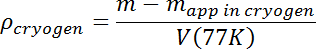
- Увеличьте плотность раствора путем пропускания дополнительного количества Ar до получения желаемой исходной плотности. Образцы капель, которые погружаются, могут быть легко потеряны, поэтому начальная плотность должна быть как минимум на несколько процентов выше ожидаемой плотности образца. Затем образец будет плавать, что упростит его отслеживание, и плотность смеси N 2 -Ar будет тогда только корректироваться вниз, добавляя жидкость N 2 .
- Снимите сверлящую трубку Ar с предварительным охлаждением и дайте ей прогреться и высушить перед следующим использованием.
6. Охлаждение капель раствора образца
- Непосредственно перед отбрасыванием и охлаждением повторите шаг 1,5 до miX криогенная жидкость азот / аргон. Будьте осторожны, чтобы не вводить пузырьки.
- Снимите воздухонепроницаемую крышку пробной трубки. Используя чистый 1 мл шприц, вылейте до 1 мл раствора и замените колпачок. Прикрепите иглу от 27 до 33 G на шприц, а затем проталкивайте небольшое количество пробы через иглу, чтобы вытеснить воздух и любые остатки от предыдущего отпуска.
- Для осаждения образцов в смесь N 2 -Ar можно использовать два метода.
- Для образцов с большими концентрациями неводных компонентов (> 45% мас. / Мас.), Которые можно остекловать при умеренных скоростях охлаждения, слегка нажмите на шприц, чтобы вытеснить небольшой (от 250 мкм до 1 мм) диаметр, от 10 до 1 мкл капли Который висит от кончика иглы поверхностным натяжением. Аккуратно нажмите на иглу, чтобы отсоединить и пропустить каплю в сторону жидкой смеси N 2 -Ar.
- Для образцов, для которых требуется более быстрое охлаждение для остекловывания, установите выход газовой трубки, подключенной к вакуумному генераторуИли (поставляемый лабораторным сжатым воздухом) в газовом пространстве над жидкой смесью N 2 -Ar, и осторожно отсасывать образовавшийся слой холодного газа. Это увеличивает скорость охлаждения небольших образцов 11 .
- Осторожно прикоснитесь к наконечнику иглы к прозрачной полимерной полосе толщиной 25-75 мкм, чтобы распределить небольшой объем (<10 нЛ, что соответствует диаметру капли <200 мкм) образца.
ПРИМЕЧАНИЕ. Чтобы получить самые маленькие, почти сферические и легко удаляемые капли, промойте полоску в гидрофобном растворе для покрытия в течение 10 минут и дайте высохнуть перед выдачей пробы. - Возьмите ленту с помощью прилагаемого пластика или деревянного стержня и вручную вверните стержень плюс полоску в жидкую смесь N 2 -Ar.
- Как только капля затвердеет и кипение прекратится, возьмите край полосы напротив стержня с помощью пинцета. Сгибайте полосу, удерживая ее погруженной в жидкость N 2 -Ar, пока капля образца не выскочит и не поплывет к прибоюТуз.
- Осторожно прикоснитесь к наконечнику иглы к прозрачной полимерной полосе толщиной 25-75 мкм, чтобы распределить небольшой объем (<10 нЛ, что соответствует диаметру капли <200 мкм) образца.
7. Оценка состояния выборки
- Используя бинокулярный микроскоп длинного рабочего расстояния (5-10 см) и яркую, холодную подсветку от светодиодного или волоконно-оптического осветителя, внимательно изучите каплю, оставив его погруженным в жидкость N 2 -Ar. Остеклованные капли должны казаться ясными 12 , 13 . Отклонить капли, которые являются туманными или мутными (вероятно, содержат более одной фазы) и / или которые показывают оптические несовершенства, включая трещины (которые могут быть связаны с пустотами, которые изменяют среднюю плотность).
ПРИМЕЧАНИЕ. Покраска внутренней поверхности медной камеры для обеспечения черного фона может облегчить идентификацию дефектов образца.
8. Определение плотности образца
- Распределенная капля изначально будет плавать, погружаться или (реже) быть нейтральной плавучей в смеси N 2 -Ar.Плавающие капли иногда могут задерживаться поверхностным натяжением, крошечными пузырьками или прилипшими частицами льда. Осмотрите всю поверхность падения с помощью микроскопа. Сместите каплю вниз с поверхности жидкости с помощью небольшого (2-3 мм в диаметре, 10 см) предварительно охлажденного пластика или деревянного стержня и наблюдайте его реакцию.
- Если капля опустится, увеличьте плотность жидкости N 2 -Ar, используя процедуру на шаге 4, пока капля не станет нейтрально плавающей или плавает.
- Если капля плавает, уменьшите плотность жидкости N 2 -Ar, добавив жидкий азот с использованием 1,8 мл криовой. При больших плотностях исходной смеси (1,2-1,3 г / мл) добавление N 2 с шагом 1 мл дает значительные изменения плотности, но это должно быть увеличено до 5 мл при низких плотностях (0,8-0,9 г / мл). Аккуратно перемешайте N 2 -Ar (чтобы не потерять следы пробы образца), используя тонкую перфорированную листу из медной фольги вверх и вниз в медной камере.
- После каждого добавления N 2, Используйте небольшой предварительно охлажденный стержень, чтобы осторожно вытеснить плавающий каплю вниз в жидкость и наблюдать за его скоростью, когда он возвращается на поверхность.
- Когда плотность раствора была отрегулирована так, чтобы капля выглядела нейтрально плавающей или поднималась очень медленно (<50 мкм / с обеспечивала бы ~ 0,1% или лучшую плотность плотности для капель с объемами до 50 пл), измерить N 2 - Ar, как описано в шаге 5. Затем добавьте дополнительную жидкость N 2 до тех пор, пока капля сначала не начнет медленно опускаться и снова измерьте плотность смеси N 2 -Ar. Эти два измерения будут обеспечивать границы плотности падения.
Результаты
Измерения плотности при Т = 77 К для остеклованных капель водного раствора глицерина и этиленгликоля по сравнению с концентрацией криопротекторов показаны на рис. 1А и рис. 1В соответственно, а соответствующее изм?...
Обсуждение
Настоящий аппарат и методы, разработанные в основном студентами с ограниченным доступом к инструментальным инструментам и машинам, тем не менее обеспечивают высокоточные измерения плотности для отдельных капель жидкости до 50 пл. В диапазоне концентраций около 50% мас. / Мас., Где для по?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана NSF под наградой MCB-1330685. DWM подтверждает частичную поддержку от гранта обучения молекулярной биофизике Корнельского университета (NIH T32GM0082567).
Материалы
| Name | Company | Catalog Number | Comments |
| centrifuge tube | Falcon | 6029236 | 15 mL conical centrifuge tube |
| glycerol, >99.5% | Sigma | G9012-100 mL | |
| ethylene glycol, >99.8% | Sigma | 324558-100 mL | |
| analytical microbalance | Mettler | AE240 | Analytical balance, 0.01 mg resolution, has hook on bottom for weighing below the balance |
| vortexer | Scientific Industries | SI-0236 | Vortex-Genie 2 |
| Apparatus enclosure framing | Unistrut | 1-5/8" metal framing | 48" wide x 24" deep x 40" tall |
| Apparatus enclosure air barrier | any clear plastic sheeting | ||
| neoprene rubber disk | 4" diameter, 1/8" thick | ||
| dewar flask | Scilogix Dilvac | SS333 | 4.5 liter dewar flask with steel case and clamp lid |
| copper chamber | This fabricated part is comprised of a 1.43" diameter, 0.017" wall thickness copper tube with a solid cylindrical copper base soldered to seal one end. The copper base is 0.87" tall and the overall chamber height is 7". | ||
| nitrogen gas | Airgas | NI HP300 | 99.998% pure N2 gas |
| argon gas | Airgas | AR HP300 | 99.998% pure Ar gas |
| rotameter | Omega | FL3692ST | 2.52 l/min max flow rate |
| foam insulating lid | This part is fabricated from 4 lb/ft3 crosslinked polyethylene foam (supplied by Technifab, 1355 Chester Industrial Parkway, Avon, OH), and has an OD of 2.42", and ID of 1.52", and a thickness of 0.79". | ||
| PTFE test mass | This fabricated part is a 0.246" diameter, 0.580" tall cylinder with a 0.060" diameter hole running perpendicular to and intersecting the cylinder axis ~0.10" from one end. | ||
| microbalance platform | Unistrut | 1-5/8" metal framing | 11" wide x 24" long x 24" high rectangular frame with an top aluminum sheet containing a hole for the monofilament and hanging test mass |
| 2 mil (50 um) monofilament line | Berkley | NF1502-CM | Nanofil fishing line |
| Argon precooling coil tubing | VWR | 60985-512 | 1/8" ID x 1/4" OD PVC tubing |
| perforated copper foil mixer | 1.4" diameter, 35 micron thick copper disk, cut from 1 ounce/ft2 copper sheet and perforated with holes using an awl or other sharp pointed tool. Insert 1-2 mm diameter rigid thermally insulating (plastic or wood) rod into the center and fix using epoxy as needed. | ||
| syringe | BD | 309628 | 1 ml Luer-Lok tip syringe |
| vacuum generator | Gast | VG-015-00-00 | compressed air venturi single stage vacuum generator |
| hydrophobic coating spray | RainX | 620036 | plastic water repellent |
| long focal length stereo microscope | Bausch and Lomb Stereozoom 6 | 0.67-4 x zoom pod with 20x eyepieces, 10 cm working distance | |
| LED ring illuminator | Amscope | LED144S | |
| LED spot illuminator | Newhouse Lighting | NHCLP-LED | 3W LED gooseneck clamp lamp |
| 1.8 ml cryo vial | Nunc | V7634-500EA | Any 1.8 or 2 ml cryovial is adequate |
Ссылки
- Fahy, G. M., Wowk, B. Principles of Cryopreservation by Vitrification. Cryopreservation and Freeze-Drying Protocols. , 21-82 (2015).
- Nagy, Z. P., Nel-Themaat, L., Chang, C. -. C., Shapiro, D. B., Berna, D. P. Cryopreservation of eggs. Human Fertility: Methods and Protocols. , 439-454 (2014).
- Kriminski, S., Caylor, C. L., Nonato, M. C., Finkelstein, K. D., Thorne, R. E. Flash cooling and annealing of protein crystals. Acta Cryst Sect D. 58 (3), 459-471 (2002).
- Juers, D. H., Matthews, B. W. Reversible lattice repacking illustrates the temperature dependence of macromolecular interactions. J Mol Biol. 311 (4), 851-862 (2001).
- Juers, D. H., Matthews, B. W. Cryo-cooling in macromolecular crystallography: advantages, disadvantages and optimization. Q Rev Biophys. 37 (2), 105-119 (2004).
- Alcorn, T., Juers, D. H. Progress in rational methods of cryoprotection in macromolecular crystallography. Acta Cryst Sect D. 66 (4), 366-373 (2010).
- Warkentin, M., Sethna, J., Thorne, R. Critical Droplet Theory Explains the Glass Formability of Aqueous Solutions. Phys Rev Lett. 110 (1), 15703 (2013).
- Kriminski, S., Kazmierczak, M., Thorne, R. E. Heat transfer from protein crystals: implications for flash-cooling and X-ray beam heating. Acta Cryst Sect D. 59 (4), 697-708 (2003).
- Loerting, T., Bauer, M., Kohl, I., Watschinger, K., Winkel, K., Mayer, E. Cryoflotation: Densities of amorphous and crystalline ices. J Phys Chem B. 115 (48), 14167-14175 (2011).
- Shen, C., Julius, E. F., Tyree, T. J., Moreau, D. W., Thorne, R. E. Thermal contraction of aqueous glycerol and ethylene glycol solutions for optimized protein-crystal cryoprotection Thermal contraction of aqueous glycerol and ethylene glycol solutions for optimized protein-crystal cryoprotection. Acta Cryst Sect D. 72 (6), 742-752 (2016).
- Warkentin, M., Berejnov, V., Husseini, N. S., Thorne, R. E. Hyperquenching for protein cryocrystallography. J Appl Cryst. 39 (6), 805-811 (2006).
- McFerrin, M. B., Snell, E. H. The development and application of a method to quantify the quality of cryoprotectant solutions using standard area-detector X-ray images. J Appl Cryst. 35 (5), 538-545 (2002).
- Chinte, U., Shah, B., DeWitt, K., Kirschbaum, K., Pinkerton, A. A., Schall, C. Sample size: An important parameter in flash-cooling macromolecular crystallization solutions. J. Appl. Cryst. 38 (3), 412-419 (2005).
- Bosart, L. W., Snoddy, A. O. Specific gravity of glycerol. Ind Eng Chem. 20 (12), 1377-1379 (1928).
- Rodrigues, M., Francesconi, A. Z. Experimental study of the excess molar volumes of binary and ternary mixtures containing water + (1,2-ethanediol, or 1,2-propanediol, or 1,3-propanediol, or 1,2-butanediol) + (1-n-butyl-3-methylimidazolium bromide) at 298.15 K and atmospheric pressure. J Solution Chem. 40 (11), 1863-1873 (2011).
- Berejnov, V., Husseini, N. S., Alsaied, O. A., Thorne, R. E. Effects of cryoprotectant concentration and cooling rate on vitrification of aqueous solutions. J Appl Cryst. 39 (2), 244-251 (2006).
- Meisburger, S. P., Warkentin, M., et al. Breaking the Radiation Damage Limit with Cryo-SAXS. Biophys J. 104 (1), 227-236 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены