Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de la deformabilidad y la heterogeneidad de glóbulos rojos en sangre por Ektacytometry
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí presentamos técnicas para medir la deformabilidad del glóbulo rojo y la heterogeneidad celular por ektacytometry. Estas técnicas son aplicables a las investigaciones generales de la deformabilidad del glóbulo rojo y las investigaciones específicas de enfermedades de la sangre caracterizadas por la presencia de rígidos y deformables eritrocitos en la circulación, tales como anemia de células falciformes.
Resumen
Disminución de eritrocitos deformabilidad es característica de varios trastornos. En algunos casos, el grado de deformabilidad defectuoso puede predecir la severidad de la enfermedad o la aparición de complicaciones graves. Ektacytometry utiliza láser viscometry difracción para medir la deformabilidad de eritrocitos sometidos a tensión de esquileo creciente o un gradiente osmótico en un valor constante de esfuerzo de corte aplicado. Sin embargo, las mediciones directas de la deformabilidad son difíciles de interpretar al medir sangre heterogénea que se caracteriza por la presencia de eritrocitos rígidos y deformables. Esto es debido a la incapacidad de las células rígidas para alinear correctamente en respuesta a la tensión de esquileo y los resultados en un patrón de difracción distorsionado caracterizado por una disminución exagerada de deformabilidad aparente. La medición del grado de distorsión proporciona un indicador de la heterogeneidad de los eritrocitos en sangre. En la anemia de células falciformes, esto se correlaciona con el porcentaje de células rígidas, que refleja la concentración de hemoglobina y la composición de la hemoglobina de los eritrocitos. Además de medir la deformabilidad, osmótico gradiente ektacytometry proporciona información acerca de la fragilidad osmótica y el estado de hidratación de los eritrocitos. Estos parámetros también reflejan la composición de la hemoglobina de los glóbulos rojos de pacientes de la célula de hoz. Ektacytometry mide deformabilidad en las poblaciones de glóbulos rojos y no, por lo tanto, proporciona información sobre la deformabilidad o propiedades mecánicas de los eritrocitos individuales. Cueste lo que cueste, el objetivo de las técnicas descritas en este documento es proporcionar un método conveniente y confiable para medir la deformabilidad y la heterogeneidad celular de la sangre. Estas técnicas pueden ser útiles para el monitoreo de cambios temporales, así como la progresión de la enfermedad y respuesta a la intervención terapéutica en algunos trastornos. Anemia de células falciformes es un ejemplo bien caracterizado. Otros posibles trastornos donde las mediciones de la deformabilidad del glóbulo rojo y heterogeneidad son de interés incluyen el almacenamiento de la sangre, diabetes, infección por Plasmodium , deficiencia de hierro y las anemias hemolíticas por defectos de membrana.
Introducción
Ektacytometry proporciona una medida conveniente de la deformabilidad de eritrocitos en respuesta a alteraciones en la tensión de esquileo (medida en pascales (Pa)) o suspendiendo la osmolalidad del medio. Correspondientes parámetros de deformabilidad del glóbulo rojo son el índice de alargamiento máximo (máximo de IE), una medida de la máxima deformabilidad de un glóbulo rojo en respuesta a la creciente tensión de esquileo y tensión de esquileo ½ (SS ½), el esfuerzo cortante requerido para lograr el máximo de la mitad deformabilidad. 1 ektacytometry gradiente osmótico tiene varios parámetros informativos. Estos incluyen el índice de alargamiento mínimo (Min IE), una medida de la relación superficie a volumen y la osmolalidad en el que ocurre (O minutos), que es una medida de la fragilidad osmótica. Max de la IE y la osmolalidad en el que ocurre (O (IE máx.)) proporcionan información sobre membrana flexibilidad y célula superficie. Medio elongación máxima en el brazo hipertónico del gradiente osmótico está representada por EI hyper. Hiper de la IE y la osmolalidad en el que se produce, O hiperactivo, proporcionan información sobre la viscosidad intracelular de la célula roja que está determinada por la concentración de hemoglobina. 2 , 3 medición de deformabilidad en sangre heterogéneo se complica por el hecho de que células rígidas, tales como glóbulos rojos falciformes, no se alinean correctamente con la dirección del flujo como células deformables en respuesta al aumento de tensión de esquileo. En lugar de producir una imagen de difracción elíptica característica, células rígidas producen un patrón esférico que se traduce en un patrón de difracción en forma de diamante cuando overlaid de la elipse producida por las células deformables. 4 , 5 , 6 el patrón esférico se ha demostrado para corresponder a las células irreversiblemente falciformes realizando ektacytometry fracciones aisladas de células después de la centrifugación de la densidad. 6 el cálculo de índice de elongación incluye las medidas de los ejes largo y corto de la elipse; forma de diamante por lo tanto produce una aparente disminución en la elongación aumentando la anchura del eje corto. 7 se ha demostrado previamente que el grado de distorsión del patrón de difracción se correlaciona con el porcentaje de la hemoglobina drepanocítica (HbS) y el porcentaje de células falciformes en la sangre de pacientes con anemia de células falciformes. 5 el grado de distorsión del patrón de difracción se puede obtener por análisis matemáticos complejos. 8 también se puede obtener mediante el ajuste de la abertura de la abertura de la cámara en el ektacytometer o el nivel gris del software de instalación para modificar la altura del patrón de difracción. 5 sin embargo, detalles sobre cómo ajustar el nivel de gris no están bien definidos y la apertura de la cámara no es fácilmente accesible en la última generación de la ektacytometer disponible en el mercado. Para evitar estos problemas, el aumento de la cámara fácilmente accesible puede utilizarse para ajustar la altura del patrón de difracción. 9 utiliza este método para estimar la heterogeneidad celular, el grado de distorsión del patrón de difracción puede ser correlacionado con el porcentaje de hemoglobina fetal en la sangre de los pacientes con anemia de células falciformes. 10 varios parámetros ektacytometry gradiente osmótico también se correlacionan con el porcentaje de fetal o hemoglobina en la sangre de pacientes con anemia de célula de hoz. Correlaciones de distorsión de difracción patrón probablemente reflejan la contribución de la composición de la hemoglobina para el porcentaje de células rígidos, indeformable. De interés adicional, el perfil entero ektacytometry osmótico de gradiente sufre cambios bifásicos que corresponden al porcentaje de células densas en circulación durante crisis de células falciformes. 11
Ektacytometry es además útil en el estudio de varios otros trastornos. Ektacytometry gradiente osmótico es de diagnóstico para los trastornos de membrana heredados del glóbulo rojo, como la esferocitosis hereditaria, eliptocitosis hereditaria y pyropoikilocytosis hereditaria. 3 , 12 , 13 , 14 deformabilidad disminuido ocurre en la deficiencia de hierro. 15 caracterización de la "lesión de almacenamiento" de sangre ha empleado ektacytometry y futuros estudios investigando tanto la naturaleza de la lesión y las intervenciones para prevenir su formación durante el almacenamiento de sangre en bancos son susceptibles de beneficiarse de la técnicas presentadas aquí. 16 deformabilidad de eritrocitos disminución también se ha correlacionado con enfermedad microvascular en la diabetes. 17 estudios recientes enlazan a hiperglucemia, las concentraciones de ascorbato del glóbulo rojo y la fragilidad osmótica sugieren que estos factores pueden ser importantes en el desarrollo de la enfermedad microvascular. 18 Ektacytometry están actualmente realizando estudios para investigar esta hipótesis (Parrow y Levine, datos no publicados). Infección palúdica de la etapa de sangre es otra vía interesante de las investigaciones de deformabilidad del glóbulo rojo. Deformabilidad celular de falciparum del Plasmodium infectan eritrocitos disminuye dramáticamente durante las 48 horas de maduración intracelular del parásito desde anillo a etapa de esquizonte. La evidencia indica que esta disminución de la deformabilidad se invierte sobre la maduración del parásito. La reversión coincide con lanzamiento de eritrocitos infectados en la circulación. Disminución de la deformabilidad es probablemente mediada por proteínas de Plasmodium que promoción el secuestro de los eritrocitos. 19 estos estudios representan una pequeña muestra de condiciones clínicamente importantes donde medición deformabilidad del eritrocito y parámetros de gradiente osmóticos son relevantes. Existen varias otras áreas de estudio.
Técnicas alternativas para la medición de la deformabilidad del glóbulo rojo incluyen pinzas ópticas (también conocidas como trampas de láser) que utilizan las propiedades físicas de los fotones para estirar las células rojas en una o más direcciones. 20 esta técnica tiene la ventaja de medir la deformabilidad de los eritrocitos individuales, pero cierta incertidumbre en la calibración de fuerza ha producido una considerable variabilidad en los estudios 21 y análisis de datos pueden ser mano de obra intensiva a menos que automatizado. 22 la aspiración de una micropipeta, que utiliza presión negativa para aspirar un eritrocito en una micropipeta, también se ha utilizado para medir la deformabilidad de los glóbulos rojos. 7 , 23 mediciones múltiples, tales como la presión necesaria para aspirar el glóbulo rojo, son posibles con cada medida de definir diversas características de la célula roja. 23 microscopía de fuerza atómica es una técnica de alta resolución que mide la rigidez de la membrana mediante la cuantificación de la desviación de la viga del laser como un indicador de la desviación del voladizo a lo largo de la superficie de un glóbulo rojo. 24 estas técnicas proporcionan información sobre los eritrocitos, no se adaptan fácilmente para medir los cambios en las poblaciones de glóbulos rojos y, en general, requieren considerables conocimientos técnicos.
El deseo individual y las poblaciones de células al mismo tiempo ha llevado a avances en la automatización y el desarrollo de la microfluídica y métodos basados en la matriz. Como ektacytometry, rheoscopy medidas de deformabilidad en función del esfuerzo cortante pero se adquieren imágenes directamente a través de microscopio. 25 para mayor análisis de rendimiento, proyección de imagen de célula automatizada se ha empleado para producir distribuciones de deformabilidad con el rheoscope. 26 heterogeneidad celular puede cuantificarse por este método si se dispone de datos de un sujeto de control sano. 27 técnicas de microfluídica también permiten alto rendimiento análisis de células individuales; múltiples diseños utilizando adaptaciones de filtración, analizadores de tránsito celular28 ,29 , que mide el tiempo requerido para un flujo de eritrocitos a través de un microporo y alternativas que miden la presión requerida para el tránsito del eritrocito más bien de tiempo 30 han sido desarrollados. Otra plataforma de alto rendimiento análisis de células individuales es el única célula microcámara array chip, que tiene la ventaja adicional de permitir la caracterización basada en fluorescencia aguas abajo de las células. 31 aunque cada una de estas técnicas es potencialmente útil y puede ser superior para aplicaciones particulares, las ventajas comparativas de ektacytometry incluye sensibilidad, facilidad de uso y precisión. 32 ektacytometers disponibles en el mercado de última generación también posee considerable versatilidad en el número de ensayos que se pueden realizar.
Protocolo
Todos los sujetos en este estudio dieron consentimiento informado conforme a la declaración de Helsinki y los protocolos nacional institutos de salud Junta de revisión institucional aprobó.
1. encender el ektacytometer
- Conecte la tubería de la solución de limpieza a las soluciones de polivinilpirrolidona (PVP) osmolar baja y alta. Tenga cuidado de conectar el tubo osmolar 0 la solución osmolar bajo y el tubo osmolar 500 a la solución osmolar elevado.
Nota: La solución PVP baja osmolar debería tener una osmolalidad entre 35 y 55 miliosmoles por kilogramo (mOsm/kg), un pH de 7.25 7.45 a 25 ° C y una viscosidad entre 27,0 y 33,0 centipoise (cP) a 37.0 ± 0.5 ° C. La solución PVP osmolar elevado debe tener una osmolalidad entre 804 y 764 mOsm/kg, un pH de 7.25 7.45 a 25 ° C y una medida de viscosidad de 27.0 33.0 cP a 37,0 ° 0.5 ° C. - Asegúrese de que la sacudida se baja completamente en la taza. Iniciar el software y cebar la máquina (Hardware Compruebe| IO del instrumento). Que el instrumento completar el ciclo de cebado. Una vez finalizado el ciclo, saque la sacudida de la taza y secar completamente el bob y la Copa con un tejido de la limpieza de pelusas bajo.
Nota: Agua residual Lisan los glóbulos rojos, produciendo interferencias.
2. medir la deformabilidad en función de aumentar la tensión de esquileo
- Obtener sangre (menos de 1 mL es suficiente para realizar estas técnicas con repeticiones) en el frasco que contiene un anticoagulante adecuado.
Nota: EDTA se prefiere sobre la heparina ya que tiene menos influencia sobre parámetros hemorheological. 33 mantenga sangre a temperatura ambiente si las mediciones se llevan a cabo dentro de las 6 horas de sangre dibujar. - Mezclar suavemente la muestra de sangre entera antes de probar invirtiendo el frasco varias veces. Añadir 25 μl de sangre a 5 mL de solución PVP de iso-osmolar por pipeteo, tapa el frasco y mezcle suavemente invirtiendo varias veces. La solución iso-osmolar PVP debe tener una osmolaridad entre 284 y 304 mOsm/kg, pH 7.3-7.4 a 25 ° C y una viscosidad de 27.0 33.0 cP a 37.0 ± 0.5 ° C.
- En el software elija deformabilidad en el menú principal. Crear un nuevo análisis y añadir detalles experimentales (deformabilidad | Añadir detalles deseados | Muy bien).
- Levante la tapa para ektacytometer, asegúrese de que la sacudida se baja completamente en copa y la Copa se está convirtiendo.
- Añadir 1 mL de solución PVP sangre en el espacio entre la Copa y bob por pipeteo.
- Levante el bob un poco para bajar las muestras. Espere hasta que todas las burbujas se han trasladado fuera de la solución, luego cierre la tapa de la ektacytometer. Si es necesario, pulse el botón de aspiración para ayudar a eliminar las burbujas.
- Ajustar la ganancia a 200 moviendo la flecha a lo largo de la barra de desplazamiento en el software (ver nota). Cuando la temperatura es estable a 37 ° C y la imagen de difracción es estable, oprima Inicio (Start).
Nota: Para muchos estudios, una imagen de difracción buena puede obtenerse sangre sanos (hemoglobina concentración > 12,0 g / dL, volumen corpuscular medio de 80-96 fL y concentración de hemoglobina corpuscular media de 33-36 g/dL) con la ganancia de la cámara ajustada a 200. Estudios de sangre de anemia de células falciformes, ajuste la ganancia de la cámara para generar una imagen de difracción de 4,5 cm ha sido sugerido como el predeterminado para permitir la comparación de resultados entre estudios y laboratorios. 9 - Observar patrones de difracción como progresa de adquisición de datos para asegurarse que sean circulares, elípticas o en forma de diamante. Cuando la adquisición de datos es completa, guardar o imprimir el informe (archivo | Guardar o archivo | Impresión). EI máximo y SS ½ valores se reportarán automáticamente, junto con índices de alargamiento correspondiente a la especificada por el usuario o por defecto del esquileo tensiones. Datos también se guardarán automáticamente por el software.
- Al final, presione la opción de limpieza en el cuadro de diálogo en el monitor de la computadora (Clean). Después de la muestra es aspirada, enjuague el espacio entre la Copa y bob por chorros de agua desionizada en el espacio mientras que el instrumento permanezca en el ciclo de limpieza. Una vez finalizado el ciclo de limpieza, saque la sacudida de la taza y secar completamente el bob y la Copa con un tejido de la limpieza de pelusas bajo (crítica: Agua Residual Lisan los glóbulos rojos, produciendo interferencias).
- Haga clic en el botón de menú principal en el software para volver a la Página principal (Main Menu).
3. medir la heterogeneidad celular
- Mezclar suavemente la muestra de sangre entera antes de probar invirtiendo el frasco varias veces. Pipetear 25 μl de sangre entera a un nuevo frasco de 5 mL de solución PVP de iso-osmolar, tapa el frasco y mezclar suavemente por inversión del tubo hasta que la mezcla esté homogénea.
- En el menú principal elegir la deformabilidad. Crear un nuevo análisis y añadir detalles experimentales (deformabilidad | Añadir detalles deseados | Muy bien).
- Levante la tapa para ektacytometer, asegúrese de que la sacudida se baja completamente en copa y la Copa se está convirtiendo.
- Pipetee 1 mL de la solución de sangre PVP en el espacio entre la Copa y bob.
- Espere hasta que todas las burbujas se han trasladado fuera de la solución, luego cierre la tapa de la ektacytometer.
- Asegúrese de que una imagen de difracción estable está presente en la pantalla. Ajustar la ganancia de la cámara moviendo la flecha a lo largo de la barra de desplazamiento en el software hasta que produce una altura de difracción de 3,8 cm. Utilice una regla para verificar la altura de la imagen en la pantalla del ordenador.
- Cuando la temperatura es estable a 37 ° C y la imagen de difracción es estable, oprima Inicio (Start).
- Observar patrones de difracción como progresa de adquisición de datos para asegurarse que sean circulares, elípticas o en forma de diamante. Cuando la adquisición de datos es completa, guardar o imprimir el informe (archivo | Guardar o | Impresión).
- Al final, presione la opción de limpieza en el cuadro de diálogo en la pantalla del ordenador (limpieza). Después de la muestra es aspirada, enjuague el espacio entre la Copa y bob por chorros de agua desionizada de una botella de squirt en él mientras que el instrumento permanezca en el ciclo de limpieza. Una vez finalizado el ciclo de limpieza, saque la sacudida de la taza y secar completamente el bob y la Copa con un tejido de la limpieza de pelusas bajo (crítica: Agua Residual Lisan los glóbulos rojos, produciendo interferencias).
- Repita los pasos 2.1-2.5 y ajustar la ganancia de la cámara para obtener una altura de patrón de difracción de 4,5 cm (criterio 2.2).
- Repita los pasos 2.1-2.5 y ajustar la ganancia de la cámara para obtener una altura de patrón de difracción de 5,4 cm (criterio 2.2).
- Al final, haga clic en el botón de menú principal para volver a la Página principal del software (menú principal).
- Para determinar el grado de distorsión del patrón de difracción basado en Max IE como un porcentaje, utilice la siguiente ecuación (la misma ecuación se puede realizar con los datos de la altura de patrón de difracción de 4,5 cm si se desea):
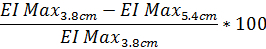
- Del mismo modo, para determinar el grado de difracción distorsión de patrón basado en SS1/2 uso la misma ecuación con el valor reportado de SS1/2:
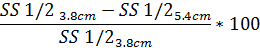
4. osmótico gradiente ektacytometry
- Obtener la muestra como se describe en 1.1. Mezclar suavemente la muestra de sangre entera antes de probar invirtiendo varias veces. Añadir 250 μl de sangre al frasco con 5 mL iso-osmolar PVP mediante pipeteo, tapa el frasco y mezclar suavemente por inversión del tubo hasta que la mezcla esté homogénea.
- Seleccione osmoscan en el menú principal (Osmoscan). Coloque el frasco que contiene la sangre solución PVP por debajo de la aguja en el lado izquierdo de la máquina. Baje la aguja hasta que toque el fondo del frasco. Asegúrese de que la tubería esté correctamente conectada a las soluciones osmolar baja y alta para la producción de gradiente. Cierre la tapa a la ektacytometer y abrir la puerta en la mitad inferior, por lo que se puede ver la sangre entrar en el tubo.
- Pulse nuevo análisis y el tipo de datos experimentales (Osmoscan | Nuevo análisis | Ingrese datos deseados | Muy bien). Ajustar la ganancia de la cámara a 200 moviendo la flecha de control en el software y permitir que la máquina funcione hasta que la sangre se ve entrar en la Copa del tubo debajo del instrumento.
- Una vez que la sangre ha entrado en la Copa y una imagen del patrón de difracción estable está en la pantalla del ordenador, comenzar adquisición de datos presionando el comienzo ahora el botón en el cuadro de diálogo (empezar ahora).
- Permiten la ektacytometer adquirir datos de hasta aproximadamente 500 mOsm/kg, luego pare el instrumento. Guardar o imprimir el informe (archivo | Guardar o archivo | Impresión). Datos también se guarda automáticamente.
- Sacar la cubeta del PVP sangre vieja. Sustituirla por una cubeta con agua desionizada. Coloque debajo de la aguja, llevar la aguja hacia abajo para que toque el fondo del frasco y presione el botón de enjuague en el cuadro de diálogo para aclarar el sistema de gradiente (enjuague).
- Una vez completado el enjuague, presione la opción de limpieza en el cuadro de diálogo en el monitor de la computadora (Clean). Una vez finalizado el ciclo de limpieza, saque la sacudida de la taza y secar completamente el bob y la Copa con un tejido de la limpieza de pelusas bajo (crítica: Agua Residual Lisan los glóbulos rojos, produciendo interferencias).
Nota: El informe de osmoscan proporciona índices de alargamiento a través de la gradiente osmótica. EI Min, O (IE Min), Max IE, O (Max IE), IE hyper y O hyper son generados automáticamente incluidas en el informe. La gama de parámetros ektacytometry gradiente osmótico obtenidos de sangre de voluntarios sanos 9 es: EI Min 0.196 0.12 unidades arbitrarias (a.u.); Oh Min 117-144 mOsm/kg; EI máximo 0.551-0.573 a.u.; O (IE Max) 272-312 mOsm/kg; EI hyper 0.278-0.286; O Hyper 454-505 mOsm/kg.
5. Apagar el ektacytometer
- Limpie el instrumento correctamente antes de se apaga.
- Para hacer esto, conectar la tubería de las soluciones de baja y alta osmolar a adaptador y la conduce a la solución de limpieza. Coloque un frasco que contenga solución de limpieza por debajo de la aguja en el lado izquierdo de la máquina y baje la aguja hasta que toque el fondo del frasco. Asegúrese de que la sacudida se baja completamente en la taza.
- Cierre el software y presione iniciar en el extremo día limpio del cuadro de diálogo en la pantalla del ordenador (cerca | Inicio). Que el instrumento limpiar completamente.
- Desconecte el tubo a la botella de residuos y saque del instrumento para desechar residuos. Seque completamente el bob. Apagar la máquina.
Resultados
Los resultados de ektacytometry descritos en este manuscrito pueden utilizarse para medir la deformabilidad del glóbulo rojo en cualquier condición. Un esquema de la configuración general de un ektacytometer se muestra en la figura 1. Poblaciones homogéneas de eritrocitos produce un patrón de difracción elíptica en respuesta al aumento de estrés de cizalla que pueden utilizarse para calcular el índice de alargamiento, como se muestra en la
Discusión
El ektacytometry técnicas descritas son sencillas y bien automatizados, asegurando resultados válidos y reproducibles. Sin embargo, existen algunos pasos críticos. Control de la temperatura adecuada de la sangre es importante. Almacenamiento a temperatura ambiente durante más de ocho horas puede afectar a SS ½ valores. 34 asegurar que la temperatura de la máquina es estable a 37 ° C también es importante, como el medio de suspensión es temperatura dependiente. Sangre se debe oxigenar comp...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el programa de investigación intramuros de los institutos nacionales de la Diabetes, digestivo y enfermedades del riñón y el National Heart, Lung and Blood Institute de los institutos nacionales de salud. Las opiniones aquí expresadas son responsabilidad exclusiva de los autores y no representan necesariamente las opiniones oficiales de los institutos nacionales de salud.
Materiales
| Name | Company | Catalog Number | Comments |
| LoRRca MaxSis standard version | Mechatronics | LORC109000 | |
| LoRRca MaxSis Osmoscan | Mechatronics | LORC109001 | |
| Polyvinylpyrrolidone solution (PVP) 0mOsm | Mechatronics | QRR030910 | |
| Polyvinylpyrrolidone solution (PVP) 500mOsm | Mechatronics | QRR030930 | |
| Polyvinylpyrrolidone solution (PVP) 5mL vials | Mechatronics | QRR030901 | |
| X clean | Mechatronics | QRR010946 | |
| P1000 | MilliporeSigma | Z646555 | |
| P200 | MilliporeSigma | Z646547 | |
| P200 filter tips | MidSci | AV200-H | |
| P1250 filter tips | MidSci | AV1250-H | |
| Kimwipes | MidSci | 8091 | |
| 1.5 mL eppendorf tubes | MidSci | AVSS1700 | |
| 15 mL conical vial | MidSci | C15R |
Referencias
- Bessis, M., Mohandas, N., Feo, C. Automated ektacytometry: a new method of measuring red cell deformability and red cell indices. Blood Cells. 6 (3), 315-327 (1980).
- Clark, M. R., Mohandas, N., Shohet, S. B. Osmotic gradient ektacytometry: comprehensive characterization of red cell volume and surface maintenance. Blood. 61 (5), 899-910 (1983).
- Da Costa, L., et al. Diagnostic tool for red blood cell membrane disorders: Assessment of a new generation ektacytometer. Blood Cells Mol Dis. 56 (1), 9-22 (2016).
- Clark, M. R., Mohandas, N., Shohet, S. B. Deformability of oxygenated irreversibly sickled cells. J Clin Invest. 65 (1), 189-196 (1980).
- Rabai, M., et al. Deformability analysis of sickle blood using ektacytometry. Biorheology. 51 (2-3), 159-170 (2014).
- Bessis, M., Mohandas, N. Laser Diffraction Patterns of Sickle Cells in Fluid Shear Fields. Blood Cells. 3, 229-239 (1977).
- Kim, Y., Kim, K., Park, Y., Moschandreou, T. E. . Blood Cell - An Overview of Studies in Hematology. , (2012).
- Streekstra, G. J., Dobbe, J. G., Hoekstra, A. G. Quantification of the fraction poorly deformable red blood cells using ektacytometry. Opt Express. 18 (13), 14173-14182 (2010).
- Renoux, C., et al. Importance of methodological standardization for the ektacytometric measures of red blood cell deformability in sickle cell anemia. Clin Hemorheol Microcirc. 62 (2), 173-179 (2016).
- Parrow, N. L., et al. Measurements of red cell deformability and hydration reflect HbF and HbA2 in blood from patients with sickle cell anemia. Blood Cells Mol Dis. 65, 41-50 (2017).
- Ballas, S. K., Smith, E. D. Red blood cell changes during the evolution of the sickle cell painful crisis. Blood. 79 (8), 2154-2163 (1992).
- Johnson, R. M., Ravindranath, Y. Osmotic scan ektacytometry in clinical diagnosis. J Pediatr Hematol Oncol. 18 (2), 122-129 (1996).
- Mohandas, N., Clark, M. R., Jacobs, M. S., Shohet, S. B. Analysis of factors regulating erythrocyte deformability. J Clin Invest. 66 (3), 563-573 (1980).
- Lazarova, E., Gulbis, B., Oirschot, B. V., van Wijk, R. Next-generation osmotic gradient ektacytometry for the diagnosis of hereditary spherocytosis: interlaboratory method validation and experience. Clin Chem Lab Med. 55 (3), 394-402 (2017).
- Anderson, C., Aronson, I., Jacobs, P. Erythrocyte Deformability is Reduced and Fragility increased by Iron Deficiency. Hematology. 4 (5), 457-460 (1999).
- Reinhart, W. H., et al. Washing stored red blood cells in an albumin solution improves their morphologic and hemorheologic properties. Transfusion. 55 (8), 1872-1881 (2015).
- Shin, S., et al. Progressive impairment of erythrocyte deformability as indicator of microangiopathy in type 2 diabetes mellitus. Clin Hemorheol Microcirc. 36 (3), 253-261 (2007).
- Tu, H., et al. Low Red Blood Cell Vitamin C Concentrations Induce Red Blood Cell Fragility: A Link to Diabetes Via Glucose, Glucose Transporters, and Dehydroascorbic Acid. EBioMedicine. 2 (11), 1735-1750 (2015).
- Tiburcio, M., et al. A switch in infected erythrocyte deformability at the maturation and blood circulation of Plasmodium falciparum transmission stages. Blood. 119 (24), e172-e180 (2012).
- Henon, S., Lenormand, G., Richert, A., Gallet, F. A new determination of the shear modulus of the human erythrocyte membrane using optical tweezers. Biophys J. 76 (2), 1145-1151 (1999).
- Mills, J. P., Qie, L., Dao, M., Lim, C. T., Suresh, S. Nonlinear elastic and viscoelastic deformation of the human red blood cell with optical tweezers. Mech Chem Biosyst. 1 (3), 169-180 (2004).
- Moura, D. S., et al. Automatic real time evaluation of red blood cell elasticity by optical tweezers. Rev Sci Instrum. 86 (5), 053702 (2015).
- Evans, E. A. New membrane concept applied to the analysis of fluid shear- and micropipette-deformed red blood cells. Biophys J. 13 (9), 941-954 (1973).
- Chen, X., Feng, L., Jin, H., Feng, S., Yu, Y. Quantification of the erythrocyte deformability using atomic force microscopy: correlation study of the erythrocyte deformability with atomic force microscopy and hemorheology. Clin Hemorheol Microcirc. 43 (3), 243-251 (2009).
- Musielak, M. Red blood cell-deformability measurement: review of techniques. Clin Hemorheol Microcirc. 42 (1), 47-64 (2009).
- Dobbe, J. G., Streekstra, G. J., Hardeman, M. R., Ince, C., Grimbergen, C. A. Measurement of the distribution of red blood cell deformability using an automated rheoscope. Cytometry. 50 (6), 313-325 (2002).
- Dobbe, J. G., et al. Analyzing red blood cell-deformability distributions. Blood Cells Mol Dis. 28 (3), 373-384 (2002).
- Kikuchi, Y., Arai, T., Koyama, T. Improved filtration method for red cell deformability measurement. Med Biol Eng Comput. 21 (3), 270-276 (1983).
- Moessmer, G., Meiselman, H. J. A new micropore filtration approach to the analysis of white cell rheology. Biorheology. 27 (6), 829-848 (1990).
- Guo, Q., et al. Microfluidic analysis of red blood cell deformability. J Biomech. 47 (8), 1767-1776 (2014).
- Doh, I., Lee, W. C., Cho, Y. H., Pisano, A. P., Kuypers, F. A. Deformation measurement of individual cells in large populations using a single-cell microchamber array chip. Appl Phys Lett. 100 (17), 173702-173703 (2012).
- Baskurt, O. K., et al. Comparison of three commercially available ektacytometers with different shearing geometries. Biorheology. 46 (3), 251-264 (2009).
- Baskurt, O. K., et al. New guidelines for hemorheological laboratory techniques. Clin Hemorheol Microcirc. 42 (2), 75-97 (2009).
- Uyuklu, M., et al. Effects of storage duration and temperature of human blood on red cell deformability and aggregation. Clin Hemorheol Microcirc. 41 (4), 269-278 (2009).
- Uyuklu, M., Meiselman, H. J., Baskurt, O. K. Effect of hemoglobin oxygenation level on red blood cell deformability and aggregation parameters. Clin Hemorheol Microcirc. 41 (3), 179-188 (2009).
- Embury, S. H., Clark, M. R., Monroy, G., Mohandas, N. Concurrent sickle cell anemia and alpha-thalassemia. Effect on pathological properties of sickle erythrocytes. J Clin Invest. 73 (1), 116-123 (1984).
- von Tempelhoff, G. F., et al. Correlation between blood rheological properties and red blood cell indices(MCH, MCV, MCHC) in healthy women. Clin Hemorheol Microcirc. 62 (1), 45-54 (2016).
- Da Costa, L., Galimand, J., Fenneteau, O., Mohandas, N. Hereditary spherocytosis, elliptocytosis, and other red cell membrane disorders. Blood Rev. 27 (4), 167-178 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados