Method Article
Ein Protokoll für Labor Housing von Türkis Killifische (Nothobranchius Furzeri)
In diesem Artikel
Zusammenfassung
Labor-Gehäuse von Türkis, die Killifische unterzubringen und effizient erhöhen Tausende von einzelnen Fische in eine zentralisierte Wasserfilter-System, mit der gleichen Infrastruktur für standard Zebrafisch genutzt skaliert werden kann. Hier zeigen wir eine Liste von standardisierten Verfahren, die effiziente Killifische Wartung ermöglichen.
Zusammenfassung
Die Entwicklung von Tierhaltungspraktiken in Labor-Modell Fisch für experimentelle Zwecke hat profitiert von der Gründung des Referenz-Fisch Modellsysteme wie Zebrafisch und Medaka. In den letzten Jahren hat eine wachsende Zahl von Forschungsgruppen in den Bereichen der Biologie des Alterns und Ökologie einer aufstrebenden Fisch – die türkisfarbenen Killifische (Nothobranchius Furzeri) – angenommen. Mit einer Gefangenschaft Lebensdauer von 4 bis 8 Monate diese Art ist die kurzlebigsten Wirbeltier in Gefangenschaft angehoben und ermöglicht die wissenschaftliche Gemeinschaft Test – in kurzer Zeit – experimentelle Interventionen, die zu Veränderungen des Alterns Rate und Lebenserwartung führen können. Angesichts die einzigartigen Biologie dieser Art, gekennzeichnet durch embryonale Diapause markiert explosive sexuelle Reifung, morphologische und Verhaltensstörungen Geschlechtsdimorphismus- und ihrer relativ kurzen Erwachsenen Lebensdauer - ad-hoc- Tierhaltung sind Praktiken in dringenden Nachfrage. Dieses Protokoll berichtet eine Reihe von wichtigen Tierhaltung Maßnahmen, mit denen optimale Türkis Killifische Labor Pflege, Aktivierung der wissenschaftlichen Gemeinschaft, diese Spezies als ein leistungsfähiges Labor Tiermodell anzunehmen.
Einleitung
Aufgrund ihrer kurzen Lebensdauer und schnelle Lebenszyklus, sind türkis Killifische als vielversprechende neue Modellorganismus in der Biologie1,2,3rasant. Diese Art zeichnet sich durch einen einzigartigen Lebenszyklus für eine teleost, bestehend aus embryonalen Diapause, schnelle sexuelle Reifung und eine verlängerte post-reproductive Lebensdauer Stufe4,5. Den letzten Arbeit hat dazu beigetragen, Aufklärung die Biologie dieser Arten in Gefangenschaft und im wilden6,7. Türkis Killifische Leben in saisonalen frischen Gewässer dieser Form während der Regenzeit in der afrikanischen Savanne in Simbabwe und Mosambik. Während der Trockenzeit überleben Embryonen im trockenen Schlamm in Abwesenheit von Wasser durch eine Stress-resistente Lebensstadium Diapause genannt.
Genetische Karten für diese Spezies wurden generierten8,9, und vor kurzem wurde ihr Genom sequenziert und montierten10,11. Mehreren Inzucht laborbelastungen Fisch entwickelt worden und Transgenese und Genom Bearbeitung via CRISPR/Cas9 sind verfügbar in dieser Spezies, de-facto- Förderung Türkis Killifische als wettbewerbsfähige Labor vertebrate Modellorganismus geworden 12,13,14.
Obwohl ein Laborprotokoll für diese Arten15bereits veröffentlicht worden, in diesem Protokoll entwickeln wir eine umfassende Liste von experimentellen Labor-Richtlinien, die speziell auf Studien, die untersuchen, Alterung und überleben. Dieses Protokoll ermöglicht Forschern bereits vertraut mit Zebrafisch und Medaka Tierhaltung in Türkis Killifische Zucht bewandert werden durch die Annahme einer Mindestanzahl von wesentliche Anpassungen. Zur gleichen Zeit bietet dieses Protokoll Forschern ohne Vorkenntnisse in Fisch Zucht mit wichtigen Tools um eine blühende Kolonie Türkis Killifische zu erhöhen.
Protokoll
Fische werden bei 28 ° C in einem Kreislaufsystem Wasser angehoben (siehe Wasserwerte), mit 10-20 % täglich Wasser zur Verfügung. Drei verschiedene Speichergrößen sind zu empfehlen: 0,8 L, 2,8 L und 9,5 L. Jeder Tank erhält einen konstanten Wasserdurchfluss von 2 mL/s.
(1) Reagenzien Vorbereitung (nicht in den Materialien enthalten)
Hinweis: Afrikanische Türkis Killifische (Nothobranchius Furzeri) kann von einem etablierten Labor Lager bereitgestellt werden. Die jährliche Killifische Austrocknung resistent Embryonen können per Mail verschickt werden. Es ist entscheidend für die Embryonen im 8-30 ° C Temperaturbereich zu versenden.
- Bereiten Sie Huminsäure (Schraffur) Lösung durch Auflösen von 1 g/L Huminsäure im System Wasser vor. Autoklaven und Store bei 4 ° C für bis zu 10 Wochen.
- Fügen Sie für die Zubereitung von HUFA Artemia Bereicherung HUFA Bereicherung zu Artemia Hatcher täglich bei einer Konzentration von 500 µL/L Artemia-Lösung hinzu.
- Bereiten Sie Methylenblau-Lösung durch 100 µL/L von Methylenblau-Stammlösung in zuvor autoklaviert System Wasser auflösen. Da Methylenblau lichtempfindlich ist, halten Sie die Lösung in dunklen Flaschen oder mit Folie abdecken. Shop bei RT
- Embryo Inkubation Kokosfaser als ein festes Substrat vorbereiten. Alternativ können Sie ein Filterpapier (siehe Abschnitt 1.5).
- Weichen Sie Kokosfaser mit destilliertem Wasser. Autoklaven und Store bei 4 ° C für bis zu 5 Wochen.
- Am Tag der Embryotransfer bereiten Sie Petrischale mit feuchter Kokosfaser vor.
- Füllen Sie einen Durchmesser von 90 mm Petrischale mit Kokosfaser unter einem Abzug und neben einer Flamme, um Kontamination durch Hefen und Bakterien zu reduzieren.
- Kompakte Kokosfaser bis zu einer Höhe von 1 cm, mit einem sterilen Tuch. Entfernen Sie die meisten der Feuchtigkeit aus der Kokosfaser durch drücken ein Papiertuch auf der Platte, das Papier um das überschüssige Wasser aufnehmen zu lassen. Erhitzen Sie einem Metalllöffel über der Flamme, und drücken Sie auf die gesamte Oberfläche der Kokosfaser. Dies verhindert, dass Kokos Faser Pilz/bakterielle Kontamination.
- Bereiten Sie das Filterpapier als ein festes Substrat für Embryo Inkubation.
- Am Tag der Übertragung der Embryonen Platz 3 Lagen Filterpapier Datenträger, auf denen die 90-mm-Petrischale passen. Fügen Sie 5 mL Huminsäure Säurelösung, Feuchtigkeit zu halten.
2. Zucht
-
Zucht von Türkis Killifische für Stamm-Wartung
Hinweis: Im Anschluss an dieses Protokoll ist sexuelle Reife bei ~ 4 Wochen nach dem Schlupf und Fruchtbarkeit Gipfeln zwischen 7 bis 9 Wochen erreicht. Es ist wichtig zu beachten, dass die Fruchtbarkeit hängt davon ab, Fütterung, Frequenz und Qualität des Essens; Daher sind mindestens zwei Fütterungen pro Tag pro Zucht Tank empfohlen, Embryonen Ertrag (siehe Abschnitt 5.6) zu erhöhen- Richten Sie einen 9,5 L Zucht Tank. Füllen Sie mit Wasser und fügen Sie eine männliche und zwei weibliche Fische.
- Als männliche afrikanische Türkis Killifische Dominanz Anzeige während der Paarung, die Belästigung von Frauen führen könnte, wählen Sie einen Mann mit einer etwas kleineren Körpergröße als das Weibchen zur Paarung Stressabbau und Reproduktionsleistung zu erhöhen. 5 Wochen alte Männchen mit 6/7 Wochen alten Weibchen eingerichtet.
- Füllen Sie einen Kunststoff-Behälter (10 x 10 x 5 cm) mit autoklaviert Sand eine Endteufe von ~ 2-3 cm erreichen und Sandkasten in der Mitte des Panzers Zucht.
- Lassen Sie Türkis Killifische kontinuierlich zu züchten und ernten Embryonen einmal pro Woche für Embryo Inkubation.
Hinweis: Die Verwendung von Sand Substrat stellt Herausforderungen an die zentrale Filteranlagen und sollte in Zukunft durch alternative Methoden ersetzt werden. Mögliche Alternativen könnte die Verwendung von Zebrafisch Zucht Panzer.
-
Zucht auf Transgenese
Hinweis: Embryonen für Injektionen verwendet bei der 1-Zellstadium synchronisiert werden müssen, und dies erfordert, dass sie unmittelbar nach der Befruchtung gesammelt werden.- Zur Ernte ein-Zellstadium Embryonen für Injektion und Generierung von transgenen Linien verwenden, richten Sie ein Zucht-Tank mit einem Männchen und zwei weibliche Fische (identisch mit 2.1.).
- Isolieren Sie zwei Tage vor der Entnahme der Embryo das Männchen in einem einzelnen Tank und halten Sie das Männchen in Sichtkontakt mit adulten Weibchen.
- Am Tag der Sammlung der Zucht Tank das Männchen und Sandkasten hinzu und lassen sie für 2 h laichen.
(3) die Embryo-Haltung
-
Embryo-Sammlung
Hinweis: Embryo Sammlung erfolgt durch Siebung und Ernte Embryonen aus dem Sandkasten. Unter normalen Bedingungen sollte jedem Sandkasten 30 bis 200 Embryonen enthalten.- Am Tag der Sammlung nehmen Sie Sandkasten aus dem Zucht-Becken. Sandkasten in ein Sieb (~0.9 mm Belastung Größe) zu entleeren und mit Wasser abspülen. Dies kann über einen großen Tank, Sand für Autoklavieren zu sammeln.
- Teilweise Tauchen das Sieb im System Wasser und Wirbel sanft, die Embryonen in der Mitte gruppieren lassen.
- Embryonen mit einer 10 mL Pasteurpipette zu sammeln.
- Transferieren Sie die Embryonen mit einem 90 mm Petrischale in ~ 40 mL Wasser.
- Überprüfen Sie Embryonen in Petrischale unter einer leichten Stereomikroskop und entfernen Sie die geplatzten Chorion und Beschädigungen zu präsentieren.
- Gehen Sie direkt zum Embryo zu bleichen.
Hinweis: Verwenden Sie immer ein Sieb pro Fisch Stamm um potenzielle Kreuz-Stamm Embryo Kontaminationen zu verhindern.
-
Embryo Bleichen
Hinweis: Embryo bleichen Mikroorganismen in Aquarien von verunreinigen die Inkubation Medien verhindert.- Vor dem Bleichen, verwenden Sie eine Einweg Pasteurpipette, um das System Wasser aus der Petrischale mit gesammelten Embryonen zu entfernen.
- Um unerwünschte Pilz- und bakterielle Wachstum zu verhindern, fügen Sie 50 mL frisch zubereitete H2O2 (1 % V/V im Autoklaven System Wasser) mit den gesammelten Embryonen.
- Schütteln Sie Embryonen für 5 min bei niedriger Drehzahl in 90 mm Petrischalen in 50 mL Lösung.
- Entfernen Sie H2O2 Lösung mit Einweg Pasteurpipette und waschen Sie Embryonen drei Mal für 5 min mit 50 mL Methylenblau-Lösung. Entfernen Sie Methylenblau-Lösung.
- Embryonen 50 mL H2O2 (1 % V/V im Autoklaven System Wasser) hinzufügen und für 5 min schütteln.
- Entfernen Sie H2O2 Lösung und waschen Sie drei Mal für 5 min mit 50 mL Methylenblau-Lösung.
- Inkubieren Sie Embryonen bei 28 ° C, synchrone Embryonen Entwicklung, bei einer maximalen Dichte von 100 Embryonen pro 90 mm Petrischale in 40 mL Methylenblau-Lösung zu erhöhen.
Hinweis: Embryo Inkubation im Bleichbad nicht verlängern. Dies kann Schäden an Ei Chorion und Embryo Sterblichkeit zu erhöhen. Embryo bleichen könnte wichtige physikalisch-chemische Veränderungen in der Ei-Chorion, die veränderten Chorion Physiologie und Schraffur Erfolg führen könnte.
-
Embryo-Inkubation in Methylenblau
Hinweis: Flüssige Inkubation in Methylenblau-Lösung verhindert das Wachstum von Parasiten und ermöglicht eine Erfassung von Toten Embryonen und unbefruchteten Eiern.- Inspizieren Sie inkubierten Embryonen, entfernen alle Toten Embryonen (blaue von Methylenblau befleckt) aus der Petrischale gegen Pilz- und bakterielle Kontamination, die das Überleben der live gesunden Embryonen betreffen.
- Entfernen Sie alte Methylenblau-Lösung und mit frischer Lösung zu ersetzen.
- PETRISCHALE, 28 ° C Inkubator (Abbildung 1A) zurück. Innerhalb von 7-10 Tagen sicherzustellen Sie, dass die entwickelten Embryonen sichtbar schwarzen Augen zeigen. Übertragen Sie diese Embryonen auf die Kokosfaser oder das Filterpapier festes Substrat Medium (Abbildung 1 b).
- Behalten Sie unbebaute Embryonen in Methylenblau zu und überwachen Sie täglich zu festen Substrat Medium zu übertragen Sie, sobald schwarze Augen entwickelt haben.
- Wiederholen Sie die Schritte 3.3.1-3.3.3 täglich bis Embryonen sichtbar schwarze Augen haben.
Hinweis: Ständiger Exposition von Embryonen zu Methylenblau kann langfristige Veränderungen der Erwachsenen Fische Physiologie induzieren.
-
Embryo-Transfer, Filterpapier
Hinweis: Türkis Killifische Embryonen können auf einem trockenen Substrat, Rekapitulation natürliche Bedingungen entwickeln. Darüber hinaus kann trocken Embryo Inkubation Forscher Embryonen zu synchronisieren und sie am selben Tag schlüpfen.- Da entwickelten Embryonen sichtbar schwarzen Augen innerhalb von 7-10 Tagen haben werden, verwenden Sie Einweg Pasteurpipette oder feinen gebogenen Pinzette Embryonen aus der Methylenblau-Lösung auf eine vorbereitete Filterpapier-Platte übertragen.
- Verbreiten Sie Embryonen ~ 5 mm auseinander mit der Pinzette, bis zu 100 Embryonen pro 90 mm Platte (Abbildung 1 b).
- Die Petrischale mit Parafilm zu versiegeln.
- 2-3 Wochen, bis sie golden IRIS voll entwickelt haben und sind bereit für Schraffur (Abbildung 1) inkubieren Sie Embryonen bei 28 ° C.
Hinweis: Nicht verlängern Sie, Inkubation von bereit-zu-Luke Embryonen länger als 2 Wochen, da ihre Überlebensfähigkeit drastisch verringert wird.
-
Embryo-Transfer, Kokosfaser
Hinweis: Autoklaviert, sterile Kokos Faser (oder organischen Torfmoos) als gültige alternative Medium für solide substratinkubation einsetzbar.- Verwenden Sie eine Einweg Pasteurpipette oder feinen gebogenen Pinzette Embryonen aus der Methylenblau-Lösung auf eine Ready-to-Use Kokos Faser Platte übertragen.
- Embryonen ~ 5 mm auseinander, bis zu 100 Embryonen pro 90 mm Platte (Abbildung 1 b) zu verbreiten.
- Die Petrischale mit Parafilm zu versiegeln.
- 2-3 Wochen, bis sie vollständig, golden IRIS (z. B. in Abbildung 1 entwickelt haben) inkubieren Sie Embryonen bei 28 ° C.
Hinweis: Für die langfristige Lagerung (bis zu einem Jahr), übertragen Sie Embryonen im 3-Tage Post Sammlung von Methylenblau-Lösungen eine Solid-Substrat-Platte bei 17 ° C. Inkubieren Sie Embryonen bis sie schwarze Augen zu entwickeln.
(4) schlüpfen Türkis Killifische
Hinweis: Türkis Killifische Embryonen können erfolgreich in einer Huminsäure Säurelösung14geschlüpft.
- Feinen gebogenen Pinzette, entwickelte Transfer sorgfältig 50-100 Embryonen zu Feld Schraffur gefüllt mit Huminsäure saure Lösung bei 4 ° C. Die Huminsäure saure Lösung besteht aus 1 g/L Huminsäure im System Wasser. Autoklaven und Store bei 4 ° C für bis zu 10 Wochen. Stellen Sie sicher, dass alle Embryonen vollständig eingetaucht sind. Huminsäure Säurelösung muss flach, nicht tiefer als 2 cm sein.
Hinweis: Niedriger Temperatur von Huminsäure saure Lösung verbessert die Schraffur und vollständiges Eintauchen des Embryos in der Lösung ermöglicht synchronisierten Schlupf. - Stellen Sie den Schraffur-Koffer in den 28 ° C schlüpfen Brutkasten. Die Schraffur-Box mit dem Deckel abdecken. Um ausreichende Belüftung zu versorgen, verbinden Sie Schraffur Box durch Schläuche mit Druckluft.
Hinweis: Nicht ausreichende Belüftung während der Inkubation führt zu hohen Wachstumsraten Fry nicht in der Lage, die Gas-Blase zu füllen ("Bauch-Schieber" Phänotyp, siehe Hinweis in Kapitel 5.1) - Ab dem Tag nach dem Schlüpfen um die ausreichende Wasserqualität im Feld Schraffur zu erhalten, fügen Sie autoklaviert System Wasser einmal pro Tag im Verhältnis 1:1, halten eine Endteufe von 2 cm.
- Übertragen Sie ungeschlüpfte Embryonen zurück auf dem festen Untergrund zu, und versuchen Sie, eine Woche später schlüpfen.
Hinweis: Nach dem schlüpfen, Türkis Killifische sind ohne weiteres in der Lage, Aufnahme und Lebendfutter zu konsumieren. Für ein optimales Wachstum feed Braten zweimal pro Tag mit überschüssigen frisch geschlüpften Artemia (Artemia Salina). Die Zeichen der vollen Sättigung ist die Orange gefärbten Bäuche von Fry nach 10-15 min von jeder Fütterung. Siphon aus der überschüssigen, gefressenes und zerlegten Artemia mit einer Pasteurpipette auf einer täglichen Basis.
5. Erhöhung der juvenilen und adulten Fische
- Fünf Tage nach dem Schlüpfen bewegen Sie Jugendliche an das Wassersystem Umluft. Verwendung von Einweg-Plastik Pipetten (oder einem Plastiklöffel), sorgfältig Übertragung fünf Jugendliche pro 0,8 L Tank ausgestattet mit 400 µm Braten Bildschirm (Abbildung 2).
Hinweis: Es ist möglich, dass ein Teil der Jugendlichen Killifische nicht die Gas-Blase, was zu einer typischen "Bauch-Schieber" Phänotyp, zeichnet sich durch Fisch nicht ordnungsgemäße Auftrieb zu erreichen, zwingen, ständig Schwimmen, verursacht schwere Missbildungen bei ausgefüllt haben, wird Erwachsene Fische. Diese Fische können nicht verwendet werden, zum Überleben Assays oder zur effizienten Brut und zensiert werden müssen. - Füttern Sie Jugendliche zweimal pro Tag mit frisch geschlüpften Artemia im Übermaß bis 14 Tage nach dem schlüpfen. Siphon aus Schutt vom unteren Rand jeder Tank täglich.
- 14 Tage alt Transfer Jungfische, 2,8-Liter-Tank mit einer 850 µm Braten Bildschirm ausgestattet. Beschriften Sie ab diesem Zeitpunkt jeden Tank mit Fisch-ID, Luke Datum, Stamm Informationen, Geschlecht der Fische und Fisch-ID-Nummer (Abbildung 3). Für Überleben Assays Haus individuell jeder Fisch in Einzeltanks ab diesem Zeitpunkt.
- Für die folgenden 7 Tage füttern Sie Jungtiere zweimal pro Tag mit ~ 2 mL Artemia pro Fisch. In diesem Stadium können Fische mit 1-3 lebendblut Würmern ergänzt werden (für den Fall, dass die wurmlarven Blut für die Fische zu groß sind, hacken sie in kleinere Stücke mit einer Rasierklinge). Vermeidung der Verschlechterung der Wasserqualität siphon aus Futterreste und zusätzlichen Abfall zweimal pro Woche.
- Nach 3 Wochen nach dem Schlüpfen Braten-Bildschirm auf der Rückseite des Behälters entfernen und beginnen zu jeder Fisch zweimal pro Tag ~ 2 mL Artemia und 0,5 mL Blut Wurm ernähren. In diesem Stadium sollte Jugendliche sollte 1 cm Körpergröße erreicht haben und in der Lage, Full-Size-Blut Wurm Einnahme.
- Im Alter von 4 Wochen füttern Sie jeder Fisch zweimal pro Tag mit ~ 2mL Artemia und 1 mL Blut Wurm. Weibchen können zusammen in einer Dichte von bis zu 3 Weibchen pro 2,8-Liter-Tank untergebracht werden.
- Sicherstellen Sie zu diesem Zeitpunkt, dass Fische vollständige Geschlechtsreife erreichen. Überprüfen Sie das Vorhandensein von großen dorsalen, anal und kaudalen flossen mit Zeichen der Färbung bei Männern und Runde Bäuche voll Eier im weiblichen Geschlecht.
Hinweis: Erhöhung der Erwachsenen Fische in einzelnen Tanks für Überleben Kohortenstudien Fisch Verhalten und Gesundheit beeinträchtigen könnten. Gruppenhaltung für Überleben Kohortenstudien fügt jedoch erhebliche Störfaktoren durch die Etablierung der sozialen Dominanz und männlicher Gebiete führt zu strengen sozialen Hierarchien.
(6) Fütterung
Hinweis: Labor Türkis Killifische kann eine Kombination von Baby Artemia (Artemia Salina Nauplien) und Blut Wurm (Chironomus spp. Larven) eingespeist werden. Türkis Killifische Braten werden ausschließlich Baby Artemia gefüttert. Jugendliche und Erwachsene Fische werden zweimal am Tag gefüttert Artemia und Blut Wurm (Abbildung 2). Fisch kann mehrmals täglich gefüttert werden, im Idealfall angegeben von mehr als 2 Fütterungen in diesem Protokoll.
-
Kultivierung von Artemia
- Hinzufügen 10 L Umkehrosmose (RO) Wasser und 350 g Rote Meer Salz ein Artemia Hatcher und lösen durch Begasung mit einer Lüftung Rohr.
- Bereichern Sie die Kultur mit 5 mL hoch ungesättigten Fettsäure (HUFA).
- 20 g von Artemia-Zysten in der Schraffur-Lösung zugeben. Überprüfen Sie, dass Artemia Zysten nicht auf der Oberfläche des Wassers Schwimmen und richtige Sauerstoffversorgung und Durchblutung der Kultur zu gewährleisten.
Hinweis: Tägliche Aliquote von trockenen Artemia Zysten können bei 4 ° c gespeichert werden - Am Nachmittag des nächsten Tages liefern Sie die Kultur mit einem anderen aliquoten von 5 mL HUFA.
-
Ernte geschlüpften Artemia
Hinweis: Nach ~ 36 h aus der Start-Kultur, Artemia sind reif für die Ernte (Instar II Phase).- 5 L der Kultur in einem Behälter mit dem Wasserhahn an der Unterseite der Hatcher zu sammeln und für 10 min ruhen lassen.
- Nach 10 min Artemia Schalen (braune Farbe) von der Oberseite des Behälters 5 L entfernen und die geschlüpften Artemia (Farbe orange) durch ein Sieb filtern. Achten Sie auf das Sediment gefunden an der Unterseite des Behälters enthält nicht geschlüpften Eiern und tot Artemia auszuschließen.
- Spülen Sie geschlüpften Artemia mit RO-Wasser in einen Behälter 2 L und 10 min ruhen lassen.
- Nach 10 min Artemia wieder durch ein Gitter zu filtern und in 2 L des RO-Wasser zu sammeln.
- Wiederholen Sie die vorherigen drei Schritte, bis Artemia Lösung frei von Zysten und Artemia Muscheln nicht geschlüpft ist.
- Übertragen Sie Artemia in Dosierflaschen für die Fütterung von 2 L-Container.
Hinweis: Kultivierung von Artemia ist ziemlich robust und zuverlässig. Zur Vermeidung von Mangel an Artemia im Falle einer erfolglosen Schraffur können jedoch kleiner (500 mL) backup Schlupfbrüter verwendet werden.
-
Einrichten des backup hatcher
- Lösen Sie 17,5 g Rote Meer Salz in 500 mL Wasser RO durch Belüftung.
- Bereichern Sie Kultur mit 500 µL HUFA.
- Fügen Sie 2 g Artemia-Zysten.
- Nach 18-24 h liefern Sie die Kultur noch einmal mit 500 µL HUFA.
Hinweis: Artemia sind nach ca. 24 h erntereif.
-
Vorbereitung von lebendblut Wurm
- Unmittelbar vor der Fütterung, zu filtern Sie eine entsprechende Menge an Blut Wurm durch ein Sieb mit RO-Wasser.
Hinweis: Lebendblut Wurm kann bei 4 ° C für ca. 7-10 Tage gespeichert werden. - Spülen Sie Blut Wurm mit einer kleinen Menge von RO-Wasser in einen Kunststoffbehälter.
- Mit einem Kunststoff Pasteur Pipette (schmale Spitze entfernt), nehmen die Blut-Wurm-Mischung für die Fütterung.
Hinweis: Fütterung Labor Killifische Kolonien mit Lebendfutter aus UN-kontrollierten Quellen addiert ein Risiko für externe Verunreinigungen von Parasiten und potenziell pathogenen mikrobieller Gemeinschaften. In Zukunft sollte eine ad-hoc-sterile Fischfutter entwickelt werden.
- Unmittelbar vor der Fütterung, zu filtern Sie eine entsprechende Menge an Blut Wurm durch ein Sieb mit RO-Wasser.
(7) Killifische Labor Stamm Genotypisierung
Bemerkung: Zur Unterscheidung unter Türkis Killifische Stämme, sowie zu bestimmen, Sex in jeder Stamm kann spezifische genetische (Mikrosatelliten) Marker verwendet9 (Tabelle 1).
-
Probenahme
- Halten Sie den Fisch sicher im Netz auf der Oberseite nassen Schwamm.
- Tupfer 2-3 Skalen aus dem Körper der Fische aus dem Kiemendeckel an der Schwanzflosse mit Wattestäbchen.
- Schuppen von den Tupfer und 2-3 Skalen in einer 1-mL-Tube mit NaOH-Lösung (200 µL 0,5 Mol/L NaOH, 1 % β-Mercaptoethanol und 0,5 % polyvinyl pyrrolidon).
- Drehen Sie die PCR-Röhrchen für 15 s um sicherzustellen, dass Skalen in der NaOH-Lösung vollständig eingetaucht sind.
-
Genomische DNA-Isolierung
- Inkubieren Sie die Probe für 20 min bei 95 ° c
- Cool bei RT, neutralisieren Probe mit 1/10 Volumen von 1 M Tris-HCl, pH 8.0.
- Zentrifugieren Sie die Probe für 5 min auf Hochtouren.
8. die Wasserwerte
Hinweis: Haltung von Organismen, deren Verwendungszweck Erwachsenen Phänotypisierung ist, erfordert hochstabile Haltungsbedingungen während der gesamten Lebensdauer der Zielarten. Daher erfordert die Kultivierung Wasserorganismen wie Türkis Killifische, strengen Kontrolle der Wasserwerte. Wasserrückführung, mit zusätzlichen vier Schritten Wasserfiltration, sorgt für eine robuste Grundlage für die Kontrolle der Wasserwerte, die alle Tanks mit den gleichen Wasserbedingungen im Laufe der Zeit zu erreichen. Es wird empfohlen, das System Wasser aus Umkehrosmose-(RO) Wasser, mit kommerziellen Meersalz und Natriumbicarbonat zu rekonstruieren.
- Wasser-Kreislauf System Schema: zunächst Abwasser aus Fisch Behälter fließt durch feste Partikel Metallfilter, das alle UN-gegessen Speisereste und größere Partikel einfängt. Metallfilter werden dreimal wöchentlich gespült; Zweitens ist im Anschluss an die erste mechanische Filtration Wasser in großen Ölwannen vermittelt und dann zu einem Biofilter gepumpt, wo Bakterien Ammoniak in Nitrit und Nitrat umwandeln; Drittens aus den Biofilter wird Wasser bis 25 µm Filterschläuche, gepumpt, die feineren Partikel der Größe fangen. Schließlich fließt das Wasser durch ultraviolette (UV) Lampen, die Wasser von Bakterien und Viren zu entkeimen. Nach diesen vier Schritten kehrt gefiltertes Wasser in den Aquarien.
- Zur Mikroorganismus Wachstum in den Tanks reduzieren, verhindern die Ansammlung von Nitraten und die ist insgesamt Salzgehalt, 10-20 % des Wassers System auf einer täglichen Basis angeordnet.
- Pflegen Sie Wasser Temperatur konstant bei 28 ° C, Wasser pH-Wert konstant im Bereich von 7,0 bis 7,5.
- Obwohl Killifische verschiedenster Salzgehalt tolerieren, zur Vermeidung von Oodinosis, pflegen Sie Leitfähigkeit innerhalb der Reichweite 650-710 Mikro-Siemens. Ein Jahr lang 12 h Hell/Dunkel-Zyklus sorgt für Kolonie Gesundheit und Produktivität.
Hinweis: Killifische verträgt wasserleitfähigkeit bis zu 1500 Mikro-Siemens.
Ergebnisse
Türkis Killifische richtige Haltung führt mediane Überlebenszeit zwischen 12-18 Wochen in der GRZ Belastung (z. B. Abbildung 4A). Variationen der mediane Überlebenszeit abhängig von Ernährung, Fütterung Frequenz und Temperatur Wohnbedingungen. Schlechte Haltung führt zu überleben Kurven präsentiert erhöht frühe Sterblichkeit und repetitive, plötzlichen Tropfen des Überlebens im Laufe der Zeit zeichnet sich durch mehrere Wendepunkte (Abbildung 4 b).

Abbildung 1: Repräsentative embryonalen Entwicklungsstufen mit entsprechenden Inkubation Substrat. (A) frisch gesammelten Embryonen, inkubiert in Methylenblau-Lösung im Inkubator bei 28 ° C. (B) Embryonen bereit, auf festem Medium übertragen werden entweder Papier oder Kokos Faser filtern. (C) Embryonen bereit, die schraffiert werden, typische golden IRIS anzeigen. Der Maßstab ist gleich bis 1 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
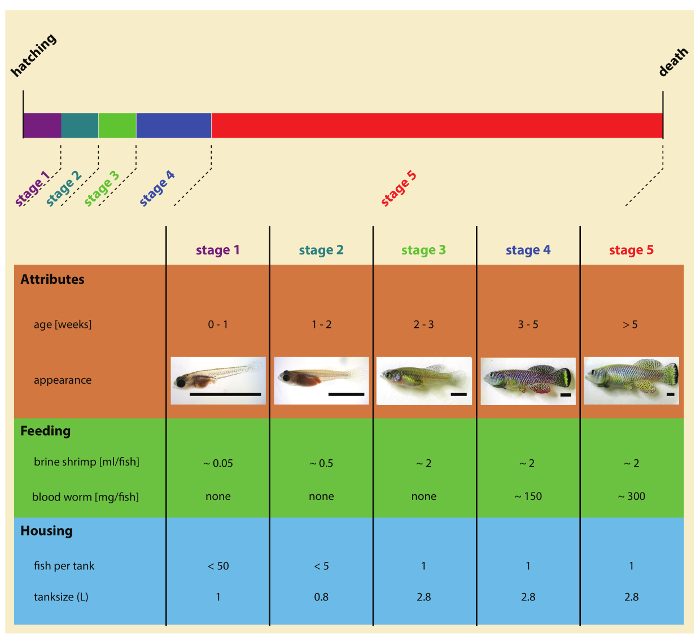
Abbildung 2: Phasen des türkisfarbenen Killifische nach dem Schlüpfen Entwicklung. Bitte klicken Sie hier für eine größere Version dieser Figur.
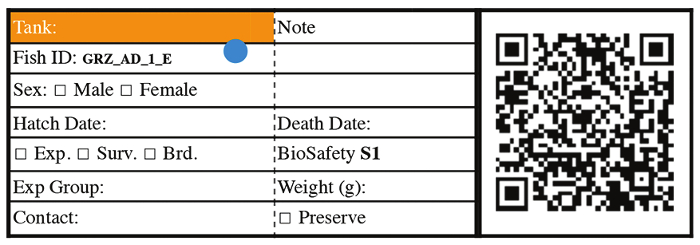
Abbildung 3: Repräsentative Fisch ID-Tag für Fische aus Stufe 3 ab. Bitte klicken Sie hier für eine größere Version dieser Figur.
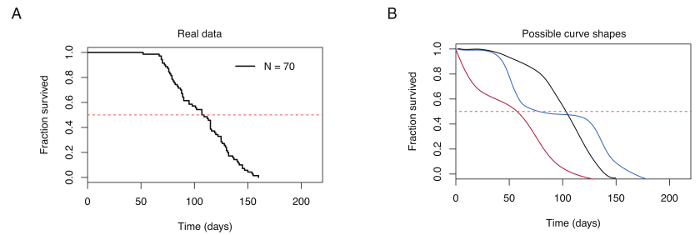
Abbildung 4: Repräsentative überleben Kurve für 70 männlichen Türkis Killifische. (A) typische überleben Kurve für Labor-raiste Türkis Killifische. (B) Vergleich der überleben Kurven gewonnenen Fische unter optimalen Haltungsbedingungen (schwarz) angehoben und schlechte Tierhaltung (rot und blau). Die gestrichelte rote horizontale Linie gibt 50 % überleben, sich überschneidenden überleben Kurve an mittlere Lebensdauer (auf der x-Achse angegeben). Bitte klicken Sie hier für eine größere Version dieser Figur.
| ID | Forward primer | Rückwärts-primer | Größenbereich (bp) | ||
| * NfuSU0007 | GGCTAAGCCTTGCTGACAGA | CAGGGAGCTGAAAACCTCAG | 166 - 214 | ||
| * NfuSU0010 | CGCAGTCTGATCAAATCGTGT | TGTTTGAAGGTTCACATTCATTATC | 220 - 272 | ||
| NfuSU0016 | CATGGCTAAACCGTGATGAA | GAAGGACGCCAGCTATGAAG | 209 - 240 | ||
| NfuSU0022 | AACACAGCTCTCGTAAGGAGGTA | TTCAGACTTGTCTTACTACCATGTTT | 198 - 238 | ||
| NfuSU0027 | TCCAGCTGAATCGGTAATGA | AAACTCGAGGGTGCAATCTG | 164 - 226 | ||
| NfuSU0049 | CTGGACAAAGTGCCAATCAC | CTCCCACAGTCCCAAAACAT | 196 - 197 | ||
| NfuSU0050 | CCAGAATGAACAATACTCAGATCAA | GCAGCTTAGTTTAATGATATCACAATG | 252 - 295 | ||
| NfuSU0060 | CTAGCCACTCCCCTGGTTTA | CCGTCACGATGTGCTGATAC | 216 - 248 | ||
| NfuFLI0030 | CAGAAGCTAAAGGCCAGACG | GGGAAACAATAGGGAACCAC | 174 - 205 | ||
| * NfuFLI0091 | ACGCTGACTCTACCCAGTC | CTGCCTGCTACTGACAATG | 355 - 373 | ||
| * - sex Bestimmung Marker | |||||
Tabelle 1: Genotypisierung Zündkapseln für Stamm-Identifikation.
Diskussion
Wir beschreiben ein Protokoll für das Labor züchten von Türkis Killifische, einschließlich Embryo Sammlung sowie Inkubation und ausgewachsenen Fischen Gehäuse, Zucht und Fütterung. Unser Protokoll richtet sich speziell an Labore, die forschen konzentrierten sich auf Erwachsene Fische, insbesondere für experimentelle Studien über das Altern und Lebensdauer. Türkis Killifische kann auf standard Zebrafisch-Anlage angehoben werden; wichtige Aspekte der Tierhaltung Killifische unterscheiden sich jedoch von standard Zebrafisch Pflege16. Diese Anpassungen umfassen frühen Übergang von Artemia nur Diät zu einer Ernährung mit Protein-reiche Blut Wurm als auch spezifische Schritte im Embryo Inkubation, bestehend aus einer flüssigen und trockenen Inkubation Bühne ergänzt.
Wichtige Schritte im Rahmen des Protokolls beinhalten Versand Embryonen im 8-30 ° C Temperaturbereich. Fruchtbarkeit hängt bei Zucht, Fütterung, Frequenz und Qualität des Essens; Wir empfehlen daher, mindestens zwei Fütterungen pro Tag pro Zucht Tank um Embryonen Ertrag (siehe Abschnitt 5.6) zu erhöhen. Während der Embryo zu bleichen, verlängern Sie Embryo Inkubation im Bleichbad nicht. Dies kann Schäden am Ei Chorion und erhöhte Embryo Sterblichkeit führen. Wenn Embryonen mit Methylenblau Inkubation, nicht verlängern Sie, Inkubation von bereit-zu-Luke Embryonen länger als 2 Wochen, da ihre Überlebensfähigkeit drastisch verringert wird. Für Schraffur Türkis Killifische, niedriger Temperatur von Huminsäure saure Lösung verbessert die Schraffur und vollständiges Eintauchen des Embryos in der Lösung ermöglicht synchronisierten Schlupf. Nicht ausreichende Belüftung während der Inkubation resultiert hohe Raten von Fry nicht in der Lage, die Gas-Blase zu füllen ("Bauch-Schieber" Phänotyp, siehe Hinweise in Abschnitt 5.1).
Einschränkung des Protokolls für die Zucht umfasst den Einsatz von Sand Substrat welche Herausforderungen auf zentrale Filteranlagen und sollte in Zukunft durch alternative Methoden ersetzt werden. Mögliche Alternativen könnte die Verwendung von Zebrafisch Zucht Panzer. Embryo bleichen könnte wichtige physikalisch-chemische Veränderungen in der Ei-Chorion, die veränderten Chorion Physiologie und Schraffur Erfolg führen könnte. Ständiger Exposition von Embryonen zu Methylenblau kann langfristige Veränderungen der Erwachsenen Fische Physiologie induzieren. Erhöhung der Erwachsenen Fische in einzelnen Tanks für Überleben Kohortenstudien könnten Fisch Verhalten und Gesundheit beeinträchtigen. Gruppenhaltung für Überleben Kohortenstudien fügt jedoch erhebliche Störfaktoren durch die Etablierung der sozialen Dominanz und männlicher Gebiete führt zu strengen sozialen Hierarchien. Daher beurteilen wir, dass Isolation von männlichen Fischen für Überleben Studien ein vernünftiger Kompromiss ist. Fütterung Labor Killifische Kolonien mit Lebendfutter aus UN-kontrollierten Quellen fügen Sie ein Risiko für externe Verunreinigungen von Parasiten und potenziell pathogenen mikrobieller Gemeinschaften. In Zukunft sollte eine ad-hoc-sterile Fischfutter entwickelt werden.
Zukünftige Verbesserungen dieses Protokolls konzentriert sich auf eine kontrollierte, nicht-live Diät führt nach wie vor Abschluss der Geschlechtsreife innerhalb von 3-4 Wochen. Zusammenfassend bietet unser Protokoll Zugänglichkeit zum türkisblauen Killifische Labor Kultivierung einer breiten Fachöffentlichkeit.
Offenlegungen
Die Autoren erklären keine finanzielle und nicht finanzielle Interessenkonflikte.
Danksagungen
Wir danken Alessandro Cellerino, Tyrone Genade, Anne Brunet, Sabrina Sharp, Mickie Powell, Simone Keil, Yumi Kim, Patrick Smith, Kai Mathar und allen Mitgliedern des Valenzano Labor am Max-Planck-Institut für Biologie des Alterns für Ihren Beitrag zu verschiedenen Aspekten des derzeitigen Killifische Tierhaltung Protokolls im Laufe der Jahre.
Materialien
| Name | Company | Catalog Number | Comments |
| Probe calibration buffer solution pH=7.0 | Roth | A518.1 | 1L buffer solution pH=7.0 to calibrate water system pH-electrode |
| Probe calibration buffer solution pH=4.0 | Roth | P712.1 | 1L buffer solution pH=4.0 to calibrate water system pH-electrode |
| Conductivity standard | VWR | 83607.260 | 500 mL Conductivity standard 1,413 uS/cm to calibrate water system conductivity-electrode |
| Easy Strips Test 6in1 | JBL | 2533900 | Test strips for determination chlorine values of system water |
| Ammonia Test | JBL | 2536500 | Test to determine ammonia content of system water |
| Red Sea Salt | Red Sea | 22 kg bucket | |
| Sodium hydrogen carbonate | VWR | 27780.360 | |
| Humic acid | Sigma- Aldrich | 53680-50G | |
| New HUFA Artemia enrichment | ZM Systems UK | 75g bottle | |
| Methylene blue | Roth | AE64.1 | |
| Hydrogen peroxide solution | Sigma- Aldrich | 31642-1L | 30% (w/w) |
| Coconut fiber | Dragon | ZCS010 | |
| Whatman paper | GE healthcare | 3030-690 | |
| Ethanol pure | VWR | 20821.467 | 100% |
| Silica sand | local pet shop | ||
| Artemia Eggs Premium Grade | Sanders | ||
| Bloodworm | local distributor | Poseidon Aquakultur Germany | |
| dNTPs solution mix | Biolabs | N04472 | 10mM |
| Taq DNA polymerase | Invitrogen | 18038-042 | 5U/uL |
| PCR 10x Buffer | Invitrogen | 18038-042 | |
| MgCl2 | Invitrogen | 18038-042 | 50mM |
| NaOH | Sigma- Aldrich | S8045-500g | 50mM |
| Tris-HCl, pH=8.0 solution | Sigma- Aldrich | T2694-1L | 1M |
| HCl 37% | Sigma- Aldrich | H1758-500mL | |
| Fish tanks | Aquaneering | volume: 0.8L, 2.8L, 9.5L; equipped with baffles, fry mesh and lids | |
| Orbital shaker | VWR | 89032-100 | model 5000 |
| Microbiological incubator | Thermo Scientific, Heratherm | 50125882 | model IMC18; for storage embryos in the liquid phase, set to t=27-28°C |
| Cooling Incubator | Binder | 9020-0209 | model KT115; for storage embryos in the solid phase, set to t=27-28°C |
| Hatching incubator | Thermo Scientific, Heratherm | 51028114 | model OGS180; for embryos hatching, set to t=27-28°C |
| Stereomicroscope | Leica | model M80 | |
| Breeding sand/hatching boxes | Roth | 1598.1 | 1000mL |
| Petri dish | Sarstedt | 82.1473 | 92x16mm |
| 50 mL Conical tube | Sarstedt | 62.547.254 | |
| 15 mL Conical tube | Sarstedt | 62.554.002 | |
| Disposable Plastic Pasteur pipette | Roth | EA71.1 | 2mL; For fish feeding with bloodworms, or embryos selection cut off the tip to open 3-4mm diameter |
| Serological pipette | Sarstedt | 86.1689.001 | 50mL |
| Syringe | Henke Sass Wolf | 4100-000V0 | 10mL |
| Metal strainer | fineness <1mm; for embryos collection | ||
| Tweezers | Dumont | 0508-5/45-PO | type5/45; for embryos transfer |
| 25 L Brine shrimp hatcher | Aquaneering | ZHBS25 | main hatcher |
| 500 mL Brine shrimp hatcher | JBL | 6106100 | model Artemio 1; backup hatcher |
| Narrow-mesh fish nets | JBL | ||
| Sand beaker | VWR | BURK7102-5000 | 5000mL |
| Brine shrimp separation beaker | VWR | BURK7102-2000 | 2000mL |
| Plastic zipper bag | Roth | P279.2 | for dead fish storage |
| Pipetboy | Integra | 155000 | model Pipetboy acu2 |
| Parafilm | P-Lab | P701605 | |
| Air tubing | www.zajac.de | AQ380 | 4-6 mm diameter |
| 1 L Glass bottle | VWR | 215-1595 | |
| 2 L Glass bottle | VWR | 215-1596 | |
| 500 mL Squeeze bottle | Roth | K665.1 | for fish feeding with brine shrimp |
| 120-μm brine shrimp strainer | Florida Aqua Farms | BB-PC2 | for brine shrimp/bloodworm collection |
| Finish filter socks | Aquaneering | MFVB025C | 25-μm |
| Central filtration fish housing system | Aquaneering, Techniplast, Aquatic Habitats, Aqua Schwarz |
Referenzen
- Valenzano, D. R., Aboobaker, A., Seluanov, A., Gorbunova, V. Non-canonical aging model systems and why we need them. EMBO J. 36 (8), 959-963 (2017).
- Harel, I., Brunet, A. The African Turquoise Killifish: A Model for Exploring Vertebrate Aging and Diseases in the Fast Lane. Cold Spring Harb Symp Quant Biol. 80, 275-279 (2015).
- Smith, P., et al. Regulation of life span by the gut microbiota in the short-lived African turquoise killifish. Elife. 6, (2017).
- Cellerino, A., Valenzano, D. R., Reichard, M. From the bush to the bench: the annual Nothobranchius fishes as a new model system in biology. Biol Rev Camb Philos Soc. 91 (2), 511-533 (2016).
- Kim, Y., Nam, H. G., Valenzano, D. R. The short-lived African turquoise killifish: an emerging experimental model for ageing. Dis Model Mech. 9 (2), 115-129 (2016).
- Blazek, R., et al. Repeated intraspecific divergence in life span and aging of African annual fishes along an aridity gradient. Evolution. 71 (2), 386-402 (2017).
- Terzibasi, E., et al. Large differences in aging phenotype between strains of the short-lived annual fish Nothobranchius furzeri. PLoS One. 3 (12), e3866 (2008).
- Kirschner, J., et al. Mapping of quantitative trait loci controlling lifespan in the short-lived fish Nothobranchius furzeri--a new vertebrate model for age research. Aging Cell. 11 (2), 252-261 (2012).
- Valenzano, D. R., et al. Mapping loci associated with tail color and sex determination in the short-lived fish Nothobranchius furzeri. Genetics. 183 (4), 1385-1395 (2009).
- Reichwald, K., et al. Insights into Sex Chromosome Evolution and Aging from the Genome of a Short-Lived Fish. Cell. 163 (6), 1527-1538 (2015).
- Valenzano, D. R., et al. The African Turquoise Killifish Genome Provides Insights into Evolution and Genetic Architecture of Lifespan. Cell. 163 (6), 1539-1554 (2015).
- Harel, I., et al. A platform for rapid exploration of aging and diseases in a naturally short-lived vertebrate. Cell. 160 (5), 1013-1026 (2015).
- Valenzano, D. R., Sharp, S., Brunet, A. Transposon-Mediated Transgenesis in the Short-Lived African Killifish Nothobranchius furzeri, a Vertebrate Model for Aging. G3. 1 (7), 531-538 (2011).
- Harel, I., Valenzano, D. R., Brunet, A. Efficient genome engineering approaches for the short-lived African turquoise killifish. Nat Protoc. 11 (10), 2010-2028 (2016).
- Polacik, M., Blazek, R., Reichard, M. Laboratory breeding of the short-lived annual killifish Nothobranchius furzeri. Nat Protoc. 11 (8), 1396-1413 (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten