このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
受容体リガンドの相互作用の解離定数の決定法として elisa 法の滴定
要約
Elisa 法の滴定を実行する詳細なプロトコルを説明します。また、滴定 Elisa を評価し、マイクロタイター プレート固定受容体に水溶性リガンドの結合の解離定数を取得する新たなアルゴリズムが表示されます。
要約
解離定数は結合平衡の 2 つのパートナー間の相互作用について説明し、彼らの親和性の尺度です。異なる配位子、例えば、競争の抑制剤、タンパク質アイソ フォームと結合パートナーに結合強さのための突然変異体を比較する重要なパラメーターです。解離定数は結合曲線として連結対無料リガンドの濃度をプロットすることによって決定されます。対照的に、滴定曲線、バインドされたリガンドの濃度に比例した信号が追加された配位子の全濃度に対してプロットされますが記録するはるかに簡単。分光学的および酵素結合抗体法 (ELISA) による、信号を検出できます。Α2β1 インテグリンの固定ターゲット ドメインに蛇毒由来 rhodocetin 結合を測定する ELISA の滴定のためのプロトコルその最たるものが。滴定 Elisa は汎用性の高い、広く使用されています。両蛋白質が純粋で、その濃度が知られているである、水溶性リガンド固定化の受容体と相互作用の蛋白質の任意のペアを使用できます。難易度はこれまでのところ滴定曲線からの解離定数を決定してきました。本研究では、滴定曲線の基礎となる数学的な関数を導入する.彩度収量の任意のエラーが発生しやすいグラフィカルな見積もり、なしは、このアルゴリズムは、非線型回帰による数学的評価によって直接 raw データ (追加されたリガンド濃度の異なるで信号強度) の処理をできます。したがって、いくつかの滴定曲線を同時に記録し、解離定数と結合活性受容体濃度の特性パラメーターのセットに変換することができ、統計学的に評価できます。このアルゴリズムと組み合わせた場合、滴定 Elisa は解離定数を直接提示の利点を得る。したがって、将来的により効率的に使用可能性があります。
概要
解離定数 K は、その配位子 (L) (R) 受容体の親和性を記述する重要なパラメーターです。質量作用の法則に基づき、K は、受容体 R と配位子 l: 受容体リガンドの複雑な RL が切り離されます、平衡状態の定義は
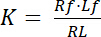 式 1
式 1
受容体とリガンドの無料非連結状態を示す指数のf 。RL、受容体-リガンド複合体の濃度は、受容体に結合リガンド Lbの濃度と同じです。受容体 Rtの濃度は無料受容体 Rfとリガンド受容体 Rbの合計 = Lb、解離定数として書き込むこともできます。
 方程式 2
方程式 2
したがって、彩度をもたらす Y、バインドされた配位子 Lb受容体 Rtの濃度の関係の一部として定義されています。
 式 3
式 3
無料配位子 Lfの濃度に依存します。
 方程式 4
方程式 4
この双曲線関係受容体-リガンド相互作用の結合曲線をについて説明し、そのプロットは、無料配位子 Lfの濃度の関数としてバインドされた配位子 Lbの濃度を示しています。結合曲線から半最大彩度降伏無料リガンドの濃度として解離定数 K を派生できます。さらに、クロッツ1、2、または成人 t 細胞またはヘインズ (Bisswanger3によって再検討されました) に従って変換によって二重逆数プロットなど、バインディング カーブをリニア化するさまざまなアルゴリズムが確立されています。ただし、すべてのアルゴリズムは漸近無料リガンド結合曲線の高濃度に近づくと、彩度収量の最大値がグラフィカルな事前評価の推定すべきありしたがっては問題に苦しむエラーを起こしやすい。
さらに、結合曲線の測定無料とバインドされたリガンドの結合平衡時の定量化が必要です。この目的のために無料のリガンドが受容体に結合リガンドから分離し定量化します。したがって、リガンドと受容体タンパク質の受容体ではなく非蛋白質リガンドなどのプロパティで違う必要があります。両方の結合パートナーはタンパク質である場合彼らはそのサイズ、料金、またはその他の分子の機能の区別する必要があります。それにもかかわらず、小規模のバインディング方法をリガンド濃度の定量化は困難な作業です。放射性標識リガンドのよくされているバインドされたリガンドの濃度を検出する必要受容体の大量された利用可能なまたは手頃な場合は特に。さらに、受容体に結合リガンドが無視できない方法で分離後を切り離して考えます。したがって、平衡ゲルろ過4、キャピラリー電気泳動5、およびパルス分解6などの複雑な方法は受容体に結合リガンドを定量化し、無料配位子と区別する必要があります。
これらの結合の試金と対照をなして、滴定実験では連結および無料配位子の定量分離の操作は不要です。このため、追加されたリガンドの濃度の異なる一定濃度で受容体を滴定します。受容体に結合することにより連結配位子無料配位子からそれを区別する、例えば測光、蛍光分析、または抗体の検出で測定可能な生物物理プロパティがあります。したがって、信号彩度に比例する S Y を得、その結果も受容体に結合リガンド (Lb) 濃度が検出された追加配位子 (Lt) の濃度の関数として。両方のパラメーター、S 信号および追加の配位子の全濃度はバインドされ、無料のリガンドの濃度より直接かつ簡単に定量化しました。特に、酵素免疫測定法 (ELISA) 受容体に結合リガンドの検出はウェル マイクロ プレートで 100 μ L 以下にサンプル ボリュームの削減だけでなく、いくつかのリガンド濃度の並列測定を許可しました。Elisa 法、滴定の受容体は物理的に同じ濃度でマイクロ プレートに吸着、水溶性リガンドで滴定します。受容体は、疎水性吸着によって本質的にプラスチック表面に固定化します。Langmuir´s 吸着等温線7によると可能性が高い非線形関係における受容体のコーティング濃度固定受容体相関の表面濃度。吸着受容体分子の総数に加え、アクティビティの状態は滴定試金のための別の重要なパラメーターです。受容体リガンド結合活性を保持している、滴定試金に関連して、最終的に滴定試金は、直接決定することができないアクティブな受容体 Rt濃度に貢献を固定しただけ。
プラスチックの表面に固定化の受容体によってカバーされていないサイトは、リガンドなどの他の蛋白質を吸着する傾向があります。このようなプラスチック表面サイト リガンドの物理吸着はまだ非特異的な受容体に結合リガンドとして同じような信号になります。この非特異的な信号は、タンパク質でコーティングされていないまだウシ血清アルブミン (BSA) でブロックされるマイクロタイター プレートのプラスチック表面サイトを減らす。ただし、いくつかの受容体リガンド滴定試金のため非特異的なバック グラウンド信号を観察することがあります。その後、他のブロッキング剤 0.04%、0.2% のゼラチンの溶液などをトゥイーン 20、お勧めします。
受容体に結合後無料配位子は 2 つの洗濯手順によって削除されます。バインドされたリガンドの受容体がマイクロだけでなく、プラスチックの表面に固定化され必要に応じて化学固定法による鉄筋のままです。その後共有結合架橋結合リガンドとグルタルアルデヒドで固定化受容体のバッファー物質トリス、リガンド結合の変更なし、HEPES に置き換えられます。トリスと対照をなして、HEPES は、グルタルアルデヒドを不活化していません。グルタルアルデヒドで共有結合性の架橋受容体結合リガンドを修正し、以降の洗濯とインキュベーションの手順中に解離度を防ぎます。したがって、受容体-リガンド相互作用が化学的に固定、洗濯とインキュベーションの以降の手順で影響を受けるである滴定曲線を保証します。ただし、リガンドと受容体の相互作用が減少、廃止またはそのような方法で、グルタールアルデヒド固定化学的に変更可能性があります。また、モノクローナル抗体を使用してバインドされたリガンドを定量化する場合に特に、配位子内エピトープの変更は検出抗体の結合親和性を変更可能性があります。この滴定 ELISA のグルタルアルデヒド固定のこれらの副作用のいずれも発生しますが、グルタルアルデヒドに向けてテストの感度は滴定の実験の前にすべての受容体-リガンド相互作用のテストをする必要があります。固定後、余分なグルタルアルデヒドはトリスを含むバッファーと 3 つの洗浄のステップで削除されます。トリスは、後続の手順で抗体を検出と特異的反応かもしれない残りのアルデヒド グループを不活性化します。
フォト メトリック ELISA 信号 s. を提供する酵素抗体結合リガンドの量を定量化します。これは合計リガンド濃度 Lt追加対サ各ウェルに。簡単に買収にもかかわらず、滴定曲線は双曲線関数結合曲線とは対照的ではないです。さらに、それがはっきりしなかった滴定曲線からの解離定数 K を計算する方法。分光学的買収した滴定曲線をリニア化するアルゴリズムが独立して報告されていない Stockell8と Heyn および Weischet9によって、彼らは最大の信号を推定の不確実性のために短く落ちた値、追加配位子の高濃度で飽和量に近づきます。
ここでは、ELISA の滴定および非線形回帰アルゴリズム受容体リガンド相互作用滴定曲線からの解離定数 K を派生させるように記載されています。このプロトコルは、コラーゲン結合 A ドメイン インテグリン α2β1 蛇毒由来阻害剤との相互作用の例示です。インテグリンは細胞接着分子は、細胞周辺の細胞外マトリックスまたは基盤となる基底膜10,11へのアンカレッジを仲介します。また、インテグリンは募集追加シグナル分子と新しい細胞小器官、細胞マトリックスの相互作用12,13、に、adhesomes を形成して細胞と細胞外マトリックスの重要な信号を伝える14. コラーゲン、α2β1 インテグリンのリガンドは人体の最も豊富な蛋白質、結合組織15の重要な足場コンポーネントです。Α2β1 インテグリンとコラーゲンの相互作用は、インテグリン α 2 サブユニットの A ドメインによって仲介される.インテグリン α2A ドメインには、コラーゲンのバインディングが必要ですし、その構造を安定化させる二価の陽イオンが含まれています。野生型のフォームと同様のものなど、グリシンが表面に露出した残渣 Y216 取り替えたされて α2A ドメインの変異体簡単に細菌の表現システムで recombinantly 生産でき、オリゴ-彼-タグを介して、NiNTA と分離トリス緩衝食塩水 (TBS; 50 mM トリス/塩酸で pH 7.4 では、150 mM の NaCl) 含む 2 mM MgCl216に対してその後透析スーパーフロウ ・列。ビシンコニン酸アッセイ (BCA) とその濃度を測定した、その純度を従来 SDS-PAGE によってテストし r250 という Coomassie ブリリアント ブルーで染色します。
Α2β1 インテグリンとコラーゲンの相互作用は、マレーマムシ (Calloselasma rhodostoma)16,17rhodocetin 蛇毒成分の結合によってブロックされます。この滴定 ELISA の水溶性リガンドとして使用すると、rhodocetin は、原油から精製された毒16を前述のよう。(HBS; 10 mM HEPES/水酸化ナトリウム、pH 7.4 では、150 mM の NaCl) HEPES バッファーの生理食塩水に溶解し、-20 ° C で凍結保存はその濃度は BCA によって決定され、その純度は、SDS-PAGE によって証明されました。として、rhodocetin だけでなくコラーゲン、インテグリンにバインドをブロック α2β1 A-ドメイン、細胞や血小板の18にコラーゲンから任意の信号を防ぐインテグリンの使用頻度の低い構造を安定化に対しても。その受容体ターゲットと rhodocetin の解離定数を決定し、こうしてその分子機構と製薬潜在的な例、抗血栓剤としてを解明する生物医学重視のです。このために、ELISA はその評価を含めて説明されている滴定 1:1 の相互作用の化学量論とほぼすべての受容体-リガンド相互作用に適用されます。
プロトコル
1. 原液
- 10 x TBS 100 mL pH 7.4 ソリューションを準備、6.06 g のトリスと 90 mL の脱イオン水に NaCl の 8.77 g を溶解、37% 塩酸溶液と 7.4 に pH 調整、脱イオン水 100 mL にボリュームを埋める、フィルター ソリューション。
- 1 の 100 mL を準備するには、M HEPES/水酸化ナトリウム、pH 7.4 ソリューションは 90 mL の脱イオン水に HEPES の 23.83 g を溶解、7.4 1.5 M NaOH で pH を調整、脱イオン水 100 mL にボリュームを埋めるし、フィルター ソリューション。
- 準備として 5 M 塩化ナトリウム溶液 100 mL、90 mL の脱イオン水に NaCl の 29.2 g を溶解します。脱イオン水 100 mL にボリュームを埋めるし、ソリューションをフィルターします。
- 1 M MgCl2溶液 100 mL を準備するには、溶解 MgCl2 · 20.33 g6 H2O 90 mL の脱イオン水に。脱イオン水 100 mL にボリュームを埋めるし、ソリューションをフィルターします。
- 水で 5% 熱不活化 BSA を準備、50 mL のチューブで BSA (分数 V, pH 7.0) の 2.5 g の重量を量るし、45 mL の脱イオン水に溶かします。脱イオン水 50 mL にソリューションを埋めるし、45 分の氷浴で冷却し、-20 ° C で保存 68 ° c の水浴のソリューションを加熱
- 25% グルタールアルデヒド水溶液を準備します。
注意: グルタルアルデヒド飲み込んだ場合吸入すると有毒有害な、火傷します。手袋、防護服を着用し、保護眼鏡/保護面。 - 上記の19としてウサギ抗血清を上げます。抗体の力価は、標準プロトコル20によると決定しました。
- アルカリホスファターゼ標識ヤギからウサギ抗免疫グロブリン抗体を準備します。
- 0.1 M グリシン溶液 100 mL を準備するには、90 mL の脱イオン水にグリシンの 0.75 g を溶解します。10.4 1.5 M NaOH 溶液を pH 調整、脱イオン水 100 mL にボリュームを埋めるし、ソリューションをフィルターします。
- 0.5 M 亜鉛 (II) の 100 mL を準備する-酢酸溶液 10.98 g 亜鉛 (II) の溶解-酢酸 ·2 H2O 90 mL の脱イオン水に。脱イオン水 100 mL にボリュームを埋めるし、ソリューションをフィルターします。
- 1.5 M NaOH 溶液 100 mL を準備するには、90 mL の脱イオン水に水酸化ナトリウムの 6.0 g を溶かします。脱イオン水 100 mL にボリュームを埋めるし、ソリューションをフィルターします。
2. バッファーを準備してソリューション
- 5 mL 10 x TBS pH 7.4、45 mL の脱イオン水を希釈し、1 M MgCl2ストック溶液 100 μ L を追加します。部屋の温度でそれを維持します。TBS、pH 7.4 では、2 mM MgCl2ソリューションは、受容体とマイクロタイター プレートを洗浄の固定化です。
- 水の熱不活化 BSA の 5% と 10 x TBS 5 mL、50 mL の脱イオン水 pH 7.4 の 10 mL を希釈します。1 M MgCl2ストック溶液 100 μ L を追加し、ソリューションをよく混ぜます。氷の上にそれを維持し、-20 ° C でさらに実験のために保存注 1 %bsa を TBS、pH 7.4 では、2 mM MgCl2でその 2.5 mL 各滴定曲線に必要です。
- 1 の 2.5 mL を希釈 M HEPES/水酸化ナトリウム、pH 7.4 と 1.5 mL 5 M NaCl 水溶液 50 mL を脱イオン水に 100 μ L 1 M MgCl2ソリューションを追加し、徹底的に HBS、pH 7.4: 50 mM HEPES/水酸化ナトリウムの 50 mL を準備するソリューションをミックス、150 mM の NaCl。
- 1 M MgCl2ストック溶液 5 μ L と 2 μ L 0.5 M 追加 Zn (II)-酢酸原液 5 mL 0.1 M グリシン溶液、pH 10.4 アルカリフォスファターゼ (AP) バッファー (pH 10.4, 1 mM MgCl2、0.2 mM Zn(II)-acetate) 0.1 M グリシン溶液等を準備する
3. 受容体 (インテグリン α2A ドメイン) のマイクロタイター プレートの固定
- Tbs、pH 7.4、最終濃度 5 μ G/ml の 2 mM MgCl2インテグリン α2A ドメインの原液を希釈します。
注: コーティング溶液の量は半分の領域マイクロタイター プレートの 12 も行で構成される 1 つの滴定曲線の 650 μ L です。 - インテグリン α2A ドメイン (野生型または変異体) の 5 μ g/mL コーティング溶液 50 μ L/ウェルで半分エリア マイクロタイター プレート上の行のすべての井戸を埋めます。少なくとも重複で滴定のすべての行を実行 (この例四つ子; として図 1にマイクロ プレートのレイアウトを参照してください)。
- 箔でプレートをシールまたはふたを閉じます。4 ° C でプレートを一晩おきます。
4. 洗浄コーティング井戸 tbs、pH 7.4 では、2 mM MgCl2 2 回プレートの
- 可溶性レセプターを削除するには、TBS、pH 7.4 では、2 mM の 50 μ L で、MgCl2がよくない物理吸着でプラスチック表面に固定されている、コーティング ソリューションを削除し、塗りつぶしは各分子。
- 洗浄ソリューションを削除します。井戸は、乾燥にならないかを確認します。したがって、残留液を削除する組織布の上にマイクロ プレートをタップしないように。すぐに、井戸を埋めるため多段ピペットやマルチ チャンネル ピペットを使用します。
- この洗浄工程をもう一度繰り返します。
5. 非特異的結合部位をブロックします。
- Tbs、pH 7.4 では、各ウェルに 2 mM MgCl2 1 %bsa 溶液 50 μ L を追加します。
- 箔と井戸を再シールかふたを閉じます。
- 井戸室温で 1 時間インキュベートします。
注: このプロトコルのインキュベーションの手順のいずれかは、ロッキングまたは振動プラットフォームで実行できます。しかし、これは必須ではありません、実験の結果は変わりません。
6. 配位子、Rhodocetin のシリアル希釈行の準備
- Rhodocetin の開始濃度およびシリアルの希薄をリガンド濃度の適切な範囲を取得して、最小値と最大信号による滴定曲線を記録するための希釈倍率が異なります。この実験では 243 nM rhodocetin の開始濃度と希釈倍率 2.3 を採用してください。シリアル希釈行の高いリガンド濃度 rhodocetin 原液を希釈します。2.3 の希釈係数と各滴定曲線の準備 1 %243 nM (すなわち、15,2 μ g/mL) rhodocetin ソリューションの 115 μ L BSA/TBS、pH 7.4 では、2 mM MgCl2試験管 #1。
- TBS、pH 7.4 では、2 mM MgCl2 #2 #11 を介して 10 の試験管内で 1 %bsa 溶液 65 μ L をご記入ください。
- テスト チューブ #1 から rhodocetin 希釈の 50 μ L を転送テスト チューブ #2、ミックス両方のソリューション (容量: 115 μ L; 希釈倍率: 1:2. 3) 製粉、そしてテスト チューブ #3 等にこの混合物から転送 50 μ L に
- テスト チューブ #11 までこのシリアル希釈を続けます。
注: 手順 6.1 6.4 は、ボリューム 1 つの滴定曲線に対して十分です。これらのボリュームを複製の数に掛けます。この場合、8 つの滴定曲線 (2 つの α2A ドメイン形式の四つ子) を実行、次のボリュームの準備: テスト チューブ #1; の最高濃度で rhodocetin ソリューションの 920 μ LTBS、pH 7.4 では、2 mM MgCl2各試験管に #2 #11; を埋めるために 1 %bsa の 520 μ L次のいずれか 1 つの管から転送量の 400 μ L。
7. 結合リガンド (Rhodocetin) に異なる濃度の固定受容器 (インテグリン α2A ドメイン)
- 真空ライン マイクロタイター プレート井戸からブロック ・ ソリューションを取り外します。
- すぐに 1 %rhodocetin 溶液 50 μ L を追加 BSA/TBS、列 1、列 2、TBS、pH 7.4 で 1 %bsa を追加 50 μ l を添加等の井戸をテスト チューブ #2 のソリューションの井戸に試験管 #1 の pH 7.4/MgCl2ソリューション、2 mM MgCl2 (ブロックと希釈バッファー) 配位子無料コントロールとして列 12 (マイクロタイター プレート、図 1のレイアウトを参照してください) の井戸へ。
- 箔と井戸を再シールかふたを閉じます。
- 室温 (約 20-22 ° C) で 1.5 h の井戸を孵化させなさい。
8. 洗浄井戸のプレート 2 回 HBS、pH 7.4 では、2 mM MgCl2と
- 非バインド リガンド分子を削除するには、バインドのソリューションを削除し、塗りつぶしは各 pH 7.4 では、2 mM MgCl2HBS の 50 μ L でも。洗浄液を取り出します。
- 井戸は乾燥にならないように注意してください。したがって、残留液を削除する組織布の上にマイクロ プレートをタップしないように。すぐに、井戸を埋めるため多段ピペットやマルチ チャンネル ピペットを使用します。
- この洗浄工程をもう一度繰り返します。
9. 2.5% 受容体に結合リガンドを固定 HBS、pH 7.4 では、2 mM MgCl2におけるグルタールアルデヒド
- 25% グルタルアルデヒド溶液の 1 部分、HBS、pH 7.4 では、2 mM MgCl2の 9 の部分を混合することによって新鮮な 2.5% グルタルアルデヒド溶液を準備します。
- HBS、pH 7.4 では、2 mM MgCl2で 2.5% グルタルアルデヒド溶液 50 μ L をマイクロタイター プレートの各ウェルを入力します。マイクロタイター プレート室温で 10 分間、インキュベートします。
10 TBS、pH 7.4 では、2 mM MgCl2の 50 μ L/ウェル プレートの 3 倍のは洗浄井戸
- 削除し、過剰なグルタルアルデヒドを不活性化、固定の解決を削除し、それぞれを記入 TBS、pH 7.4 では、2 mM MgCl2の 50 μ L でも。洗浄ソリューションを削除します。
注: マイクロタイター プレートから固定のグルタルアルデヒドを含む解決を皿に注ぎ、それは TBS、pH 7.4 の等量によって不活化されている後固定液を捨てください。 - 井戸は乾燥にならないように注意してください。したがって、残留液を削除する組織布の上にマイクロ プレートをタップしないように。すぐに、井戸を埋めるため多段ピペットやマルチ チャンネル ピペットを使用します。
- この洗浄工程を 2 回繰り返します。
11. elisa 法による受容体に結合を配位子の定量
- Tbs、pH 7.4 では、2 mM MgCl21 %bsa の一次抗体溶液 50 μ L/ウェルを追加します。一次抗体はウサギ抗血清 rhodocetin19に対して提起、tbs、pH 7.4 では、2 mM MgCl21 %bsa で 1:2,000 を希釈します。
- 常温で 75-90 分のプレートを孵化させなさい。3 回と TBS、pH 7.4 では、2 mM MgCl2の 50 μ L/ウェル プレートのすべての井戸を洗浄します。洗浄手順、ティッシュにマイクロタイター プレートのタップ 3 中布は必要ではありません。
- Tbs、pH 7.4 では、2 mM MgCl21 %bsa の二次抗体溶液 50 μ L/ウェルを追加します。このためには、二次抗体、アルカリホスファターゼ、tbs、pH 7.4 では、2 mM MgCl21 %bsa で 1:2,000 すると共役ウサギ免疫グロブリン ターゲット ヤギ抗体を希釈します。常温で 75-90 分のプレートを孵化させなさい。
- 4-ニトロフェニル リン酸二ナトリウム水和物 (アルカリホスファターゼ基質) AP バッファー (pH 10.4、MgCl2 1 mM と 0.2 mM Zn(II)-acetate) を含む 0.1 M グリシン溶液等の 5 mL を含む 5 mg 錠剤を溶解することにより AP 検出ソリューションを準備します。
- 3 回で pH 7.4 では、次の手順を実行する前にすぐに 2 mM MgCl2TBS の 50 μ L/ウェル プレートのすべての井戸を洗浄します。液体のすべてのトレースを削除する最後の洗浄工程後組織布の上にマイクロ プレートをタップします。
- マイクロ プレートのウェルに AP 検出溶液 50 μ L/ウェルを追加します。可能な限り同時に酵素の変換を開始するすべての井戸に速やかに AP 検出ソリューションを追加します。したがって、マルチ チャンネル ピペットを使用します。
- リガンドの濃度と井戸のソリューションが黄色に変わるまでは、室温でプレートを孵化させなさい。
注: 信号強度に応じて 1 h と 5 分間インキュベーション時間が異なる場合があります。 - 1.5 M 水酸化ナトリウム溶液 50 μ L/ウェルを追加することによって脱燐酸化酵素の基質の変換を停止します。両方のソリューションの混合力のないことを確認する数分間板立っているままにします。すべての井戸で同じ潜伏期間を保証するには、マルチ チャンネル ピペットを使用し、ステップ 11.8 で AP 検出基板の井戸に追加する順序と同じ順序で 1.5 M NaOH を追加します。
- 405 で光学濃度 (OD) を測定 ELISA リーダーによって各ウェルの nm。
12 滴定信号の評価
- Excel で、OD405 nm値の生データのテーブルを開きます。滴定曲線のこれらの信号の値が行の読んで、列と別の列に追加されたリガンドの濃度のラベルに値を置換します。
- グラフパッド プリズム 5 (バージョン 5.0) を開きます。メイン メニューで、新しいプロジェクト ファイルを開きます。[新しいデータとグラフのXYフォーマットを選択します。Y 軸のオプション入力と値ごとに単一の点のプロットを選択します。
- 2 つの列は、追加されたリガンドの濃度をコピーし、値 (OD405 nm ) excel からファイルとしてグラフパッド プリズムのデータシートに貼り付けること信号 X と Y 値は、それぞれ。
- グラフパッド プリズム 5解析サブ プログラムを開き、[ XY 解析非線形回帰のオプションを選択します。ユーザー定義の式を選択し、新しい方程式を作成する新規作成] ボタンを押します。
- フォームの滴定曲線の数式を入力: Y =(Smax-Smin)*((X+R+K)-sqrt((X+R+K)^2-4*R*X))/(2*R) Smin + B * X は新しくオープンしたテンプレート シートに追加の配位子 L の濃度 X S、シグナル値をされている Y、R の濃度をされている固定受容体、解離定数をされている K と B の背景の中斜面します。K など、適切な制約を定義する > 0、R > 0。
注: この式は、別の形の方程式 9の同じ方程式です。 - 新しく作成されたユーザー定義の式を選択することで、データ ・ シートの値を分析します。近似計算値のテーブルを開く (K、Rt、SmaxS分と B) これはソフトウェア画面の左側にある [結果のセクション下に表示されます。
注: ソフトウェアは、滴定曲線は、少なくとも 5 つのデータ ポイントで構成されて 場合にのみ、非線型回帰分析の反復的なあてはめによる 5 のパラメーターを決定します。 - パラメーター K、Rt、SmaxS分と滴定曲線のすべてのグループの B は、統計的に評価し、グループ (変異や化学修飾したリガンド受容体) の特定の機能とパラメーターを関連付けます。
結果
ELISA の後、開発されている変換アルカリホスファターゼ基質、パラnitrophenolate の黄色の色から追加された rhodocetin の濃度の低下とともに連結 rhodocetin 配位子の量を減少させることを示す列 1 に 11 (図 1)。コラムで 12 rhodocetin 無料井戸で無色の井戸は、低バック グラウンド信号を示します。
405 ?...
ディスカッション
Elisa 法の滴定は、受容体-リガンド相互作用の解離を決定する多彩なテスト システムです。滴定として ELISA を回避必要無料とバインドされている配位子を効果的に分離してその濃度を定量的に大幅により多くの研究および出版物は結合曲線を記録代わりに滴定 Elisa を採用しています。.また、滴定 Elisa 実行し、易い受容体とリガンドの合理的に低い量を必要とします。解離定数の正確な分析?...
開示事項
著者は、何を開示します。
謝辞
プロトコルとアルゴリズムは、ドイツ研究振興協会 (DFG グラント SFB1009 A09 と EB177/13-1) によって融資プロジェクト内で開発されました。著者は、バーバラ Schedding とテクニカル サポートのフェリックス ・ Schmalbein 博士ナイランド批判的に原稿を読み取るためのおかげでください。
資料
| Name | Company | Catalog Number | Comments |
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
参考文献
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection--a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved