JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
적정 수용 체 Ligand 상호 작용의 분리 상수를 결정 하는 방법으로 ELISA
요약
자세한 프로토콜 ELISA 적정 수행을 설명 합니다. 또한, 새로운 알고리즘 적정 ELISAs를 평가 하 고 결정 플레이트 움직일 수용 체 성 ligand의 바인딩의 분리 상수를 제공 됩니다.
초록
분리 상수 바인딩 평형에 두 업체 간의 상호 작용을 설명 하 고 그들의 선호도의 측정 이다. 그것을 비교할 다른 ligands, 예를 들면, 경쟁 저 해제, 단백질 isoforms 및 돌연변이, 바인딩 파트너에 게 그들의 바인딩 강도 대 한 중요 한 매개 변수입니다. 분리 상수 플로팅 바인딩 곡선으로 바인딩된 대 무료 ligand의 농도 의해 결정 됩니다. 반면, 적정 곡선, 바인딩된 ligand의 농도에 비례 하는 신호 추가 ligand의 총 농도 대 한 플롯은 훨씬 쉽게 기록할 수 있습니다. 시선 및 효소 연결 된 immunosorbent 분석 결과 (ELISA)에 의해 신호를 감지할 수 있습니다. 이것은 뱀 독에서 파생 된 rhodocetin α2β1 integrin의 고정된 대상 도메인에 바인딩을 측정 ELISA 적정에 대 한 프로토콜에서 궁 행. 적정 ELISAs 다목적 널리 사용 됩니다. 두 단백질은, 순수 하 고 그들의 농도 알려진 고정된 수용 체와 녹는 ligand 상호 작용 단백질의 어떤 쌍 든 지를 사용할 수 있습니다. 지금까지 어려움은 적정 곡선에서 분리 상수 결정 되었습니다. 이 연구에서는 적정 곡선을 기본 수학 함수 소개 된다. 채도 수확량의 어떤 오류가 그래픽 평가 없이이 알고리즘 아닌-선형 회귀를 통해 수학 평가 의해 직접 원시 데이터 (추가 ligand의 다른 농도에서 농도 신호)의 처리를 허용 한다. 따라서, 여러 적정 곡선을 동시에 기록 하 고 분리 상수 및 바인딩-활성화 수용 체의 농도 그들의 사이에서 특성 매개 변수 집합으로 변형 수 그리고 그들은 통계적으로 평가 될 수 있다. 이 알고리즘와 결합 하면, 적정 ELISAs 분리 상수를 직접 제시의 이점을 얻을. 따라서, 그들은 미래에 보다 효율적으로 사용할 수 있습니다.
서문
분리 상수 K는 그것의 ligand (L)에 대 한 수용 체 (R)의 선호도 설명 하는 핵심 매개 변수입니다. 대량 작업의 법칙에 따라, K는 수용 체 ligand 복잡 한 RL R 수용 체와 리간드 l: 분리 평형에 대 한 정의
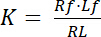 공식 1
공식 1
수용 체와 ligand의 무료/언바운드 상태를 나타내는는 인덱스 f 와. RL, 수용 체 ligand 복합물의 농도 수용 체 바인딩 ligand Lb의 농도. 수용 체 Rt 의 총 농도 무료 수용 체 Rf 와 수용 체 ligand 바인딩 Rb 의 합 = Lb, 분리 상수 또한 쓸 수:
 공식 2
공식 2
따라서, 채도 항복 Y, 바인딩된 리간드 Lb 수용 체 Rt의 총 농도의 관계의 일부분으로 정의
 식 3
식 3
무료 리간드 Lf의 농도에 따라 다릅니다.
 방정식 4
방정식 4
이 쌍곡선 관계 수용 체 ligand 상호 작용의 바인딩 곡선을 설명 하 고의 음모 무료 리간드 Lf의 농도의 기능으로 바인딩된 리간드 Lb 의 농도 보여 줍니다. 바인딩 곡선에서 분리 상수 K 반 최대한 채도 항복 무료 ligand의 농도 파생 될 수 있습니다. 또한, 다른 알고리즘을 바인딩 커브를 선형화 설립 되었습니다, Klotz1,2또는 Scatchard 또는 헤 인 즈 (Bisswanger3검토) 변환에 의해 더블-상호 음모 등. 그러나, 모든 알고리즘 asymptotically 무료 ligand 바인딩 곡선에서의 높은 농도에서 접근 된다, 채도 수율의 최대값 그래픽 사전 평가에서 추정 될 수 있다 며 따라서 문제에서 고통 오류 발생.
또한, 바인딩 곡선의 결정 바인딩 평형 동안 자유롭고 바인딩 ligand의 정량화를 해야합니다. 이 위해 무료 ligand 수용 체 바인딩 ligand에서 분리 하 여 정량 있다. 따라서, ligand와 수용 체는 단백질 수용 체는 반대로 비 단백질 ligand 등 그들의 속성에 다 해야 합니다. 두 바인딩 파트너 단백질 인 경우에, 그들은 그들의 크기, 비용, 또는 다른 분자 기능에서 구별할 수 있다. 그럼에도 불구 하 고, 소규모 바인딩 접근에 있는 ligand 농도의 정량화 어려운 작업입니다. ligand의 방사성 라벨 자주 되었습니다 바운드 ligand의 낮은 농도 검출 하는 데 필요한 특히 수용 체의 상당한 양의 없는 경우 사용할 수 또는 저렴 한. 또한, 수용 체 바인딩 ligand 무시할 수 비 방식에서 중과 격리 후 분리 수 있습니다. 따라서, 평형 젤 여과4,5, 모 세관 전기 이동 법 및 펄스 베이스6, 같은 복잡 한 방법을 수용 체 바인딩 ligand를 계량 하 고 무료 ligand에서 그것을 분리 하는 데 필요한 있습니다.
이러한 바인딩 분석 실험, 달리 적정 실험에서는 바운드 및 무료 ligand의 정량적 분리가 필요 하지 않습니다. 이 위해, 일정 농도에서 수용 체 추가 ligand의 다른 농도와 적정 이다. 수용 체에 바인딩하여 바인딩된 ligand는 무료 ligand에서 그것을 구별 하 고, 예를 들어, 광도, fluorometry, 또는 항 체 검출에 의해 측정 되는 생물 속성이 있습니다. 따라서, S, 채도에 비례 하는 신호 Y를 항복 하 고 따라서 또한 수용 체 바인딩 ligand (Lb)의 농도를 감지 추가 ligand (Lt)의 총 농도의 기능으로. 매개 변수, 신호 S 및 추가 ligand의 총 농도 바운드 및 무료 ligand의 농도 보다 직접적이 고 쉽게 방식으로 측정할. 특히, 효소 연결 된 immunosorbent 분석 결과 (ELISA)에 의해 수용 체 바인딩 ligand 감지 다 잘 결정 접시에 100 µ L 아래에 샘플 볼륨의 감소 뿐만 아니라 여러 ligand 농도의 병렬 측정 허용. ELISA 적정에서 수용 체 물리적으로 동일한 농도에서 결정 플레이트에 흡착 이며 수용 성 리간드로 적정. 수용 체는 움직일 수 플라스틱 표면에 본질적으로 소수 성 흡착에 의해. Langmuir´s 흡착 등온선7에 따라 가능성이 비선형 관계에 수용 체의 코팅 농도와 고정된 수용 체 상호의 표면 농도. 흡착된 수용 체 분자의 전체 숫자 이외에 그들의 활동 상태가 적정 분석에 대 한 또 다른 중요 한 매개 변수입니다. 만 움직일 수 수용 체 ligand 바인딩 활동 유지, 적정 분석 결과 대 한 관련 되 고 결국 직접 확인할 수 없는 적정 분석 결과의 활성 수용 체 Rt 의 총 농도에 기여.
플라스틱 표면에 고정된 수용 체에 포함 되지 않습니다이 사이트는 ligand 같은 다른 단백질을 흡착 하는 경향이 있다. 같은 플라스틱 표면 사이트 리간드의 물리적 흡착 수용 체 바인딩 ligand로 유사한 신호에서 아직 일반적인 방식으로 발생 합니다. 이 일반적인 신호는 단백질으로 코팅 하지 아직 소 혈 청 알 부 민 (BSA)와 차단 될 것입니다 결정 접시의 플라스틱 표면 사이트를 줄이기 위해. 그러나, 일부 수용 체 ligand 적정 분석에 대 한 일반적인 배경 신호를 관찰할 수 있습니다. 그런 다음, 다른 차단 에이전트 0.04% 또는 0.2% 젤라틴의 솔루션 등 트윈 20는 것이 좋습니다.
수용 체에 바인딩을, 후 무료 ligand 두 세척 단계에 의해 제거 됩니다. 바운드 ligand 수용 체, 결정 잘의 플라스틱 표면에 움직일 이며 선택적으로 화학 기정에 의해 강화 된 남아 있습니다. 후속 공유 교차 결합의 바인딩된 ligand와도 함께 고정된 수용 체에 대 한 버퍼 물질 트리 ligand 바인딩에 어떤 변화 없이 HEPES에 대 한 대체 됩니다. HEPES, 트리 스, 달리도 비활성화 하지 않습니다. 도와 공유 교차 결합 그것의 수용 체 바인딩된 ligand 해결 이후 세척 및 인큐베이션 단계 동안 그것의 분리를 방지 한다. 따라서, 수용 체 ligand 상호 작용 화학적으로 고정 하 고 영장 적정 곡선을 세척 및 외피의 후속 단계에 의해 영향을 받지 않습니다. 그러나, 글 고정은 ligand와 같은 방식으로 그들의 상호 작용의 감소 또는 폐지는 수용 체에 화학적으로 수정할 수 있습니다. 또한,는 리간드 내에서 epitopes의 단일 클론 항 체 바인딩된 ligand 척도를 사용 하는 경우에 특히 탐지 항 체 바인딩 선호도 변경할 수 있습니다. 비록 어느 쪽도 정착의 이러한 부작용의 발생이 적정 ELISA에서에서,도로 시험의 감도 적정 실험 전에 모든 수용 체 ligand 상호 작용에 대 한 테스트 되어야 한다. 고정, 후 초과 트리 스 포함 된 버퍼와 3 개의 세척 단계에서 제거 됩니다. 트리 스 nonspecifically 후속 단계에서 항 체를 검출 반응 수 있는 나머지 알데하이드 그룹은.
바인딩된 ligand의 양 광도 ELISA 신호 미를 제공 하는 효소 연결 된 항 체와 계량 이 추가 총 ligand 농도 Lt 대 플롯은 각 잘 하. 쉽게 인수에 불구 하 고 적정 곡선 쌍곡선 함수 바인딩 곡선 달리 아니다. 또한, 그것 되었습니다 분명 적정 곡선에서 분리 상수 K를 계산 하는 방법. 시선 인수 적정 곡선을 선형화 하는 알고리즘을 독립적으로 보고 되었습니다 하지 Stockell8 및9에 있는 Heyn와 Weischet 의해, 하지만 그들은 최대 신호 추정의 불확실성으로 인해 미흡 값은 채도 수익률 추가 ligand의 높은 농도에 접근 한다.
여기, ELISA 적정 및 비 선형 회귀 알고리즘 기술 적정 곡선에서 수용 체 ligand 상호 작용에 대 한 분리 상수 K를 파생 된다. 이 프로토콜은 뱀 독 파생 억제제와 integrin α2β1의 콜라겐 바인딩 A 도메인의 상호 작용에 대 한 궁 행. Integrins는 세포 접착 분자, 주변 기질 또는 기본 지하실 멤브레인10,11셀의 앵커리지 중재. 또한, integrins 모집 추가 신호 분자 및 새로운 휴대 organelles, 세포-매트릭스 상호 작용12,13, 에 adhesomes를 형성 하 여 세포와 세포 외 매트릭스 사이 중요 한 신호 전달 14. 콜라겐, α2β1 integrin의 ligand의 가장 풍부한 단백질 이며 결합 조직15의 중요 한 비 계 구성 요소. Α2β1 integrin과 콜라겐 사이 상호 작용은 integrin α2 소 단위의 A 도메인에 의해 중재 됩니다. Integrin α2A-도메인 포함 divalent 양이온, 콜라겐 바인딩 필요 하 고 그것의 구조를 안정화 합니다. 야생-타입 폼으로 있는 것과 같은 표면 노출 찌 꺼 기 Y216는 글리신에 대 한 대체 했다 α2A 도메인의 돌연변이 세균 식 시스템에서 recombinantly 생산를 수 통해 그들의 올리고-그의-태그는 NiNTA와 절연 TRIS 버퍼 염 분 (TBS, 50 m m TRIS/HCl, pH 7.4, 150 mM NaCl) 포함 2 m MgCl2m16에 대 한 후속 투와 superflow 열. 그들의 농도 bicinchoninic 산 분석 결과 (BCA)로 결정 했다 그리고 그들의 순도 기존의 SDS 페이지 테스트 Coomassie 화려한 블루 R250 스테인드.
Α2β1 integrin과 콜라겐 사이 상호 작용은 뱀 독 구성 요소, 말레이 모사 (Calloselasma rhodostoma)16,17에서 rhodocetin의 바인딩에 의해 차단 됩니다. 이 적정 ELISA에에서 수용 성 리간드로 사용, rhodocetin 원유에서 정제는 앞에서 설명한16독. HEPES 버퍼링 염 분 (HBS; 10 mM HEPES/NaOH, pH 7.4, 150 mM NaCl)에 용 해 하 고-20 ° c.에 냉동 저장 그것의 농도 BCA에 의해 결정 되었다 고 그 순도 SDS 페이지에 의해 입증 되었다. 길 항 제로 rhodocetin 뿐만 아니라 콜라겐은 integrin에 바인딩 차단 α2β1 A-도메인, 하지만 또한 그로 인하여 어떤 세포 또는 혈소판18로 콜라겐에서 신호 방지 integrin의 비활성 형태를 안정 시킨다. 그것은 그것의 수용 체 표적으로 rhodocetin의 분리 상수를 결정 하 고 따라서 그것의 분자 메커니즘 및 제약 잠재적인 예를 들어, 지원을 에이전트로 해명에 생물 의학 중요성의. 이 위해, 그것의 평가 포함 하 여 설명 하는 ELISA 적정을 1:1 상호 작용 산출할와 거의 모든 수용 체 ligand 상호 작용에 적용 됩니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 재고 솔루션
- 10 x TBS의 100 mL pH 7.4 솔루션을 준비 하려면 분해 트리 스와 이온을 제거 된 물 90 mL에 NaCl의 8.77 g 6.06 g, 7.4 37 %HCl 솔루션에 pH를 조정, 볼륨 100 mL을 이온을 제거 된 물,를 필터링 솔루션.
- 1의 100 mL를 준비 하 M HEPES/NaOH, pH 7.4 솔루션 23.83 g HEPES의 이온을 제거 된 물 90 mL에 녹, 1.5 M NaOH와 7.4 pH 조정, 볼륨 100 mL을 이온된 수로를 필터링 솔루션.
- 5 M NaCl 용액 100 mL를 준비 하려면 29.2 g NaCl의 이온을 제거 된 물 90 mL에 용 해. 이온을 제거 된 물 100 mL에 볼륨을 필터링 솔루션.
- 100 mL의 1 M MgCl2 솔루션을 준비, 해산 20.33 g MgCl2 · 6 H2O의 이온을 제거 된 물 90 ml. 이온을 제거 된 물 100 mL에 볼륨을 필터링 솔루션.
- 준비 물에 5% 열 비활성화 BSA, 50 mL 튜브에 BSA (분수 V, pH 7.0)의 2.5 g 무게 하 고 이온을 제거 된 물 45 mL에 용 해. 이온된 수, 50 ml 솔루션 작성 및 45 분 얼음 목욕에서 그것을 냉각 하 고-20 ° c.에 그것을 저장할 68 ° C에서 물 욕조에 솔루션을 열
- 25%도 용액을 준비 합니다.
주의:도 유해한 경우에 삼 켜, 흡입에 의해 독성 이며 화상의 원인. 장갑, 보호복을 착용 하 고 눈/얼굴 보호. - 앞에서 설명한19로 토끼 원으로를 올립니다. 원으로 titer20표준 프로토콜 따라 결정 되었다.
- 염소 알칼리 성 인산 가수분해 효소와 활용에서 안티 토끼 면역 글로불린 항 체를 준비 합니다.
- 100 mL의 0.1 M 글리신 솔루션을 준비, 글리신 이온 물 90 ml에서의 0.75 g을 분해. 1.5 M NaOH 솔루션 10.4 pH를 조정 하 고 이온된 수 100 mL에 볼륨을 채워 필터링 솔루션.
- 0.5 M Zn (II) 100 mL를 준비-아세테이트 솔루션, 10.98 g Zn (II)의 해산-아세테이트 · 2 H2O의 이온을 제거 된 물 90 ml. 이온을 제거 된 물 100 mL에 볼륨을 필터링 솔루션.
- 1.5 M NaOH 솔루션의 100 mL를 준비 하려면 6.0 g NaOH의 이온을 제거 된 물 90 mL에 용 해. 이온을 제거 된 물 100 mL에 볼륨을 필터링 솔루션.
2. 준비 버퍼 솔루션 작업
- 5 10 x TBS pH 7.4의 45 mL와 함께 이온된 물 희석 고 1 M MgCl2 재고 솔루션의 100 µ L를 추가 합니다. 실내 온도에 그것을 유지. TBS, pH 7.4, 2 mM MgCl2 솔루션 결정 접시를 세척 하 고 수용 체의 동원 정지입니다.
- 물에 열 비활성화 BSA의 5% 및 10 x TBS의 5 mL 50 mL에 이온된 수와 pH 7.4의 10 mL를 희석. 1 M MgCl2 재고 솔루션의 100 µ L을 추가 하 고 솔루션을 잘 섞는다. 얼음에 그것을 유지 하 고-20 ° c.에 추가 실험을 위해 그것을 저장합니다 참고 1% BSA TBS, pH 7.4, 2 mM MgCl2 에서 그 2.5 mL는 각 적정 곡선 필요 합니다.
- 1의 2.5 mL를 희석 M HEPES/NaOH, 이온 물 50 mL에 pH 7.4와 1.5 mL 5 M NaCl 해결책 100 µ L 1 M MgCl2 솔루션을 추가 하 고 철저 하 게 준비 하는 HBS, pH 7.4: 50 mM HEPES/NaOH의 50 mL 솔루션 혼합 150 mM NaCl.
- 1 M MgCl2 재고 솔루션의 5 µ L를 더하고 2 µ L 0.5 M Zn (II)-5 mL 0.1 M 글리신 솔루션, pH 알칼리 성 인산 가수분해 효소 (AP) 버퍼 (0.1 m M 글리신 솔루션, pH 10.4, 1 mM MgCl2, 0.2 m Zn(II)-acetate) m를 준비 하는 10.4 아세테이트 재고 솔루션.
3. 결정 플레이트 (Integrin α2A-도메인) 수용 체의 동원 정지
- Integrin α2A-TBS, pH 7.4, 2 mM MgCl2 5 µ g/mL의 최종 농도 대 한 도메인의 재고 솔루션을 희석.
참고: 볼륨 코팅 솔루션의 절반 지역 결정 플레이트의 12 음 행으로 구성 된 한 적정 곡선에 대 한 650 µ L입니다. - 50 µ L/잘 integrin α2A 도메인 (야생-타입 또는 돌연변이)의 5 µ g/mL 코팅 솔루션의 절반 지역 결정 접시에 행의 모든 잘 채워. 중복에 적어도 모든 적정 행 수행 (쌍둥이;이 예제에서 그림1에서 결정 판의 레이아웃 참조).
- 호 일 접시를 밀봉 하거나 뚜껑을 닫습니다. 밤새 4 ° C에서 접시를 남겨 주세요.
4. 세척 코팅 웰 스는 접시 두 번 TBS, pH 7.4, 2 mM MgCl2 와
- 수용 성 수용 체를 제거 하려면 하지 플라스틱 표면에 물리적 흡착에 의해 움직일 되어 코팅 솔루션을 제거 하 고 각 채우기 분자 잘 TBS, pH 7.4, 2mm의 50 µ L와 MgCl2.
- 세척 솔루션을 제거 합니다. 우물 건조가 되지 않습니다 확인 하십시오. 따라서, 잔여 액체를 제거 하려면 조직 옷감에 결정 플레이트를 누릅니다 하지 않습니다. 다단계 피 펫 또는 다중 채널 피 펫을 사용 하 여 신속 하 게 우물을 채우기 위해.
- 한 번이 세 단계를 반복 합니다.
5. 일반적인 바인딩 사이트 차단
- TBS, pH 7.4, 각 음을 2 m m MgCl2 에 1 %BSA 솔루션의 50 µ L를 추가 합니다.
- 호 일 우물을 다시 봉인 또는 뚜껑을 닫습니다.
- 실 온에서 1 h에 대 한 웰 스를 품 어.
참고:이 프로토콜의 인큐베이션 단계 락 또는 떨고 플랫폼에서 수행할 수 있습니다. 그러나,이 필요 하지 않습니다 하 고 실험의 결과 변경 하지 않습니다.
6. 리간드, Rhodocetin의 직렬 희석 행 준비
- Rhodocetin의 시작 농도 직렬 희석, ligand 농도의 적절 한 범위를 및 최소 및 최대 신호 전체 적정 곡선 기록의 희석 요인이 다. 이 실험에서 243 nM rhodocetin의 시작 농도 및 2.3의 희석 비율을 사용 합니다. 직렬 희석 행의 가장 높은 ligand 농도에 rhodocetin 재고 솔루션을 희석. 2.3 희석 요소와 각 적정 곡선, 1%에서 243 nM (즉, 15,2 µ g/mL) rhodocetin 솔루션의 115 µ L를 준비 BSA/TBS, pH 7.4, 테스트 튜브 # 1에서에서 2 mM MgCl2 .
- TBS, pH 7.4, #2 #11-표시 10 시험관에서 2 mM MgCl2 에 1 %BSA 솔루션의 65 µ L을 입력 합니다.
- 테스트 튜브 # 1에서에서 rhodocetin 희석의 50 µ L를 전송 테스트 튜브 #2, 혼합 두 솔루션 (전체 용량: 115 µ L, 희석 비율: 1:2. 3) 분쇄, 그리고 테스트 튜브 #3, 등 이 혼합물에서 전송 50 µ L
- 테스트 튜브 # 11까지 직렬이 희석을 계속 합니다.
참고: 단계 6.1 6.4에서에서 주어진 볼륨 한 적정 곡선에 대 한 충분 한 있습니다. 이러한 볼륨 복제의 수에 곱하십시오. 이 경우 8 적정 곡선 (2 개의 α2A 도메인 형태의 쌍둥이)를 수행 하 고 다음 볼륨 준비: 테스트 튜브 #1;에 높은 농도에서 rhodocetin 솔루션의 920 µ L TBS, pH 7.4, 2 mM MgCl2 #2 ~ #11; 테스트 튜브의 각 입력에서 1 %BSA 520 µ L 그리고 중 하나에 1 개의 관에서 전송 볼륨의 400 µ L.
7. 바인딩 Ligand (Rhodocetin)를 서로 다른 농도에서 수용 체 (Integrin α2A-도메인) 움직일
- 진공 라인에 의해 결정 판 우물에서 차단 솔루션을 제거 합니다.
- 즉시 추가 1 %rhodocetin에서 솔루션의 50 µ L BSA/TBS, 테스트 튜브 #1 열 1, 열 2, TBS, pH 7.4에에서 1 %BSA등 추가 50 µ L의 우물을 테스트 튜브 # 2의 솔루션의 우물으로 pH 7.4/MgCl2 솔루션 2 m m MgCl2 (차단 및 희석 버퍼) ligand 무료 컨트롤로 열 12 (레이아웃 결정 판, 그림 1참조)의 우물을.
- 호 일 우물을 다시 봉인 또는 뚜껑을 닫습니다.
- 상 온 (약 20-22 ° C)에서 1.5 h에 대 한 웰 스를 품 어.
8. 세척 우물의 플레이트 두 번 HBS, pH 7.4, 2 mM MgCl2 와
- 비 바운드 ligand 분자를 제거 하려면 바인딩 솔루션을 제거 하 고 각 채우기 HBS, pH 7.4, 2 mM MgCl2의 50 µ L로 잘. 그런 다음 세척 솔루션을 제거 합니다.
- 돌 우물 건조가 되지 않습니다. 따라서, 잔여 액체를 제거 하려면 조직 옷감에 결정 플레이트를 누릅니다 하지 않습니다. 다단계 피 펫 또는 다중 채널 피 펫을 사용 하 여 신속 하 게 우물을 채우기 위해.
- 한 번이 세 단계를 반복 합니다.
9. 2.5% 수용 체 바인딩 Ligand 수정 HBS, pH 7.4, 2 mM MgCl2 에
- 25%도 솔루션의 1 부분과 HBS, pH 7.4, 2 mM MgCl2의 9 부분을 혼합 하 여 신선한 2.5%도 솔루션을 준비 합니다.
- HBS, pH 7.4, 2 mM MgCl2에서 2.5%도 솔루션의 50 µ L로 결정 판 모든 우물을 채우십시오. 실 온에서 10 분을 위한 결정 플레이트를 품 어.
10. TBS, pH 7.4, 2 mM MgCl2 의 50 µ L/잘 접시 세 번의 워시 우물
- 제거 하 고 초과 비활성화, 고정 솔루션을 제거 하 고 각 채우기 TBS, pH 7.4, 2 mM MgCl2의 50 µ L로 잘. 세척 솔루션을 제거 합니다.
참고: 결정 판에서 글에 포함 된 고정 솔루션 그릇에 부 어 하 고 TBS, pH 7.4의 동일한 볼륨에 의해 비활성화 된 후 고정 솔루션을 삭제. - 돌 우물 건조가 되지 않습니다. 따라서, 잔여 액체를 제거 하려면 조직 옷감에 결정 플레이트를 누릅니다 하지 않습니다. 다단계 피 펫 또는 다중 채널 피 펫을 사용 하 여 신속 하 게 우물을 채우기 위해.
- 이 세척 단계를 두 번 반복 합니다.
11. 일 라에 의해 수용 체 바인딩 Ligand의 정량화
- TBS, pH 7.4, 2 mM MgCl2에 1 %BSA 50 µ L/우물의 1 차적인 항 체 솔루션을 추가 합니다. 1 차적인 항 체 솔루션은 토끼 원으로 rhodocetin19에 대 한 발생, TBS, pH 7.4, 2 mM MgCl2에 1 %BSA 1:2,000 희석.
- 실 온에서 75-90 분 동안 접시를 품 어. 세 번와 TBS, pH 7.4, 2 mM MgCl2의 50 µ L/잘 접시의 모든 우물을 씻어. 3 단계 세척, 조직에 결정 플레이트의 도청 중 천으로 필요 하지 않습니다.
- TBS, pH 7.4, 2 mM MgCl2에 1 %BSA 50 µ L/잘 이차 항 체 솔루션을 추가 합니다. 이 위해, 이차 항 체, 토끼 면역 글로불린을 대상으로 염소 항 체 알칼리 성 인산 가수분해 효소, TBS, pH 7.4, 2 mM MgCl2에 1 %BSA 1:2,000 함께 활용 된 희석. 실 온에서 75-90 분 동안 접시를 품 어.
- 4-nitrophenyl 인산 disodium 염 hexahydrate (인산 가수분해 효소 기질) AP 버퍼 (0.1 m M 글리신 솔루션, pH 10.4, 포함 하는 1 m m MgCl2 와 0.2 m m Zn(II)-acetate)의 5 ml에서를 포함 하는 5 mg 태블릿을 용 해 하 여 AP 검색 솔루션을 준비.
- 세 번의 TBS, pH 7.4, 다음 단계를 수행 하기 전에 즉시 2 m m MgCl2, 50 µ L/잘 사용 판 모든 우물을 씻어. 액체의 모든 흔적을 제거 하는 마지막 세척 단계 후 조직 옷감에 결정 플레이트를 누릅니다.
- 50 µ L/AP 검색 솔루션의 잘 결정 접시의 우물을 추가 합니다. 가능한 동시에 효소 변환 하려면 모든 우물에 AP 검색 솔루션을 신속 하 게 추가 합니다. 따라서, 다중 채널 피 펫을 사용 합니다.
- Ligand 밀집 된 우물에서 솔루션 노란색 차례 때까지 실 온에서 접시를 품 어.
참고: 5 분 및 신호 강도 따라 1 시간 사이 부 화 시간이 달라질 수 있습니다. - 50 µ L/잘 1.5 M NaOH 솔루션을 추가 하 여 인산 가수분해 효소 기판의 변환을 중지 합니다. 두 솔루션의 혼합 연속 무료 되도록 몇 분 동안 접시 서를 둡니다. 모든 우물에 동일한 잠복기를 보증, 다중 채널 피 펫을 사용 하 여를 단계 11.8에서에서 AP 탐지 기판의 우물에 추가 된 동일한 순서로 1.5 M NaOH를 추가 합니다.
- 405에서 광학 밀도 (OD)를 측정 각 잘 ELISA 리더의 nm.
12입니다. 적정 신호 평가
- Excel과 원시 데이터, OD405nm 값의 테이블을 엽니다. 적정 곡선의 신호 값이 행에서 읽고는, 열을 다른 열에 추가 된 ligand의 농도와 레이블 값을 조 변경할.
- Graphpad Prism을 5 (버전 5.0)을 엽니다. 주 메뉴에서 새 프로젝트 파일을 엽니다. 새 데이터 및 그래프에서 XY 형식을 선택 합니다. Y 축에 대 한 Enter 및 플롯 각 값에 대 한 단일 지점 옵션을 선택 합니다.
- 두 개의 열, 추가 ligand의 농도 복사 하 고 값 (OD405nm 값)는 excel에서 파일을로 GraphPad Prism의 데이터 시트에 붙여넣을 신호 X 및 Y 값, 각각.
- GraphPad Prism 5 분석 하위 프로그램 열고 비 선형 회귀 XY 분석아래 옵션을 선택 합니다. 사용자 정의 방정식 을 선택 하 고 새로운 방정식을 만들기 새로운 버튼 을 누릅니다.
- 적정 곡선 방정식 형태로 입력: Y =(Smax-Smin)*((X+R+K)-sqrt((X+R+K)^2-4*R*X)) /(2*R) + Smin + y 신호 값 S, 추가 리간드 L의 농도가 되 고 X 되 고 새롭게 문이 연된 템플릿 시트 B * X R의 농도 되 움직일 수용 체, 되 고 분리 상수 K와 B 배경 되 고 경사. 정의 적절 한 제약 조건, K > 0와 R > 0.
참고:이 방정식은 다른 형태의 방정식 9의 동일한 방정식. - 새로 작성 된 사용자 정의 방정식을 선택 하 여 데이터 시트의 값을 분석 합니다. 계산 된 근사치 값으로 테이블을 열고 (K, Rt,최대S, S분, 그리고 B)는 소프트웨어 스크린의 왼쪽에 있는 결과 섹션 아래에 표시 됩니다.
참고: 소프트웨어는 적정 곡선 적어도 5 데이터 포인트의 구성 하는 경우에 비-선형 회귀의 반복 피팅 여 5 매개 변수를 결정 합니다. - 매개 변수 K, Rt,최대S, S분및 B 적정 곡선의 모든 그룹에 대 한 통계, 평가 하 고 (돌연변이 또는 화학 수정 ligand 또는 수용 체) 그룹의 특정 기능 매개 변수를 연관.
Access restricted. Please log in or start a trial to view this content.
결과
후에 ELISA 개발 되었습니다, 변환 된 알칼리 성 인산 가수분해 효소 기질, 파라-nitrophenolate의 노란 색, 바인딩된 rhodocetin ligand의 금액에서 추가 된 rhodocetin의 농도 감소와 감소 열 1 ~ 11 (그림 1). 무색 열 12에에서 rhodocetin 무료 우물 우물 낮은 배경 신호를 표시합니다.
405에서 광도 정량화 nm 제공 분석 ...
Access restricted. Please log in or start a trial to view this content.
토론
ELISA 적정 수용 체 ligand 상호 작용의 분리를 결정 하는 다양 한 테스트 시스템입니다. 적정으로 ELISA circumvents 자유롭고 바운드 ligands를 효과적으로 분리 하 고 양적, 그들의 농도 분석을 실질적으로 더 많은 연구 필요성 및 간행물 바인딩 곡선을 기록 하는 대신 적정 ELISAs 고용 . 또한, 적정 ELISAs 수행 수용 체 그리고 ligand의 합리적으로 낮은 금액을 필요로 하는. 분리 상수의 정확한 분석에 대 한 수?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 상관이 있다.
감사의 말
프로토콜 및 알고리즘 도이치 가운데 (DFG 그랜트 SFB1009 A09와 EB177/13-1)에 의해 자금을 프로젝트 내에서 개발 되었다. 저자는 바바라 Schedding 및 기술 지원에 대 한 펠릭스 Schmalbein 박사 Niland 비판적 원고를 읽기 위한 감사 합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
참고문헌
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , Wiley VCH Verlag GmbH. 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection--a glue for tissue repair? J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978(2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492(2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, Cold Spring Harbor Laboratory. 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유