A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
زراعة الطحالب الخضراء في فقاعة العمود Photobioreactors وفحص للدهون محايدة
In This Article
Summary
نقدم هنا، وضع بروتوكول لبناء مختبر-مقياس الفقاعة العمود photobioreactors واستخدامها للثقافة الطحالب المجهرية. كما يوفر طريقة لتحديد معدل نمو الثقافة والمحتوى الدهني محايدة.
Abstract
وهناك اهتمام كبير في دراسة الطحالب المجهرية للتطبيقات الهندسية مثل إنتاج الوقود الأحيائي، والمنتجات عالية القيمة، ومعالجة النفايات. كما يبدأ معظم الجهود البحثية الجديدة في المختبرات، هناك حاجة لطرق فعالة من حيث التكلفة لاستزراع الطحالب بطريقة استنساخه. وهنا نتواصل نهجاً فعالاً للثقافة من الطحالب المجهرية في photobioreactors في المختبرات، وقياس النمو والمحتوى الدهني محايدة أن الطحالب. كما يتم تضمين إرشادات حول كيفية إعداد النظام فوتوبيوريكتور. على الرغم من أن الكائنات الحية المثال الأنواع Chlorella و أوكسينوتشلوريلا، يمكن تكييفها مع هذا النظام لزراعة مجموعة واسعة من الطحالب المجهرية، بما في ذلك الثقافات المشارك من الطحالب مع الأنواع غير الطحالب. وتزرع الثقافات الأسهم أولاً في زجاجات لإنتاج العدوى للنظام فوتوبيوريكتور. تتركز العدوى الطحالب وتحويلها إلى photobioreactors لزراعة في الوضع الدفعي. يتم جمع عينات يوميا لقراءات الكثافة البصرية. في نهاية ثقافة دفعة، خلايا يتم حصادها بالطرد المركزي، غسلها، وتجميد المجفف للحصول على تركيز وزن جاف نهائي. تركيز الوزن الجاف النهائي يستخدم لإنشاء ارتباط بين الكثافة البصرية وتركيز الوزن الجاف. استخدمت طريقة فلك معدلة في وقت لاحق لاستخراج الدهون الإجمالية من الكتلة الأحيائية المعصوفه وهو جزيئي الاستخراج لمحتواه الدهن محايدة مقايسة ميكروسكوبية باستخدام. هذا التحليل قد صدر سابقا ولكن الخطوات البروتوكول أدرجت هنا لتسليط الضوء على الخطوات الحاسمة في الإجراء حيث تحدث الأخطاء بشكل متكرر. مفاعل حيوي النظام المذكور هنا يملأ مكانة بين زراعة قارورة بسيطة والمفاعلات الحيوية التجارية تسيطر عليها تماما. يتطابق حتى مع فقط 3-4 البيولوجية كل معاملة، ونهجنا لاستزراع الطحالب ويؤدي إلى ضيق الانحرافات المعيارية في فحوصات النمو والدهن.
Introduction
تطبيق الطحالب المجهرية في الهندسة والتكنولوجيا الأحيائية قد اجتذب اهتماما كبيرا في السنوات الأخيرة. وتجري الآن دراسة الطحالب المجهرية للاستخدام في المياه المستعملة المعالجة1،2،،من34، الوقود الحيوي الإنتاج5،6،،من78، إنتاج المغذيات وغيرها9،منتجات عالية القيمة10. الطحالب هي أيضا يجري المعدلة وراثيا بمعدلات أكبر في محاولة لتحسين لياقتهم البدنية ل11،التطبيقات الهندسية الخاصة12. ونتيجة لذلك، هناك اهتمام كبير في التجريب مع الكائنات ذات الصلة صناعيا في الإعدادات التي تسيطر عليها. والغرض من هذا الأسلوب هو للتواصل نهجاً فعالاً لثقافة الطحالب المجهرية في بيئة مختبرية تحت التحكم، وقياس النمو والمحتوى الدهني محايدة أن الطحالب. تحسين نمو معدلات ومحتوى الدهون محايدة من الطحالب المجهرية قد حددت كاثنين من الاختناقات الرئيسية نحو تسويق الوقود الحيوي الطحالب13.
استخدمت مجموعة واسعة من النهج للطحالب الثقافة لأغراض تجريبية. وبصفة عامة، يمكن تقسيم هذه النهج بين زراعة في الهواء الطلق على نطاق واسع، وزراعة حوض صغير. زراعة في الهواء الطلق في photobioreactors والبرك المفتوحة المناسبة للتجريب تهدف إلى الارتقاء بمستوى العمليات التي ثبت فعلا في المختبرات (مثلاً، لاختبار الارتقاء بسلالة الدهنية عالية جديدة من الطحالب)14. ومع ذلك، زراعة صغار داخلي مناسب عند تطوير سلالات جديدة أو محسنة الطحالب أو إجراء تجارب تهدف إلى فهم الآليات البيولوجية. وفي هذه الحالات الأخيرة، مطلوب درجة عالية من التحكم التجريبي لندف عليها بعض التغييرات الطفيفة في السلوك البيولوجي. تحقيقا لهذه الغاية، غالباً ما يطلب أكسينيك الثقافات بغية التقليل من العوامل الحيوية المعقدة المرتبطة بالكائنات الأخرى (مثل البكتريا والطحالب الأخرى) التي تنمو لا محالة في نظم في الهواء الطلق واسعة النطاق. حتى عند دراسة التفاعلات بين الطحالب وغيرها من الكائنات الحية، وقد وجدنا أن استخدام الشروط التجريبية الخاضعة للغاية مفيد عند دراسة تبادل الجزيئية بين الكائنات الحية15،،من1617.
ضمن فئة زراعة الطحالب داخلي صغير، استخدمت مجموعة من النهج. ولعل النهج الأكثر شيوعاً تنمو الطحالب في قوارير Erlenmeyer على طاولة شاكر تحت18،بنك خفيفة19. ويجري تبادل الأوكسجين وأول أكسيد الكربون2 بنشر السلبي من خلال المكونات رغوة في أعلى قارورة. وقد تحسنت بعض الباحثين هذا التشكيل عن طريق تهوية نشطة في قوارير20. نهج آخر زراعة الطحالب في زجاجات، المختلطة بواسطة شريط ضجة وتهوية نشطة. وعلى الرغم من بساطتها، وجدنا أن استخدام قوارير وزجاجات غالباً ما يؤدي إلى نتائج غير متناسقة بين replicates البيولوجية. يفترض أن هذا سبب موقف آثار-مواقف مختلفة تلقي كميات مختلفة من الضوء، والتي تؤثر أيضا على درجات الحرارة الداخلية المفاعل. التناوب اليومي من المفاعلات إلى مواقع جديدة يمكن أن تساعد ولكن ليس التخفيف من المشكلة لأن مراحل معينة من نمو الطحالب (مثلاً، أوائل أسي) هي أكثر حساسية للتأثيرات الموضعية من غيرها (مثلاً، سجل المرحلة).
على الجانب الآخر من طيف التطور التكنولوجي هي photobioreactors التجارية التي تسيطر عليها تماما. هذه الأنظمة باستمرار رصد وضبط الأوضاع في المفاعل لتحسين نمو الطحالب. لديهم الإضاءة قابلة للبرمجة والتحكم في درجة الحرارة في الوقت الحقيقي ومراقبة درجة الحموضة. لسوء الحظ، أنها غالية الثمن وتكلف عادة عدة آلاف من الدولارات في المفاعل. أهم المجلات العلمية والهندسية تتطلب النسخ المتماثل البيولوجية للنتائج، مما استلزم شراء المفاعلات الحيوية متعددة. نحن الحاضرين هنا نظام مفاعل عمود فقاعة تلك الجسور الفجوة بين بسيطة (قارورة) ومتطورة (تسيطر عليها تماما مفاعل حيوي) نهج لزراعة الطحالب على نطاق المختبر. استخدام الأعمدة فقاعة ارتفاع فقاعات الغاز لتسهيل تبادل الغازات ومزيج المفاعل. هذا النهج يوفر درجة من التحكم في الإضاءة ودرجة الحرارة ولكنه يفعل ذلك بطريقة فعالة من حيث التكلفة. وعلاوة على ذلك، فقد وجدنا هذا النظام إلى نتائج متسقة عالية بين replicates البيولوجية، تخفيض العدد المطلوب من replicates البيولوجية اللازمة من أجل الحصول على نتائج مهمة إحصائيا بالمقارنة مع النهج قارورة أو زجاجة. كما أننا استخدمنا هذا النظام بنجاح زراعة مخاليط من الطحالب والبكتيريا21. بالإضافة إلى زراعة الطحالب، أننا مخطط إجراء لقياس المحتوى الدهني محايدة في الطحالب المستزرعة. الأسلوب الأخير قد تم نشرها في أماكن أخرى من22، ولكن نقوم بتضمين الإجراء هنا لتوفير الإرشادات خطوة بخطوة عن كيفية استخدامها بنجاح.
Protocol
1-الإعداد لفقاعة العمود Photobioreactors
- إنشاء مجموعة من أغطية تنفيس من الأغطية البلاستيكية التي جاءت مع 1 لتر الزجاجات والأنابيب التهجين (انظر الشكل 1 التخطيطي والصور). بناء الأغطية المرطب، خلط فخ وكل فوتوبيوريكتور النقل الجوي وكل زجاجة المفاعل.
- حفر ¼ "ثقوب في الغطاء: 2 الثقوب اللازمة لاغطية مفاعل حيوي والمرطب؛ ثمة حاجة إلى 3 ثقوب فخ الخلط.
- تنزلق من ¼ "الدائري على المواضيع من المناسب اللوير جبل الفريق 1/8"، والشرائح وهذا في حفرة ¼ "حفر في الغطاء (الشكل 1A).
- زلة ثاني ¼ "الدائري على المواضيع حيث أن الغطاء هو تقع بين اثنين من حلقات س. زلة ربطه على المواضيع وتشديد لإصلاح نظام جبل لوحة في المكان.
- انجذاب خواتم قفل على إسقاط نظام الذكور المكشوفة من الغطاء. كرر الخطوات 1.1.2-1.1.4 لكل ثقب في الغطاء.
- لإرفاق الأغطية التي سيتم استخدامها في المفاعلات العمود وزجاجة فقاعة، 1/8 "اللوير الإناث لتجهيزات لاذع إلى 1.5" قطعة من 1/8 "الأنابيب" البلاستيكية معرف ". إرفاق هذه إلى كل من التركيبات اللوير الذكور المعرضة على الغطاء.
- الاتصال صمام الاختيار (الإشارة بعيداً عن الغطاء) إلى نهاية مجاناً من 1/8 "قطعة.
ملاحظة: هذا سيكون بمثابة منفذ العادم مفاعل حيوي. - الاتصال نظام ذكور بارب المناسب للقطعة الثانية من 1/8 "أنابيب إسقاط من الغطاء. انقر فوق الحلبة قفل الدورية في مكانها وربط عامل تصفية هواء 0.2 مم لهذا.
ملاحظة: هذا سيكون بمثابة مدخل الميناء للمفاعل.

رقم 1. التخطيطي وصور لبناء المفاعلات الحيوية. التخطيطي (A) لتشييد مفاعل حيوي أغطية (ب) صور من غطاء مفاعل حيوي المجمعة، وصور (ج) غطاء المجمعة المستخدمة المرطب. علما أن تجهيزات المرطب يجب أن تكون مغلفة في سيليكون مقاوم للمياه لضمان ختم محكم مع الغطاء. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
- تجميع نظام التسليم بالهواء (انظر الشكل 2 ألف و 2 باء التخطيطي وصور).
- إرفاق معاهدة عدم الانتشار الموضوع 1/8 "لتجهيزات لاذع لمداخل ومنافذ في الجزء الخلفي من كل روتاميتير.
ملاحظة: يتم 200 2,500 سم3دور/دقيقة روتاميتيرس لتعديل ضغط الهواء المنبع من المرطب، 100 1,000 سم3دور/دقيقة روتاميتيرس من أجل زجاجة المفاعلات، 50-500 سم3/روتاميتيرس مين للهواء رفع المفاعلات الحيوية، و 5-50 سم3/ روتيميتيرس دقيقة من أجل تنظيم تدفق2 CO. من المستحسن أن جبل روتاميتيرس إلى سطح ثابت (مثل ورقة من البلاستيك) حتى لا تقع خلال العملية. - إيقاف تشغيل مصدر الهواء المضغوط، ثم قم بتوصيل ¼ "معرف الأنابيب البلاستيكية المرنة مصدر الهواء المضغوط مع المشبك خرطوم. التنحي قطر خرطوم إلى 1/8 "الأنابيب" البلاستيكية معرف "مرونة استخدام ¼" الإناث لتركيب لاذع ومن 1/8 "ذكور لتركيب لاذع.
- قم بتوصيل الطرف الحرة 1/8 "معرف الأنابيب إلى المدخل روتاميتير دور/دقيقة 200 2,500 سم3.
ملاحظة: سوف تغذية المآخذ من هذا روتاميتير زجاجة المرطب عبر معرف أنابيب 1/8 ". - توصيل الأنابيب إلى مدخل إلى غطاء التهوية (استخدام اللوير الإناث بارب المناسب لإجراء الاتصال) 1/8 ". قم بتوصيل قطعة ثانية من 1/8 "أنابيب إلى داخل جبل الفريق المناسب.
ملاحظة: سيتم إنهاء هذه القطعة لأسفل في المرطب وفقاعة الهواء عن طريق المياه. - إرفاق 1/8 "اللوير الإناث بارب التجهيزات إلى نهاية كل قطعة من 1/8" معرف الأنابيب وتستخدم هذه القطعة للاتصال بمأخذ المرطب مدخل فخ الخلط.
- بنفس الطريقة التي يعامل بها 1.2.5، الاتصال بالمأخذ المنظم2 CO منفذ ثان في فخ الخلط.
- بناء متعددة استخدام 1/8 "شوكة متعددة المنافذ الأنابيب و 1/8" (انظر الشكل 2 ج) لتغذية الهواء المصارف روتاميتير.
ملاحظة: سيتم استخدام هذه روتاميتيرس لتوريد المفاعلات الحيوية. تجنب بناء روتاميتيرس أكثر من 6 في السلسلة. بدلاً من ذلك، استخدام المصارف الموازية من روتاميتيرس لتوسيع نطاق النظام. التأكد من أن الطلب التدفق الإجمالي لجميع المفاعلات أقل من سم 2,5003دور/دقيقة (أو آخر سوف تكون هناك حاجة إلى روتاميتير أكبر المنبع من المرطب). - قم بتوصيل المخرج (3شارع الميناء) فخ الخلط البنوك روتاميتير المشيدة حديثا باستخدام 1/8 "الأنابيب وفي 1/8" الإناث إلى شوكة اللوير.
- الاتصال طويلة بما فيه الكفاية 1/8 "أنابيب لمنافذ البيع لكل روتاميتير في الضفة روتاميتير الإمداد الجوي للمفاعلات الحيوية. قم بتسمية نهايات الأنابيب، فضلا عن روتاميتيرس في البنك الدولي.
- تطبيق سيليكون الماء حول كافة المنافذ المرطب وخلط الأغطية الملائمة التأكد من أنها الهواء ضيقة.
- إرفاق معاهدة عدم الانتشار الموضوع 1/8 "لتجهيزات لاذع لمداخل ومنافذ في الجزء الخلفي من كل روتاميتير.
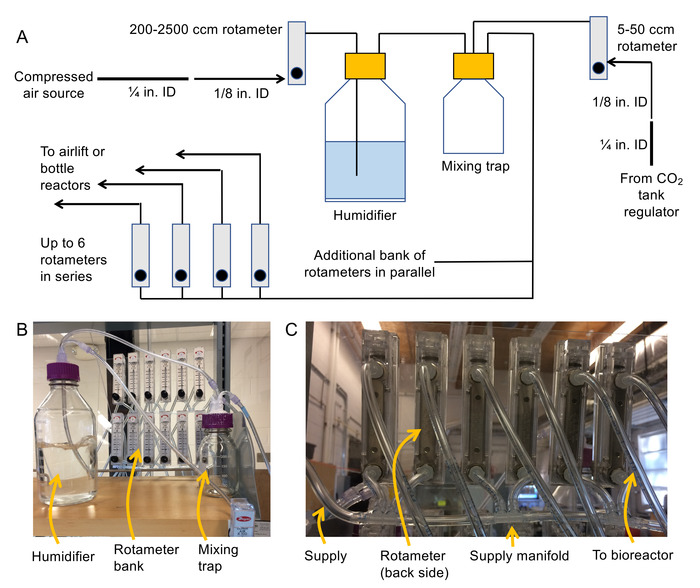
رقم 2. التخطيطي والصور لتجميع نظام العمود الفقاعي. التخطيطي (A) للصورة (ب) نظام التهوية من المرطب، خلط فخ، ومصرف روتاميتير، وصور (ج) من الفتحات تستخدم لربط البنوك روتاميتير معا. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
- إعداد أحواض الأسماك، ويحرك الصفائح، وأضواء (الشكل 3).
تحذير: يتطلب هذا النظام عدد كبير من المنافذ وقدرة الدائرة كافية لدعم كافة المكونات. تجنب التوتير معا العديد من شرائح الطاقة وتمديد الأسلاك بطريقة سلسلة الأقحوان لأن هذا مخاطر كهربائية. استخدام شرائح الطاقة ومنافذ نوع GFI تشجيعا كبيرا بسبب وجود المياه في النظام.- ترتيب النمامون الأضواء المغنطيسية على سطح مستو تكون قوية بما يكفي لإجراء وزن أحواض الأسماك مملوءة بالمياه.
- مكان خشبية أو بلاستيكية كتل صغيرة (التي أطول قليلاً من لوحات ضجة) حول المحيط اللوحات إثارة لدعم وزن الدبابات الأسماك.
تحذير: تجنب وضع الدبابات الأسماك مباشرة على لوحات ضجة حسب الوزن سيتم سحقهم. - ضع الدبابات الأسماك على لوحات إثارة ودعم كتل وملء الخزانات بالماء.
- قص قطعة من ورقة بلاستيكية قاسية لاحتوائه على رأس خزان الأسماك كغطاء. قطع ثقوب في هذا الغطاء الشريحة أنابيب التهجين والخروج. كما قطع حفرة لسخان للدبابات الأسماك.
- ترتيب البنوك الضوء الفلورسنت بجوار خزان الأسماك لتوفير الإضاءة الأفقية للمفاعلات الحيوية. قم بتوصيل البنك الخفيفة جهاز توقيت خفيفة دورة اليوم/الليل.

الشكل 3. النظام التخطيطي للمفاعلات الحيوية زجاجة (يسار) وفقاعة عمود photobioreactors (يمين). وقد تم تعديل هذا الرقم من هيغنز et al. 17- الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
2-إعداد العدوى الطحالب المجهرية
- الحصول على الطحالب المجهرية العدوى من ثقافة الحفاظ على البرد أو مطلي، أو السائل.
ملاحظة: من المستحسن أن يكون مطلي cryopreserved الكائنات قبل استخدام كالعدوى ضمان أن خلايا قابلة للتطبيق، وأن الثقافة الناتجة أكسينيك. متوسط أجار (مثلاً.، 5 # ATCC سبورولاتينج أجار)21 هو متوسط غنى الذي يعمل جيدا لإنعاش الأنواع Chlorella و أوكسينوتشلوريلا من البرد-التخزين. - إعداد ل 2.4 متوسطة المعدنية المناسبة لأنواع معينة من الطحالب المجهرية.
ملاحظة: الأمثلة على N8 المتوسطة23 نوعا من Chlorella، N8-NH4 متوسطة21 نوعا من أوكسينوتشلوريلا. استخدام وسيلة مناسبة لسلالة الطحالب واحد من أهم الخطوات نحو ضمان نمو الطحالب قوية. - إضافة الكوة ل 2.4 متوسطة المعدنية على قدم المساواة إلى ثلاثة قوارير زجاجية 1 لتر، يقلب أشرطة لكل زجاجة وتجميع الأغطية تنفيس (الشكل 1) لكل زجاجة. الاختيار مزدوج هو أنبوب التهوية في الجانب مدخل وكل زجاجة يضم حانة ضجة في ذلك.
- اﻷوتوكﻻف الزجاجات المخزون باستخدام تعقيم سائل دورة (121 درجة مئوية) 30 دقيقة اﻷوتوكﻻف 100 مل من المياه (dH2س)، وبعض أنابيب 1.5 مل في نفس الوقت، الذي سيتم استخدامه في وقت لاحق للطلاء. تسمح على المديين المتوسط وباردة بين عشية وضحاها. وبدلاً من ذلك، تبريد المفاعل إلى درجة حرارة الغرفة وثم تهوية ح 2 قبل التطعيم.
- في السلامة الأحيائية مجلس الوزراء (BSC)، تطعيم الطحالب المجهرية من لوحة أو ثقافة السائل أكسينيك في زجاجات الأسهم. استخدام أسلوب تعقيم للحفاظ على الثقافات أكسينيك في الخطوات التالية.
- إضافة 20 مل من يعقم dH2س إلى أنبوب الطرد مركزي عقيمة 50 مل. استخدم حلقة المتاح 10 ميليلتر عقيمة لاختيار عدة مستعمرات واحدة من اللوحة من الخطوة 2، 1. وتراجع في الحلقة في أنبوب 50 مل ويغسل خلايا الطحالب إلى 20 مل من يعقم dH2يهز O. أنبوب 50 مل جعل حل الطحالب المجهرية متجانسة.
- "الماصة؛" 6 مل من محلول الطحالب المجهرية في كل زجاجة الأسهم مع 10 مل ماصة مصلية عقيمة. دوامة الزجاجة مزيج من الطحالب المجهرية بالتساوي في المتوسط.
- استخدام ماصة مصلية عقيم 2 مل لاستخلاص عينات 1 مل من كل زجاجة الأسهم ونقلها في أنابيب معقمة 1.5 مل.
ملاحظة: لا ينصح ميكروبيبيتيس لهذه الخطوة نظراً لخطر التلوث. تشديد الأغطية تنفيس في زجاجات الأسهم. - ضع الزجاجات الأسهم على لوحات ضجة (~ 150 لفة في الدقيقة) وضبط معدل تدفق الهواء، وأول أكسيد الكربون2، ومستويات الإضاءة حسب الاقتضاء للأنواع. استدارة موضع زجاجة الأسهم كل يوم.
- تمييع 1 مل العينات التي تم الحصول عليها أثناء الخطوة 2.6 (تمييع 100-fold في الماء المعقم وعادة ما يعمل بشكل جيد) ونشر لوحة على متوسط أجار غنية.
ملاحظة: يمكن استخدام هذه اللوحات التحقق من حالات التلوث كذلك بمثابة مصدر للعدوى الطحالب مستقبلا لمواصلة تجارب. - أخذ عينات من الزجاجات (في البحرين) كل يومين للتأكد من أن نمو الطحالب المجهرية.
وضع العينات في ميكروسكوبية 96-جيدا في ثلاث نسخ (200 ميليلتر) وقياس الكثافة البصرية (OD) عند 550 نانومتر و 680 نانومتر كل يومين حتى OD تصل إلى 0.2-0.3 (والتي عادة ما تتطلب 5-7 أيام). - وقف في الحضانة والزجاجات الأسهم على مقاعد البدلاء ح 24-48 للسماح لخلايا الطحالب تسوية بالجاذبية.
ملاحظة: ستستخدم الخلايا استقر القادم لتطعيم photobioreactors عمود الفقاعة. إذا كان المطلوب هو مجموعة خلايا أكثر سرعة، قد فصل الخلايا في أي أكثر من 1,000 ز x لجمع الخلايا.
3-زراعة الطحالب المجهرية في فقاعة العمود Photobioreactors
- مفاعل حيوي التطعيم، قبل يوم من تحضير الوسائط المناسبة ونقل 200 مل (أو المجلد المطلوب) إلى فوتوبيوريكتور عمود فقاعة الأنابيب (أنابيب التهجين). أنابيب اﻷوتوكﻻف مع وسائل الإعلام وأغطية التهوية في المكان.
ملاحظة: إذا كان استخدام المياه المستعملة كوسيلة نمو، اﻷوتوكﻻف إفراغ المفاعلات الحيوية وإضافة العقيمة تصفية المياه المستعملة (إذا كان المطلوب هو الثقافة أكسينيك). - تركز الأسهم الطحالب المجهرية تمت تسويتها عن طريق إزالة المادة طافية باستخدام مضخة فراغ. ترك أقل من 100 مل متوسط في كل زجاجة ولكن تجنب إزالة الطحالب تمت تسويتها.
ملاحظة: هذا الإجراء داخل BSC واتبع أسلوب تعقيم. يمكن تركيب جهاز فراغ بسيط باستخدام أما فراغ قارورة أو زجاجة. يصلح ماصة معقمة مصلية إلى نهاية الأنبوب. - تعليق ونقل الطين الطحالب إلى أنابيب الطرد المركزي العقيمة 50 مل. أجهزة الطرد المركزي في 1,000 س ز لمدة 5 دقائق لزيادة تركيز الطحالب.
- بكالوريوس العلوم، إزالة المادة طافية ما يكفي لتحقيق إجمالي حجم ~ 80 مل من الطحالب ويركز على فوتوبيوريكتيرس 12. تجنب كنس بها بيليه. نقل تركيز الطحالب إلى حاوية معقمة (أو زجاجة الأسهم الطحالب المستخدمة).
- إضافة 6 مل ملاط الطحالب في كل فوتوبيوريكتور مع ماصة معقمة 10 مل مصلية.
- عقيمة عامل تصفية (0.2 مم المحاقن أو فراغ) وإضافة الكميات المناسبة من أي مركبات أخرى (مثل مخزون فيتامين) التي لا يمكن أن يعقم.
- دوامة المفاعلات الحيوية مزيج الطحالب في المتوسط.
- رسم نموذج 2 مل من كل مفاعل حيوي باستخدام ماصة المصلية ونقل إلى أنبوب 2 مل. جمع عينة 2 مل (في BSC) كل 24 ساعة رصد التقدم المحرز في الثقافة. فحص العينة للأس الهيدروجيني باستخدام اختبار شرائط وضبط المفاعل حسب الحاجة باستخدام أما 3 M هيدروكسيد الصوديوم أو 3 M HCl.
- تشديد الأغطية مفاعل حيوي، ووضع جميع المفاعلات الحيوية في حمام مياه خزان الأسماك. ضبط CO2، التهوية والإضاءة إلى المستوى المناسب لهذه الأنواع. استدارة موضع مفاعل حيوي كل يوم بعد أخذ العينات (الخطوة 3، 8).
- تطبيق 200 ميليلتر من كل عينة الثقافة في ثلاث نسخ إلى آبار 96 الميكروسكوبية جيدا. قياس الكثافة البصرية (OD) على 550 نانومتر و 680 نانومتر.
- في اليوم الأخير من فترة الثقافة، قياس القطر الخارجي تحت عوامل تخفيف مختلفة (مثلاً، علامة x 1، 2 x، 4 x، 8 x، 16 x و 32 x) إلى إنشاء علاقة متبادلة بين التطوير التنظيمي والوزن الجاف الفعلية بعد الحصاد (الخطوة 4).
- الطرد المركزي أنبوب عينة 2 مل في 12,000 س ز لمدة 5 دقائق.
- تصفية المادة طافية من خلال 0.2 ميكرون الحقن غير المعقمة التصفية وتخزين المادة طافية (وبيليه إذا لزم الأمر) أي أعلى من-20 درجة مئوية للتخزين على المدى الطويل وتحليلات لاحقة للتغييرات في تكوين وسائط الإعلام.
4-الحصاد وتجميد تجفيف الكتلة الحيوية ميكروالجال
- قياس كمية ثابتة من الطحالب الثقافة من كل مفاعل حيوي مع اسطوانة (مثلاً 160 مل من مفاعل حيوي أن 200 مل الواردة أصلاً في المتوسط)، ونقل في زجاجات للطرد المركزي. شطف الاسطوانة مع dH2س ما بين كل قياس.
- أجهزة الطرد المركزي في 4,696 س ز للحد الأدنى 5 تجاهل المادة طافية بعناية كنس بها.
- نقل الكريات للأنابيب المسماة 50 مل. شطف بزجاجات الطرد المركزي مع dH2س، ونقل المحتويات إلى أنابيب 50 مل. التأكد من حجم أنبوب إجمالي لا يتجاوز 45 مل.
- تغسل الكريات الطحالب مع dH2س لإزالة الأملاح.
- الطرد المركزي أنابيب 50 مل في 4,696 س ز لمدة 5 دقائق وتجاهل المادة طافية.
- إضافة مل 40 درهم2س إلى كل أنبوب 50 مل؛ دوامة المزيج. الطرد المركزي مرة أخرى في 4,696 س ز لمدة 5 دقائق وتجاهل المادة طافية.
- كرر الخطوة 4.4.2 مرة أخرى.
- التسمية ووزنها فارغة 15 مل أنابيب الطرد المركزي على توازن 4-عشري (تسمية كل من غطاء وأنبوب وتزن عليهم معا). وزن أنبوب واحد كل ثقافة الطحالب. تزن كل أنبوبة 15 مل مرتين لتقليل الخطأ.
- بعد يغسل الماضي، تجاهل المادة طافية، وإضافة 7.5 مل من dH2س إلى كل أنبوب 50 مل. دوامة ونقل أنابيب عجائن الطحالب إلى 15 مل قبل موزون. شطف أنابيب 50 مل مع إضافية dH2س ونقل السائل إلى أنابيب 15 مل. تجنب تجاوز 12 مل حجم الإجمالي في أنابيب 15 مل.
- الطرد المركزي أنابيب 15 مل في 4,696 س ز لمدة 5 دقائق وصب المادة طافية. تجميد هذه الأنابيب مع الكريات في-80 درجة مئوية لمدة 30 دقيقة على الأقل استعدادا للتجميد.
- تجميد جاف بين عشية وضحاها أو حتى مجففة.
- زن وسجل أنابيب 15 مل تجميد المجفف مع الطحالب.
5-الدهن الاستخراج باستخدام أسلوب "تعديل فلك"24
- تزن من 20 ملغ المعصوفه الكتلة الحيوية الطحلبية في أنبوب 2 مل ملولبة البوليبروبيلين (الاختيار الصانع تسمية لضمان المنتج مناسب لعمليات الاستخراج حبة).
- إضافة 1.5 مل مذيب فلك (كلوروفورم/الميثانول 2:1) لكل أنبوبة 2 مل (الذي يحتوي على 20 ملغ طحالب المعصوفه). صب ~0.5 مل الزركونيا/السليكا الخرز (0.5 ملم) في كل أنبوبة حتى يصل إلى مستوى السائل في الأنبوب 2 مل.
تنبيه: التعامل مع كلوروفورم والميثانول في غطاء دخان وتجنب الأبخرة في التنفس أو الجلد الاتصال. - مجانسة عينات الطحالب في طاحونة حبة 20 s بسرعة 6.5 m/s. نقل أنابيب الجليد لمدة 30 ثانية لالبرد وعينات. كرر خمس مرات أكثر لاستخراج الدهون تماما.
- تصفية هوموجيناتي عن طريق حقنه 5 مل يحتوي على قرص شبكة أسلاك الفولاذ المقاوم للصدأ (مش #60) إلى سلالة من الخرز، جمع filtrate في أنبوب 15 مل.
- أغسل حبات مع 1.5 مل مذيب فلك، دفع السائل عن طريق المحاقن عند الاقتضاء. كرر هذا يغسل مرتين أخريين وجمع جميع فيلتراتي في الأنبوبة 15 مل، تسفر عن وحدة تخزين نهائي لحوالي 6 مل.
- إضافة 1.2 مل من 0.9% (w/v) محلول كلوريد الصوديوم لاستخراج فولتش في أنبوب 15 مل ودوامه مزيج جيد.
ملاحظة: إذا لزم الأمر، يمكن استخدام المذيبات فلك أكثر لغسل حبات (استخدام 0.2 x حجم غسل الكلي من محلول كلوريد الصوديوم 0.9% للحث على انفصال). - الطرد المركزي أنابيب 15 مل في س 6,000 ز لأدنى 5 سجل حجم المرحلة (الأخضر) كلوروفورم أسفل إلى أقرب 0.1 مليلتر باستخدام خطوط على جانب الأنبوبة 15 مل. نقل المرحلة السفلي لقنينة زجاج (مع الغطاء) استخدام زجاج ماصة باستور.
- تخزين الدهون في-20 درجة مئوية أو (-80 درجة مئوية إذا كانت هناك خطط لاستخدام هذا المقتطف لتحليل الأحماض الدهنية).
6. "مقايسة الدهن" محايدة لاستخدام أسلوب الميكروسكوبية (مقتبس من هيغنز et al. عام 201422)
- إعداد حلول الأسهم. إعداد معيار زيت نباتي 1 مغ/مل 10 مل في كلوروفورم وتخزينها في-20 درجة مئوية.
ملاحظة: قد تستخدم أي زيت نباتي في هذا التحليل لأنها ليست حساسة لأنواع الأحماض الدهنية. إعداد 10 مل من 200 ميكروغرام/مل الحل "الأحمر النيل" في ثنائي ميثيل سلفوكسيد ([دمس]) وتخزينها في الظلام في درجة حرارة الغرفة. - كتلة الميكروسكوبية الجافة قبل الحرارة إلى 55 درجة مئوية في غطاء دخان. في حين أن هذا هو تدفئة، تمييع مقتطفات الدهون والزيوت النباتية القياسية 3-fold مع الميثانول.
ملاحظة: يمكن تغيير هذا التخفيف استناداً إلى محتوى الدهن من الطحالب، ولكن هذا المستوى يعمل بشكل جيد ل معظم Chlorella. - لكل عينة مخففة، إضافة ميليلتر 80 إلى ميكروسكوبية جيدا البوليبروبيلين 96 في البيلوروسية.
تحذير: لا ينصح باستخدام البوليسترين بلاستيكواري للاستخدام مع المذيبات العضوية. - المذيب فارغة، تطبيق ميليلتر 80 من 2:1 الميثانول/كلوروفورم في البيلوروسية. للمعايير، وإضافة 10 و 30، 60، 90 و 120 ميليلتر من الزيت النباتي المخفف القياسية في البيلوروسية.
- مكان الميكروسكوبية في سخان كتلة جافة في 55 درجة مئوية لمدة 20-30 دقيقة حتى يتبخر جميع المذيبات. في حين يتبخر المذيب، يعد العامل "الأحمر النيل" الحل (الحاجة إلى 200 ميليلتر من الحل 1 ميكروغرام/مل كل لوح جيدا). على سبيل مثال، عينات اثنا عشر ومجموعة كاملة من المعايير يتطلب 16 مل من 1.0 ميكروغرام/مل الحل؛ تعد بحل ميليلتر 80 من مجموع 200 ميكروغرام/مل (في [دمس]) إلى 16 مل dH2o.
- إزالة الصفيحة من كتلة التدفئة والسماح لتبرد بدرجة حرارة الغرفة. إضافة 30 ميليلتر من كحول الأيزوبروبيل لكل بئر ومزيج من بيبيتينج صعودا وهبوطاً. ضمان جميع ماصة قنوات يتم خلط الحل وريسوسبيندينج الدهون، مما أسفر عن سائل أخضر متجانسة.
- إضافة 200 ميليلتر من حل "الأحمر النيل" (1 ميكروغرام/مل) لكل منها أيضا، "الماصة؛" أعلى/لأسفل 10 مرات لخلط. احتضان لوحة لمدة 5 دقائق في درجة حرارة الغرفة. بينما كان ينتظر، إعداد حل التبييض 50% بخلط التبييض (6% هيبوكلوريت) مع dH2سين 20 ميليلتر الواحدة وكذلك هناك حاجة. يتم إعداد 3 مل التبييض 50% كافية لعينات 12 ومجموعة كاملة من المعايير.
- إضافة 20 ميليلتر من حل التبييض لكل الميكروسكوبية جيدا و "الماصة؛" صعودا وهبوطاً 5 مرات مزيج جيد. احتضان 30 دقيقة في درجة حرارة الغرفة.
- بعد 30 دقيقة، قراءة الأسفار في العينات كل 5-10 دقيقة في الإثارة/575 نانومتر 530 نانومتر الانبعاثات مع قطع السيارات تعيين إلى 570 نانومتر حتى تستقر الإشارة من عينات الطحالب. عادة ما يكون 60 دقيقة من مجموع حضانة كافية.
- إنشاء منحنى معايرة لمعايير الزيوت النباتية (في النطاق من 0-40 نانوغرام/آبار النفط).
ملاحظة: خطي تناسب تعمل بشكل جيد منخفض (< 30 نانوغرام/بئر) يمكن استخدام تركيزات النفط ومتعدد حدود تناسب إذا تجاوز المستوى 30 نانوغرام/جيدا. استخدم هذا الارتباط لقياس الدهون محايدة في الآبار عينة.
النتائج
هذا الإجراء يعطي دورة وقت بيانات الكثافة البصرية الطحالب في شمال البحر الأبيض المتوسط OD 550 (الشكل 4 أ). الكثافة البصرية والوزن الجاف تركيز البيانات التي يمكن ربطها (الشكل 4 باء). هذا هو إنجاز بأول حساب تركيز الطحالب الوزن الجاف النهائي بعد خط...
Discussion
أهم الاعتبارات عند استزراع الطحالب فهم للاحتياجات المحددة للكائن أو مجموعة الكائنات. الطحالب يمكن استخدام نظام زراعة الموصوفة هنا للثقافة مجموعة واسعة من الطحالب ولكن العوامل اللاأحيائية محددة (درجة الحرارة، ووسائل الإعلام، الأس الهيدروجيني، كثافة الضوء، المستوى2 CO، معدل تهوية) ?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
قدم الدعم لهذه البحوث بوزارة الزراعة المعهد الوطني للأغذية والزراعة هاتش مشروع ALA0HIGGINS ومكاتب جامعة أوبورن قائد الشرطة العسكرية، نائب الرئيس للبحوث، وصموئيل أي Ginn كلية الهندسة. وقدم الدعم أيضا من جبهة الخلاص الوطني منح كبيت-1438211.
Materials
| Name | Company | Catalog Number | Comments |
| Supplies for airlift photobioreactor setup | |||
| 1 L Pyrex bottles | Corning | 16157-191 | For bottle reactors, humidifiers |
| 1/2" hose clamp | Home Depot | UC953A | or equivalent |
| 1/4" female luer to barb | Nordson biomedical | Nordson FTLL360-6005 | 1/4" ID, PP |
| 1/4" ID, 3/8" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-244 | 50' |
| 1/4" in O-rings | Grainger | 1REC5 | #010 Medium Hard Silicone O-Ring, 0.239" I.D., 0.379"O.D. |
| 1/8" Female luer to barb | Nordson biomedical | FTLL230-6005 | |
| 1/8" ID, 1/4" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-608 | 250' |
| 1/8" male spinning luer to barb | Nordson biomedical | MLRL013-6005 | |
| 1/8" multiport barb | Nordson biomedical | 4PLL230-6005 | 1/8" multiport barb |
| 1/8" NPT to barb | Nordson biomedical | 18230-6005 | 1/8" 200 series barb |
| 1/8" panel mount luer | Nordson biomedical | Nordson MLRLB230-6005 | 1/8", PP |
| 10 gallon fish tank | Walmart | 802262 | Can hold up to 8 bioreactors depending on layout |
| 100-1000 ccm flow meter | Dwyer | RMA-13-SSV | For bottle reactors |
| 2 ft fluorescent light bank | Agrobrite | FLT24 T5 | |
| 200-2500 ccm flow meter | Dwyer | RMA-14-SSV | For air regulation upstream of humidifier |
| 250 mL Pyrex bottles | Corning | 16157-136 | For gas mixing after humidifier |
| 50-500 ccm flow meter | Dwyer | RMA-12-SSV | For hybridization tube reactors |
| 5-50 ccm flow meter | Dwyer | RMA-151-SSV | For CO2 flow rate control |
| Air filters 0.2 µm | Whatman/ Fisher | 09-745-1A | Polyvent, 28 mm, 0.2 µm, PTFE, 50 pack |
| Check valves | VWR | 89094-714 | |
| Corning lids for pyrex bottles | VWR | 89000-233 | 10 GL45 lids |
| Female luer endcap | Nordson biomedical | Nordson FTLLP-6005 | Female stable PP |
| Hybridization tubes | Corning | 32645-030 | 35x300 mm, pack of 2 |
| Light timer | Walmart | 556393626 | |
| Locknuts | Nordson biomedical | Nordson LNS-3 | 1/4", red nylon |
| Low profile magnetic stirrer | VWR | 10153-690 | Low profile magnetic stirrer |
| Male luer endcap | Nordson biomedical | Nordson LP4-6005 | Male plug PP |
| Spinning luer lock ring | Nordson biomedical | Nordson FSLLR-6005 | |
| Stir bars - long | VWR | 58949-040 | 38.1 mm, for bottle reactors |
| Stir bars - medium | VWR | 58949-034 | 25 mm, for hyridization tubes |
| Supplies and reagents for culturing algae | |||
| 0.2 µm filters | VWR | 28145-491 | 13 mm, PTFE, for filtering spent media from daily culture sampling |
| 1 mL syringes | Air-tite | 89215-216 | For filtering spent media from daily culture sampling |
| 1.5 mL tubes | VWR | 87003-294 | Sterile (or equivalent) |
| 10 mL Serological pipettes | Greiner Bio-One | 82050-482 | Sterile (or equivalent) |
| 100 mm plates | VWR | 25384-342 | 100x15 mm stackable petri dishes, sterile |
| 15 mL tubes | Greiner Bio-One | 82050-276 | Sterile (or equivalent), polypropylene |
| 2 mL Serological pipette tips | Greiner Bio-One | 82051-584 | Sterile (or equivalent) |
| 2 mL tubes | VWR | 87003-298 | Sterile (or equivalent) |
| 50 mL tubes | Greiner Bio-One | 82050-348 | Sterile (or equivalent), polypropylene |
| 96 well microplate | Greiner Bio-One | 89089-578 | Polystyrene with lid, flat bottom |
| Inocculating loops | VWR | 80094-478 | Sterile (or equivalent) |
| Liquid carbon dioxide tank and regulator | Airgas | CD-50 | |
| Supplies and reagents for lipid extraction and neutral lipid assay | |||
| 2 mL bead tubes | VWR | 10158-556 | Polypropylene tube w/ lid |
| 96 well microplates | Greiner Bio-One | 82050-774 | Polypropylene, flat bottom |
| Bleach | Walmart | 550646751 | Only use regular bleach, not cleaning bleach |
| Chloroform | BDH | BDH1109-4LG | |
| Dimethyl sulfoxide | BDH | BDH1115-1LP | |
| Isopropyl alcohol | BDH | BDH1133-1LP | |
| Methanol | BDH | BDH20864.400 | |
| Nile red | VWR | TCN0659-5G | |
| Pasteur pipette tips | VWR | 14673-010 | |
| Sodium chloride | BDH | BDH9286-500G | |
| Vegetable oil | Walmart | 9276383 | Any vegetable oil should work as long as it is fresh |
| Zirconia/ silica beads (0.5 mm diameter) | Biospec products | 11079105z | |
| Equipment | |||
| Analytical balance | Mettler-Toledo | XS205DU | Capable of at least 4 decimal accuracy |
| Bead homogenizer | Omni | 19-040E | |
| Benchtop micro centrifuge | Thermo | Heraeus Fresco 21 with 24x2 | Including rotor capable of handling 1.5 and 2 mL tubes |
| Dry block heater | VWR | 75838-282 | Including dry block for a microplate |
| Freeze dryer | Labconco | 7670520 | 2.5L freeze drying system |
| Large benchtop centrifuge | Thermo | Heraeus Megafuge 16R Tissue | Including rotors capable of handling 400 mL bottles, 50 mL tubes, and 15 mL tubes |
| Microplate reader | Molecular Devices | SpectraMax M2 | Capable of reading absorbance and fluorescence |
| Vortex mixer | VWR | 10153-838 |
References
- Prandini, J. M., et al. Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgae Scenedesmus spp. Bioresource Technology. , 67-75 (2016).
- Liu, C., et al. Phycoremediation of dairy and winery wastewater using Diplosphaera sp. MM1. Journal of Applied Phycology. 28 (6), 3331-3341 (2016).
- Passero, M., Cragin, B., Coats, E. R., McDonald, A. G., Feris, K. Dairy Wastewaters for Algae Cultivation, Polyhydroxyalkanote Reactor Effluent Versus Anaerobic Digester Effluent. BioEnergy Research. 8 (4), 1647-1660 (2015).
- Hodgskiss, L. H., Nagy, J., Barnhart, E. P., Cunningham, A. B., Fields, M. W. Cultivation of a native alga for biomass and biofuel accumulation in coal bed methane production water. Algal Research. 19, 63-68 (2016).
- Gao, C., et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics. 15, (2014).
- Burch, A. R., Franz, A. K. Combined nitrogen limitation and hydrogen peroxide treatment enhances neutral lipid accumulation in the marine diatom Phaeodactylum tricornutum. Bioresource Technology. 219, 559-565 (2016).
- Brennan, L., Owende, P. Biofuels from microalgae--A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable Sustainable Energy Reviews. 14 (2), 557-577 (2009).
- Branyikova, I., et al. Microalgae - Novel highly efficient starch producers. Biotechnology and Bioengineering. 108 (4), 766-776 (2010).
- Chalima, A., et al. Utilization of Volatile Fatty Acids from Microalgae for the Production of High Added Value Compounds. Fermentation. 3 (4), (2017).
- Harun, R., Singh, M., Forde, G. M., Danquah, M. K. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and Sustainable Energy Reviews. 14 (3), 1037-1047 (2010).
- Liu, L., et al. Development of a new method for genetic transformation of the green alga Chlorella ellipsoidea. Molecular biotechnology. 54 (2), 211-219 (2013).
- Cheng, J., et al. Mutate Chlorella sp. by nuclear irradiation to fix high concentrations of CO2. Bioresource Technology. 136, 496-501 (2013).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Sales, C. M., Au, Comparison of Scale in a Photosynthetic Reactor System for Algal Remediation of Wastewater. Journal of Visualized Experiments. (121), e55256 (2017).
- Higgins, B. T., et al. Cofactor symbiosis for enhanced algal growth, biofuel production, and wastewater treatment. Algal Research. 17, 308-315 (2016).
- Higgins, B., et al. Algal-bacterial synergy in treatment of winery wastewater. Nature Clean Water. 1 (6), (2017).
- Higgins, B. T., et al. Impact of thiamine metabolites and spent medium from Chlorella sorokiniana on metabolism in the green algae Auxenochlorella prototheciodes. Algal Research. 33, 197-208 (2018).
- Lépinay, A., et al. First insight on interactions between bacteria and the marine diatom Haslea ostrearia: Algal growth and metabolomic fingerprinting. Algal Research. 31, 395-405 (2018).
- Franchino, M., Comino, E., Bona, F., Riggio, V. A. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate. Chemosphere. 92 (6), 738-744 (2013).
- Choix, F. J., Lopez-Cisneros, C. G., Mendez-Acosta, H. O. Azospirillum brasilense Increases CO2 Fixation on Microalgae Scenedesmus obliquus, Chlorella vulgaris, and Chlamydomonas reinhardtii Cultured on High CO2 Concentrations. Microbial Ecology. 76 (2), 430-442 (2018).
- Higgins, B., VanderGheynst, J. Effects of Escherichia coli on mixotrophic growth of Chlorella minutissima and production of biofuel precursors. PLoS One. 9 (5), e96807 (2014).
- Higgins, B., Thornton-Dunwoody, A., Labavitch, J. M., VanderGheynst, J. S. Microplate assay for quantitation of neutral lipids in extracts from microalgae. Analytical Biochemistry. 465, 81-89 (2014).
- Tanadul, O. U., Vandergheynst, J. S., Beckles, D. M., Powell, A. L., Labavitch, J. M. The impact of elevated CO2 concentration on the quality of algal starch as a potential biofuel feedstock. Biotechnology and Bioengineering. 111 (7), 1323-1331 (2014).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Higgins, B. T., et al. Informatics for improved algal taxonomic classification and research: A case study of UTEX 2341. Algal Research. 12, 545-549 (2015).
- Garrett, R. H., Grisham, C. M. . Biochemistry. , 578-730 (2012).
- de-Bashan, L. E., Trejo, A., Huss, V. A. R., Hernandez, J. -. P., Bashan, Y. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater. Bioresource Technology. 99 (11), 4980-4989 (2008).
- Wang, Q., Higgins, B., Ji, H., Zhao, D. . Annual International Meeting of the ASABE. , (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved