Method Article
鼠心围细胞的分离与纯化
摘要
我们优化了一个方案,以分离和纯化鼠心脏围细胞,用于基础研究和研究其生物学和治疗潜力。
摘要
众所周知,微血管和毛细血管的血管内细胞在血管生成、血管稳定和内皮屏障完整性方面起着一定的作用。然而,他们在心脏的组织特定功能没有得到很好的理解。此外,目前尚无利用易于获取的材料来分离和纯化心脏源的围成体的协议。我们的协议侧重于使用广泛使用的哺乳动物模型,小鼠,作为我们的细胞来源。利用心脏组织的酶消化和机械解散,我们得到了一种粗细胞混合物,通过荧光激活细胞分拣(FACS)通过大量的标记进一步纯化。由于没有单一明确标记的围细胞,我们门控的细胞是CD31-CD34-CD45-CD140b+NG2+CD146+。纯化后,这些原细胞被培养和多次通过,在形态和标记表达上没有任何变化。利用我们的方案定期获得原生鼠心脏围细胞,我们希望进一步了解围细胞在心血管生理学中的作用及其治疗潜力。
引言
被称为血管细胞的血管细胞环绕着血管1、2的微血管和毛细血管。在生理上,它们已知促进和发挥作用的血管生成,增加屏障完整性,由于其与内皮细胞的密切关系,以及稳定和成熟的血管1,2。此外,这些细胞的功能障碍和/或损失与阿尔茨海默氏病2、3和各种心血管疾病4等疾病有关。这些细胞在整个身体中都被发现,但细胞数量与组织相关。由于血脑屏障1、2的血管化程度高,在大脑中研究的围脑最为显著。然而,在心脏,围细胞的生物学研究不足。
最近,人们对于心脏围质器领域的兴趣增加,但目前尚无简化的协议,可以将其与生物学中最常用的工具之一——小鼠——隔离。文献中有关于从大脑5、视网膜6、胎盘7和骨骼肌8、9分离的食脑体的协议;然而,很少有协议是隔离围卵体从心脏。有几个组具有孤立的心脏围细胞。Nees等人能够从包括小鼠在内的多种物种中分离出大量心脏围细胞;然而,他们的方法使用特定的内部内置设备,降低了可重复性10。Avolio等人11、陈等人12人、贝利等人13日也成功从人的心脏组织中分离出心脏围细胞,但人体组织并非总能获得,一些研究者很难获得。在这里,我们开发了一种分离方法,从小鼠模型获得心脏围细胞,供研究人员用现成的材料进一步研究其生物学。
使用酶消化和荧光活化细胞分拣(FACS)与已知的关键围细胞标记14,我们的协议使我们能够分离和纯化以CD31-CD34-CD45为特征的围细胞群-CD140b=NG2+CD146=.我们的标记面板包含包含和排除标记。CD45用作标记,以排除造血细胞。CD31用作标记,以排除内皮细胞。CD34用作标记,以排除造血细胞和内皮祖细胞。CD146是血管周围细胞的标记物。最后,NG2和CD140b(也称为血小板衍生生长因子受体β+PDGFR®)都是围卵体14的公认标记。获得的主要区域性可以培养和多次传递,在形态或标记表达上没有变化。此外,这些细胞可以与内皮细胞共同培养,以研究它们之间的相互作用和串扰。这种细胞分离方法将使研究者能够从野生型、疾病和基因变异小鼠模型中研究心脏围细胞的生物学和病理生理学。
研究方案
所有动物都被安置在实验室动物护理协会(AAALAC)认可的设施中,并在适当的兽医监督下,在机构动物下进行。护理和使用委员会 (IACUC) 批准的 Amgen Inc. 协议
1. 工具和文化媒体的准备
- 高压灭菌手术 9 厘米直尖细点剪刀和 10 厘米角锯齿状钳子。
- 将 25 mL 的 5% 胎儿牛血清 (FBS) 和 5 mL 的 1% 青霉素链霉素 (P/S) 加入一瓶 500 mL 不含钙的 Dulbeco 的磷酸盐缓冲盐水 (CMF-DPBS)。将溶液放入冰浴中,以确保在使用时会结冰。将 50 mL 加入 50 mL 锥形管中,用于心脏隔离。将250单位/mL的肝素钠溶液加入50 mL等分。这将称为肝化 CMF-DPBS。
- 在 500 mL 瓶装高葡萄糖 Dulbecco 的改性鹰培养基 (DMEM) 中加入 20% FBS (100 mL) 和 1% P/S (5 mL)。这将被称为无酶培养。DMEM 的 20 mL = 20% FBS = 1% P/S,并加入 500 μg/mL 的胶原酶 B。这将被称为酶溶液。在培养箱或水浴中,将无酶培养基和酶溶液在37°C下保持温暖。
2. 动物的制备和心脏组织的采购
- 用31G针注射器注射250单位肝素钠溶液的小鼠。然后等待 10-15 分钟,而鼠标在主笼中保持活动状态。
注:本研究中的代表性数据来自一只4个月大的雄性C57BL/6小鼠。然而,无论应变、年龄、性别、体重等如何,此协议都可以在任何小鼠上使用。 - 用5%的胶然来麻醉小鼠。通过捏反射检查小鼠的麻醉深度。
- 将麻醉小鼠置于上肢位置,并胶带向下放前肢。小心地打开胸腔,用25G蝴蝶针将下行主塔打上。
- 在右中庭打一个刻痕,用可变流量蠕动泵以2mL/min的速度,用至少20 mL的250个单位/mL肝化CMF-DPBS灌满心脏。当PBS从右侧的洗净中出来时,灌注就完成了。
- 切出主塔上的心脏,并将其放入冰冷的 CMF-DPBS 中。
3. 心脏组织的分离
- 将心脏转移到 15 厘米 x 15 厘米培养皿中。使用弹簧剪刀和细点钳子将心脏切成小块(1 毫米/件),并采用足够的酶溶液覆盖这些碎片(10⁄15 mL)。
- 将碎片和溶液转移到50 mL锥形管中,用石蜡塑料薄膜密封,并在37°C下在120rpm的轨道摇床上孵育75分钟。
- 使用酶溶液消化胶原酶后,将液体通过100μm细胞滤网放入新的50 mL管中,但留下足够的溶液,以确保这些液块不会干涸。
- 使用细点钳子,从管子中拿出组织,在显微镜幻灯片上放置几块。然后在两个显微镜幻灯片之间研磨组织以分解组织。用无酶培养剂将幻灯片冲洗到新的 50 mL 锥形管中。
- 重复步骤 3.4,直到所有组织片分离。
- 将步骤 3.3×3.5 中的解决方案组合到一个管中。通过100μm细胞过滤器将产生的悬浮液应变到新的50 mL锥形管中。
- 在220 x g,4°C下离心,5分钟。从以前的溶液中吸出,并在新鲜的无酶培养基中轻轻重新悬浮细胞颗粒。
- 使用细胞计数器对细胞进行计数并检查其可行性。将细胞稀释至1 x 106/mL,具有含有500 mL DPBS和10~25 mL 2~5%牛血清白蛋白(BSA)的冷FACS染色缓冲液。单元格已准备好进行染色和排序。
4. 使用FACS从粗细胞混合物中纯化围细胞
- 为所有对照组和细胞样本准备和标记 5 mL FACS 管。无污染样品的配色细胞(每管1 mL细胞),荧光减1(FMO)对照,等型匹配对照。使用其余单元格进行排序。所有控件和样品可以同时准备和染色。
注意:0.5 x 10 时共 13 mL6细胞/mL用于代表排序从一个心脏。然而,体积取决于研究者从隔离中获得多少细胞,他们使用多少心脏,以及心脏组织的消化情况;每个心脏的大小也是一个变量,可以改变体积。- 使用补偿珠 (材料表) 优化荧光补偿控制.在标有 5 mL FACS 管的实验中为每个氟铬准备一个补偿控制。对于本实验,准备总共 9 个补偿控制 - 2 种未染色的珠子加上标记面板中的 7 种不同的荧光铬,包括 NG2-FITC、CD31-APC、CD140b-PE、CD146-BV605、CD34-BV421、CD45-PE-Cy7 和细胞活力-APC-Cy7 (材料表)。
- 将挤压小瓶中一滴补偿珠(± 50 μL)添加到每个管中。然后向珠子中加入1μL抗体。对标记面板中的每个抗体重复上述步骤。通过脉冲涡旋大力混合。在4°C下孵育30分钟,防止光线照射,但细胞活力珠子除外,这些珠子可在室温下远离光线。
- 接下来,在每个管中加入3 mL的FACS染色缓冲液,并在4°C下以300 x g离心5分钟。吸出溶液,将每个珠子颗粒重新悬浮在400μL的FACS染色缓冲液中。补偿控制已准备就绪,可供使用。保持冰上。
- 使用 FMO 控制来优化由于光谱重叠而导致的背景染色。
- 在 5 mL FACS 管中使用从 4.1 节的 1 mL 的细胞进行 FMO 控制,并在步骤 4.1.1 中描述的标记面板中加入所有抗体,稀释1:100,但不包括一种抗体。例如,通过包括 CD31-APC、CD140b-PE、CD146-BV605、CD34-BV421、CD45-PE-Cy7、细胞活力染料而不是 NG2-AF488 抗体的抗体来制备 NG2-AF488 FMO。通过脉冲涡旋轻轻混合。对每个抗体重复7次对照。在4°C下孵育30分钟,防止光线照射。
- 接下来,在每个管中加入3 mL的FACS染色缓冲液,并在4°C下以300 x g离心5分钟。吸出溶液,在400μL的FACS染色缓冲液中重新悬浮每个细胞颗粒。FMO 控件已准备就绪,可供使用。保持冰上。
- 使用等型匹配控制抗体 (材料表) 进行非特异性染色.
- 通过将等型匹配对照抗体(材料表)添加到从第 4.1 节制备的 1 mL 细胞样本中,在 5 mL FACS 管中各稀释 1:100,制备等型对照。通过脉冲涡旋轻轻混合。在4°C下孵育30分钟,防止光线照射。
- 接下来,在每个管中加入3 mL的FACS染色缓冲液,并在4°C下以300 x g离心5分钟。吸出溶液,在400μL的FACS染色缓冲液中重新悬浮每个细胞颗粒。等型控件已准备就绪,可供使用。保持冰上。
- 通过将抗体鸡尾酒添加到新鲜分离的细胞中,制备要分类的细胞。
- 从第 4.1 节制备细胞样本,在含有抗小鼠 NG2-AF488、CD31-APC、CD140b-PE、CD146-BV605、CD34-BV421、CD45-PE-Cy7 的抗体鸡尾酒中加入,每个抗体稀释1:100稀释细胞,细胞活力染料在1:1,000稀释。轻轻涡旋混合。在4°C下孵育样品30分钟,防止光线照射。
- 染色后,用FACS染色缓冲液在300 x g下离心洗涤细胞,5分钟4°C。吸出溶液,在FACS染色缓冲液中重新悬浮细胞颗粒至0.5 x 106细胞/mL。
- 使用具有 35 μm 滤网顶部的新 FACS 管,将移液器染色细胞样品放在盖子上并进行重力滤芯,以获得单个细胞悬浮液。保持冰上。
- 使用补偿珠 (材料表) 优化荧光补偿控制.在标有 5 mL FACS 管的实验中为每个氟铬准备一个补偿控制。对于本实验,准备总共 9 个补偿控制 - 2 种未染色的珠子加上标记面板中的 7 种不同的荧光铬,包括 NG2-FITC、CD31-APC、CD140b-PE、CD146-BV605、CD34-BV421、CD45-PE-Cy7 和细胞活力-APC-Cy7 (材料表)。
- 使用细胞分拣机净化细胞。
- 运行电池分拣机上的未染色电池以设置电压并校正背景信号(例如,将正向散射的电压设置为 490*560,将侧散射设置为 180*250)。
- 一次运行一个单色补偿珠样本,以调整每个通道的电压,并调整正极信号的栅极。收集数据。使用该软件通过计算补偿矩阵来计算光谱重叠。所有电压都准备就绪。
- 一次运行一个等型控件,此数据可用于调整门,以进行非特定绑定(如果有)。
- 一次运行每个 FMO 样本,并调整每个通道的电压,以校正由于多色面板而导致的光谱出血。
- 在细胞分拣机中运行染色细胞样本,在10mL无酶培养基(DMEM = 20%FBS = 1%P/S)中收集细胞。使用以下门控策略:单细胞门、活细胞门、CD45负细胞门、CD34和CD31负细胞门、NG2正细胞门、CD146和CD140b阳性细胞门。
5. 佩里特斯的栽培
- 用 0.2% 明胶涂覆 24 孔板 5 分钟,并吸出明胶溶液。种子新鲜获得的细胞从步骤4.2.5在DMEM + 20%FBS + 1%P/S高达2 x 104细胞/厘米2 。细胞培养箱中的培养细胞设定在37°C、5%CO2和95%O 2。
- 过天环
- 一旦细胞是95%的汇入,用温暖的1x DPBS洗涤细胞,并在室温下将200μL 0.1%胰蛋白酶的细胞提升3-5分钟。
- 轻轻敲击板以松开细胞。
- 用3.5倍的培养培养素(700μL DMEM = 20%FBS = 1%P/S)和种子通道两个(P2)细胞,在2 x 104细胞/cm2的未涂布6孔板上中和胰蛋白酶。
- 每口孔在汇合时,都可以移动到单个T-75烧瓶中作为P3细胞,然后可以以1:6的比例分裂。
6. 佩里杨的特性
-
流式细胞测定分析
- 使用与第 4 节前面所述相同的 FACS 染色协议和浇注策略。
- 在流量细胞仪上运行控制和染色样品。使用分析软件(材料表)收集数据和分析数据。
- 要收集亮场图像,在细胞培养箱中以37°C、5%CO2和95%O 2的烧瓶中生长细胞。在细胞附着到表面后,在显微镜上捕捉图像。
-
免疫细胞化学
- 在96孔板中生长细胞,直到90%汇入。用温1x DPBS清洗细胞,在室温下用4%的甲醛固定30分钟。
- 用1x DPBS清洗细胞3倍,在室温下用0.1%洗涤剂渗透10分钟。
- 在室温下,用阻塞缓冲液孵育细胞1小时。阻断后,加入原抗体(每井一个抗体)稀释1:100在阻断缓冲液中,并在4°C孵育过夜。主要抗体有:抗NG2、抗CD140b、抗CD31、抗维明、抗脱敏、抗α平滑肌活动。
- 第二天,用洗涤缓冲液清洗细胞3倍(材料表)。在阻断缓冲液中加入稀释1:1,000的二级抗体,在黑暗中室温下孵育2小时。二级抗体是一种与FITC结合的抗兔子抗体。
- 用洗涤缓冲液清洗细胞3倍。在室温下以1:1,000稀释300μM核污渍5分钟。
- 用 1x DPBS 清洗细胞 3 倍,并安装带安装介质。
- 带共聚焦显微镜的图像细胞。
结果
在整颗心脏的酶消化和分离后,在FACS细胞纯化之前,细胞是一种粗糙的混合物,含有来自心脏的许多不同的细胞类型(图1A)。经过FACS纯化和培养,细胞是同质的。它们是单核的,相当平坦,并且具有典型的围质菱形形态(图1B)。
使用FACS,细胞被纯化为均质。未染色的对照单元样本用于显示浇注策略 (图 2)。首先,碎片和双发块根据正向和侧面散射分布进行封闭。然后,死细胞被封闭,因为他们的胺反应与染料,产生一个信号更大,更强烈比活细胞。在活细胞中,造血细胞被CD45+封闭。为了进一步去除造血细胞和内皮细胞,CD34+和CD31+细胞被封闭。最后,NG2+和 CD140b+/CD146+细胞被选定为具有典型围细胞标记表达的血管内细胞(图3)。标记面板也测试了小鼠冠状内皮细胞作为对照(补充图1)。分类后,只有大约1%的粗细胞混合物由围细胞组成。
为了验证细胞是否确实是围细胞,我们通过细胞进行进一步表征。细胞在T-75烧瓶中达到P3后迅速生长,随着年龄的增长,其生存能力没有变化(补充图2)。与人脑围变体相比,细胞的形态相似(图4A)。与小鼠和人类平滑肌细胞相比,细胞的形态不同(图4A)。免疫染色时P7的形态或标记表达也没有观察到变化,在通过后通过流细胞学分析(图4B,C)。
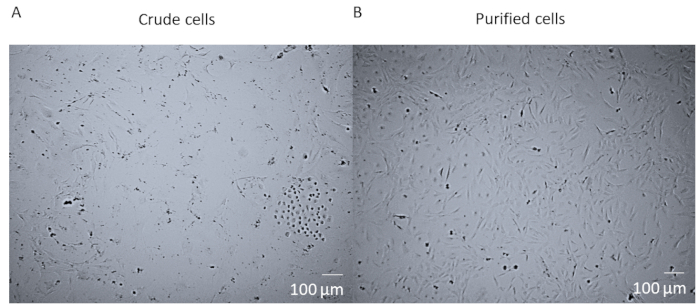
图 1:粗细胞与纯化细胞。(A) 在T25烧瓶中培养了14天的粗细胞混合物后全心酶消化和解散的明亮场图像。(B) 心脏围盘的同质种群在14天后分拣和培养的明亮场图像。比例尺 = 100 μm。请点击此处查看此图的较大版本。
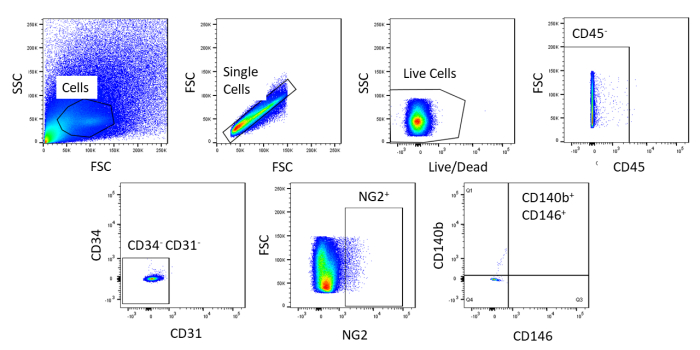
图 2:FACS未染色细胞分析的代表性图像。用于纯化粗细胞混合物的浇注策略的原理表示。门的细胞是单,活,CD45-, CD31-, CD34-, NG2+,CD146+, 和 CD140b=.请点击此处查看此图的较大版本。
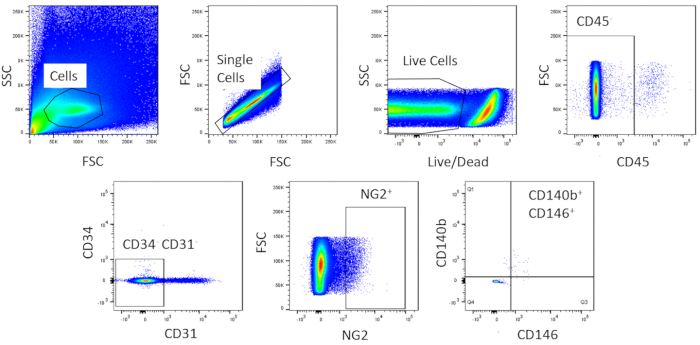
图 3:FACS分析粗细胞的代表性图像。用于获得心脏围盘的同质总体的分拣的原理表示。大约 1% 的粗电池是 CD31-CD34-CD45-CD140b+NG2+CD146+.请点击此处查看此图的较大版本。
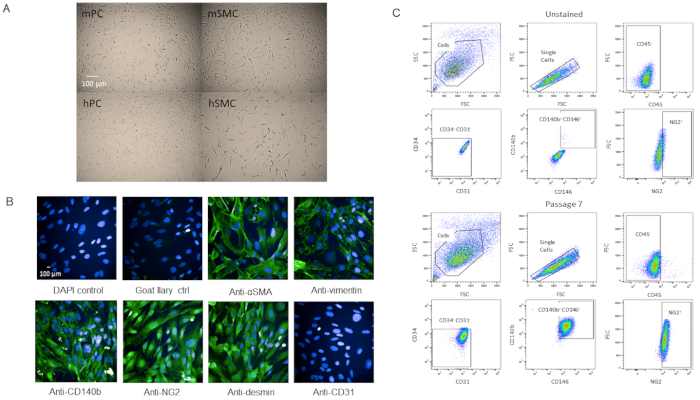
图 4: 原发性孤立心脏围细胞的特征(A) 来自人脑 (hPC) 和小鼠心脏 (mPC) 的培养细胞的明亮场图像显示类似的坐体细胞形态,但形态与人类平滑肌细胞 hSMC 和小鼠平滑肌细胞 (mSMC) 不同。刻度条 = 100 μm . (B) 通过免疫细胞化学对P7的细胞进行表征表表征。比例尺 = 100 μm. (C) 在 P7 处通过流式细胞分析,其中对负标记 CD31、CD34、CD45 和正标记 NG2、CD140b 和 CD146 进行封闭。人口仍然是同质的。请点击此处查看此图的较大版本。
补充图1:使用标记面板对内皮细胞的流细胞测定分析的代表性图像。小鼠冠状内皮细胞系用于控制标记物的结合特异性。使用与在排序中使用的相同浇注策略,但 CD31 的正门除外,而不是负门,CD45、CD34、NG2、CD140b 和 CD146 的内皮细胞为负,但 CD31 的正数如预期。请点击此处下载此图。
补充图2:mPC不同通道的流式细胞测定分析的代表性图像。主要孤立的心脏围细胞被培养,并通过到通道12。细胞被染色碘化,并在流动细胞仪上进行分析。控制群是死细胞和活细胞的混合物。通道之间的活细胞数量没有显著差异。请点击此处下载此图。
讨论
由于对心脏围质的研究相对较新,围细胞在心血管生理学和病理生理学中的作用尚未确定。在其他器官中,它们已被证明在血管平衡和灌注1,2中起着关键作用。与大脑等其他器官的围卵体文献相比,关于心脏围细胞的出版物明显减少。心脏围细胞的分离对于理解其功能特征和信号机制至关重要。因此,该协议将为研究者提供一种更容易的方式从更容易获得的组织来源访问心脏围细胞,并促进对其生物学的研究。它将有助于回答有关心脏围质如何促进心脏平衡和病理生理学的问题,以及研究其治疗潜力。
从鼠心中分离出来的围群,以CD31-CD34-CD45-CD140b + NG2+CD146+为特征,已经通过多次(最多到P12,并且仍然很强),这不生存能力下降并迅速传播(补充图2)。细胞也被冷冻和恢复,至少95%的生存能力。然而,我们更喜欢使用细胞P7或更年轻的实验。比较我们围细胞与人脑围细胞的明亮场图像,两个细胞系具有可比较的细胞形态(图4A),而它们与平滑肌细胞的形态不同(图4A)。我们的P7细胞的特点是免疫细胞化学的围细胞标记,一些从我们的FACS面板(NG2和CD140b),和几个不在面板(维明,德明,βSMA),我们发现细胞表达的围细胞标记同质(图4B)。此外,我们的P7细胞再次通过流细胞学分析,使用相同的标记面板,以评估由于传递引起的标记表达的变化,我们发现没有变化(图4C)。因此,无论是表型的,还是形态上的,我们的细胞都是围细胞。
Nees等人10、Avolio等人11、陈等人12人、贝利等人13人的研究表明,心脏围痕分离是成功的。然而,Nees等人10号使用内部定制设备将围网体从微容器中分离出来,涉及两个腔室,泵通过网状网堆来回注入蛋白酶溶液,这很难复制。未提供仪器的示意图和/或设备的图片及其构建方式。虽然Nees等人10成功地从许多物种中分离出心脏围细胞,但我们始终无法复制它们的方法。我们协议中的围杨分离步骤只是使用轨道振动器(分离所有细胞),在大多数(如果不是所有实验室)中,大多数实验室都可以使用,在锥形管中使用组织和酶溶液,然后是机械分离步骤。无需自定义设备。第二,其余的协议涉及人体组织的使用,因此,人体组织的采购仅限于研究者。我们的协议是修改和优化当前协议9,12使用小鼠模型(野生类型,转基因,疾病)和材料,随时可供所有研究者使用。
由于围脑细胞一般是敏感的,细胞的生存能力对于获得良好的产量至关重要。在心脏组织和细胞染色的采购过程中,组织/细胞需要保持冰冷。其次,组织的酶消化可能需要单独优化。根据酶小瓶的活动单位,浓度和消化时间可能需要优化。确保酶溶液每次都新鲜,否则产量会减少。第三,粗混合物含有大量的细胞,有些已经死亡和/或死亡,最好将染色缓冲液中的FBS浓度从5%降至2%。如果您在分类过程中遇到细胞堵塞喷嘴的问题,则首先使用死细胞去除试剂盒来丰富细胞。您还可以将 EDTA/HEPES 缓冲液或 DNase 治疗添加到细胞预排序中,以防止细胞聚集。最后,由于我们的抗体面板相当大,并且使用许多荧光团,请确保您的FMO控制和补偿控制正确完成。
这种方法的一个限制是每个心脏可以获得的心脏围细胞的数量。在我们的例子中,我们一个小鼠心脏的粗混合物中只有1.1%是围细胞,这和人类心脏分离的百分比相当,但由于小鼠提供的心脏组织量,细胞数量明显减少。由于 FACS 之后的细胞起始数量如此之低,因此最好同时从多个心脏分离。然而,问题在于你需要在一天内整理的细胞数量。如果你有超过3000万个细胞,将很难在不影响细胞生存能力的情况下通过排序。如果调查员有多个细胞分拣机,那么在一天内从多个心脏中分离是可以做到的。另一个限制是,因为我们不知道心脏中是否有围细胞的亚群,比如有骨骼肌15,16,我们不知道我们是否正在消除我们门控策略中的亚型。我们正在描述我们的心脏围形体,到目前为止,在我们的未发表的数据中,它们在功能上与文献中的其他围冰体一样。
我们的协议将使研究人员能够回答有关心脏坐周特性、特性、功能和其他方面的问题,这将有助于确定他们对心脏平衡和流体动力学的贡献。一旦这些细胞的生物学功能得到更好的理解,它们就可能对心血管疾病有治疗作用。
披露声明
作者没有什么可透露的。
致谢
作者要感谢 Amgen 流式细胞学核心在荧光素面板设计、故障排除和细胞分选方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-053-Cl | dilute with 1x DPBS to get 0.1% |
| 100 μM Cell strainer | FisherSci | 22363549 | |
| 15 mL Falcon conical tubes | BD | 352096 | |
| 24-well plate | Corning | CLS3527 | |
| 25 gauge butterfly needle | FisherSci | 22-253-146 | |
| 31 gauge needle syringe | FisherSci | B328446 | |
| 50 mL Falcon conical tubes | BD | 352098 | |
| 6-well plate | Corning | CLS3516 | |
| anti-alpha smooth muscle actin rabbit mAb | abcam | ab32575 | Antibody used in ICC 1:100 dilution |
| anti-CD140b rabbit mAb | Cell Signaling | 28E1 | Antibody used in ICC 1:100 dilution |
| anti-CD31 rabbit pAb | abcam | ab28364 | Antibody used in ICC 1:100 dilution |
| anti-desmin rabbit pAb | abcam | ab8592 | Antibody used in ICC 1:100 dilution |
| anti-NG2 conjugated to AF488 | Millipore | MAB5384A4 | Antibody used in ICC 1:100 dilution |
| anti-vimentin rabbit mAb | abcam | ab92547 | Antibody used in ICC 1:100 dilution |
| ArC Amine Reactive Compensation bead kit | Invitrogen | A10346 | compensation beads for Live/Dead Near IR dye |
| Brightfield Microscope | camera attached | ||
| CD140b-PE (clone APB5) | eBioscience | 12-1402-81 | Antibody used in FACS 1:100 dilution |
| CD146-BV605 (clone ME-9F1) | BD | 740434 | Antibody used in FACS 1:100 dilution |
| CD31-APC (clone MEC 13.3) | BD | 551262 | Antibody used in FACS 1:100 dilution |
| CD34-BV421 (clone RAM 34) | BD | 56268 | Antibody used in FACS 1:100 dilution |
| CD45-PE-Cy7 (clone 30-F11) | BD | 552848 | Antibody used in FACS 1:100 dilution |
| Centrifuge | eppendorf | ||
| Collagenase B | Roche | 11088815001 | 0.226 U/mg lyo. |
| Confocal Microscope | |||
| DAPI | ThermoFisher | D1306 | nuclear stain |
| DMEM with 4.5 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-013-CV | 500 mL |
| Dowell scissors | FST | 15040-11 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Corning | 21-030-CV | 500 mL |
| Dulbecco's Phosphate-Buffered Saline without Ca and Mg (CMF-DPBS) | Corning | 21-031-CV | 500 mL |
| Dumont #5 Fine Forceps | FST | 11254-20 | |
| FACSAria cell sorter | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| FACSAria software | BD | ||
| Falcon tube round-bottom polypropylene, 5 mL | BD | 38057 | |
| Falcon tube with cell strainer cap, 5 mL | BD | 08-771-23 | |
| Fetal Bovine Serum | Corning | 35-015-CV | 500 mL |
| Fine scissors | FST | 14060-09 | |
| FlowJo software | FlowJo LLC | ||
| Fortessa LSR flow cytometer | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| Gelatin-based coating | Cell Biologics | 6950 | |
| Goat anti-rabbit IgG (H+L) Cross-Absorbed Secondary antibody, Alexa Fluor 488 | Invitrogen | A-11008 | Antibody used in ICC 1:1000 dilution |
| Graefe Forceps | FST | 11049-10 | |
| Heparin sodium solution | Hospira | NDC 0409-2720-02 | 10,000 USP units/10 mL; from porcine intestines |
| Incubator | set at 37 °C, 5% CO2, 95% O2 | ||
| Live/Dead-Near IR | Life Technologies | L10119 | |
| Microscope slides | FisherSci | 12-550-343 | |
| NG2-FITC | Millipore | AB5320A4 | Antibody used in FACS 1:100 dilution |
| Oribital shaker | VWR | Inside 37 °C incubator or room | |
| Paraformaldehyde | FisherSci | 50-980-487 | dilute with 1x DPBS to get 4% |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Petri dish | FisherSci | FB0875714 | |
| Pipette and tips | |||
| ProLong Diamond | ThermoFisher | P36965 | mounting media |
| Propidum Iodide | ThermoFisher | cell viability dye for supplemental figure 2 | |
| Rabbit IgG FITC | eBiosciences | 11-4614-80 | Isotype control antibody - FITC |
| Rat IgG2a APC | Biolegend | 400512 | Isotype control antibody - APC |
| Rat IgG2a BV421 | Biolegend | 400536 | Isotype control antibody - BV421 |
| Rat IgG2a BV605 | BD | 563144 | Isotype control antibody - BV605 |
| Rat IgG2a PE | Biolegend | 400308 | Isotype control antibody - PE |
| Rat IgG2b PE-Cy7 | Biolegend | 400617 | Isotype control antibody - PE-Cy7 |
| SuperBlock | ThermoFisher | 37515 | blocking buffer |
| T75 | ThermoFisher | 156499 | |
| Triton X-100 | Sigma | X100 | detergent, dilute with x DPBS to get 0.1% |
| UltraComp beads | Invitrogen | 01-2222-42 | compensation beads |
| Variable-Flow Peristaltic Pump | FisherSci | 13-876-1 | |
| ViCell Cell counter | Beckman | ||
| Wash buffer | 1:10 dilution of Superblock in 1x DPBS |
参考文献
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Sengillo, J. D., et al. Deficiency in mural vascular cells coincides with blood-brain barrier disruption in Alzheimer's disease. Brain Pathology. 23 (3), 303-310 (2013).
- Avolio, E., Madeddu, P. Discovering cardiac pericyte biology: From physiopathological mechanisms to potential therapeutic applications in ischemic heart disease. Vascular Pharmacology. 86, 53-63 (2016).
- Dore-Duffy, P. Isolation and characterization of cerebral microvascular pericytes. Methods in Molecular Medicine. 89, 375-382 (2003).
- Bryan, B. A., D'Amore, P. A. Pericyte isolation and use in endothelial/pericyte coculture models. Methods in Enzymology. 443, 315-331 (2008).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant outgrowth, propagation and characterization of human pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Crisan, M., Corselli, M., Chen, W. C., Peault, B. Perivascular cells for regenerative medicine. Journal of Cellular Molecular Medicine. 16 (12), 2851-2860 (2012).
- Crisan, M., et al. Purification and long-term culture of multipotent progenitor cells affiliated with the walls of human blood vessels: myoendothelial cells and pericytes. Methods in Cellular Biology. 86, 295-309 (2008).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology Heart Circulatory Physiology. 302 (1), H69-H84 (2012).
- Avolio, E., et al. Expansion and characterization of neonatal cardiac pericytes provides a novel cellular option for tissue engineering in congenital heart disease. Journal of the American Heart Association. 4 (6), e002043 (2015).
- Chen, W. C., et al. Human myocardial pericytes: multipotent mesodermal precursors exhibiting cardiac specificity. Stem Cells. 33 (2), 557-573 (2015).
- Baily, J. E., et al. Isolation of Perivascular Multipotent Precursor Cell Populations from Human Cardiac Tissue. Journal of Visualized Experiments. (116), e54252 (2016).
- Murray, I. R., et al. Skeletal and cardiac muscle pericytes: Functions and therapeutic potential. Pharmacology & Therapeutics. 171, 65-74 (2017).
- Birbrair, A., et al. Role of pericytes in skeletal muscle regeneration and fat accumulation. Stem Cells Development. 22 (16), 2298-2314 (2013).
- Birbrair, A., et al. Skeletal muscle pericyte subtypes differ in their differentiation potential. Stem Cell Research. 10 (1), 67-84 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。