Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung von Zellextrakten durch Cryogrinding in einer automatisierten Gefriermühle
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir beschreiben eine zuverlässige Methode zur Herstellung von ganzen Zellextrakten aus Hefe oder anderen Zellen mit hilfe einer kryogenen Gefriermühle, die den Abbau und die Denaturierung von Proteinen minimiert. Die Zellextrakte eignen sich zur Reinigung funktioneller Proteinkomplexe, proteomischer Analysen, Co-Immunpräzipitationsstudien und zum Nachweis von labilen Proteinmodifikationen.
Zusammenfassung
Die Leichtigkeit der genetischen Manipulation und die starke evolutionäre Konservierung der eukaryotischen Zellmaschinerie in der angehenden Hefe Saccharomyces cerevisiae hat es zu einem herausragenden genetischen Modellorganismus gemacht. Da jedoch die effiziente Proteinisolierung von einer optimalen Störung der Zellen abhängt, wird die Verwendung von Hefe für die biochemische Analyse zellulärer Proteine durch ihre Zellwand behindert, die teuer zu verdauen ist (mit Lyticase oder Zymolyase), und schwer mechanisch zu stören ist (mit einem traditionellen Perlenschlag, einer französischen Presse oder einem Kaffeeschleifer), ohne eine Erwärmung von Proben zu verursachen, was wiederum zu Proteindenaturierung und Degradation führt. Obwohl das manuelle Schleifen von Hefezellen unter flüssigem Stickstoff (LN2) mit einem Mörtel und Stößel eine Überhitzung von Proben vermeidet, ist es arbeitsintensiv und unterliegt einer Variabilität der Zelllyse zwischen den Bedienern. Seit vielen Jahren bereiten wir erfolgreich hochwertige Hefeextrakte mit Kryoschleifen von Zellen in einer automatisierten Gefriermühle vor. Die mit LN2 erreichte Temperatur von -196 °C schützt das biologische Material vor dem Abbau durch Proteasen und Nukleasen und ermöglicht das Abrufen intakter Proteine, Nukleinsäuren und anderer Makromoleküle. Hier beschreiben wir diese Technik im Detail für aufkeimende Hefezellen, bei der zunächst eine Suspension von Zellen in einem Lysepuffer durch ihre tropfenweise Zugabe zu LN2 eingefroren wird, um gefrorene Zelltröpfchen zu erzeugen, die als "Popcorn" bekannt sind. Dieses Popcorn wird dann unter LN2 in einer Gefriermühle pulverisiert, um einen gefrorenen "pulverisierten" Extrakt zu erzeugen, der langsam aufgetaut und durch Zentrifugation geklärt wird, um unlösliche Ablagerungen zu entfernen. Die resultierenden Extrakte sind bereit für nachgelagerte Anwendungen wie Protein- oder Nukleinsäurereinigung, proteomische Analysen oder Co-Immunpräzipationsstudien. Diese Technik ist weit verbreitet für die Zellextraktvorbereitung aus einer Vielzahl von Mikroorganismen, pflanzlichen und tierischen Geweben, marinen Proben einschließlich Korallen, sowie die Isolierung von DNA/RNA aus forensischen und Permafrostfossilien.
Einleitung
Hefe ist ein beliebter Modellorganismus für Proteinstudien, da es sich um einen einfachen eukaryotischen Organismus mit einer Fülle von genetischen und biochemischen Werkzeugen für Forscher1. Aufgrund ihrer stabilen Zellwand besteht eine Herausforderung, vor der Forscher stehen, darin, die Zellen effizient zu lysieren, ohne den Zellinhalt zu beschädigen. Verschiedene Methoden sind verfügbar für die Gewinnung von Proteinextrakten durch Störung von Hefezellen, die enzymatische Lyse (Zymolyse)2,3, chemische Lyse4, physikalische Lyse durch Frosttau5, druckbasiert (französische Presse)6, 7, mechanisch (Glasperlen, Kaffeemühle)8,9, beschallungsbasiert10 und kryogen2,11. Die Effizienz der Zelllyse und die Proteinausbeute können je nach eingesetzter Technik erheblich variieren, was das Endergebnis oder die Eignung für die gewünschte nachgeschaltete Anwendung für das Lysat beeinflusst. Bei der Untersuchung von Proteinen, die instabil sind, flüchtige posttranslationale Modifikationen aufweisen oder temperaturempfindlich sind, ist es besonders wichtig, eine Methode zu verwenden, die den Probenverlust oder -abbau während der Vorbereitung minimiert.
| Extraktvorbereitungstechnik | Details | Vorteile | Nachteile | Downstream-Analyse | Verweis |
| Französische Presse: Hochdruckhomogenisator (auch Mikrofluidisator genannt) mit enzymatischer Vorbehandlung mit Zymolyase | Zymolyase-20T, ein Mikrofluidizer Hochdruckhomogenisator. Der Disruptor besteht aus einer luftbetriebenen Hochdruckpumpe (Verhältnis 1:250; erforderlicher Luftdruck 0,6-l MPa) und einer speziellen Störkammer mit einer zusätzlichen Gegendruckeinheit. Für die Verarbeitung ist eine Mindestprobengröße von 20 ml erforderlich. | Die endgültige Gesamtstörung, die mit dem kombinierten Protokoll erzielt wurde, näherte sich 100 % mit 4 Durchgängen bei einem Druck von 95 MPa, verglichen mit nur 32 % Störung mit 4 Durchgängen bei 95 MPa, wobei nur die Homogenisierung ohne zymolyase verwendet wurde. | Nicht geeignet für kleine Anwendungen. Die Enzyme können für großflächige Präparate teuer werden. | Proteinreinigung | 6 |
| Perlenschläger: Zymolyase behandelte Zellen mit Glasperlen in einem Fastprep-Instrument lysiert | Ungefähr ein gleiches Volumen kalter, trockener, säuregewaschener 0,5 mm Glasperlen wird einem gegebenen Volumen von Zellpellets im Lysepuffer zugesetzt und die Zellen werden durch kräftige manuelle Rührung gestört. | Es ist besonders nützlich, wenn Extrakte aus vielen verschiedenen kleinen Hefekulturen für Assaying-Zwecke statt für die Proteinreinigung zu machen. | Während des Glasperlenverfahrens werden Proteine hart behandelt und verursachen umfangreiches Schaumbildung, was zu einer Proteindenaturierung führt. Die Menge des Zellbruchs variiert, während proteolyse sowie Modifikation der Proteine durch Erwärmung des Extrakts über 4°C während des mechanischen Bruchs entstehen können. | Meistens DNA-RNA-Analysen, aber auch Proteinanalysen durch Denaturierung der Gelelektropheorese, entweder mit oder ohne Western-Blotting. | 8 |
| Zymolyase-Behandlung mit anschließender Lyse mit einer Kombination aus osmotischem Schock und Dounce-Homogenisierung | Nach der enzymatischen Verdauung der Zellwände werden Spheroplaste mit 15 bis 20 Strichen eines eng anliegenden Stößeles (Clearance 1 bis 3 m) in einem Dounce Homogenisator lysiert. | Vorteilhaft für die Verwendung von Protease-mangelhaften Stämmen wie BJ926 oder EJ101. Dies ist der sanfteste Weg, Hefezellen zu brechen und eignet sich daher am besten für die Herstellung von Extrakten, die komplexe enzymatische Funktionen (z.B. Translation, Transkription, DNA-Replikation) ausführen können und in denen die Integrität makromolekularer Strukturen (z.B. Ribosomen, Spleißsomen) aufrechterhalten werden muss. Es ist auch nützlich für die Isolierung intakter Kerne, die für Chromatinstudien (Bloom and Carbon, 1982) oder für Kernproteinextrakte (Lue und Kornberg, 1987) verwendet werden können. | Die Hauptnachteile des Spheroplastlyseverfahrens sind, dass es relativ mühsam und teuer ist, insbesondere bei großflächigen Präparaten (>10 Liter), und die langen Inkubationszeiten können zu Proteolyse oder Proteinmodifikation führen. Bei Chromatinpräparaten scheinen sie eine unterschiedliche oder niedrigere Qualität zu haben als die durch die Differentialzentrifugation erzeugten (basierend auf der Integrität der Nukleosomenleiter). | Isolieren intakter Kerne für Chromatinstudien, Extrakte, die komplexe enzymatische Funktionen ausführen können, Extrakte, die die Integrität makromolekulare Strukturen, Kernproteinextrakte. | 2 |
| Zellstörung von Blitz-Gefrierzellen durch Schleifen in Flüssigstickstoff mit einem Mörtel/Pestle oder einem Mixer | Die Zellen werden sofort in flüssigem Stickstoff eingefroren und dann durch manuelles Schleifen in einem Mörtel mit einem Stößel oder mit einem Waring-Mixer in Gegenwart von flüssigem Stickstoff lysiert. | Das Protokoll ist schnell und einfach. Es kann unterschiedliche Mengen an Hefezellen einschließlich sehr großer Kulturen aufnehmen. Sein Hauptvorteil besteht darin, dass Zellen sofort aus dem aktiv wachsenden Zustand in flüssigen Stickstoff (ca. 196 °C) entnommen werden, wodurch abbauende Enzymaktivitäten wie Proteasen und Nukleasen sowie Aktivitäten, die Proteine modifizieren (z. B. Phosphatasen und Kiinasen), abnehmen. Es eignet sich besonders für die Herstellung von Vollzellextrakten aus einer einzigen Hefekultur zur großflächigen Proteinreinigung. | Ein bisschen chaotisch und potenziell gefährlich für den sorglosen Ermittler. Kleine Proben (d. h. 10- bis 100-ml-Hefekulturen) sind nicht leicht zu verarbeiten, da es nicht genügend Masse an gefrorenen Zellklumpen gibt, um effektiv im Mixer zu brechen. Es ist zeitaufwändig, einzelne Proben zu verarbeiten und die Geräte zwischen den Einsatzmöglichkeiten zu reinigen. | Vollzellextrakte aus einer einzigen Hefekultur zur großflächigen Proteinreinigung. | 2 |
| Autolyse, Perlenmühle | pH 5,0, 50 °C, 24 h, 200 Umdrehungen pro Minute / x 0,5 mm, 5 × 3 min/3 min | Schnelle und effiziente Lyse, insbesondere für die kleine Extraktzubereitung | Wärmeerzeugung führt zur Denaturierung und Degradation von Makromolekülen. Perlenschlagen Ausrüstung erforderlich. | Kleine Analysen. | 10 |
| Autolyse, Beschallung | pH 5.0, 50 °C, 24 h, 200 Rpm, 4 × 5 min/2 min, Pulser 80%, Leistung 80% | Beschallungsgeräte sind in der Regel in den meisten Institutionen verfügbar. | Wärmeerzeugung führt zur Denaturierung und Degradation von Makromolekülen. Beschallungsausrüstung erforderlich. Die langsame Lyse kann mehr als 24 Stunden dauern. | Hefe-Zell-Wand-Präparate. | |
| Siede- und Gefrier-Tau-Prozess | Außer einem Standard-Gefrierschrank und einem Heizblock oder Warmwasserbad sind keine speziellen Geräte erforderlich. | Effizient, reproduzierbar, einfach und kostengünstig. | Wärmeerzeugung führt zur Denaturierung und Degradation von Makromolekülen. | DNA-Analysen per PCR. | 5 |
Tabelle 1: Vergleich der zur Herstellung von Hefeextrakten verfügbaren Methoden.
Kryoschleifen (auch kryogenes Schleifen/kryogenes Fräsen genannt) wird häufig eingesetzt, um Nukleinsäuren, Proteine oder Chemikalien zuverlässig aus temperaturempfindlichen Proben für quantitative oder qualitative Analysen abzurufen. Es wurde erfolgreich für verschiedene Anwendungen in verschiedenen Bereichen wie Biotechnologie, Toxikologie, Forensik12,13, Umweltwissenschaften, Pflanzenbiologie14 und Lebensmittelwissenschaft eingesetzt. Die Isolierung intakter biologischer Makromoleküle ist in der Regel stark von der Temperatur abhängig. Extrem niedrige Temperaturen sorgen dafür, dass die Proteasen und Nukleasen inaktiv bleiben, was zu einer zuverlässigen Isolierung intakter Proteine, Nukleinsäuren und anderer Makromoleküle für nachfolgende Analysen führt. Tatsächlich hält eine Gefriermühle in der Regel eine Probentemperatur von -196 °C (der Siedepunkt von LN2)aufrecht, wodurch DNA/RNA oder Proteindenaturierung und -abbau minimiert werden.
Die Gefriermühle verwendet eine elektromagnetische Schleifkammer, die schnell einen festen Metallstab oder Zylinder in einer Durchstechflasche hin und her bewegt, die die Probe enthält, die zwischen Edelstahl-Endsteckern pulverisiert werden soll. Das Instrument erzeugt und kehrt schnell ein Magnetfeld innerhalb der Schleifkammer um. Wenn sich das Magnetfeld hin und her verschiebt, zerkleinert der Magnet die Probe gegen die Stecker und erreicht so das "Kryoschleifen" und die Pulverisierung des Popcorns. Die Gefriermühle ersetzt Mörtel und Stößel und ermöglicht die sequentielle Bearbeitung mehrerer Proben (oder bis zu 4 kleinere Proben gleichzeitig) mit hoher Reproduzierbarkeit und vermeidet die Durchlässigkeit des Benutzers im Zusammenhang mit dem manuellen Schleifen. Sobald die Proben verarbeitet sind, können die Zellextrakte für eine Vielzahl von nachgelagerten Anwendungen verwendet werden.
Protokoll
1. Zubereitung von Hefe-Popcorn
- Wachsen Sie Hefezellen in 0,5 L YPD-Medien auf eine Dichte von 1 x 107 Zellen/ml. Zählen Sie Zellen mit einem Coulter-Zähler oder anderen Mitteln.
- Zentrifugenzellen für 10 min bei 2.400 g und 4 °C.
- Waschen Sie jede Probe einmal mit 500 ml eiskaltem deionisiertem 18 Mega Ohm Milli-Q Wasser.
- Pellets in 15 ml eiskaltem Lysispuffer [20 mM HEPES-KOH pH pH 7,5, 110 mM KCl, 0,1% Tween, 10% Glycerin, mit frisch zugesetztem Reduktionsmittel 10 mM β-Mercaptoethanol, Protease-Inhibitor-Cocktail, 10 M Proteasom-Inhibitor MG-132, 1 mM Deacetylase-Inhibitor Natriumbutyrat und Phosphatase-Inhibitoren (1 mM Natriumvanadate, 50 mM Natriumfluorid, 50 mM Natrium-β-Glycerophosphat)]. Weitere Informationen finden Sie in der Tabelle der Materialien. Bewahren Sie resuspendierte Zellen auf Eis auf, bis die Proben für den nächsten Schritt bereit sind.
HINWEIS: Eine Vielzahl von Lysepuffern, die eine Reihe von nichtionischen Detergenzien enthalten, kann mit den darin enthaltenen Proben und spezifischen Inhibitoren auf der Grundlage der nachgeschalteten Anwendung verwendet werden. Die Einbeziehung von Protease- und proteasomalen Inhibitoren ist entscheidend, um den Proteinabbau zu verhindern, insbesondere wenn die Extrakte aufgetaut sind. - Machen Sie Snap gefrorene hefe Popcorn durch langsame Zugabe der Zellsuspension einen Tropfen nach dem anderen mit einer vorgekühlten serologischen Pipette in eine oder mehrere 50 ml Zentrifuge Rohre auf Trockeneis gehalten und mit LN2 gefüllt, bis knapp unter dem Rand. Flüssigstickstoff im Rohr häufig aufladen, um seinen Verlust durch schnelle Verdunstung auszugleichen. Arbeiten Sie in einem gut belüfteten Bereich, um die mit der Stickstofferstickung verbundenen Gefahren zu vermeiden.
- Anstelle eines 50 ml Rohres mehrere 50 ml Rohre zusammengebunden (oder einen beliebigen Behälter mit einem großen Mund, wie eine große Kunststoffzentrifuge Flasche, die kryogene Temperaturen vertragen kann) für Pop-Mais-Vorbereitung (Abbildung 1A). Je größer der Behälter und seine Öffnung, desto einfacher ist die Popcorn-Zubereitung, da dies verhindert, dass das Klumpen des Popcorns große Aggregate bildet. Ein Größenbereich von 0,3-0,5 cm für das Popcorn ist ideal für die richtige Schleifung/Pulverisierung mit der Gefriermühle (Abbildung 1B).
- Stellen Sie sicher, dass der LN2 vollständig aus den Röhren, die das Popcorn enthalten, verdampft ist, bevor Sie sie bei -80 °C lagern. Es ist möglich, nach der Zubereitung des Hefe-Popcorns zu stoppen, da sie für mehrere Jahre stabil sind, wenn sie bei -80 °C gehalten werden.

Abbildung 1:Hefe-Popcorn-Zubereitung. (A) Hefe "Popcorn" wird durch das tropfende Einfrieren der Zellsuspension in LN2hergestellt. Wir verwenden ein bis drei 50 ml Rohre, die zusammen mit einem Gummiband zusammengehalten und in einen mit Trockeneis gefüllten Eiskübel gelegt werden. Die Rohre sind mit LN2 bis knapp unter ihren Felgen gefüllt und werden häufig mit flüssigem Stickstoff aufgefüllt, um sie fast voll zu halten, bis die gesamte Zellsuspension zu Popcorn gemacht wurde (B) Die Größe des Popcorns ist ein wichtiger Determinant für eine optimale Schleifeffizienz. Der Größenbereich des Popcorns sollte zwischen 0,3 und 0,5 cm Durchmesser liegen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Kryoschleifen
- Stellen Sie zunächst sicher, dass genügend LN2 zur Verfügung steht, um die Gefriermühle zu kühlen, Fläschchen zu schleifen, Vorräte zu liefern und die Maschine für alle Proben zu betreiben. Für weniger als fünf Proben sollten 30-35 L von LN2 ausreichen. Füllen Sie die Gefriermühlenkammer mit LN2 bis zur Fülllinie.
WARNUNG: Alle Schritte, die LN2 betreffen, sollten in einem gut belüfteten Bereich durchgeführt werden, und die Gefriermühle selbst sollte sich in einem solchen Bereich befinden, um das Risiko von Erstickung zu vermeiden. Tragen Sie persönliche Schutzausrüstung, einschließlich richtiges Schuhwerk, Labormantel, Schutzbrille, eine Basisschicht aus Nitrilhandschuhen, dann Thermohandschuhe, gefolgt von einem weiteren Paar Nitrilhandschuhe. Seien Sie äußerst vorsichtig, wenn Sie mit LN2umgehen. - Schließen Sie den Gefrierwalzendeckel langsam, vermeiden Sie den Spritzer von LN2 und lassen Sie ein paar Minuten für die Maschine abkühlen. Es kann notwendig sein, die Kammer mit LN2 aufzufüllen, um den Verlust durch Verdunstung zu kompensieren, bevor Sie mit dem nächsten Schritt fortfahren.
HINWEIS: LN2 nach Bedarf nur bis zur Fülllinie nachfüllen. Überfüllen Sie die Kammer nicht, da dies sowohl gefährlich als auch schädlich für die Maschine sein kann. Automatisierte Nachfüllsysteme stehen für die Gefriermühle zur Verfügung, die den verdampfenden LN2 nach Bedarf direkt aus einem an die Gefriermühle angeschlossenen Lagertank auffüllen kann. - Die großen Schleiffläschchen und den magnetischen Stoßstangen vorab abkühlen, indem man sie in LN2 dunkt, gehalten in einem separaten kleinen Dewar. Decant alle LN2, wenn die LN2 aufhört zu sprudeln. Dann das Probe-/Hefe-Popcorn in die Schleifflasche geben und mit den beiden Edelstahl-Endsteckern fest versiegeln.
- Füllen Sie nicht mehr als ein Drittel der Schleifflasche mit der Probe, da dies die Effizienz des Schleifens reduzieren kann. Stattdessen können größere Proben verarbeitet werden, indem sie in zwei oder mehr Durchstechflaschen unterteilt und sequenziell geschliffen werden. Kleinere Schleiffläschchen können für kleinere Proben (bis zu 3 ml) verwendet werden.
- Legen Sie die Schleifflasche in die Gefriermühlenkammer und verriegeln Sie sie. Schließen Sie den Deckel.
- Für angehende Hefe, schleifen Sie die Proben für insgesamt drei Zyklen für 2 min/Zyklus (mit 2 min Bruch für die Kühlung zwischen den Zyklen) mit einer Brechrate von 14. Wenn die Maschine nach Abschluss der Zyklen anhält, öffnen Sie den Gefriermühlendeckel langsam und entriegeln Sie vorsichtig die Durchstechflasche mit dem pulverförmigen gefrorenen Zelllysat und entfernen Sie sie aus der Gefriermühle. Wenn mehrere kleine Fläschchen verwendet werden, arbeiten Sie schnell, um eine Durchstechflasche nach der anderen zu entfernen und legen Sie sie in Trockeneis.
HINWEIS: Es ist in der Regel nicht notwendig, die Schleifparameter anzupassen, wenn Fläschchen unterschiedlicher Größe mit dem gleichen Probentyp verwendet werden. Die Schleifparameter wie die Anzahl der Zyklen und die Schleifrate müssen jedoch empirisch für verschiedene Probentypen bestimmt werden, abhängig von der Leichtigkeit, mit der sie lysieren. Die meisten Säugetierzellen und Weichgewebe lysieren in 1-2 Zyklen mit einer Zerkleinerungsrate von 10. Schwerer zu lyse Proben wie Bakterien, Hefe, Fliegenlarven und erwachsene Fruchtfliegen erfordern 3-6 Zyklen mit der maximalen Rate, während harte Gewebe wie Knochen, Zähne, etc. bis zu 10 Zyklen erfordern können. Ein kleines Aliquot der aufgetauten Probe kann vor und nach dem Schleifen unter dem Mikroskop betrachtet werden, um die Anzahl der intakten, nicht lysierten Zellen zu zählen, um die Lyseeffizienz zu bestimmen. Eine ausgezeichnete Analyse der Auswirkungen von Kryoschleifparametern auf die Freisetzung von Proteinen und DNA aus angehender Hefe wurde bereitsveröffentlicht 15. - Arbeiten Sie schnell, um die Probe nicht auftauen zu lassen, schrauben Sie vorsichtig eines der Endstücke (wählen Sie das, das während des Schleifens etwas locker geworden zu sein scheint) mit dem Öffnungswerkzeug ab. Verwenden Sie dann ein Paar lange Zangen (die in einem Eimer mit Trockeneis vorgekühlt sind), um den Stoßstangen zu entfernen. Sammeln Sie die pulverisierte Probe, indem Sie die Schleifflasche invertieren und auf eine mit LN2 vorgekühlte Polystyrol-Wägeschale anzapfen.
- Nachdem das gesamte pulverisierte gefrorene Zelllysat aus der Schleifflasche zurückgewonnen wurde, gießen Sie das pulverisierte Lysat aus der Wägeschale zurück in das 50 ml-Rohr und gehen Sie sofort zum als nächstes beschriebenen langsamen Auftauschritt, um optimale Ergebnisse zu erzielen. Alternativ können Sie das gefrorene Pulverlysat über Nacht bei -80 °C lagern, obwohl dies zu einer gewissen Verschlechterung führen kann.
- Bereiten Sie einen Eiskübel mit einer 50%igen Gülle aus Eis und Wasser vor und legen Sie ihn mit einem Magnetrührer auf eine Rührplatte. Tauchen Sie ein Drahtgestell oder ein anderes geeignetes Rack in die Eisschlämme ein, um die Proben zu halten.
- Dann, langsam auftauen die Proben auf einem Eisgüllebad mit ständiger Erregung der Gülle mit einem magnetischen Rührer. Fügen Sie mehr Eis hinzu, um das schmelzende Eis zu ersetzen (möglicherweise muss etwas Wasser entsorgt werden, um ein Überlaufen des Eiskübels zu verhindern). Da mehrere Inhibitoren kurze Halbwertszeiten in wässrigen Puffern haben, fügen Sie zusätzlichen Proteasehemmer-Cocktail (siehe Materialtabelle)und 10 M-Proteasom-Inhibitor MG-132 in das Lysat ein, sobald die Proben mit dem Auftauen beginnen (nach ca. 30 min).
- Entfernen Sie das auf der Außenseite der Rohre gebildete Eis alle 5 min, um den Auftauprozess zu beschleunigen. Beachten Sie, dass ein schnelles Auftauen der Proben bei Raumtemperatur oder höher zu einer signifikanten Verschlechterung führen kann.
- Nachdem die Proben vollständig aufgetaut sind (je nach Probenmenge kann es weit über eine Stunde dauern), zentrifugieren Sie das Lysat bei 3.220 g für 20 min in einer gekühlten Tischzentrifuge bei 4 °C, um den Großteil des Zellschrotts aus dem Lysat zu entfernen.
- Übertragen Sie den Überstand auf 50 ml Polycarbonatzentrifugenrohre, die auf Eis vorgekühlt wurden, und zentrifugieren Sie die Proben bei 16.000 g für 20 min bei 4 °C (siehe Materialtabelle).
- Übertragen Sie nur den klaren Überstand, der aus dem geklärten ganzen Zellextrakt aus der Mitte der Flüssigkeitssäule im Rohr besteht, sehr langsam und vorsichtig, ohne die trübe Lipidschicht (Abbildung 2) zu stören, in ein gekühltes 15 ml-Rohr mit vorgekühlten serologischen Pipetten. Vermeiden Sie es, das gesamte Lysat im Zentrifugenrohr zu entfernen, um eine Übertragung von Lipiden und Schmutz zu verhindern. Das übrig gebliebene Lysat im Zentrifugenrohr kann mehrmals zentrifugiert werden, um nach jeder Drehung kleine Mengen Ansaugkraft zurückzugewinnen.
HINWEIS: Lipide zusammen mit denaturierten Proteinen würden trüb/milchig erscheinen und sich an der Spitze der Flüssigkeits-Luft-Schnittstelle und gelegentlich über dem Pellet selbst befinden, das aus unlöslichen Zellablagerungen besteht (Abbildung 2).
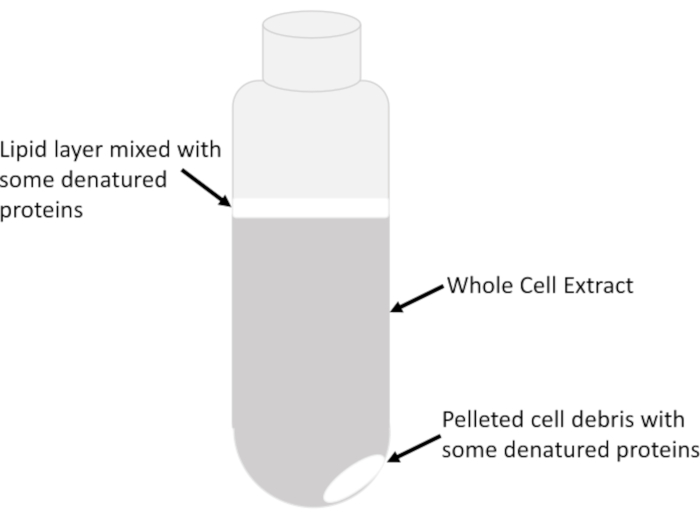
Abbildung 2:Extrahieren Sie Schichten in einem Zentrifugenrohr. Die wichtigsten sichtbaren Merkmale des gesamten Zellextrakts in einem Rohr nach Zentrifugation bei 16.000 g für 20 min sind angezeigt. Die relative Häufigkeit jedes Merkmals hängt vom Probentyp, der Wachstumsphase der Zellen (exponentiell versus stationär), der Menge des Lysepuffers, der zum Resuspendieren von Zellen verwendet wird, und der Lyseeffizienz ab. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Zentrifugieren Sie alle verbleibenden Lysat für 5 min, um mehr des Extraktes zu erholen. Wiederholen Sie diese 5 min Zentrifugation mehrmals, wenn nötig, um so viel wie möglich des klaren Extrakts wiederherzustellen. Entsorgen Sie das trübe Lysat, das Lipide in der Nähe des Bodens des Rohres in der Nähe des Pellets enthält.
- Verwenden Sie diese Extrakte für nachgelagerte Anwendungen wie Proteinkomplexreinigung, Immunpräzipitation und proteomische Analyse.
Ergebnisse
Wir verglichen zwei verschiedene Methoden für die Hefezelllyse, nämlich das Glasperlenfräsen bei 4 °C und ein automatisiertes Kryoschleifverfahren bei -196 °C, um die relativen Rückgewinnungsproteine in den mit beiden Methoden hergestellten Zellextrakten zu bewerten. Für diese Studie haben wir uns für einen angehenden Hefestamm YAG 1177 entschieden (MAT a lys2-810 leu2-3,-112 ura3-52 his3-'200 trp1-1[am] ubi1-'1::TRP1 ubi2-'2::ura3 ubi3-''.1 ub-2 ubi4-2::LEU2 [pUB39] [pUB221])
Diskussion
Eine Einschränkung des Studiums einheimischer Proteine aus Hefe ist die ineffiziente Lyse von Hefezellen aufgrund ihrer harten Zellwand. Obwohl mehrere Methoden entwickelt wurden, ist die konsequenteste und effizienteste Methode in unseren Händen das Kryoschleifen von Hefezellen, die als Popcorn eingefroren sind. Diese Methode ermöglicht die zuverlässige Herstellung von hochwertigen Vollzellextrakten aus angehender Hefe im Vergleich zu anderen Lysemethoden. Die repräsentativen Ergebnisse zeigten, dass Das Kryoschlei...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Forschung im Gunjan-Labor wird durch Fördermittel der National Institutes of Health, der National Science Foundation und des Florida Department of Health unterstützt. Wir danken dem Studenten John Parker für die technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 50 mL polycarbonate tubes with screw caps | Beckman | 357002 | Centrifuge tubes |
| BD Bacto Peptone | BD Biosiences | 211677 | Yeast YPD media component |
| BD Bacto Yeast Extract | BD Biosiences | 212750 | Yeast YPD media component |
| Beckman Avanti centrifuge | Beckman | B38624 | High speed centrifuge |
| Beckman JLA-9.1000 | Beckman | 366754 | Rotor |
| D-(+)-Dextrose Anhydrous | MP Biomedicals | 901521 | Yeast YPD media component |
| Eppendorf A-4-44 | Eppendorf | 22637461 | Swinging bucket rotor |
| Eppendorf refrigerated centrifuge 5810 R | Eppendorf | 22625101 | Refrigerated centrifuge |
| Glycerol | SIGMA-ALDRICH | G5150-1GA | Volume excluder and cryoprotectant |
| HEPES | FisherBiotech | BP310-100 | Buffer |
| HIS6 antibody | Novagen | 70796 | Antibody for HIS tag |
| KCl | SIGMA-ALDRICH | P9541-1KG | Salt for maintaining ionic strength |
| MG-132 | CALBIOCHEM | 474790 | Proteasome Inhibitor |
| Phosphatase inhibitor cocktail | ThermoFisher Scientific | A32957 | Phosphatase inhibitor cocktail |
| Ponceau S | SIGMA | P7170-1L | Protein Stain |
| Protease inhibitor cocktail | ThermoFisher Scientific | A32963 | Protease inhibitor cocktail |
| Rotor JLA 25.500 | Beckman | JLA 25.500 | Rotor |
| Sodium Butyrate | EM Science | BX2165-1 | Histone Deacetylase Inhibitor |
| Sodium Fluoride | Sigma-Aldrich | S6521 | Phosphatase Inhibitor |
| Sodium Vanadate | MP Biomedicals | 159664 | Phosphatase Inhibitor |
| Sodium β-glycerophosphate | Alfa Aesar | 13408-09-8 | Phosphatase Inhibitor |
| Spex Certiprep 6850 freezer mill | SPEX Sample Prep | 6850 | Freezer Mill |
| TALON Metal Affinity Resin | BD Biosiences | 635502 | For pulling down HIS tagged proteins |
| Tween 20 | VWR International | VW1521-07 | Non-ionic detergent |
| β-Mercaptoethanol | AMRESCO | M131-250ML | Reducing agent |
Referenzen
- Botstein, D., Chervitz, S. A., Cherry, J. M. Yeast as a model organism. Science. 277 (5330), 1259-1260 (1997).
- Dunn, B., Wobbe, C. R. Preparation of protein extracts from yeast. Current Protocols in Molecular Biology. , (2001).
- Holm, C., Meeks-Wagner, D. W., Fangman, W. L., Botstein, D. A rapid, efficient method for isolating DNA from yeast. Gene. 42 (2), 169-173 (1986).
- Nandakumar, M. P., Marten, M. R. Comparison of lysis methods and preparation protocols for one- and two-dimensional electrophoresis of Aspergillus oryzae intracellular proteins. Electrophoresis. 23 (14), 2216-2222 (2002).
- Silva, G. A. D., Bernardi, T. L., Schaker, P. D. C., Menegotto, M., Valente, P. Rapid yeast DNA extraction by boiling and freeze-thawing without using chemical reagents and DNA purification. Brazilian Archives of Biology and Technology. 55, 319-327 (2012).
- Baldwin, C., Robinson, C. W. Disruption of Saccharomyces cerevisiae using enzymatic lysis combined with high-pressure homogenization. Biotechnology Techniques. 4 (5), 329-334 (1990).
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nature Biotechnology. 17 (10), 1030-1032 (1999).
- Hudspeth, M. E., Shumard, D. S., Tatti, K. M., Grossman, L. I. Rapid purification of yeast mitochondrial DNA in high yield. Biochimica et Biophysica Acta. 610 (2), 221-228 (1980).
- Szymanski, E. P., Kerscher, O. Budding yeast protein extraction and purification for the study of function, interactions, and post-translational modifications. Journal of Visualized Experiments. (80), e50921 (2013).
- Bzducha-Wróbel, A., et al. Evaluation of the efficiency of different disruption methods on yeast cell wall preparation for β-glucan isolation. Molecules. 19 (12), 20941-20961 (2014).
- Umen, J. G., Guthrie, C. A novel role for a U5 snRNP protein in 3' splice site selection. Genes & Development. 9 (7), 855-868 (1995).
- Smith, B. C., Fisher, D. L., Weedn, V. W., Warnock, G. R., Holland, M. M. A systematic approach to the sampling of dental DNA. Journal of Forensic Sciences. 38 (5), 1194-1209 (1993).
- Sweet, D., Hildebrand, D. Recovery of DNA from human teeth by cryogenic grinding. Journal of Forensic Sciences. 43 (6), 1199-1202 (1998).
- Lorenz, W. W., Yu, Y. S., Dean, J. F. An improved method of RNA isolation from loblolly pine (P. taeda L.) and other conifer species. Journal of Visualized Experiments. (36), e1751 (2010).
- Singh, M. R., Roy, S., Bellare, J. R. Influence of Cryogenic Grinding on Release of Protein and DNA from Saccharomyces cerevisiae. International Journal of Food Engineering. 5 (1), (2009).
- Singh, R. K., Kabbaj, M. H., Paik, J., Gunjan, A. Histone levels are regulated by phosphorylation and ubiquitylation-dependent proteolysis. Nature Cell Biology. 11 (8), 925-933 (2009).
- Liang, D., Burkhart, S. L., Singh, R. K., Kabbaj, M. H., Gunjan, A. Histone dosage regulates DNA damage sensitivity in a checkpoint-independent manner by the homologous recombination pathway. Nucleic Acids Research. 40 (19), 9604-9620 (2012).
- Singh, R. K., Gonzalez, M., Kabbaj, M. H., Gunjan, A. Novel E3 ubiquitin ligases that regulate histone protein levels in the budding yeast Saccharomyces cerevisiae. PLoS One. 7 (5), 36295 (2012).
- Gunjan, A., Verreault, A. A Rad53 kinase-dependent surveillance mechanism that regulates histone protein levels in S. cerevisiae. Cell. 115 (5), 537-549 (2003).
- Gill, P., et al. Identification of the remains of the Romanov family by DNA analysis. Nature Genetics. 6 (2), 130-135 (1994).
- Alain, K., et al. DNA extractions from deep subseafloor sediments: novel cryogenic-mill-based procedure and comparison to existing protocols. Journal of Microbiological Methods. 87 (3), 355-362 (2011).
- Mohammad, F., Buskirk, A. Protocol for Ribosome Profiling in Bacteria. Bio-Protocol. 9 (24), 3468 (2019).
- Liew, Y. J., et al. Identification of microRNAs in the coral Stylophora pistillata. PLoS One. 9 (3), 91101 (2014).
- Lopez de Heredia, M., Jansen, R. P. RNA integrity as a quality indicator during the first steps of RNP purifications: a comparison of yeast lysis methods. BMC Biochem. 5 (14), (2004).
- Grant, L. J., et al. Purified plant cell walls with adsorbed polyphenols alter porcine faecal bacterial communities during in vitro fermentation. Food & Function. 11 (1), 834-845 (2020).
- Lolo, M., et al. Cryogenic grinding pre-treatment improves extraction efficiency of fluoroquinolones for HPLC-MS/MS determination in animal tissue. Analytical and Bioanalytical Chemistry. 387 (5), 1933-1937 (2007).
- Santos, D., et al. Determination of Cd and Pb in food slurries by GFAAS using cryogenic grinding for sample preparation. Analytical and Bioanalytical Chemistry. 373 (3), 183-189 (2002).
- da Silva, E. G. P., et al. Fast method for the determination of copper, manganese and iron in seafood samples. Journal of Food Composition and Analysis. 21 (3), 259-263 (2008).
- Kamogawa, M. Y., Nogueira, A. R. A., Costa, L. M., Garcia, E. E., Nobrega, J. A. A new strategy for preparation of hair slurries using cryogenic grinding and water-soluble tertiary-amines medium. Spectrochimica Acta Part B-Atomic Spectroscopy. 56 (10), 1973-1980 (2001).
- Sillen, A., Hall, G., Richardson, S., Armstrong, R. Sr-87/Sr-86 ratios in modern and fossil food-webs of the Sterkfontein Valley: Implications for early hominid habitat preference. Geochimica Et Cosmochimica Acta. 62 (14), 2463-2473 (1998).
- Nielsen-Marsh, C. M., et al. Sequence preservation of osteocalcin protein and mitochondrial DNA in bison bones older than 55 ka. Geology. 30 (12), 1099-1102 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten