Method Article
Alimentazione e quantificazione del sangue di origine animale e dei pasti artificiali nelle zanzare Aedes aegypti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
L'obiettivo di questo protocollo è quello di fornire pasti di sangue di origine animale e artificiale alle zanzare Aedes aegypti attraverso un alimentatore di membrane artificiale e quantificare con precisione il volume di farina ingerita.
Abstract
Le femmine di alcune specie di zanzare possono diffondere malattie mentre mordeno ospiti vertebrati per ottenere pasti nel sangue ricchi di proteine necessari per lo sviluppo delle uova. In laboratorio, i ricercatori possono fornire pasti di sangue di origine animale e artificiale alle zanzare tramite alimentatori a membrana, che consentono la manipolazione della composizione dei pasti. Qui presentiamo metodi per nutrire sangue e pasti artificiali alle zanzare Aedes aegypti e quantificare il volume consumato dalle singole femmine.
L'alimentazione mirata e la quantificazione degli alimenti artificiali / ematici hanno ampi usi, tra cui testare gli effetti dei componenti dei pasti sul comportamento e sulla fisiologia delle zanzare, fornire composti farmacologici senza iniezione e infettare le zanzare con agenti patogeni specifici. L'aggiunta di colorante di fluoresceina al pasto prima dell'alimentazione consente una successiva quantificazione delle dimensioni del pasto. Il volume del pasto consumato dalle zanzare può essere misurato in peso, se le femmine devono essere utilizzate in seguito per esperimenti comportamentali, o omogeneizzando le singole femmine in piastre da 96 pozzetti e misurando i livelli di fluorescenza usando un lettore di piastre come test finale. La quantificazione delle dimensioni dei pasti può essere utilizzata per determinare se la modifica dei componenti del pasto altera il volume del pasto ingerito o se il consumo di pasti differisce tra i ceppi di zanzare. Una quantificazione precisa delle dimensioni dei pasti è fondamentale anche per i saggi a valle, come quelli che misurano gli effetti sull'attrazione o sulla fecondità dell'ospite. I metodi qui presentati possono essere ulteriormente adattati per tenere traccia della digestione dei pasti nel corso dei giorni o per includere più marcatori distinguibili aggiunti a pasti diversi (come nettare e sangue) per quantificare il consumo di ogni pasto da parte di una singola zanzara.
Questi metodi consentono ai ricercatori di eseguire da solo misurazioni ad alta produttività per confrontare il volume dei pasti consumato da centinaia di zanzare individuali. Questi strumenti saranno quindi ampiamente utili alla comunità dei ricercatori di zanzare per rispondere a diverse domande biologiche.
Introduzione
Presentiamo un protocollo per l'alimentazione di pasti nel sangue modificati alle zanzare Aedes aegypti utilizzando un alimentatore a membrana artificiale e misurando con precisione il volume del pasto consumato da ogni singola zanzara. Questo protocollo può essere adattato in modo flessibile per alterare il contenuto del pasto o per confrontare il volume del pasto consumato da diversi gruppi sperimentali di zanzare.
La zanzara Ae. aegypti minaccia la salute globale diffondendo agenti patogeni che causano malattie tra cui febbre gialla, febbre dengue, chikungunya e Zika1,2,3,4,5. Ae. le femmine di aegypti sono emoderizzatrici obbligate; devono consumare sangue vertebrato per ottenere la proteina necessaria per lo sviluppo delle uova e ogni frizione di uova richiede un pasto a sangue pieno da almeno un ospite6,7,8. La zanzara femmina morde per la prima volta il suo ospite perforando la pelle con il suo stile e iniettando saliva, che contiene composti che innescano la risposta immunitaria dell'ospite9. Quindi si nutre pompando sangue attraverso il suo stile nel suo midgut. Durante il consumo di un pasto di sangue da un ospite infetto, può ingerire agenti patogeni trasmessi dalsangue 6,8, che poi migrano dal midgut della zanzara alle sue ghiandole salivari10. Le zanzare femminili infettate in questo modo possono diffondere malattie iniettando agenti patogeni insieme alla saliva quando mordeno ospitisuccessivi 11,12. Comprendere e quantificare i meccanismi del comportamento di alimentazione del sangue sono passaggi cruciali per controllare la trasmissione delle malattie trasmesse dalle zanzare.
Molti protocolli di laboratorio per l'allevamento e la sperimentazione delle zanzare utilizzano animali vivi tra cui topi, porcellini d'India o esseri umani come fontedi sangue 13,14,15,16. L'uso di animali vivi impone preoccupazioni etiche e requisiti complessi per la formazione del personale, l'alloggio e la cura degli animali e il rispetto delle politiche del Comitato istituzionale per la cura e l'uso degli animali (IACUC). Limita anche i tipi di composti che possono essere consegnati alle zanzare, il che limita gli studi che possono essere effettuati17.
Gli apparati artificiali per l'alimentazione del sangue, che in genere utilizzano un sistema a membrana per simulare la pelle ospite, sono strumenti utili per studiare i comportamenti di alimentazione del sangue che eludeno la necessità di migliorare la necessità di ospitare ospiti vivi. Il sangue intero può essere acquistato da un certo numero di venditori e alimentato alle zanzare utilizzando alimentatori a membrana artificiale riscaldati e con giacca ad acqua o dispositivisimili 18,19. In questo protocollo, dimostriamo l'uso di piccoli alimentatori a membrana usa e getta chiamato "Glytubes". Questo alimentatore a membrana, precedentemente pubblicato da Costa-da-Silvaet al. Il Glytube è un'alternativa economica ed efficiente ad altri alimentatori artificiali commerciali, che possono richiedere volumi di pasto maggiori e sono più adatti per l'alimentazione in lotti di grandi gruppi di zanzare su una singola formulazione dipasto 21.
Questo protocollo comprende due sezioni: preparazione/consegna di pasti artificiali e quantificazione del consumo. Nella prima sezione, i Glytube vengono utilizzati come mezzo efficiente per fornire diete manipolate. Il sangue intero può essere sostituito con un pasto interamente artificiale per confrontare gli effetti dei sostituti del sangue al posto di una farina di sangue. Una ricetta adattata da Kogan (1990)22 è presentata qui, anche se molteplici formulazioni di pasti artificiali sono statesviluppate 23,24. Inoltre, l'alimentazione è un metodo meno invasivo e meno laborioso per introdurre composti farmacologici rispetto all'iniezione. A causa del basso volume totale richiesto per ogni pasto (1-2 mL), questo protocollo fornisce un metodo di consegna interessante per ridurre le quantità di reagenti costosi. Le femmine di Aegypti consumano prontamente pasti privi di proteine di soluzione salina con adenosina 5′-trifosfato (ATP)25,26, che fornisce una linea di base per misurare gli effetti dei singoli componenti del pasto. Ad esempio, il recettore simile a Neuropeptide Y 7 (NPYLR7) in Ae. aegypti è noto per mediare la soppressione in cerca di ospite dopo un pasto sanguigno ricco di proteine, e quando gli agonisti NPYLR7 vengono aggiunti a un pasto salino privo di proteine, le zanzare femminili mostrano una soppressione in cerca di ospiti simile a quelle che hanno consumatosangue intero 7.
Nella seconda sezione vengono presentati i passaggi per quantificare il volume di ogni pasto consumato da una singola zanzara femmina. Questo saggio è a base di fluorescenza e cattura lo stato di alimentazione in una risoluzione più elevata rispetto ai metodi in cui le femmine sono classificate come "nutrite" o "non nutrite" sulla base della sola valutazione visiva della distensione addominale. Aggiungendo fluoresceina al pasto prima dell'alimentazione, i volumi di farina ingeriti dagli individui possono essere quantificati omogeneizzando ogni zanzara in una piastra da 96 pozze e misurando l'intensità della fluorescenza come lettura. Questo saggio può misurare le differenze nel vigore alimentare in risposta a variabili come la composizione dei pasti o il background genetico delle zanzare. Una quantificazione precisa è fondamentale per le dimensioni intermedie delle farine, ad esempio quando alle femmine vengono offerti pasti non ottimale contenenti deterrenti per l'alimentazione o quando consumano pasti di saccarosio di dimensionivariabili 27. Se le zanzare nutrite sono necessarie per i successivi test comportamentali dopo la quantificazione delle dimensioni dei pasti, la dimensione del pasto può invece essere calcolata pesando le femmine anestetizzate in gruppi e stimando la massa media aumentata per individuo. Sebbene meno precisa della marcatura della fluoresceina, la pesatura fornisce ancora una stima aggregata del volume dei farine e consente di esaminare l'effetto del pasto sui processi a valle, come la fecondità o la successiva attrazione ospite. Mentre la dimensione delle farine nel sangue è variabile e può essere influenzata da una miriadedi fattori 11,28,29, le dimensioni ingerite delle farine misurate con i metodi qui descritti sono coerenti con le precedentiquantificazioni 7,30,31.
Protocollo
Le procedure di alimentazione del sangue non sono state eseguite utilizzando animali vivi o ospiti umani e hanno rispettato le linee guida stabilite dal Rockefeller University Institutional Animal Care and Use Committee (IACUC) e dall'Institutional Review Board (IRB).
1. Preparazione dei pasti
- Preparazione del fagostimolante, adenosina 5′-trifosfato
- Preparare una soluzione da 25 mM di NaHCO3 acquoso (peso molecolare, MW = 84,006 g/mol). Per 100 mL di 25 mM NaHCO3, aggiungere 210 mg di NaHCO3 a un pallone volumetrico e riempire con acqua doppia distillata (ddH2O) ad un volume totale di 100 mL. Utilizzando una barra di agitazione magnetica, mescolare accuratamente la soluzione fino a quando tutto il NaHCO3 non viene sciolto.
- Ricostituire l'IDrato di sale disodico ATP (MW = 551,14 g/mol) nell'acquoso NaHCO3 da 25 mM a una concentrazione finale di 200 mM ATP. Per un volume totale di 10 ml di ATP da 200 mM in tampone NaHCO3 da 25 mM, aggiungere 1,1 g di idrato di sale disodico ATP in un pallone volumetrico e riempire con tampone NaHCO3 da 25 mM a un volume totale di 10 ml. Utilizzando una barra di agitazione magnetica, mescolare accuratamente la soluzione fino a quando tutto l'ATP non viene sciolto.
NOTA: Per ridurre al minimo l'idrolisi dell'ATP, deve essere tamponato da una soluzione salina come NaHCO3. - Aliquota la soluzione ATP e conservare a -20 °C.
NOTA: Questa soluzione stock di ATP viene in genere resa fresca ogni sei mesi e viene utilizzata per tutti i pasti descritti di seguito. Per prevenire la degradazione, le aliquote ATP non devono subire più cicli di congelamento-scongelamento o essere riscaldate insieme ad altri componenti del pasto.
- Preparazione della soluzione di tracciante fluorescente, fluoresceina
- Preparare una soluzione stock del 2% (w/v) di fluoresceina acquosa. Per un volume totale di soluzione stock di 10 mL, mescolare 0,2 g di sale disodico di fluoresceina con 10 ml di ddH2O in un tubo conico da 15 ml avvolto in un foglio di alluminio a temperatura ambiente. Questa soluzione stock di fluoresceina può essere utilizzata per la diluizione in tutti i pasti descritti di seguito.
NOTA: Poiché la fluoresceina è sensibile alla luce, evitare l'esposizione alla luce avvolgendo i contenitori in un foglio di alluminio.
- Preparare una soluzione stock del 2% (w/v) di fluoresceina acquosa. Per un volume totale di soluzione stock di 10 mL, mescolare 0,2 g di sale disodico di fluoresceina con 10 ml di ddH2O in un tubo conico da 15 ml avvolto in un foglio di alluminio a temperatura ambiente. Questa soluzione stock di fluoresceina può essere utilizzata per la diluizione in tutti i pasti descritti di seguito.
- Preparazione di farine di sangue di origine animale
- Calcola il numero di pasti necessari per nutrire tutte le zanzare; ogni Glytube contiene un pasto di 2 mL e nutre circa 25 zanzare. Preparare un pasto aggiuntivo per calibrare la curva standard per le letture di fluorescenza. Salvo diversa indicazione, tutte le fasi di questa sezione descrivono gli importi dei reagenti necessari per preparare un pasto con un volume finale di 2 mL.
- Per gli esami del sangue di origine animale, trasferire 1,98-2 ml di sangue di pecora defibrinato in un tubo conico da 15 ml (vedere il passaggio 3.3 per il volume desiderato di sangue).
NOTA: Possono essere utilizzate fonti commercialmente defibrinate di sangue vertebrato, anche da pecore, porcellini d'India e esseri umani13. Prima dell'uso, assicurarsi che il sangue acquistato non abbia superato la data di scadenza e mescolarlo bene invertendo la bottiglia, specialmente se c'è una separazione visibile dei componenti del sangue. - Per un'alimentazione ottimale, aggiungere l'ATP a una concentrazione finale di 1-2 mM dopo che il sangue di pecora è stato riscaldato a 45 °C in un bagno d'acqua. Per una concentrazione finale di 1 mM ATP, aggiungere 10 μL della soluzione stock ATP da 200 mM a 1,99 mL di sangue e miscela preri warmed. Per una concentrazione finale di 2 mM ATP, aggiungere 20 μL dello stock ATP da 200 mM a 1,98 mL di sangue prerifapidto e mescolare. Se l'ATP non deve essere aggiunto, riscaldare 2 mL di sangue di pecora defibrinato.
- Se la quantificazione delle dimensioni delle farine basata sulla fluorescenza deve essere successivamente effettuata, aggiungere la soluzione di fluoresceina ad una concentrazione finale dello 0,002% (2 μL del 2% di fluoresceina in 2 mL volume totale di farina). Ridurre il volume di sangue della stessa quantità della fluoresceina aggiunta. Conservare 1 mL della formulazione finale del pasto contenente 0,002% di fluoresceina per generare la curva standard di riferimento. Trattare il volume trattenuto in modo identico al pasto che viene consegnato alle zanzare; esporre alle stesse condizioni di luce e temperatura per tutta la durata dell'esperimento, e successivamente congelare questo insieme al pasto consegnato.
- Preparazione di pasti di sangue artificiale
- Calcola il numero di pasti necessari per nutrire tutte le zanzare; ogni Glytube contiene un pasto di 2 mL e nutre circa 25 zanzare. Preparare un pasto aggiuntivo per calibrare la curva standard per le letture di fluorescenza. Salvo diversa indicazione, tutte le fasi di questa sezione descrivono gli importi dei reagenti necessari per preparare un pasto di 2 mL.
- Per preparare il sangue artificiale (adattato da Kogan (1990)22), come nella tabella 1, prima fare una soluzione stock di 400 mM NaHCO3. Per un volume totale di 10 mL di 400 mM NaHCO3 (MW = 84,006 g/mol), aggiungere 336 mg di NaHCO3 a un pallone volumetrico e riempire con acqua doppia distillata (ddH2O) ad un volume totale di 10 mL. Utilizzando una barra di agitazione magnetica, mescolare accuratamente la soluzione fino a quando tutto il NaHCO3 non viene sciolto.
- Per i componenti proteici del sangue artificiale, preparare soluzioni stock di 50 mg/mL di γ-globuline in 400 mM NaHCO3, 35 mg/mL di emoglobina in ddH2O e 300 mg/mL di albumina in ddH2O. Le soluzioni proteiche possono essere conservate a 4 °C per un massimo di 2 mesi. La concentrazione finale di proteine umane totali nel sangue artificiale è di 125 mg/mL. Ciò include concentrazioni finali di 15 mg/mL γ-globuline, 8 mg/mL di emoglobina e 102 mg/mL di albumina.
- Per ogni pasto di 2 mL, combinare 600 μL di γ-globuline, 460 μL di emoglobina, 680 μL di albumina e 250 μL di ddH2O da soluzioni stock elencate nella tabella 1. Attendere di aggiungere 10 μL di soluzione stock ATP da 200 mM fino a quando il pasto non è stato riscaldato a 45 °C, immediatamente prima di presentare il pasto.
- Se la quantificazione delle dimensioni delle farine basata sulla fluorescenza deve essere successivamente effettuata, aggiungere la soluzione di fluoresceina ad una concentrazione finale dello 0,002% (2 μL del 2% di fluoresceina in 2 mL volume totale di farina). Ridurre il volume di ddH2O nel passaggio 4.4 della stessa quantità della fluoresceina aggiunta. Conservare almeno 1 mL della formulazione finale del pasto contenente 0,002% di fluoresceina per generare la curva standard di riferimento. Trattare il volume trattenuto in modo identico al pasto che viene consegnato alle zanzare; esporre alle stesse condizioni di luce e temperatura per tutta la durata dell'esperimento, e successivamente congelare questo insieme al pasto consegnato.
- Preparazione di pasti salini senza proteine di esempio (adattati da Duvall et al. (2019)7)
NOTA: I pasti salini senza proteine possono essere preparati in più modi7,27,32. Il pasto salino presentato qui è una versione senza proteine della ricetta del sangue artificiale descritta sopra.- Calcola il numero di pasti necessari per nutrire tutte le zanzare; ogni Glytube contiene un pasto di 2 mL e nutre circa 25 zanzare Preparare un pasto aggiuntivo per calibrare la curva standard per le misurazioni della fluorescenza. Salvo diversa indicazione, tutte le fasi di questa sezione descrivono gli importi dei reagenti necessari per preparare un pasto di 2 mL.
- Per preparare il pasto salino, fare una soluzione stock di 400 mM NaHCO3. Per un volume totale di 10 mL di 400 mM NaHCO3 (MW = 84.006 g/mol), aggiungere 336 mg di NaHCO3 a un pallone volumetrico e riempire con ddH2O ad un volume totale di 10 mL. Utilizzando una barra di agitazione magnetica, mescolare accuratamente la soluzione fino a quando tutto il NaHCO3 non viene sciolto.
- Per ogni pasto da 2 ml, combinare in un tubo conico da 15 ml 600 μL di 400 mM NaHCO3 con 1,39 ml di ddH2O. Attendere di aggiungere 10 μL della soluzione stock di ATP da 200 mM fino a quando il pasto non è stato riscaldato a 45 °C in un bagno d'acqua.
- Se si vuole successivamente effettuare una quantificazione a base di fluorescenza delle dimensioni delle farine, aggiungere la soluzione di fluoresceina ad una concentrazione finale dello 0,002% (2 μL del 2% di fluoresceina in 2 mL del volume totale delle farine). Ridurre il volume di ddH2O nel passaggio 5.3 della stessa quantità della fluoresceina aggiunta. Conservare almeno 1 mL della formulazione finale del pasto contenente 0,002% di fluoresceina per generare la curva standard di riferimento. Trattare il volume trattenuto in modo identico al pasto che viene consegnato alle zanzare; esporre alle stesse condizioni di luce e temperatura per tutta la durata dell'esperimento, e successivamente congelare questo insieme al pasto consegnato.
2. Consegna dei pasti alle zanzare
- Impostazione di contenitori per zanzare per l'alimentazione
NOTA: Le zanzare possono essere alimentate in una varietà di contenitori purché siano soddisfatti i seguenti criteri. Assicurati che il contenitore sia abbastanza grande da far volare le zanzare, ma non così grande che sarà difficile per le zanzare localizzare la superficie della rete e iniziare a nutrirsi. La rete utilizzata per coprire il contenitore può variare in base al materiale e alle dimensioni del foro. I fori devono essere abbastanza grandi da far traforare lo stile della zanzara femmina, ma non così grandi che la zanzara può fuggire. Fissare saldamente la rete in modo che sia tesa e il Glytube possa poggiare stabilmente sulla sua superficie per tutto il periodo di alimentazione.- Un contenitore di esempio (Figura 1) è un secchio di plastica in polietilene ad alta densità (HDPE) modificato da 946 ml (32 once). Per replicare questa configurazione, utilizzare una lama di rasoio per tagliare un foro centrale di ~ 10 cm di diametro nel coperchio della benna. Per assemblare il contenitore per l'occupazione da parte delle zanzare, fissare un pezzo quadrato di ~ 400 cm2 di zanzariera in poliestere bianco da 0,8 mm sopra il secchio, spingendo saldamente il coperchio perforato verso il basso su di esso per scattare saldamente.
- Raccogli zanzare femminili che sono almeno 3 giorni dopo l'eclusione per garantire che siano abbastanza mature da nutrire il sangue. I tassi di alimentazione ottimali si osservano dopo 7giorni 33.
- Posizionare le zanzare femminili nel contenitore e coprire con la rete. Se il contenitore è densamente popolato da zanzare, aumentare il numero di Glytube utilizzati. L'alimentazione ottimale si ottiene con ~ 25 zanzare / Glytube. Ciò riduce la concorrenza per l'accesso alla membrana di alimentazione.
- Mettere da parte un gruppo di controllo di zanzare non fed a cui non verrà offerto un pasto. Nel protocollo di misurazione del peso, pesare il gruppo non alimentato separatamente e utilizzare questo peso per stimare l'aumento di peso nel gruppo sperimentale che si è nutrito di un pasto. Nel protocollo di quantificazione basato sulla fluorescenza, aggiungere il gruppo non fed di zanzare ai pozzi per i calcoli della curva standard e per i controlli negativi. Per abbinare l'autofluorescenza del tessuto di zanzara di base nel gruppo sperimentale, assicurarsi che la curva standard e i pozzi di controllo negativi contengano una zanzara senza fed.
- Costruzione e creazione del Glytube (adattato da Costa-da-Silva et al. (2013)20)
- Come illustrato nella figura 1, per generare una fonte di calore, riempire un tubo conico da 50 ml con 40 ml di glicerolo al 100%. Sigillare il tubo conico aperto con un parafilm da 5 cm × 5 cm e ripetere con un pezzo aggiuntivo di 5 cm × parafilm da 5 cm per ridurre al minimo la possibilità di perdite. Opzionalmente, il parafilm può essere tenuto in posizione utilizzando elastici. Invertire il tubo per assicurarsi che non ci siano fori o spazi vuoti.
- Per creare il dispositivo di consegna dei pasti, tagliare un foro centrato di 2,5 cm di diametro nel tappo a vite del tubo conico utilizzando una lama affilata o, per una migliore consistenza, un tornio. Allungare un parafilm × 5 cm in modo uniforme in modo che raddoppi di dimensioni grossolanamente. Il parafilm dovrebbe essere abbastanza sottile che le zanzare possono facilmente perforarlo, ma non dovrebbero esserci perdite. Sigillare sulla superficie esterna del tappo della vite per coprire completamente il foro e mettere da parte il cappuccio.
NOTA: Per aumentare l'attrazione per il Glytube, prima di allungare il parafilm, profumarlo con odore umano strofinandolo delicatamente su una macchia di pelle umana senza cosmetici applicati, facendo attenzione che non si creano buchi. Questo è raccomandato se l'esperimento non è finalizzato a studiare i segnali sensoriali necessari affinché le zanzare si avvicinino al pasto. - Riscaldare sia il tubo sigillato del glicerolo che il pasto (con tutti i componenti ad eccezione dell'ATP) in un bagno d'acqua di 42-45 °C per almeno 15 minuti. Non preriri riscaldare l'ATP; aggiungerlo immediatamente prima di iniziare l'esperimento.
- Aggiungere accuratamente ATP al pasto riscaldato e al vortice. Pipettare 2 ml del pasto riscaldato nella camera interna del tappo a vite e posizionare delicatamente il tubo conico invertito, riscaldato, riempito di glicerolo da 50 ml. Avvitare parzialmente il tappo con il pasto sul tubo riempito di glicerolo, quanto basta per evitare perdite del pasto o del glicerolo.
NOTA: Il volume dei pasti utilizzati può variare da 1 mL a 2,5 mL. Volumi inferiori possono essere particolarmente utili quando i pasti vengono utilizzati per fornire composti scarsi o costosi. È importante lavorare rapidamente in questa fase in modo che il pasto non si raffredda a temperatura ambiente e riduca la probabilità di alimentazione massima. La velocità di raffreddamento dipenderà dalla temperatura ambiente della stanza in cui vengono condotti questi passaggi, ma in genere dovrebbero essere completati entro 5 minuti a 25 °C. - Posizionare il Glytube assemblato sopra il contenitore delle zanzare e consentire alle zanzare di accedere per nutrirsi per almeno 15 minuti per ottenere velocità di alimentazione massime.
- Per un'alimentazione ottimale, posizionare i contenitori per zanzare all'interno di una camera dotata di un tampone di CO2 e consentire almeno 15 minuti di acclimatazione a 25-28 °C e umidità del 70-80% prima di consegnare il pasto. La camera di dosaggio qui utilizzata è una modifica semplice e a basso costo di una configurazione precedentemente pubblicata16. Utilizza una scatola di stoccaggio in polipropilene traslucido di dimensioni 36 cm L × 31 cm W × 32 cm H con coperchio rimovibile. Un foro di 1,5 cm di diametro realizzato nella parete della camera consente l'erogazione di CO2 attraverso tubi in silicone. Ilcuscinetto di diffusione di CO 2 è apposto sul centro interno del coperchio per la consegna di aria purificata e CO2 per condizionare l'atmosfera della camera durante la prova.
NOTA: Assicurarsi che siano presenti segnali host (calore e CO2, con odore ospiteopzionale 16) in modo che le zanzare siano attratte dall'alimentatore a membrana. Se le zanzare non si affollano sotto il Glytube, controllare che la CO2 sia consegnata correttamente e che il pasto e Glytube siano sufficientemente caldi. Se non è disponibile una fonte esterna di CO2, la CO2 può essere consegnata tramite sbuffi di respiro umano espirato. - Dopo l'alimentazione, il tappo di Glytube può essere scartato come rifiuto a rischio biologico o riutilizzato dopo essere stato immerso in una soluzione di candeggina a bassa percentuale e risciacquo completo in acqua.
3. Quantificazione dei pasti consumati
- Pesare le zanzare da utilizzare per ulteriori esperimenti
NOTA: Pesare le zanzare per quantificare le dimensioni dei pasti consente loro di essere utilizzate per ulteriori sperimentazioni dal vivo, ma questo metodo richiede misurazioni del peso da un gruppo di 5 zanzare. Poiché i pesi delle singole zanzare sono difficili da misurare con precisione utilizzando la maggior parte delle balancei di laboratorio, la variabilità nelle dimensioni dei singoli pasti non può essere facilmente quantificata misurando i pesi. La pesatura è raccomandata solo per le situazioni in cui le femmine si ingombro visibilmente sul pasto.- Anestetizza le zanzare fredde spostando il loro contenitore in una stanza fredda di 4 °C o posizionandolo sul ghiaccio.
- Pesare gruppi di 5 femmine dalla coorte non nutrita (cioè zanzare a cui non è mai stato offerto un pasto) e calcolare il loro peso medio come stima del peso "pre-alimentazione". Il peso medio di una zanzara non confed dipende dal genotipo, dal sesso e dalle condizioni di allevamento. Le zanzare Ae. aegypti femmina non confed allevate con accesso ad libitum al saccarosio pesano tipicamente circa 2 mg ciascuna.
- Dalla coorte sperimentale (cioè le zanzare a cui è stato offerto un pasto), ordinare le femmine in pile "nutrite" e "non nutrite" in base alla distensione addominale osservabile dall'occhio7. Dividere ciascuna delle pile "nutrite" e "non alimentate", rispettivamente, in gruppi di 5 zanzare per la pesatura. Le zanzare all'interno di ciascun gruppo di 5 devono essere derivate dalla stessa coorte sperimentale per l'adozione di misurazioni del peso di gruppo. Calcolare il peso medio per femmina da ciascuna delle pile "alimentate" e "non alimentate" del gruppo sperimentale.
- Misurazione della fluorescenza per l'analisi del punto finale7,27,34
NOTA: Per ottenere misurazioni precise delle dimensioni dei pasti dalle singole zanzare che non sono più necessarie per ulteriori sperimentazioni dal vivo, conservare le zanzare e i restanti 1 mL di farina contenenti 0,002% di fluoresceina a -20 °C immediatamente dopo l'alimentazione. L'esperimento può essere messo in pausa qui. Questo metodo è delineato in Figura 2.- Per generare una curva standard di riferimento, preparare una diluizione seriale dello stesso pasto contenente 0,002% di fluoresceina che è stata offerta al gruppo sperimentale di zanzare. Ci saranno un totale di 8 soluzioni curve standard. In ciascuna di queste soluzioni, il volume finale di farina contenente 0,002% di fluoresceina sarà 5, 2,5, 1,25, 0,625, 0,3125, 0,15625, 0,078125, o 0 μL, e ciascuno sarà in 1x salina tamponata da fosfati (PBS) per un volume totale di 100 μL (ad esempio, 5 μL di farina contenente 0,002% di fluoresceina in 95 μL di 1x PBS).
- Per fare la prima soluzione della curva standard, aggiungere a fondo 50 μL di farina contenente 0,002% di fluoresceina a 950 μL di 1x PBS e vortice (volume finale: 5 μL di farina contenente 0,002% di fluoresceina in 95 μL di 1x PBS). Per rendere il resto delle soluzioni curve standard, eseguire una diluizione di 2 volte per ogni passo prendendo 500 μL dal tubo precedente e aggiungendolo a un nuovo tubo contenente 500 μL di 1x PBS. Vortice ben prima di preparare la successiva diluizione di 2 volte.
- Per preparare pozzi da utilizzare per generare una curva standard di riferimento, pipetta 100 μL di ciascuna delle soluzioni curve standard in ciascuno degli 8 pozzi nella prima colonna di una piastra PCR da 96 porvili. Aggiungere 1 zanzara di controllo senza fed a ciascuno degli stessi 8 pozzi nella prima colonna del piatto. Ripetere nella seconda colonna della piastra per una misurazione replicata.
NOTA: Se ai gruppi sperimentali vengono offerti diversi tipi di pasto, deve essere preparata una curva standard di riferimento separata per ogni tipo di pasto. - Aggiungere 100 μL di 1x PBS in ogni pozzo rimanente per i gruppi di controllo e sperimentale non fed. Se il tessuto deve essere interrotto nelle fasi successive utilizzando un omogeneizzatore o un vortice di mulino perline, aggiungere una perla in vetro solido borosilicato da 3 mm a ciascun pozzo.
- Come controllo negativo, aggiungi 1 zanzara non afed a ogni pozzo nelle prossime 2 colonne della piastra. La fluorescenza misurata in questo gruppo stabilisce un taglio di base per tenere conto dell'autofluorescenza tissutale e verrà utilizzata per determinare se una zanzara nel gruppo sperimentale alimentata con il pasto.
- Aggiungere 1 zanzara per pozzo ai pozzi rimanenti dei gruppi sperimentali a cui è stato offerto un pasto.
- Sigillare la piastra con attenzione e interrompere il tessuto mediante macinazione manuale. L'addome deve essere accuratamente omogeneizzato per rilasciare il pasto. I metodi per interrompere i tessuti includono l'uso di un omogeneizzatore di mulino perline con perline di vetro solido borosilicate da 3 mm (30 Hz per 30 secondi), miscelatore di vortici con perline in vetro solido borosilicato da 3 mm o una smerigliatrice per parassiti senza perline.
- Centrifugare la piastra a 2000 giri/min per 1-2 minuti per raccogliere il lisato.
- Preparare una piastra nera da 96 porvili con 180 μL di 1x PBS in ogni pozzo.
- Trasferire 20 μL di lysate in ogni pozzo con 180 μL di 1x PBS e mescolare. Se disponibile, utilizzare una pipetta multicanale in questo passaggio per una maggiore velocità e una migliore coerenza.
- Misurare l'intensità di fluorescenza di ciascun pozzo utilizzando un lettore di piastre sul canale di eccitazione/emissione 485/520. Generare la curva standard di riferimento tracciando il volume noto del pasto rispetto alla corrispondente misurazione dell'intensità di fluorescenza.
- Utilizzando la curva standard di riferimento generata, estrapolare il volume del pasto ingerito da ciascuna delle zanzare di gruppo sperimentali. Sottrarre la lettura media dell'intensità di fluorescenza del gruppo di controllo negativo delle zanzare non confed dalla lettura dell'intensità di fluorescenza di ogni individuo del gruppo sperimentale per correggere l'autofluorescenza del tessuto di base.
Risultati
La figura 1 presenta uno schema per l'assemblaggio del Glytube, mentre la figura 2 mostra una panoramica del progetto sperimentale per misurare le dimensioni dei pasti utilizzando il saggio a base di fluorescenza qui descritto. La figura 3 fornisce misurazioni rappresentative delle dimensioni delle farine di fluoresceina da un esperimento di alimentazione del sangue. La figura 4, la figura 5e la figura 6 illustrano un campione di questioni biologiche che possono essere affrontate utilizzando questo protocollo. Le applicazioni del protocollo sono ad ampio raggio e includono l'alterazione della composizione delle farine nel sangue, l'alimentazione di composti farmacologici, la quantificazione precisa degli esami del sangue non ottimali o dei pasti di nettare più piccoli e il confronto del comportamento alimentare tra i genotipi delle zanzare.
Per generare una curva standard per i calcoli del volume dei pasti, le letture della fluorescenza vengono tracciate dai pozzi di riferimento designati, ciascuno contenente una zanzara non fed e un volume noto del pasto con 0,002% di fluoresceina (Figura 3A). Le letture di fluorescenza dai pozzi rimanenti, che contengono zanzare del gruppo di controllo negativo delle zanzare non fed o del gruppo sperimentale di zanzare offerte un pasto, vengono confrontate con questa curva standard per quantificare il volume del pasto (μL) consumato da ogni zanzara (Figura 3B). Per convalidare le letture di base in questo saggio, va confermato che alle zanzare del gruppo di controllo negativo non pari a unfed non viene assegnato un valore positivo di μL consumato (Figura 3B, sinistra). Sebbene a tutte le femmine del gruppo sperimentale sia stata offerta la farina di sangue, alcune zanzare si sononutrite (figura 3B, al centro)e alcune no(figura 3B, a destra). Questo risultato dimostra che due tipi di dati possono essere ottenuti da questo protocollo: 1) la percentuale di femmine totali che si nutrono di un dato pasto e 2) il volume ingerito dalle femmine che si nutrono di un dato pasto.
Questo protocollo può essere utilizzato per fornire e quantificare pasti con varie composizioni proteiche. La figura 4A,B mostra i dati raccolti utilizzando i pasti con fluoresceina aggiunta. La proporzione di zanzare che si nutrivano e il volume dei pasti che ingerivano, rispettivamente, sono stati calcolati dalle letture della fluorescenza. Queste letture sono altamente sensibili e consentono una quantificazione precisa di μL, ma hanno la limitazione che le zanzare non possono essere utilizzate per futuri esperimenti dal vivo. La figura 4C,D mostra i dati raccolti da un esperimento indipendente con zanzare che sono state segnate come nutrite o non alimentate a occhio dopo che sono stati offerti pasti senza fluoresceina. La dimensione del pasto è stata calcolata come peso medio / femmina da gruppi di 5 zanzare. Sebbene queste misurazioni del peso siano meno sensibili delle misurazioni della fluorescenza, consentono alle femmine di essere recuperate e utilizzate per ulteriori sperimentazioni dal vivo. La percentuale di zanzare che si nutrono può variare in diversi giorni sperimentali, come si riflette nella figura 4A e nella figura 4C.
La figura 5 mostra il volume consumato di pasti contenenti farmaci che regolano il comportamento di ricerca di ospiti di zanzare. In questi esperimenti, alle femmine sono stati offerti pasti di sangue, soluzione salina + ATP o salina + ATP con 100 μM dell'agonista del recettore NPY Y2 umano, TM30338. Questo farmaco altera il comportamento di ricerca dell'ospite attraverso l'attivazione del recettore Ae. aegypti NPY-like 7. Misurare le dimensioni dei pasti è fondamentale per l'interpretazione degli esperimenti per valutare l'effetto di questo farmaco sul comportamento post-alimentazione del sangue perché consente al ricercatore di calcolare la dose consumata da ogni femmina.
Negli esempi precedenti, le femmine venivano nutrite con sangue o pasti nel sangue sostitutivi, che hanno portato tutti a pasti da 3 a 5 μL(figura 3, figura 4, figura 5). Questo saggio a base di fluorescenza può anche essere utilizzato per misurare dimensioni di farina più piccole e/o più variabili che non possono essere accuratamente individuate dalle misurazioni medie del peso di gruppo. Nella figura 6, lo stesso protocollo di quantificazione della fluorescenza è stato utilizzato per misurare il comportamento di alimentazione del nettare scambiando il Glytube con un batuffolo di cotone saturo di saccarosio al 10% contenente 0,002% di fluoresceina. Gli zuccheri di nettare non possono essere presentati nel saggio di Glytube perché le femmine non riescono a rilevare la presenza di zuccheri nettare con lo stile e non iniziano a nutrire27. Questi dati consentono al ricercatore di determinare che i pasti di zucchero sono costantemente più piccoli degli esami del sangue, in accordo con illavoro precedente 34 (Figura 6).
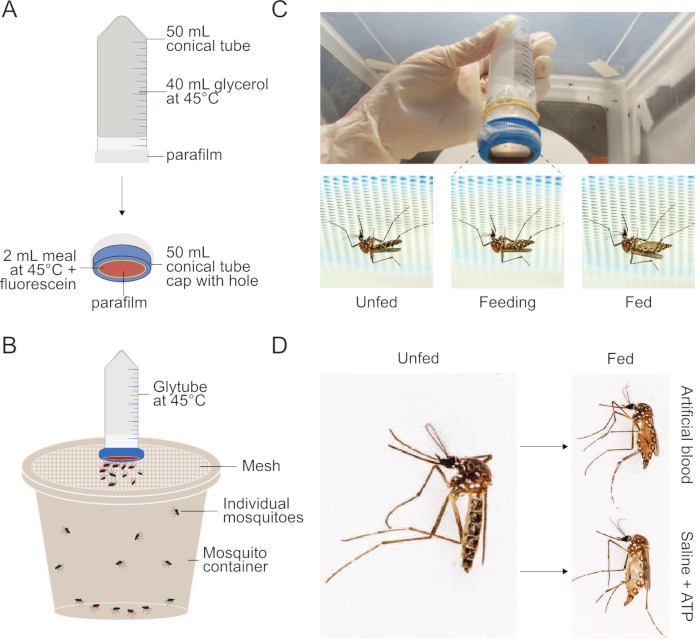
Figura 1: Impostazione del metodo Glytube utilizzato per alimentare i pasti alle zanzare. (A) Schema di un Glytube decostruito utilizzato per nutrire il sangue e altri pasti alle zanzare. (B) Schema di un Glytube presentato in cima a un contenitore di zanzare con un coperchio a rete. Le zanzare femminili possono perforare il coperchio della rete per nutrirsi. (C) Fotografie delle zanzare Aedes aegypti di Glytube (in alto) e delle femmine di Aedes aegypti prima, durante e dopo l'alimentazione (in basso, da sinistra a destra) su un pasto consegnato da Glytube. Le zanzare vengono mostrate penetrare attraverso la rete che copre il loro contenitore per accedere all'alimentatore a membrana. (D) Fotografie che mostrano l'aspetto delle zanzare Ae. aegypti femminili che non sono sane (a sinistra) e che si sono ingoiate su un pasto di sangue artificiale (destra, in alto) o su un pasto salino + ATP (destra, in basso). Il metodo Glytube è stato precedentemente pubblicato in Costa-da-Silvaet al. Le fotografie in( C) e (D) sono per gentile concessione di Alex Wild. Clicca qui per visualizzare una versione più grande di questa figura.
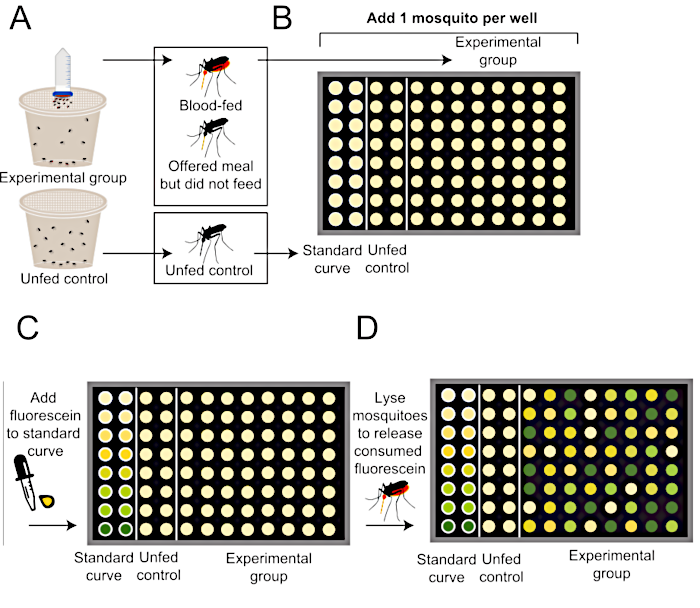
Figura 2: Schema di come quantificare le dimensioni dei pasti dopo il protocollo di alimentazione del sangue di Glytube. (A) Alle zanzare viene offerto un pasto con fluoresceina (superiore, gruppo sperimentale) o nessun pasto (gruppo di controllo negativo inferiore e non a fed). (B) Le singole zanzare vengono aggiunte a una piastra da 96 pozzetta dopo aver interrotto l'esperimento di alimentazione. (C) La curva standard viene generata utilizzando quantità note di farina contenenti 0,002% di fluoresceina. (D) Le zanzare sono omogeneizzate per rilasciare qualsiasi fluoresceina consumata e i livelli di fluorescenza in ogni pozzo sono quantificati utilizzando un lettore di piastre. Questo metodo di quantificazione della fluorescenza è modificato da Lieschet al. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Esperimento di alimentazione del sangue di Glytube con quantificazione a base di fluoresceina. (A) Misurazioni standard della curva ottenute dai pozzi in cui una zanzara del gruppo di controllo non fusa è stata aggiunta a una quantità nota di farina contenente lo 0,002% di fluoresceina (scala dell'asse y = unità arbitrarie). (B) Volume dei pasti calcolato utilizzando letture di fluorescenza per le femmine del gruppo di controllo non alimentato (sinistra, nera, n = 40), il gruppo sperimentale che si nutriva di sangue (medio, rosso, n = 37) e il gruppo sperimentale che non si nutriva di sangue (destra, rosso, n = 23). Ogni punto rappresenta una misura di una singola femmina. I dati vengono visualizzati come mediani con intervallo. Le lettere indicano gruppi statisticamente distinti, il test di Kruskal-Wallis con il confronto multiplo di Dunn, p<0.01. Questi dati sono stati pubblicati in Jové etal. Clicca qui per visualizzare una versione più grande di questa figura.
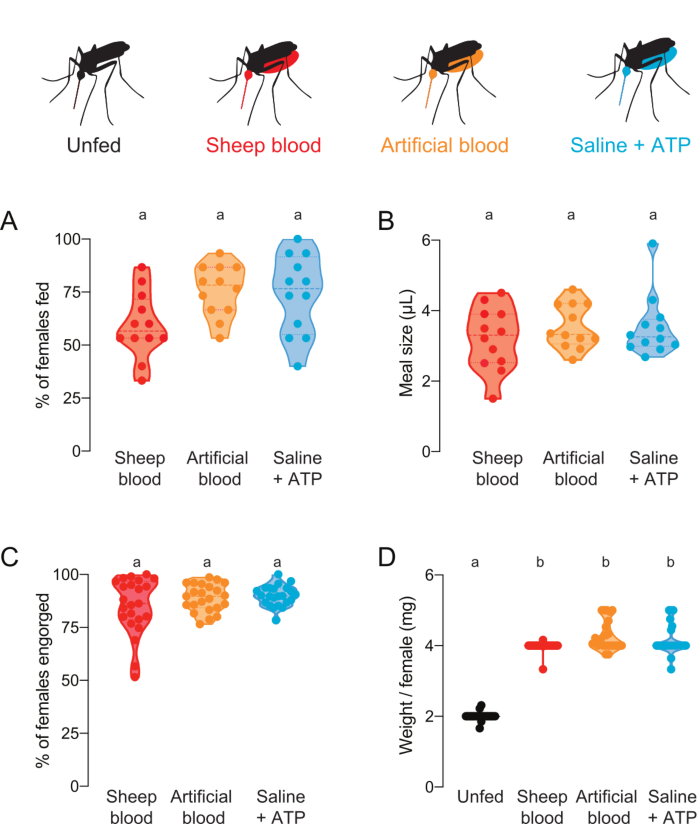
Figura 4: Quantificazione dei pasti con diversa composizione proteica. Alle femmine venivano offerti pasti di sangue di pecora (rosso), sangue artificiale con proteine del sangue umano (Kogan (1990)22) (arancione), o soluzione salina senza proteine + farina ATP (aqua)7. (A) Percentuale di femmine nutrite valutate utilizzando letture a fluorescenza. Ogni punto rappresenta un gruppo di 12-16 femmine. I dati sono mostrati come mediane con intervalli, n = 12. (B) Volume dei pasti calcolato mediante letture a fluorescenza. Ogni punto rappresenta una misurazione di una singola femmina in un'unica prova della figura 4A. I dati sono mostrati come mediane con intervalli, n = 12. (C) Percentuale di femmine completamente ingoiate dopo l'alimentazione artificiale della membrana, segnata dall'occhio. Ogni punto rappresenta la percentuale di femmine ingoiate da gruppi di 20-30 femmine. I dati sono mostrati come mediane con intervalli, n = 23. (D) Le dimensioni dei pasti sono state valutate come peso/femmina dopo che lo stato di alimentazione è stato valutato a occhio. I pesi sono stati calcolati come media di gruppi di 5 zanzare. I dati sono mostrati come mediane con intervalli, n = 23. A–D: Le lettere indicano gruppi statisticamente distinti, test di Kruskal-Wallis con il confronto multiplo di Dunn, p<0.05. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Quantificazione dei pasti con composti farmacologici. Le femmine consumano pasti delle stesse dimensioni di sangue di pecora (rosso), soluzione salina + ATP (acqua) e salina + ATP + 100 μM dose di agonista del recettore NPY Y2 umano TM30338 (blu scuro). Volume dei pasti calcolato utilizzando letture di fluorescenza. Ogni punto rappresenta una misura di una singola femmina. I dati sono mostrati come mediane con intervalli, n = 12. Le lettere indicano gruppi statisticamente distinti, il test di Kruskal-Wallis con il confronto multiplo di Dunn, p<0.05. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Quantificazione dei pasti più piccoli di nettare. (A) Schema del saggio di alimentazione del nettare. (B) Volume dei pasti calcolato utilizzando letture di fluorescenza per le femmine di tipo selvatico che offrivano pasti di acqua (blu, n = 36) o 10% di saccarosio (verde, n = 53), ciascuno con 0,002% di fluoresceina, nel saggio di alimentazione del nettare. Ogni punto rappresenta una misura di una singola femmina. I dati vengono visualizzati come mediane con intervalli. Le lettere indicano gruppi statisticamente distinti, test mann-whitney, p<0.05. Questi dati sono stati pubblicati in Jové etal. Clicca qui per visualizzare una versione più grande di questa figura.
| Farina di sangue artificiale | |||
| Concentrazione della soluzione stock (mg/mL) | Volume della soluzione stock in farina (μL/mL) | Concentrazione finale delle farine (mg/mL) | |
| Componenti proteici* | |||
| γ-globuline | 50 | 300 | 15 |
| Emoglobina | 35 | 230 | 8 |
| Albumina | 300 | 340 | 102 |
| Proteine totali | - | - | 125 |
| Componenti non proteici | |||
| Concentrazione della soluzione stock (mM) | Volume della soluzione stock in farina (μL/mL) | Concentrazione finale dei pasti (mM) | |
| Nacl | Nel γ-globulina | - | 5-10 |
| NaHCO3 | Nel γ-globulina | - | 120 |
| Atp | 200 | 5 | 1 |
| Acqua | - | 125 | - |
| *I componenti proteici sono preparati in soluzione stock di acqua doppia distillata, ad eccezione delle γ-Globuline, che vengono sciolte in NaHCO3 da 400 mM e includono una quantità variabile di NaCl (2-4%) nel prodotto. | |||
Tabella 1: Ricetta per la preparazione di esami del sangue artificiale (adattati da Kogan (1990)22). Il sangue artificiale è costituito da componenti proteici e non proteici che si trovano regolarmente nel sangue umano e offre la possibilità di variare i rapporti di questi componenti. Le zanzare possono produrre uova dopo essersi nutrite di sangueartificiale 7,22.
| Pasto salino | |||
| Componente | Concentrazione della soluzione stock (mM) | Volume della soluzione stock in farina (μL/mL) | Concentrazione finale dei pasti (mM) |
| Nacl | - | - | - |
| NaHCO3 | 400 | 300 | 120 |
| Atp | 200 | 5 | 1 |
| Acqua | - | 695 | - |
Tabella 2: Ricetta per pasti salini con ATP (adattato da Duvall et al. (2019)7). I pasti salini senza proteine possono essere utilizzati per fornire composti di interesse alle zanzare mentre si imita ancora la distensione addominale che si verifica dopo l'alimentazione del sangue, ma senza innescare lo sviluppo delle uova che si verifica quando le proteine vengono ingerite.
Discussione
Per molte applicazioni di laboratorio, gli alimentatori a membrana artificiale offrono benefici distinti rispetto agli host dal vivo consentendo ai ricercatori la possibilità di manipolare direttamente il contenuto del pasto. Sebbene siano disponibili più metodi per l'alimentazione artificiale a membrana, il metodo descritto qui offre vantaggi in termini di flessibilità, costi e produttività. Rispetto ad altri alimentatori commerciali a membrana, il saggio Glytube richiede un piccolo volume di pasti, rendendolo un meccanismo di consegna efficiente per costosi reagenti, compresi farmaci o agenti patogeni, riducendo al minimo il volume totalerichiesto 7,35. Poiché sia i pasti del sangue salino che artificiali esenti da proteine promuovono l'ingorgemento, composti o agenti patogeni possono essere aggiunti a entrambi i pasti come alternativa ad alta produttività e non invasiva alle iniezioni. Inoltre, ogni componente del Glytube può essere facilmente lavato, sostituito o scalato per fornire e quantificare più tipi di pasto senza contaminazione incrociata dell'apparato di alimentazione.
Per quantificare i volumi di pasti consumati dalle zanzare, il metodo a base di fluorescenza consente una quantificazione delle dimensioni dei pasti più precisa rispetto alla pesatura delle zanzare prima e dopo l'alimentazione. Va notato che questo metodo è un saggio del punto finale. Al contrario, la pesatura consente di mantenere in vita le zanzare per ulteriori sperimentazioni. Utilizzando un lettore di piastre, il metodo a base di fluorescenza può essere facilmente scalato per una quantificazione ad alta produttività dei pasti consumati da centinaia di singole femmine.
Per ottenere alti tassi di alimentazione, deve essere presente una combinazione di segnali host sufficienti per attivare il comportamento femminile in cerca di ospite e attirare le femmine nell'alimentatore. Se le zanzare non si affollano sotto il Glytube, il pasto potrebbe non essere riscaldato correttamente o la consegna di CO2 potrebbe non essere sufficiente. L'aggiunta di odore umano alla superficie della membrana aumenta in modo affidabile l'attrattiva della membrana artificiale. Se le zanzare vengono osservate sotto il Glytube ma non riescono a nutrirsi, la composizione del pasto potrebbe essere difettosa. Le femmine non possono nutrirsi se il pasto stesso non è caldo, il sangue è troppo vecchio o se gli additivi al pasto sono intrinsecamente avversi o causano una reazione chimicaindesiderabile 36. L'ATP aggiuntivo aumenta anche in modo affidabile i tassi di alimentazione e può essere scalato fino a una concentrazione finale di 2 mM in ciascuna delle ricette fornite. Le femmine non possono nutrirsi se il parafilm non viene tirato teso attraverso il tappo di Glytube; il parafilm dovrebbe essere uniformemente trasparente e non dovrebbe allacciarsi, in quanto ciò impedisce alla femmina di essere in grado di perforare efficacemente il parafilm con il suo stile. Se il pasto perde attraverso il Glytube sulla rete, il parafilm potrebbe aver strappato durante il processo di stiramento e deve essere sostituito.
Cambiare la composizione del pasto può anche consentire ai ricercatori di manipolare il periodo di tempo necessario per cancellare il pasto dal midgut e il successivo comportamento di ricerca dell'ospite. I pasti qui presentati richiedono 24-36 ore per ladigestione 7 simili al sangue di origine animale. Dopo essersi nutrite di uno di questi pasti, le femmine sopprimono la ricerca dell'ospite durante la finestra del tempo di digestione. Poiché il pasto salino manca di proteine, le femmine tornano alla ricerca dell'ospite dopo che il pasto è stato eliminato. Se è auspicabile un ritorno più veloce, i ricercatori possono scegliere pasti salini alternativi "quick clearing" che vengono escreti in circa 6 h27. Mentre la composizione del pasto salino qui presentato è abbinata per confrontare direttamente i risultati con la farina di sangue artificiale, il pasto di "pulizia rapida" corrisponde più strettamente ai livelli fisiologici di sale trovati nel sangue vertebrato.
I metodi qui descritti hanno limitazioni che dovrebbero essere prese in considerazione prima di selezionare il saggio più adatto agli obiettivi sperimentali del ricercatore. Le misurazioni della fluoresceina descritte non consentono di utilizzare nuovamente le zanzare per ulteriori sperimentazioni. Tuttavia, le misurazioni del peso possono essere effettuate prima della quantificazione delle dimensioni dei farine utilizzando il saggio sulla fluoresceina. Se il peso e le dimensioni dei pasti sono coerenti in più prove per un determinato pasto, il peso può essere utilizzato come proxy negli esperimenti futuri. Inoltre, questo protocollo non distingue tra deficit nella ricerca dell'ospite rispetto al comportamento di alimentazione del sangue; le zanzare che mostrano compromissioni nella ricerca dell'alimentatore a membrana avranno una riduzione dei tassi di alimentazione e / o delle dimensioni dei pasti. Aggiungendo una fotocamera per registrare il comportamento durante il test, i ricercatori possono determinare se le femmine non riescono a trovare il Glytube, o se trovano il Glytube, ma non si nutrono.
Il saggio descritto qui può essere adattato per esplorare molte domande in sospeso relative al comportamento alimentare nelle zanzare. Ad esempio, il contributo di specifiche proteine del sangue può essere esplorato alterando il rapporto tra proteine costituenti o concentrazione totale di proteine nella farina di sangue artificiale. Per valutare le dimensioni dei pasti da più eventi di alimentazione, è possibile aggiungere coloranti con spettri di fluorescenza distinti per differenziare i pasti da fontiuniche 37. Questo protocollo può anche essere modificato per stimolare separatamente le parti interne della bocca che rilevano il sangue e che vengono utilizzate per l'ingestione (cioè stylet), e le appendici chemiosensoriche che contattano la pelle (cioè laboratorio, gambe) mentre la zanzara atterra per iniziare l'alimentazione delsangue 36. Ad esempio, se i ligandi vengono aggiunti direttamente al pasto, non contattano il labium e le gambe, poiché la membrana viene perforata solo dallo stile. Se invece i ligandi vengono aggiunti alla superficie esterna del parafilm, rimangono separati dal pasto e possono essere contattati dal labium e dalle gambe36. Infine, la cinetica dettagliata del comportamento di alimentazione del sangue non è ben compresa e il metodo qui presentato potrebbe essere modificato per combinare il tracciamento ad alta risoluzione con strumenti di apprendimento automatico per estrarre letture comportamentali della locomozione, della postura e della dinamica dialimentazione 38.
Questo protocollo ha lo scopo di essere user-friendly ed economico, con la capacità di servire i ricercatori che impiegano manipolazioni farmacologiche e genetiche per studiare l'alimentazione del sangue delle zanzare e il comportamento post-emoderinazione.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Nipun Basrur, Adriana K. Rosas Villegas, Nadav Shai e Trevor Sorrells per i commenti sui manoscritti, e Zhongyan Gong e Kyrollos Barsoum per l'assistenza tecnica. Ringraziamo Alex Wild per le fotografie utilizzate nella Figura 1. K.V. è stato supportato dalla borsa di dottorato Boehringer Ingelheim Fonds. V.J. è stato supportato in parte da NIH T32-MH095246. Questo lavoro è stato supportato in parte da una sovvenzione alla Rockefeller University dall'Howard Hughes Medical Institute attraverso il programma James H. Gilliam Fellowships for Advanced Study a V.J. Questo materiale si basa sul lavoro sostenuto dal National Science Foundation Graduate Research Fellowship Program nell'ambito del Grant No. Da NSF DGE-1325261 a V.J. Le opinioni, i risultati e le conclusioni o raccomandazioni espressi in questo materiale sono quelli dell'autore o degli autori e non riflettono necessariamente le opinioni della National Science Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | Fisher Scientific | 14-959-70C | |
| 3 mm diameter borosilicate solid-glass bead | MilliporeSigma | Z143928 | For use for bead mill homogenizer; not required if using pellet pestle grinder |
| 32 oz. high-density polyethylene (HDPE) plastic cup | VWR | 89009-668 | Example mosquito container used for feeding assays shown; alternate options can be used |
| 50 mL conical tubes | Fisher Scientific | 14-959-49A | |
| 96-well black polystyrene plate | ThermoFisher | 12-566-09 | |
| 96-well PCR plate sealing film | Bio-Rad | MSB1001 | Alternate options can be used |
| 96-well PCR plates | Bio-Rad | HSP9621 | Alternate options can be used |
| Adenosine 5′-triphosphate (ATP) disodium salt hydrate | MilliporeSigma | A6419 | |
| Albumin (human serum) | MilliporeSigma | A9511 | |
| Aluminum foil | Fisher Scientific | 01-213 | Alternate options can be used to block light entering fluorescein container |
| Balance | Fisher Scientific | 01-911 | Alternate options can be used |
| Bead mill homogenizer | Qiagen | 85300 | Not required if using pellet pestle grinder |
| Cotton ball | Fisher Scientific | 22456880 | For nectar-feeding; alternate options can be used |
| Defibrinated sheep blood | Hemostat Laboratories | DSB100 | Alternate options can be used |
| Drosophila CO2 fly pad | Tritech Research | MINJ-DROS-FP | Alternate options can be used |
| Fluorescein | MilliporeSigma | F6377 | |
| Fluorescence plate-reader | ThermoFisher | VL0000D0 | Alternate options can be used |
| Gamma-globulin (human blood) | MilliporeSigma | H7379 | |
| Glycerol | MilliporeSigma | G7893 | |
| Hemoglobin (human) | MilliporeSigma | G4386 | |
| Laboratory wrapping film - parafilm | Fisher Scientific | 13-374 | |
| Magnetic stirrer | Fisher Scientific | 90-691 | Alternate magnetic stirrers can be used |
| Microcentrifuge for 96-well plate | VWR | 80094-180 | Alternate options can be used |
| Microcentrifuge Tubes | MilliporeSigma | 2236412 | Alternate options can be used |
| Pellet pestle grinder | VWR | KT749521-1500 | Not required if using bead mill homogenizer |
| Phosphate buffered solution (PBS) | Fisher Scientific | BW17-516F | Optional |
| Razor blades | Fisher Scientific | 12-640 | Alternate options can be used, such as a lathe for better consistency of cutting |
| Rubber bands | |||
| Silicone tubing | McMaster Carr | Needed if using a fly pad for CO2 delivery | |
| Sodium bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Sodium chloride (NaCl) | MilliporeSigma | S9888 | |
| Stir bars | Fisher Scientific | 14-512 | Alternate magnetic stir bars can be used |
| Translucent polypropylene storage box with removable lid | Example box used for feeding assays shown | ||
| Vortex mixer | |||
| Water bath | Alternate heating device may be used | ||
| White 0.8 mm polyester mosquito netting | American Home & Habit Inc. | F03A-PONO-MOSQ-M008-WT | Alternate options can be used |
Riferimenti
- Bhatt, S., et al. The global distribution and burden of dengue. Nature. 496 (7446), 504-507 (2014).
- Rogers, D. J., Wilson, A. J., Hay, S. I., Graham, A. J. The global distribution of yellow fever and dengue. Advances in Parasitology. 62 (05), 181-220 (2006).
- Chouin-Carneiro, T., et al. Differential susceptibilities of Aedes aegypti and Aedes albopictus from the Americas to Zika virus. PLoS Neglected Tropical Diseases. 10 (3), (2016).
- Guerbois, M., et al. Outbreak of Zika virus infection, Chiapas State, Mexico, 2015, and first confirmed transmission by Aedes aegypti mosquitoes in the Amercias. Journal of Infectious Diseases. 214 (9), 1349-1356 (2016).
- Weaver, S. C., et al. Zika virus: history, emergence, biology, and prospects for control. Antiviral Research. 130, 69-80 (2016).
- Attardo, G. M., Hansen, I. A., Raikhel, A. S. Nutritional regulation of vitellogenesis in mosquitoes: implications for anautogeny. Insect Biochemistry and Molecular Biology. 35 (7), 661-675 (2005).
- Duvall, L. B., Ramos-Espiritu, L., Barsoum, K. E., Glickman, J. F., Vosshall, L. B. Small-molecule agonists of Ae. aegypti neuropeptide Y receptor block mosquito biting. Cell. 176 (4), 687-701 (2019).
- Dimond, J. B., Lea, A. O., Hahnert, W. F., DeLong, D. M. The amino acids required for egg production in Aedes aegypti. The Canadian Entomologist. 88 (2), 57-62 (1956).
- Guerrero, D., Cantaert, T., Missé, D. Aedes mosquito salivary components and their effect on the immune response to arboviruses. Frontiers in Cellular and Infection Microbiology. 10, 1-11 (2020).
- Raquin, V., Lambrechts, L. Dengue virus replicates and accumulates in Aedes aegypti salivary glands. Virology. 507, 75-81 (2017).
- Farjana, T., Tuno, N. Multiple blood feeding and host-seeking behavior in Aedes aegypti and Aedes albopictus (diptera: Culicidae). Journal of Medical Entomology. 50 (4), 838-846 (2013).
- Scott, T. W., Takken, W. Feeding strategies of anthropophilic mosquitoes result in increased risk of pathogen transmission. Trends in Parasitology. 28 (3), 114-121 (2012).
- Ross, P. A., Lau, M. J., Hoffmann, A. A. Does membrane feeding compromise the quality of Aedes aegypti mosquitoes. PLoS ONE. 14 (11), 1-19 (2019).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with wolbachia. Journal of Visualized Experiments. 2017 (126), 1-8 (2017).
- Briegel, H., Hefti, M., DiMarco, E. Lipid metabolism during sequential gonotrophic cycles in large and small female Aedes aegypti. Journal of Insect Physiology. 48 (5), 547-554 (2002).
- McMeniman, C. J., Corfas, R. A., Matthews, B. J., Ritchie, S. A. S., Vosshall, L. B. Multimodal integration of carbon dioxide and other sensory cues drives mosquito attraction to humans. Cell. 156 (5), 1060-1071 (2014).
- Pakes, S. P., et al. . Guide for the Care and Use of Laboratory Animals. , (2011).
- Deng, L., Koou, S. Y., Png, A. B., Ng, L. C., Lam-Phua, S. G. A novel mosquito feeding system for routine blood-feeding of Aedes aegypti and Aedes albopictus. Tropical Biomedicine. 29 (1), 169-174 (2012).
- Gunathilaka, N., Ranathunge, T., Udayanga, L., Abeyewickreme, W. Efficacy of blood sources and artificial blood feeding methods in rearing of Aedes aegypti (Diptera: Culicidae) for sterile insect technique and incompatible insect technique approaches in Sri Lanka. BioMed Research International. 2017, 3196924 (2017).
- Costa-da-Silva, A. L., et al. Glytube: a conical tube and parafilm M-based method as a simplified device to artificially blood-feed the Dengue vector mosquito, Aedes aegypti. PLoS ONE. 8 (1), 53816 (2013).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments. 83 (83), 1-10 (2014).
- Kogan, P. H. H. Substitute blood meal for investigating and maintaining Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 27 (4), 1-4 (1990).
- Gonzales, K. K., Hansen, I. A. Artificial diets for mosquitoes. International Journal of Environmental Research and Public Health. 13 (12), (2016).
- Baughman, T., et al. A highly stable blood meal alternative for rearing Aedes and Anopheles mosquitoes. PLoS Neglected Tropical Diseases. 11 (12), 0006142 (2017).
- Galun, R. Feeding stimuli and artificial feeding. Bulletin of the World Health Organization. 36, 590-593 (1967).
- Galun, R. Feeding response in Aedes aegypti: stimulation by adenosine triphosphate. Science. 142, 1674-1675 (1963).
- Jové, V., et al. Sensory Discrimination of Blood and Floral Nectar by Aedes aegypti Mosquitoes. Neuron. 108, 1-18 (2020).
- Petersen, M. T., et al. The impact of the age of first blood meal and Zika virus infection on Aedes aegypti egg production and longevity. PLoS ONE. 13 (7), 1-15 (2018).
- Sissoko, F., et al. Frequent sugar feeding behavior by Aedes aegypti in Bamako, Mali makes them ideal candidates for control with Attractive Toxic Sugar Baits (ATSB). PLoS ONE. 14 (6), 0214170 (2019).
- Houseman, J. G., Downe, A. E. R. Methods of measuring blood meal size and proteinase activity for determining the effects of mated state of digestive processes of female Aedes aegypti (L.) (Diperta: Culicidae). The Canadian Entomologist. 18, 241-248 (1986).
- Redington, B. C., Hockmeyer, W. T. A method for estimating blood meal volume in Aedes aegypti using a radioisotope. Journal of Insect Physiology. 22 (7), 961-966 (1976).
- Gonzales, K. K., et al. The effect of SkitoSnack, an artificial blood meal replacement, on Aedes aegypti life history traits and gut microbiota. Scientific Reports. 8 (1), 1-14 (2018).
- Klowden, M. J. The endogenous regulation of mosquito reproductive behavior. Experientia. 46 (7), 660-670 (1990).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 22486 (2013).
- Frances, S. P., Sithiprasasna, R., Linthicum, K. J. Laboratory evaluation of the response of Aedes aegypti and Aedes albopictus uninfected and infected with Dengue virus to Deet. Journal of Medical Entomology. 48 (2), (2011).
- Dennis, E. J., Goldman, O. V., Vosshall, L. B. Aedes aegypti mosquitoes use their legs to sense DEET on contact. Current Biology. 29 (9), 1551-1556 (2019).
- Harrington, L. C., et al. Heterogeneous feeding patterns of the Dengue vector, Aedes aegypti, on individual human hosts in rural Thailand. PLoS Neglected Tropical Diseases. 8 (8), 3048 (2014).
- Hol, F. J., Lambrechts, L., Prakash, M. BiteOscope, an open platform to study mosquito biting behavior. eLife. 9, 1-24 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon