Method Article
レプトメニンゲレス病の直接標的療法を研究するマウス・オンマヤ異種移植片モデル
要約
ここでは、患者のOmmaya貯留層に機能的に類似したマウス異種移植片モデルについて述べる。私たちは、普遍的に致命的なレプトメニンゲール病の新しい治療法を研究するためにマウスオンマヤを開発しました。
要約
レプトメニンゲレス病(LMD)は、脳脊髄液(CSF)に対する中枢神経系(CNS)のまれなタイプの転移である。LMDを引き起こす最も一般的な癌は、乳癌および肺癌および黒色腫である。LMDと診断された患者は予後が非常に悪く、一般的に数週間または数ヶ月間しか生き残らない。LMDに対する全身療法の有効性の欠如の1つの考えられる理由は、脈絡叢を横切る無傷で比較的不浸透性の血液脳関門(BBB)または血液CSFバリアのためにCSF中の薬物の治療的に有効な濃度を達成できなかったことである。したがって、直接、これらの障壁を克服し得る内耳通りまたは心室内の薬物を投与する。このグループは、慢性的に治療(すなわち、薬物、抗体、細胞療法)の効果的な送達を可能にするモデルを開発し、CSFの薬物濃度および標的変調を決定するCSFの繰り返しサンプリング(腫瘍微小環境がマウスを標的とする場合)を可能にする。このモデルは、臨床的に使用される磁気共鳴画像性のOmmayaリザーバーに相当するマウスです。このモデルは、頭蓋骨に貼り付けられ、「ネズミのオンマヤ」に指定されています。治療的な概念実証として、ヒト表皮成長因子受容体2抗体(クローン7.16.4)をマウス・オンマヤを介してCSFに送達し、ヒト表皮成長因子受容体2陽性乳癌からLMDを用いたマウスを治療した。マウス・オムマヤは、ミニチュアアクセスポートを使用して薬物送達の効率を高め、過剰な薬物の浪費を防ぎます。分子および免疫学的研究のためにCSFのサンプリングを妨げない。マウス・オムマヤは、LMDの実験モデルで新しい治療薬をテストするのに有用である。
概要
レプトメニンゲ症候群(LMD)は、CNSの積極的な後期転移であり、腫瘍細胞がCSFにアクセスし、脳および脊髄1の表面に浸透する。LMDを引き起こす最も一般的な癌は、黒色腫と同様に、乳癌および肺のものが含まれる。LMDは、頭痛、脳神経麻痺、肩こり、ラジカルパチーなどの神経学的症状や徴候の数をもたらします。LMD患者の予後は、一般的に非常に悪い(平均生存率は週単位で測定される)、普遍的に致命的な3、4、5、6、7である。手術、放射線、全身化学療法による治療は緩和的です。LMDに対する全身療法は、脈絡叢1を横切る無傷のBBBまたは血液CSFバリアを横切るCSFへの不十分な薬物浸透のために失敗する可能性がある。
従って、がん治療薬(例えば、チェックポイント阻害剤および細胞療法を含む薬物および抗体ベースの治療法)を直接CSFに投与することは、この制限8を克服し得る。患者からのCSFへのアクセスおよびサンプリングは頭皮の下に埋め込まれるOmmayaの貯蔵所を通して可能である。この装置は、脊髄タップを行わずに、癌剤(例えば、メトトレキサートおよびトラスツズマブ)の投与と診断研究のためのCSFのサンプリング(例えば、治療への応答を監視するLMDの細胞学的診断)を可能にする。マウスオンマヤ貯水池は、臨床的に使用されるものを模倣するように設計されました.貯蔵所は、アクセスポートとスペーサー部品の組み立てとマウスの缶取技術の変更を必要とし、薬物研究の期間中、デバイスを永久にそのまま残すことができます。この装置は「ネズミのオンマヤ」として指定されています。
浸透圧注入ポンプ技術とは対照的に、チューブ内の空きスペースを予め充填するために余分な液体量を調製し、頻繁な注射9に対する連続注入を必要とする、マウス・オンマヤは薬物溶液の浪費を最小限に抑える。ハミルトンシリンジ、ミニチュアアクセスポート、自動インジェクタを使用して、一定の時間に少量(3〜7 μL)で複数の治療をCSFに効果的に投与できます。リアルタイムでは、LMDに対する試験薬の有効性は、イメージングによって決定することができる。このアプローチを用いて、様々な化学療法、抗体、および細胞免疫療法(単一または複合剤として)をLMDに対してテストし、生体内所見を患者の合理的な治療戦略に変換することができる。LMDの患者由来異種移植片(PDX)モデルのイメージング能力をさらに向上させるために、組み立てを必要とせず、使用する準備ができているM.ingmayaの磁気共鳴画像(MRI)互換バージョンを開発するためにメーカーとのコラボレーションが行われました。MRI機能は、特にCSFからの循環腫瘍細胞(CTC)の量が制限因子であるPDXモデルに対して有益であり、しばしばCTCの事前標識が不可能な場合である。
このペーパーでは、LMD を使用してマウスをレンダリングする CTC の注入から始まる詳細なプロトコルについて説明します。その後、マウス・オンマヤを外科的に移植し、マウス・オンマヤを介して複数の薬物治療ステップが行われる。実証の概念実証として、in vivoを並べて比較し、マウスヒト表皮成長因子受容体2(Her2)抗体をクローン7.16.4(ヒト相当トラスツズマブ)と呼んで10を送達した。抗体は、マウス・オンマヤ(直接標的療法または内皮療法)または腹腔内注射(全身療法)のいずれかを介してHer2+ 乳癌細胞を標的とする。その結果、直接頭蓋内免疫療法を受けたLMDを有するマウスは、同じ治療を全身的に治療したものよりも有意に長く生きていたことが示された。マウス・オンマヤを介して治療されたマウスのCNS転移は、治療の第3週の第3用量によってほぼ完全に後退し、全体的な生存率を改善した。
プロトコル
この議定書は、南フロリダ大学の制度的動物の世話と使用委員会(IS00005974)によって承認されました。
1. CSF への CTC の注入によるマウス LMD モデルの生成
- CTCの準備
- 注射に必要なCTCの数を計算し、1.0×104 細胞/μLの無菌リン酸緩衝生理食塩水(PBS)で単細胞懸濁液を調製します。細胞懸濁液を氷の上または4°Cの手順全体で置きます。
注:トリプシン化が必要な細胞株を使用する場合は、トリプシンを除去するために滅菌PBSで細胞を2回洗浄してください。ヘモサイトメーターまたは自動セルカウンターを使用して細胞数を計算します。大きなコホート(>50マウス)を使用する場合は、細胞を再集計し、注射の間の細胞生存率を検証して、マウスごとに一貫した数の細胞が投与されるようにします。
- 注射に必要なCTCの数を計算し、1.0×104 細胞/μLの無菌リン酸緩衝生理食塩水(PBS)で単細胞懸濁液を調製します。細胞懸濁液を氷の上または4°Cの手順全体で置きます。
- 前外科手術
- マウスを皮下に1mg/kgブプレノルフィン持続放出(Bup-SR)で注入する。
注:提案された切開の領域を注入しないでください。十分に肩甲骨から離れた注射部位を選択してください。 - マウスを2~3%のイソフルランで麻酔し、右反射の兆候が見えなくなるまで麻酔をします。また、尾や足のピンチ反射を確認して麻酔の状態を確認します。
- 手術領域から離れた場所で手術のためにマウスを準備します。切開部位を汚染する毛皮を防ぐのに十分な境界領域を有する外科部位(すなわち、頭蓋骨の後ろ面)をクリップする。次に、殺菌性皮膚消毒剤でサイトを飽和し、サイトの中心から周辺まで働き、乾燥させます。滅菌ドレープまたは滅菌接着剤で裏打ちされたプラスチックドレープ材料を塗布して、外科現場を汚染から保護します。
注:器具は事前にオートクレーブされ、先端はガラスビーズの殺菌器を使用して動物間で再殺菌されるべきである。 - 頭部の腹側表面全体の毛皮を剃り、滅菌技術を用いて皮膚を準備する。
- 立体戦術装置の改変されたL字型の鼻コーンで鼻を設置し、ナレスが透明で開いたままであることを確認します。両ピネの腹側表面にテープを使用して、皮膚を優しく前方に引っ張って鼻コーンに固定し、一度固定したら約90°の角度で首を曲げます。麻酔を維持するために1.5%のイソファランを投与する。
注:適切な位置決めは、後頭部骨の尾根の容易な識別を可能にする方法で切開領域が提示される結果となる。 - 背骨が水槽マグナと同じレベルに保たれるように体を配置し、尾部にわずかなトラクションを施しながら、テールベースにテープを置いて固定します。
- マウスを皮下に1mg/kgブプレノルフィン持続放出(Bup-SR)で注入する。
- 外科用水槽マグナ注射
- 首を完全に伸ばして、ピネの間から始まり、後頭部の骨を横切ってわずかな圧力で外科的はさみの先端を下方に走らします。
注:この正中の位置にいる間、シスターナマグナの上の凹部にはさみの先端が浸ると、小さなくぼみが目立ちます。 - 触診した凹部のすぐ上に小さな3〜5mmの正中線切開を行います。1.0 × 10個の 4 細胞/μL (合計 5.0 × 104 細胞) で 5 μL の細胞懸濁液を 30 G ハミルトンシリンジに引き込みます。
- 1-2 mmの先端を持つ鈍い先端の鉗子を使用して、水槽のマグナを静かに押し下げます。閉じた位置にチップを導入し、硬膜に下圧を加えながら開きます。
- 硬膜が容易に同定されるまで前のステップで説明した鈍い解剖を繰り返し、そして、関連する血管が露出領域に見える。
注:結果として得られる注入の窓は針の挿入の間に血管が損傷を受けなくなっている保障する。 - 鉗子を開いたまま周囲の筋肉を引き込む間、ベベルを視覚化するために硬膜の下に30Gの非得点針を導入する。針がベベル自体を超えて導入されていることを確認します。ゆっくりと注射器プランジャーを展開し、硬膜のすぐ下に細胞を送達します。
- ベベルを適切に配置して、硬膜の下に注射を観察します。慎重に技術を管理し、膜への損傷を防ぎ、最小限の漏出を確保するために30 Gの非採点針を使用します。漏れが指摘された場合は、綿の先端のアプリケーターで穏やかな圧力を加えます。
- 傷ついたクリップまたは皮膚接着剤のマイクロドロップを塗布して、皮膚を閉じます。注射が正常に行われたら、マウスは暖かい毛布の麻酔から回復し、胸骨の位置を維持し、意図的な動きを実証できるようになるまで継続的に観察することができます。
- 最初の週の手術後、毎日マウスを監視します。マウスが痛みや苦痛を感じているようであれば、12~24時間に1回、12~24時間に1回、獣医の相談と指示に基づいてカルプロフェンを10mg/kgの皮下注射で治療してください。マウスが回復し、次のステップに進む前に、少なくとも48〜72時間監視できるようにします。
注意:Bup-SRは、プリエンプティブに与えられ、最大72時間持続するので、追加の鎮痛薬は通常必要ありません。しかし、動物は必要に応じて追加の鎮痛薬を提供されます(無気力、食べない、フリルの場合)。手術部位が術後感染の兆候(すなわち、発赤、腫脹、圧痛、痛み、痛み、痛み、または膿瘍)を発症した場合、またはマウスが患部を守っている場合、マウスを安楽死させる。がん細胞がCSFに正常に注入された場合、LMDおよび腫瘍の進行は1〜2週間以内にCNSで発症する(使用されるCTまたは細胞株の種類に応じて) (図1)。
- 首を完全に伸ばして、ピネの間から始まり、後頭部の骨を横切ってわずかな圧力で外科的はさみの先端を下方に走らします。
2. ネズミオンマヤアセンブリと移植
- 駅の準備
- ステーション表面を消毒します。青い被覆を表面に置き、 図2に示されているすべての滅菌工具と消耗品を準備してください。
- 前外科手術
- 鎮痛(Bup-SR)を適用し、セクション1.2で説明したように滅菌技術を維持する。
- ネズミのオンマヤの外科的移植
- 25 G (0.51 mm の外径) のミニチュア射出口と 1 mm のスペーサー ディスクを使用して、マウス オンマヤインジェクション デバイスを組み立てます。シアノクリレート滅菌接着剤を使用して、右脳半球への約2.5mmの金属カニューレの浸透を確実にする(図3A-C)。
注:MRI互換マウスOmmayaプロトタイプは、すでに両方の部品(ミニチュアインジェクションポートとスペーサ)を1つのユニットとして一緒に3Dプリントしたこの研究室で開発されました(図3D)。単一ユニットバージョンはMRIによってテストされ、組み立てステップを排除することで時間を節約できます。 - 右反射の兆候がなくなるまで、2-3%イソフルランでマウスを麻酔します。また、麻酔の状態を確認するために、尾や足のピンチ反射を確認してください。
- ファーの頭の腹側表面全体を剃り、手順1.2.3で前述したように、滅菌技術に従って皮膚を準備する。マウスを鼻コーンで立体化装置に入れ、処置中にイオブルラン投与を継続する。イオブルランを1.5%に減らす。耳の棒を軽く締めて頭を固定し、目の潤滑剤を塗布してマウスの目を覆います。
- 小さな皮膚切開(3mm)を行い、続いて下層の皮下組織を鈍い解剖して頭蓋骨を露出させる。過酸化水素浸し綿チップアプリケータースティックを使用して頭蓋骨を乾燥させます。
- 頭蓋骨に0.5mm後部および1.1mmの針状縫合糸が矢状縫合糸によって垂直に交差する頭蓋骨の矢状の解剖学的点の1.1mm側面にバリ穴を開け、0.9mmのバリ穴を開けて硬膜を露出させる。マイクロドリルを脇に移動し、注射口(約2.5mmの深さ)を挿入する前に、バリ穴を取り囲む骨を優しくスコアリングし、シアノアクリル酸滅菌接着剤を使用して頭蓋骨に貼り付けます。中断されたステッチパターンまたは財布の紐縫合線11に4-0ノー吸光度ナイロン縫合糸を使用して射出スポットの周りの状態縫合。
- 手術後のマウスを個々のケージに入れて、手術の回復を行う。
注:複数の手術で回復したマウスが同じケージに収容されている場合、マウスオンマヤが外れる可能性があります。マウス・オンマヤ移植マウスは、薬物有効性試験の過程で個別に(またはケージあたり2匹以下のマウス)収容することが推奨される。
- 25 G (0.51 mm の外径) のミニチュア射出口と 1 mm のスペーサー ディスクを使用して、マウス オンマヤインジェクション デバイスを組み立てます。シアノクリレート滅菌接着剤を使用して、右脳半球への約2.5mmの金属カニューレの浸透を確実にする(図3A-C)。
3. ネズミオンマヤ治療
- マウス・オンマヤを使用したマウスのドージング
- 反射を右にする兆候がなくなるまで、2-3%のイソフルランでマウスを麻酔します。また、尾や足のピンチ反射を確認して麻酔の維持を確認します。
- ポートインジェクションアダプターとハミルトン注射器を使用して、マウス・オンマヤにアクセスします。鉗子を使用して、ミニチュア注入口の上部を保持し、ポートインジェクターアダプターをポートの中隔に完全に静かに挿入します。
注:ポートインジェクタは、デッドスペースを最小限に抑え、電動シリンジポンプを介して制御された注入を可能にする方法でポートの中隔を貫通します(図4A)。麻酔下で、標的/新規治療を1 μL/minの流量で注入します。治療は、研究者の裁量に従って、一定の期間(数週間/月)、指定された間隔(毎日/毎週)で与えられる予定です。
3 μL から 7 μL までのボリュームは、3 μL <のボリュームが信頼性が低く、7 μL >のボリュームが圧力を大きくする可能性があるため、最適です。ハミルトンシリンジのサイズは、各治療アームのマウスの数に応じて、10〜100 μLの範囲で可能です。適切なボリュームをハミルトンのシリンジにプリロードすることで、シリンジの繰り返し交換が防止され、エラーを最小限に抑えることができます。治療アームごとに1ハミルトンシリンジを捧げるのが最善です。 - 注射が行われたら、鉗子を使用してポートインジェクションアダプターからマウス・オンマヤを取り外し、ステップ1.3.7で前述したように、マウスをケージに戻して麻酔から回復します。
- 安楽死
- 圧縮タンク源から二酸化炭素(CO2)を吸入してマウスを安楽死させる。マウスをCO2 の濃度を増加させる(すなわち、チャンバー体積/分の10%から30%の変位率が使用される)に当てはめるため、不快感や苦痛を回避または最小限に抑えます。心血管および呼吸運動の停止の保証までマウスを監視します。
結果
マウスでは、CSFの総体積は約35〜40μLで、約350nL/minの速度で生産されます。それは1日12回12-13回をひっくり返す。注射の経路を可視化するために、2%エバンスブルーをマウス・オンマヤモデルを介して注射し、その後15分および30分が分析のために脳を収穫する前に経過することを許された。染料は15分で心室と脳に浸透した。30分以内に、色素が脊髄に見えるようになった(図4)。
概念実証として、BALB/cマウスにルシメラーゼ標識Her2+TUBO乳癌細胞株を内分槽内に注射し、マウス・オンマヤスを移植した。癌細胞の注入から約1週間後、マウスはLMDを発症し始めた。これらのマウスは、腹腔内注射またはマウス・オンマヤを介した腹腔内注射による全身療法を介して、ハー2抗体免疫療法で週に1回最大4週間治療した(図5A)。
未治療マウスは19日目までに死亡したが、マウス・オンマヤを通じて脳内療法を受けたすべてのマウスは生存した(P= 0.004)。第4週までに、腫瘍の完全な退行が観察された。LMDの治療に適度な成功を収めた全身療法で治療されたマウスと比較して、脳内療法を受けたマウスは、全生存期間がはるかに長かった(図5B)。
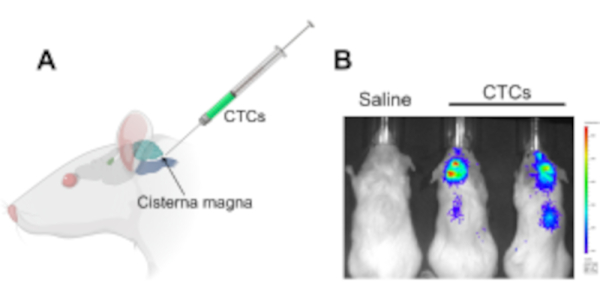
図1:レプトメニンゲレス病および中枢神経系転移を研究するために、マウス異種移植片モデルにおける循環腫瘍細胞の水槽マグナへの注入(A)ハミルトン注射器を用いてCTCsを注入するシスタンナマグナおよびCSFアクセス部位の位置を示す図。(B)循環腫瘍細胞で2週間注射した後にレプトメニンゲール病と中枢神経系転移(脳及び脊髄に沿って)を発症したマウスの代表的なIVIS画像。細胞はルシファーゼレポーター遺伝子で標識した。生理液を注射した対照動物は腫瘍(n=3)を発症せず、三重化で実験を行った。略語: CTC = 循環腫瘍細胞;IVIS =インビボイメージングシステム。この図の大きなバージョンを表示するには、ここをクリックしてください。
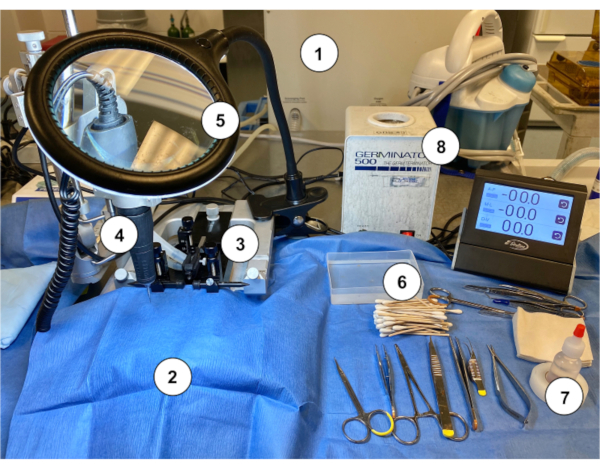
図2:マウスでマウス・オンマヤ移植を行うワークステーションのセットアップ例 (1) ガス麻酔装置/気化器。(2)立体的スタンドを覆う無菌ブルーペーパードレープ。(3)立体装置(スタンド/ステージ、イヤーバー、ノーズコーン)。(4) マイクロドリル。(5)ガラスを光で拡大する。(6)滅菌綿タップアプリケーターは、滅菌生理食糸リンス容器を貼り付けます。(7)過酸化水素。(8)ビード滅菌剤。 この図の大きなバージョンを表示するには、ここをクリックしてください。
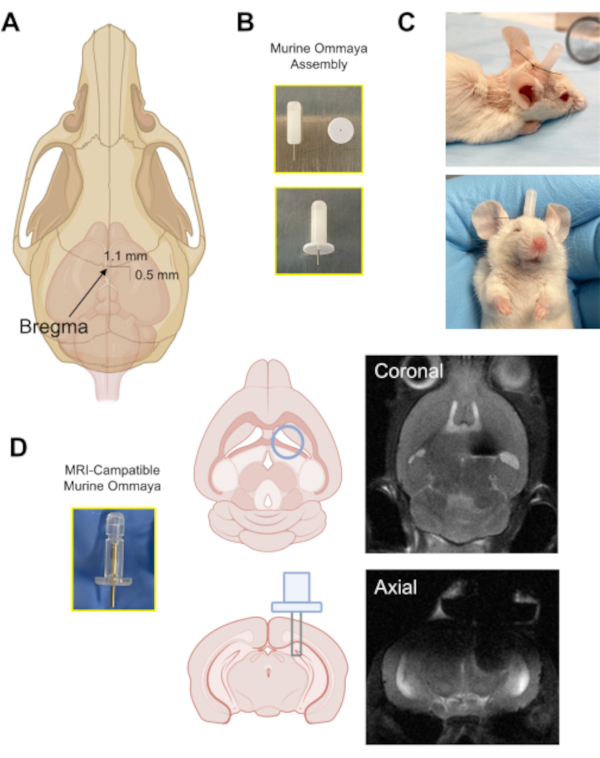
図3: マウス・オンマヤ装置の移植( A)頭蓋骨のブレグマの位置を指す矢印を持つ図と、マイクロドリルを用いてブレグマから頭蓋骨(0.5mm後部/1.1mm側面)にバリ穴が開けられるおおよその距離。(B)マウス・オンマヤは、金属カニューレと1mmスペーサーをスカルに接着剤付着用のベースとして組み合わせて組み立てます。(C) マウスオムマヤスを移植したマウスの代表的な画像;これらのマウスは、注射を受ける前に明るく、警告し、反応性があることを確認するために監視されます。(D) マグリン・オムマヤ移植器の磁気共鳴画像適合性マウス・オンマヤと代表的な脳磁気共鳴画像画像画像の例。 この図の大きなバージョンを表示するには、ここをクリックしてください。
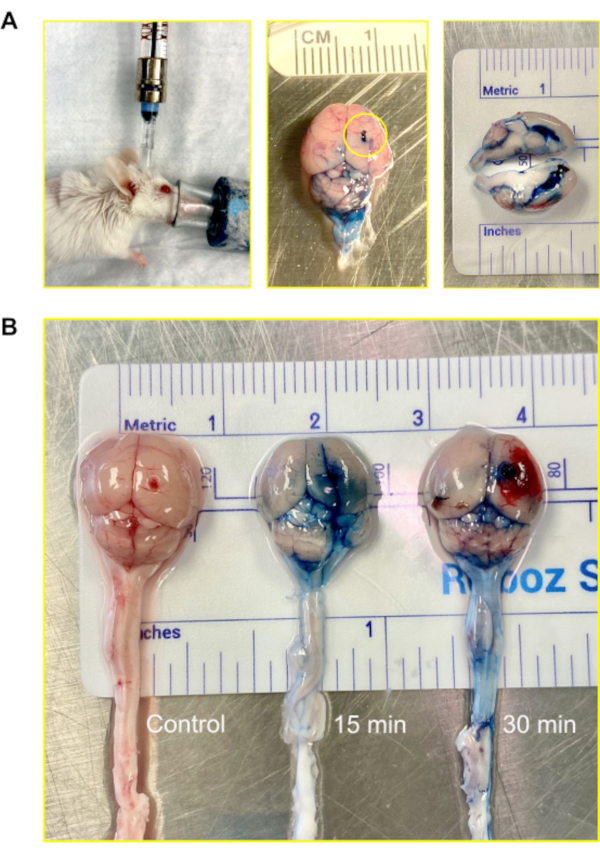
図4:マウス・オンマヤを用いた脳室内(中枢神経系)注射(A)マウス・オンマヤを介して心室および中枢神経系にアクセスする注射の画像。マウスは注射中に麻酔下に残る。この例では、マウス・オンマヤは、プレフィルド・ハミルトン・シリンジに取り付けられたミニチュアポートに接続されています。注入は1μL/minの自動注入の速度および5-7 μLの容積で設定される自動注入を使用して行われる。エバンスブルーを注入したマウス脳の画像が表示されます。円は、マウス・オンマヤが取り付けられた場所を示しています。脳の外面には色素の漏出は認められなかった。脳の断面は、側心室が染料で満たされたことを示しています。色素は脳のパレンチマを貫通しなかった。(B) エバンスブルー染料の注射後15分と30分後のマウス脳の画像。色素が脳に浸透し(15分)、脊髄(30分)に循環し始めた。5匹のマウスのうち、4匹は視覚化用の染料を受け取り、1匹は対照役を務めた。実験は三重で繰り返された。この図の大きなバージョンを表示するには、ここをクリックしてください。
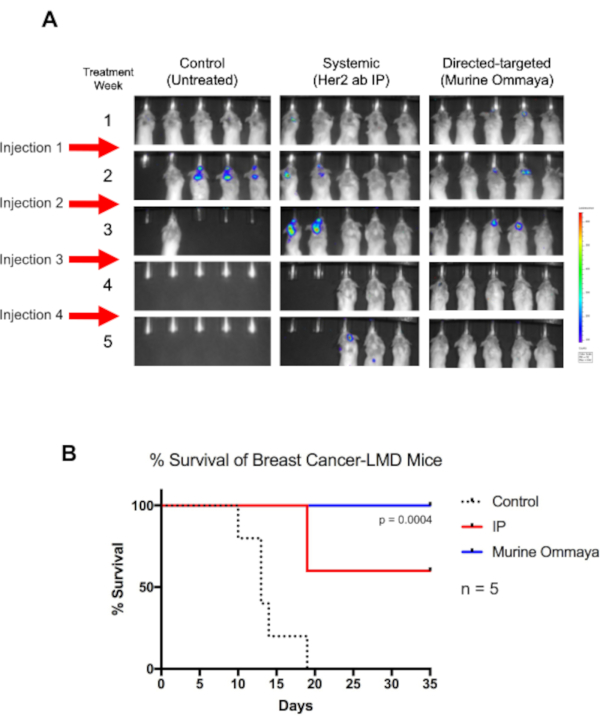
図5:マウス・オンマヤを用いた直接標的免疫療法は、乳癌関連レプトメニンゲレス病マウスの全生存率を増加させる。(A)BALB/cマウスにルシファーゼレポーター標識ヒト表皮成長因子受容体2陽性TUBO細胞、マウス乳癌細胞株を注射した。水槽マグナ注射の3日後、マウス・オンマヤスが移植された。マウスは注射後1週間にレプトメニンゲール病(LMD)を発症し始めた。LMDマウスは、ヒト表皮成長因子受容体受容体抗体を腹腔内注射を介して全身的に、または直接標的化アプローチとして、その内皮(M.Ommaya)を介して治療した。注射は週に1回、最大4週間投与した。未治療マウスと比較して、免疫療法を受けているマウスははるかに長く生存した。マウス・オンマヤマウスは4週目までに完全な疾患退縮を行い、これらのマウスは最終的に疾患を治癒した。(B) これらのマウスは、中央値生存率も有意に良い(マンテル-コックス試験;P = 0.004;n = 治療アームあたり5匹のマウス)と、体系的に処置されたLMDマウスよりも全体的な生存率が優れている。略語: LMD = レプトメニンゲール病;IP = 腹腔内。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここで、マウス・オンマヤは、LMDおよび他のCNS関連疾患の前臨床モデルにおけるCSF空間への抗癌剤の繰り返し投与を可能にする信頼できるモデルとして説明されている。CSFは、デバイスがまだ中断することなく取り付けられている間にマウスからサンプリングされた。この直接標的療法異種移植片モデルは、LMDの合理的な治療戦略を開発し、テストする上で重要なステップです。水槽マグナ注射からLMDの初期徴候までの時間は、がん細胞の種類によって異なります。LMDおよびCNS転移は、CTC接種後約1〜2週間で形成され始める。増殖性の高いがん細胞株を使用すると、<7日で転移が起こり得る。この場合、腫瘍の増殖による血管化は、時々マウス・オンマヤの移植を困難にする可能性がある。この課題の1つの解決策は、CSF空間への注入のための癌細胞の数を減らし、腫瘍の発症前により多くの時間を与える。さらに、このプロトコルは、最初の治療の前にマウスが手術から回復するのに十分な時間を確保するために、水槽マグナ注射後72時間までにマウスオンマヤを移植するように最適化されています。研究者は、治療レジメンを計画する前に、異種移植片モデルにおけるCTCの成長率を計算する必要があります。
上記9のように、浸透圧ポンプシステムやイントレーレブロナーリ(ICV)ボーラス注射を使用するなど、他の直接の心室内送達方法があるが、M).M.Ommayaモデルを使用することにはいくつかの利点がある。例えば、ICVボーラス注射は単一の送達で行われるのに対し、Min Ommayaは、単一の薬剤として与えられるか、または併用療法として与えられたかどうかにかかわらず、いつでも複数の用量の治療を可能にする。浸透ポンプはポンプが交換を必要とする前に14、28、または42日まで持続するように設計され、時にはより小さいポンプを有する小さいマウスが使用される場合より頻繁に。浸透圧ポンプを変更するには外科的処置が必要であり、腫瘍を持つマウスにストレスを加える。マウスオンマヤの交換は、デバイスがそのまま残っている限り、長期間の実験には必要ありません。また、ポンプ9の変更によって生じる潜在的な変動性を最小限に抑えます。実験マウスに埋め込まれたマウス・オンマヤスは42日以上そのまま残り、この持続期間は長生き治療レジメンに対して可能となった。
これまでの知見は、CSFへの間欠的な投薬は、注入による長期の薬物送達プロセスよりもLMDに対する有効性が高いことを示唆している。浸透圧ポンプシステムを使用して、単回投与注射を繰り返すことは不可能であろう.各注入の後に残りの閉じ込められた液体を洗い流す容易な方法がない。浸透性ポンプは、互換性のあるまたは単一の薬物の混合物を送達することに限定され、通常、連続注入のための薬物製剤の量が多く必要です。対照的に、マウス・オンマヤは、死空間を考慮することなく、わずか3〜7μLの正確なマイクロ注射用に設計されており、免疫細胞療法を含む研究者が使用できる薬物の種類に制限はありません。また、特定のサンプルが貴重な場合は試薬の無駄を最小限に抑え、その資源の使用を最大限に活用します。複数の抗癌療法を必要とする治療レジメンでは、マウス・オンマヤは使いやすく、感染や外科的誤用のリスクは最小限で、CSFに外科的に、または針で繰り返し送達する代替アプローチを用いる。マウス・オムマヤは、薬物濃度と服用頻度を調整し、対象の研究に応じて研究のターゲット変調と持続時間を評価する柔軟性を研究者に提供します。
マウス・オンマヤの制限は、研究者が小さなマウスにデバイスを埋め込むのが難しいかもしれないということです。したがって、少なくとも8〜10週齢のマウスを使用する方が良いです。移植ステップ中に装置が頭蓋骨に固定されておらず、接着剤が摩耗した場合、またはマウスが研磨剤によって改ざんされた場合、治療試験中にマウス・オンマヤが外れる可能性があります。後者のシナリオは、複数のマウスが同じケージに収容された場合に発生します。したがって、治療スケジュールの期間中、ケージごとに2匹以下のマウス・オンマヤ移植マウスを収容することをお勧めします。このプロトコルは、スペーサーにシアノクリレート滅菌接着剤を適用するように変更されました, これは、頭蓋骨表面にスペーサーを接着し、マウスオンマヤが外れるのを防ぐための最も効果的な接着剤であることが判明しました.結果は、LMDマウスがマウスオンマヤを介して直接の内腔内療法の恩恵を受け、全体的な生存率が増加したことを示した。単一マイクロリットルの体積は、BBBをバイパスして安全に投与することができ、それによって薬物製剤の量を減少させる。最も重要なことは、Her2抗体免疫療法研究からCNS転移を治癒したマウスは健康なままである。
LMDのPDXモデルのためのマウス・オンマヤのMRI互換バージョンを開発することを目的としたメーカーとのコラボレーション。このプロトタイプ版はスペーサーが組み込まれているので、組み立ては必要ないので、頭蓋骨へのより良い付着を可能にする。このプロトタイプの制限は、デバイスはMRI互換ですが、デバイスが挿入される場所にシャドウを生成し、定量分析のための画像の可視性を低下させることです。MRI互換バージョンは、ex vivo CTC サンプリングが制限因子であり、セルの事前ラベル付けが不可能な場合に適した代替ツールです。LMD異種移植片モデルとマウス・オンマヤ法の組み合わせは、BBBをバイパスする直接標的薬の有効性を研究するのに有益である。これらのインビボ研究の結果は、LMD患者のための合理的な治療戦略を設計するのに臨床的に関連しています。
開示事項
ピーター・フォーサイスは、提出された作品の外で、Abvie Inc.、バイエル、ブリストル・マイヤーズスクイブ、BTG、イノビオ、ノボキュア、トカゲン、ジオファームの諮問委員会を務めています。他のすべての著者は何も開示する必要はありません。
謝辞
ミケーレ・L・ダニエルソン、トリシア・フェイバーズ=ワトソン、そして南フロリダ大学の比較医学チームの残りの部分に、彼らの技術的なサポートと動物の維持に感謝したいと思います。インステック・ラボラトリーズ社は、MRI互換のマウス・オンマヤの開発を要請し、当社と協力してくださった努力に感謝します。この研究は、国立衛生研究所(NIH)R21 CA216756(K.S..Mスモーリーへ)、国防総省(DOD)W81XWH1910675(B.チェルニエッキとP.カリンスキーへ)、モフィットがんセンターCBMM革新的賞(P.フォーサイスとダケット)によってサポートされています。編集支援は、ポール・フレッチャー博士とデイリー・ドラッカー博士によってモフィットがんセンターの科学執筆局によって提供されました。通常の給料を超える報酬は与えられなかった。
資料
| Name | Company | Catalog Number | Comments |
| 1 mm spacer disc | Alzet, Durect Corporation | #0008670 | Spacer disc only |
| 4-0 ethilon nylon suture | Any vendor | n/a | |
| Automatic syringe pumps | Harvard Syringe Pumps (or any vendor) | #70-4505 | Pump 11 Elite |
| Bead sterilizer | Braintree Scientific Inc. (or any vendor) | #GER 5287-120V | Germinator 500 |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Cyanoacrylate sterile adhesive | Any vendor | ||
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100 μL | 30 G for cisterna magna injection |
| Hydrogen peroxide | Any vendor | n/a | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Microdrill | Stoelting (or any vendor) | #51555M | |
| MRI imaging | Bruker | BioSpec series | Optional |
| Murine Ommaya (MRI-compatible) prototype | Instech Laboratories, Inc. | #VAB620-25MRI-3.3 | |
| Phosphate-buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile-Filtered |
| PinPort injector | Instech Laboratories, Inc. | #PNP3M-50 | |
| PinPort | Instech Laboratories, Inc. | #1-PNP3F28-50 | |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Stereotaxic device | Stoelting (or any vendor) | #51730M | |
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a |
参考文献
- Chamberlain, M. C. Leptomeningeal metastasis. Current Opinion in Neurology. 22 (6), 665-674 (2009).
- Nayar, G., et al. Leptomeningeal disease: current diagnostic and therapeutic strategies. Oncotarget. 8 (42), 73312-73328 (2017).
- Shapiro, W. R., Johanson, C. E., Boogerd, W. Treatment modalities for leptomeningeal metastases. Seminars in Oncology. 36 (4), 46-54 (2009).
- Davies, M. A., et al. Prognostic factors for survival in melanoma patients with brain metastases. Cancer. 117 (8), 1687-1696 (2011).
- Znidaric, T., et al. Breast cancer patients with brain metastases or leptomeningeal disease: 10-year results of a national cohort with validation of prognostic indexes. Breast Journal. 25 (6), 1117-1125 (2019).
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell & Melanoma Research. 33 (4), 527-541 (2020).
- Raizer, J. J., et al. Brain and leptomeningeal metastases from cutaneous melanoma: survival outcomes based on clinical features. Neuro-oncology. 10 (2), 199-207 (2008).
- Taillibert, S., et al. Leptomeningeal metastases from solid malignancy: a review. Journal of Neurooncology. 75 (1), 85-99 (2005).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326 (2013).
- Kodumudi, K. N., et al. Sequential anti-PD1 therapy following dendritic cell vaccination improves survival in a HER2 mammary carcinoma model and identifies a critical role for CD4 T cells in mediating the response. Frontiers in Immunology. 10, 1939 (2019).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiments. (75), e50265 (2013).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta. 1862 (3), 442-451 (2016).
- Shackleford, G. M., et al. Continuous and bolus intraventricular topotecan prolong survival in a mouse model of leptomeningeal medulloblastoma. PLoS One. 14 (1), 0206394 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved