Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Sphères de cellulose bactérienne qui encapsulent des matériaux solides
Dans cet article
Résumé
Ce protocole présente une méthode facile et peu coûteuse de formation de sphères de cellulose bactérienne (BC). Ce biomatériau peut fonctionner comme un milieu d’encapsulation pour les matériaux solides, y compris le biochar, les sphères polymères et les déchets miniers.
Résumé
Les sphères de cellulose bactérienne (BC) ont fait l’objet de recherches de plus en plus nombreuses depuis la popularisation de bc comme un nouveau matériau. Ce protocole présente une méthode abordable et simple pour la production de sphères BC. En plus de produire ces sphères, une méthode d’encapsulation pour les particules solides a également été identifiée. Pour produire des sphères BC, l’eau, le thé noir, le sucre, le vinaigre et la culture bactérienne sont combinés dans une fiole déconcertée et le contenu est agité. Après avoir déterminé les conditions de culture appropriées pour la formation de sphères BC, leur capacité à encapsuler des particules solides a été testée à l’aide de biochar, de billes de polymère et de déchets miniers. Les sphères ont été caractérisées à l’aide du logiciel ImageJ et de l’analyse gravimétrique thermique (TGA). Les résultats indiquent que des sphères de 7,5 mm de diamètre peuvent être réalisées en 7 jours. L’ajout de diverses particules augmente la taille moyenne des capsules bc. Les sphères encapsulaient 10 à 20% de leur masse sèche. Cette méthode montre la production et l’encapsulation de sphères à faible coût qui est possible avec des matériaux facilement accessibles. Les sphères bc peuvent être utilisées à l’avenir comme aide à l’élimination des contaminants, au revêtement d’engrais à libération contrôlée ou à l’amendement du sol.
Introduction
La cellulose bactérienne (BC) a été connue pour son utilisation potentielle dans l’industrie en raison de sa résistance mécanique, de sa pureté et de sa cristallinité élevées, de ses capacités de rétention d’eau et de sa structure complexe de fibres1,2,3,4. Ces caractéristiques font de la Colombie-Britannique un biomatériau favorable pour une variété d’applications, y compris les utilisations biomédicales, de transformation des aliments et d’assainissementde l’environnement 1. La formation d’un film BC peut être faite avec des cultures à organisme unique ou des cultures mixtes comme celles utilisées pour le kombucha5, une boisson à base de thé fermenté. Le brassage du kombucha repose sur une « culture symbiotique de bactéries et de levures », communément appelée SCOBY. En utilisant cette culture symbiotique d’organismes, une technique similaire est employée pour créer des sphères BC. Ce biomatériau peut être utilisé pour aider à isoler les contaminants environnementaux et à ancrer les amendements agricoles comme le biochar pour obtenir une production agricole plus efficace.
La littérature précédente a discuté comment les caractéristiques de BC produites dans des conditions agitées se comparent à BC produites dans une culture stationnaire. Une culture stationnaire donne un film qui se forme à l’interface liquide-air, tandis qu’une culture secouée entraîne des particules, des brins et des sphères BC variables en suspension dans le liquide6. De nombreuses études ont fait référence à l’affirmation selon laquelle la production commerciale de BC est plus réalisable dans les conditionsdynamiques 6,7,fournissant une justification de l’application de la méthode de cet article. De plus, diverses études sur la structure et les propriétés des sphères de la Colombie-Britannique ont été menées. Toyosaki et coll.6 ont comparé des fioles d’Erlenmeyer déconcertées et à paroi lisse dans leur production agitée en Colombie-Britannique. Une étude de Hu et Catchmark4 a déterminé les conditions pour les sphères bc qui ont été utilisées comme lignes directrices pour le processus actuel de production de sphère BC, et leurs résultats indiquent que la taille de la sphère ne continue pas à augmenter après 60 heures. Un examen de la production de la Colombie-Britannique par Mohammad et al.1 indique que la secousse de la culture de la Colombie-Britannique assure même l’approvisionnement et la distribution de l’oxygène, ce qui est nécessaire pour une croissance réussie en Colombie-Britannique. Holland et coll.8 ont étudié la cristallinité et la structure chimique de la Colombie-Britannique à l’aide de la diffraction des rayons X et de la spectroscopie infrarouge à transformée de Fourier. On suppose que les capsules de la Colombie-Britannique présenteront des caractéristiques similaires et que les recherches futures étudieront les propriétés structurelles. Des études ont également exploré les effets bénéfiques de l’utilisation de la Colombie-Britannique pour produire des biocomposites améliorés. En utilisant la résine époxy comme base, les chercheurs ont montré que l’ajout de BC améliore les caractéristiques des matériaux telles que la durée de vie en fatigue, la ténacité à la rupture et la résistance à la traction et à la flexion9,10. Comme le montrent les recherches passées et actuelles, bon nombre d’entre nous s’intéressent à la commercialisation de l’utilisation de la Colombie-Britannique.
De nombreux chercheurs ont étudié la cellulose bactérienne dans des systèmes à libération contrôlée, et la méthode décrite ici génère des capsules qui pourraient être utilisées comme systèmes à libération contrôlée. Une grande partie de cette recherche se concentre sur la libération contrôlée dans le domaine biomédical, ainsi que sur l’exploration dans l’administration d’engrais à libération contrôlée (CRF). Compte tenu du succès de la libération contrôlée d’amoxicilline11,de lidocaïne12et d’ibuprofène13par la Colombie-Britannique, la Colombie-Britannique peut présenter des caractéristiques d’administration similaires à celles d’autres substances, comme un engrais granulé. Un aperçu des FRC par Shaviv et Mikkelsen14 reconnaît que les FRC sont plus efficaces, économisent de la main-d’œuvre et causent généralement moins de dégradation de l’environnement que l’application d’engrais conventionnels. La cellulose bactérienne peut fonctionner comme matériau d’encapsulation favorable pour les FRC. Les engrais peuvent s’infiltrer hors des membranes de la Colombie-Britannique ou se décharger à mesure que la colombie-britannique se biodégrade15,16. La capacité de gonflement élevé de l’eau de la Colombie-Britannique peut également agir comme un amendement bénéfique du sol17,18,19 parce que les nutriments d’engrais et l’humidité peuvent se libérer dans le sol par l’application de sphères de la Colombie-Britannique. Avec ces caractéristiques, un CRF formé par encapsulation de sphère BC peut avoir un avantage sur d’autres matériaux de revêtement d’engrais qui pourraient avoir des effets négatifs pendant leurs étapes de production et d’élimination. L’adaptation de la Colombie-Britannique en revêtement d’engrais pourrait améliorer davantage les technologies CRF. En réduisant le taux de libération d’engrais, les cultures auront suffisamment de temps pour absorber l’engrais et prévenir le ruissellement excessif dans les plans d’eau, réduisant ainsi l’eutrophisation et les zones nonoxygènes. Des engrais similaires à libération lente ont été préparés et mis à l’essai à l’aide de revêtements polymères20.
Contrairement aux protocoles décrits dans les recherches précédentes, celui-ci se concentre sur la production de sphères uniformes et cohésives plutôt que sur un rendement élevé en cellulose. De plus, l’encapsulation BC d’autres solides a été étudiée avec des films de cellulose, mais pas avec des sphères21. En élargissant la recherche sur les sphères de cellulose bactérienne, d’autres mesures peuvent être prises pour produire de la BC commercialement, ce qui est bénéfique en raison des caractéristiques de sécurité environnementale de la Colombie-Britannique. Cette méthode de fabrication de sphères BC utilise des ingrédients culinaires peu coûteux et facilement disponibles. Après l’assemblage initial, les sphères BC commencent à se former dans les 2 jours sans interférence. La production de sphères BC grâce à cette stratégie nécessite peu d’espace et a un sous-produit comestible, le thé fermenté « kombucha ». Les techniques d’encapsulation mentionnées dans d’autres études comprennent les revêtements formés par la technique d’inversion de phase22,23,la formation de matrice24,le séchage par atomisation25,et l’encapsulation directe lors de la synthèse26. La méthode d’encapsulation directe décrite dans ce manuscrit est utile pour ceux qui désirent un processus facile et peu coûteux qui utilise des matériaux facilement disponibles.
Grâce à cette recherche, un protocole réussi pour la production et l’encapsulation de sphères bc a été créé. Les sphères bc peuvent encapsuler des particules solides de biochar, de résidus miniers et de microbilles de polystyrène dans leurs structures individuelles. Bien qu’il ne soit pas encore largement utilisé dans l’industrie, bc est un matériau pratique, durable et naturel qui pourrait être utilisé pour des applications futures.
Protocole
1. Création et maintien de la culture de démarrage de cellulose bactérienne
- Obtenir une culture de démarrage de cellulose bactérienne, d’environ 50 g, sous la forme d’un SCOBY. Il peut être acheté commercialement (p. ex., auprès de Cultures for Health). Placez le SCOBY dans un bécher de 1 L, recouvert d’une serviette en papier.
- Faire bouillir 700 mL d’eau désionisée, la transférer dans un récipient distinct de celui contenant le SCOBY et ajouter 85 g de saccharose.
- Une fois le saccharose dissous, ajoutez 2 sachets de thé noir (4,87 g). Infuser le thé pendant 1 h, puis retirer soigneusement les sachets de thé à l’aide d’une tige de brassage.
- Ajouter 200 ml de vinaigre blanc distillé au thé. Laisser refroidir le mélange à 25 °C. Une fois refroidi, ajouter 700 mL de thé à température ambiante au bécher contenant le SCOBY.
ATTENTION: L’ajout du thé acide alors qu’il fait trop chaud peut nuire aux organismes dans le SCOBY. - Couvrez le bécher avec une serviette en papier et fixez-le avec un élastique, et placez le bécher dans une zone de stockage qui maintient une température de 25 °C. Ce navire est communément appelé culture de stock ou un hôtel.
- Pour garder le SCOBY en bonne santé, l’entretien est nécessaire environ 2 fois par mois.
- En utilisant des mains gantées pour retenir les tapis SCOBY, égouttez le liquide de l’hôtel dans un bécher séparé. Dans le récipient contenant le liquide, ajoutez suffisamment de thé acide pour un total de 700 ml de solution.
- Dissoudre 65 g de saccharose dans le récipient avec le thé acide. En attendant que le saccharose se dissolve, rincez soigneusement les tapis SCOBY dans de l’eau DI.
- Une fois le saccharose complètement dissous, le liquide peut être ajouté au bécher contenant les tapis SCOBY rincés. Couvrez le bécher et retournez-le dans la zone d’incubation.
2. Production de sphères de cellulose bactérienne
REMARQUE: Faites preuve de prudence lorsque vous travaillez avec de l’eau bouillante. Assurez-vous que la verrerie peut résister aux températures de l’eau bouillante, qu’elle est exempte de défauts et qu’elle est de la taille appropriée. Un schéma décrivant la production de sphères BC est donné à la figure 1.
- Faire bouillir 350 mL d’eau désionisée à l’aide d’une bouilloire à thé. Transférer l’eau chaude dans un bécher de 500 mL. Dissoudre 42,5 g de saccharose granulé dans l’eau chaude à l’aide d’une tige d’agitation.
- Lorsque le saccharose est complètement dissous, trempez 1 sac de thé noir (2,54 g) dans le ballon contenant le saccharose et de l’eau pendant 1 h. Après cela, retirez le sachet de thé avec une tige de brassage, en prenant soin d’éviter d’ouvrir le sachet de thé, puis jetez-le à la poubelle.
- Ajouter 100 mL de vinaigre blanc distillé au bécher, puis bien remuer le mélange. Transacer 80 mL du mélange de thé acide dans une fiole déconcertée de 250 mL. Laisser refroidir le mélange de thé à température ambiante, 20 - 25 °C.
REMARQUE: À ce stade, le mélange peut être laissé refroidir pendant la nuit ou jusqu’à ce qu’il soit préparé pour l’étape suivante. - Une fois que la température du liquide est à température ambiante (20 - 25 °C), ajouter 20 mL de liquide de culture de démarrage microbien dans la fiole déconcertée. Ce liquide peut être obtenu dans un hôtel SCOBY. Recouvrir le ballon de parafilm.
- Placer la fiole déconcertée sur une table de secousse orbitale et régler la vitesse à 125 rotations par minute (tr/min). Laisser le mélange secouer pendant 3 jours dans une pièce ou un incubateur à une température de 20 à 25 °C pour produire des sphères BC.
NOTA: Si des formes irrégulières se forment dans le contenu du ballon ou si des touffes de cellulose collent aux parois du ballon, elles doivent être enlevées pour éviter que d’autres masses BC irrégulières ne se forment. Utilisez une pince à épiler pour éliminer les masses BC indésirables, y compris les cordes minces, les anneaux, les formes tubulaires et d’autres formes clairement non sphériques. - Une fois les sphères formées, versez-les doucement du ballon et analysez, éliminez-les ou utilisez-les d’une manière qui n’est pas décrite dans le présent document.
3. Utilisation de sphères de cellulose bactérienne pour encapsuler des particules ou des contaminants
- Suivez les étapes 2.1 à 2.5 ci-dessus.
- Après avoir secoué pendant 3 jours, ajouter environ 0,01 g de particules finement broyées dans la fiole déconcertée. Les solides appropriés comprennent le biochar (260 ± 140 μm), les déchets miniers (350 ± 140 μm) et les microbilles de polystyrène (3 μm). Les données de ces documents sont présentées dans la section Résultats représentatifs. Veuillez consulter la table des matériaux ci-jointe pour plus de descriptions du biochar, des déchets miniers et des microbilles.
- Recouvrir à nouveau le ballon avec le parafilm et le replacer sur un agitateur orbital, en utilisant la même vitesse et la même température ambiante (20 - 25 °C) pendant 3 jours supplémentaires. Enlever les particules encapsulées par la Colombie-Britannique à des fins d’analyse, d’élimination ou d’autres utilisations.
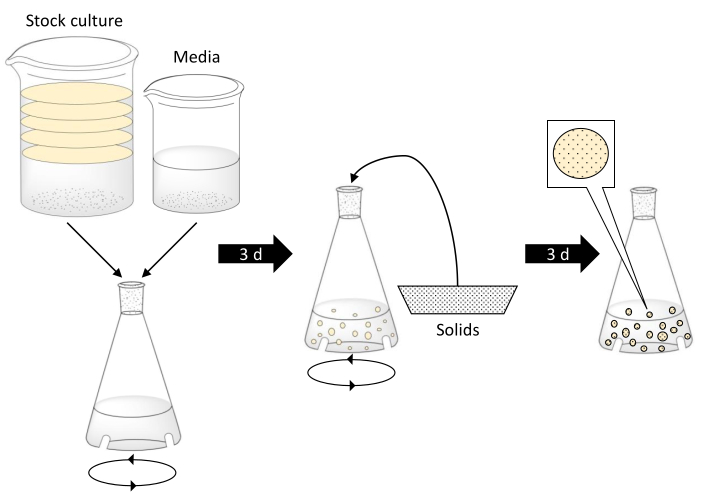
Figure 1. Fabrication de sphères de cellulose bactérienne et encapsulation de particules solides. L’étape 1 consiste à combiner la culture de bouillon bactérienne avec du thé noir, du sucre et des milieux de vinaigre dans une fiole déconcertée. Les disques de la culture de stock représentent des tapis BC. Ensuite, le ballon déconcerté est placé sur une table de secousse orbitale pendant 3 jours. L’étape du milieu montre que des solides sont ajoutés au ballon une fois que les sphères BC se sont formées. Le ballon est agité pendant 3 jours de plus. Dans la dernière étape, les sphères BC ont continué à augmenter en taille et ont encapsulé les particules solides. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Résultats
Les sphères BC ont le taux de croissance le plus rapide au cours des 48 premières h de culture (Figure 2). La figure 2 montre également comment les sphères ont tendance à atteindre une taille moyenne maximale, puis à rester constantes. Dans cette expérience, les sphères ont atteint un diamètre moyen de 7,5 ± 0,2 mm. Bien que les sphères de la Colombie-Britannique ne se détériorent jamais complètement au cours de la période de croissance de 10 jour...
Discussion
Ce protocole décrit les méthodes de production et d’encapsulation de sphère BC qui sont faciles à conduire et rentables. Grâce à divers ajustements apportés au protocole initial, un processus adéquat a été identifié. Des mesures cruciales doivent être prises pour garantir la viabilité des sphères. Tous les ingrédients impliqués dans la formation de bc jouent un rôle clé dans la santé et la durabilité des sphères. Le saccharose nourrit les organismes, le thé fournit de l’azote et le vinaigre abai...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail s’inscrit dans la continuité d’un projet du Montana Tech Research Assistant Mentorship Program d’Adolfo Martinez, Catherine Mulholland, Tyler Somerville et Laurel Bitterman. La recherche a été parrainée par la National Science Foundation dans le cadre de la subvention no. OIA-1757351 et le Laboratoire de recherche de l’Armée du Commandement du développement des capacités de combat (accord de coopération numéro W911NF-15-2-0020). Les opinions, constatations et conclusions, ou recommandations exprimées dans ce document sont celles des auteurs et ne reflètent pas nécessairement les points de vue de la National Science Foundation ou du Army Research Lab. Nous tenons également à remercier Amy Kuenzi, Lee Richards, Katelyn Alley, Chris Gammons, Max Wohlgenant et Kris Bosch pour leurs contributions.
matériels
| Name | Company | Catalog Number | Comments |
| 100 mL graduated cylinder | |||
| 1000 mL beaker | |||
| 25 mL graduated cylinder | |||
| 250 mL Erlenmeyer baffled flask | Chemglass | CLS-2040-02 | |
| 500 mL beaker | |||
| Balance | |||
| Biochar | Ponderosa pine heat treated under argon gas, heated at 15 °C per minute to 800 °C | ||
| Black tea | |||
| Deionized water | |||
| Distilled white vinegar | |||
| Elastic band | |||
| Microbial starter culture | Cultures for Health | ||
| Mine waste | Collected from Butte, MT: 46.001978,-112.582465. Mine waste contains soil and metals originating from past copper mining. Mn, Si, Ca, Al, and Fe were the five most prevalent elements measured in the mine waste through x-ray diffraction. | ||
| Mortar and pestle | |||
| Orbital shaker | Used various brands | ||
| Paper towel | |||
| Polystyrene microbeads | Polybead | 17138 | 3 micron diameter |
| Stir rod | |||
| Sucrose | |||
| Tea kettle | |||
| TGA | TA Instruments | TA Q500 | 400 °C/min to 800 °C, 100 mL/min N2 |
| Thermometer | |||
| XRF Analyzer | ThermoFisher Scientific | 10131166 |
Références
- Mohainin Mohammad, S., Abd Rahman, N., Sahaid Khalil, M., Rozaimah Sheikh Abdullah, S. An Overview of Biocellulose Production Using Acetobacter xylinum Culture. Advances in Biological Research. 8 (6), 307-313 (2014).
- Dufresne, A. Bacterial cellulose. Nanocellulose. , 125-146 (2017).
- Czaja, W., Romanovicz, D., Brown, R. M. Structural investigations of microbial cellulose produced in stationary and agitated culture. Cellulose. 11 (3-4), 403-411 (2004).
- Hu, Y., Catchmark, J. M. Formation and characterization of spherelike bacterial cellulose particles produced by acetobacter xylinum JCM 9730 strain. Biomacromolecules. 11 (7), 1727-1734 (2010).
- Goh, W. N., Rosma, A., Kaur, B., Fazilah, A., Karim, A. A., Bhat, R. Microstructure and physical properties of microbial cellulose produced during fermentation of black tea broth (kombucha). International Food Research Journal. 19 (1), 153-158 (2012).
- Toyosaki, H., Naritomi, T., Seto, A., Matsuoka, M., Tsuchida, T., Yoshinaga, F. Screening of Bacterial Cellulose-producing Acetobacter Strains Suitable for Agitated Culture. Bioscience, Biotechnology, and Biochemistry. 59 (8), 1498-1502 (1995).
- Shi, Z., Zhang, Y., Phillips, G. O., Yang, G. Utilization of bacterial cellulose in food. Food Hydrocolloids. 35, 539-545 (2014).
- Holland, M. C., Eggensperger, C. G., Giagnorio, M., Schiffman, J. D., Tiraferri, A., Zodrow, K. R. Facile Postprocessing Alters the Permeability and Selectivity of Microbial Cellulose Ultrafiltration Membranes. Environmental Science and Technology. 54 (20), 13249-13256 (2020).
- Le Hoang, S., Vu, C. M., Pham, L. T., Choi, H. J. Preparation and physical characteristics of epoxy resin/ bacterial cellulose biocomposites. Polymer Bulletin. 75 (6), 2607-2625 (2018).
- Vu, C. M., Nguyen, D. D., Sinh, L. H., Pham, T. D., Pham, L. T., Choi, H. J. Environmentally benign green composites based on epoxy resin/bacterial cellulose reinforced glass fiber: Fabrication and mechanical characteristics. Polymer Testing. 61, 150-161 (2017).
- Pavaloiu, R. D., Stoica, A., Stroescu, M., Dobre, T. Controlled release of amoxicillin from bacterial cellulose membranes. Central European Journal of Chemistry. 12 (9), 962-967 (2014).
- Trovatti, E., et al. Biocellulose membranes as supports for dermal release of lidocaine. Biomacromolecules. 12 (11), 4162-4168 (2011).
- Trovatti, E., et al. Bacterial cellulose membranes applied in topical and transdermal delivery of lidocaine hydrochloride and ibuprofen: In vitro diffusion studies. International Journal of Pharmaceutics. 435 (1), 83-87 (2012).
- Shaviv, A., Mikkelsen, R. L. Controlled-release fertilizers to increase efficiency of nutrient use and minimize environmental degradation - A review. Fertilizer Research. 35 (1-2), 1-12 (1993).
- Eggensperger, C. G., et al. Sustainable living filtration membranes. Environmental Science and Technology Letters. 7 (3), 213-218 (2020).
- Schröpfer, S. B., et al. Biodegradation evaluation of bacterial cellulose, vegetable cellulose and poly (3-hydroxybutyrate) in soil. Polimeros. 25 (2), 154-160 (2015).
- Orts, W. J., Glenn, G. M. Reducing soil erosion losses with small applications of biopolymers. ACS Symposium Series. 723, 235-247 (1999).
- Mohite, B. V., Patil, S. V. A novel biomaterial: Bacterial cellulose and its new era applications. Biotechnology and Applied Biochemistry. 61 (2), 101-110 (2014).
- Mikkelsen, R. L. Using hydrophilic polymers to control nutrient release. Fertilizer Research. 38 (1), 53-59 (1994).
- Du, C. W., Zhou, J. M., Shaviv, A. Release characteristics of nutrients from polymer-coated compound controlled release fertilizers. Journal of Polymers and the Environment. 14 (3), 223-230 (2006).
- Serafica, G., Mormino, R., Bungay, H. Inclusion of solid particles in bacterial cellulose. Applied Microbiology and Biotechnology. 58 (6), 756-760 (2002).
- Tomaszewska, M., Jarosiewicz, A. Use of polysulfone in controlled-release NPK fertilizer formulations. Journal of Agricultural and Food Chemistry. 50 (16), 4634-4639 (2002).
- González, M. E., et al. Evaluation of biodegradable polymers as encapsulating agents for the development of a urea controlled-release fertilizer using biochar as support material. Science of the Total Environment. 505, 446-453 (2015).
- Shavit, U., Shaviv, A., Shalit, G., Zaslavsky, D. Release characteristics of a new controlled release fertilizer. Journal of Controlled Release. 43 (2-3), 131-138 (1997).
- Kolakovic, R., Laaksonen, T., Peltonen, L., Laukkanen, A., Hirvonen, J. Spray-dried nanofibrillar cellulose microparticles for sustained drug release. International Journal of Pharmaceutics. 430 (1-2), 47-55 (2012).
- Zaharia, A., et al. Bacterial cellulose-poly(acrylic acid-: Co-N, N ′-methylene-bis-acrylamide) interpenetrated networks for the controlled release of fertilizers. RSC Advances. 8 (32), 17635-17644 (2018).
- Peterson, J. D., Vyazovkin, S., Wight, C. A. Kinetics of the thermal and thermo-oxidative degradation of polystyrene, polyethylene and poly(propylene). Macromolecular Chemistry and Physics. 202 (6), 775-784 (2001).
- Goh, W. N., Rosma, A., Kaur, B., Fazilah, A., Karim, A. A., Bhat, R. Fermentation of black tea broth (kombucha): I. effects of sucrose concentration and fermentation time on the yield of microbial cellulose. International Food Research Journal. 19 (1), 109-117 (2012).
- Zhu, H., Jia, S., Yang, H., Jia, Y., Yan, L., Li, J. Preparation and application of bacterial cellulose sphere: A novel biomaterial. Biotechnology and Biotechnological Equipment. 25 (1), 2233-2236 (2011).
- Nguyen, V. T., Flanagan, B., Gidley, M. J., Dykes, G. A. Characterization of cellulose production by a Gluconacetobacter xylinus strain from Kombucha. Current Microbiology. 57 (5), 449-453 (2008).
- Costa, A. F. S., Almeida, F. C. G., Vinhas, G. M., Sarubbo, L. A. Production of bacterial cellulose by Gluconacetobacter hansenii using corn steep liquor as nutrient sources. Frontiers in Microbiology. 8, 1-12 (2017).
- Watanabe, K., Tabuchi, M., Morinaga, Y., Yoshinaga, F. Structural features and properties of bacterial cellulose produced in agitated culture. Cellulose. 5 (3), 187-200 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon