Method Article
Spettroscopia di correlazione incrociata a fluorescenza a doppio colore per studiare l'interazione proteina-proteina e la dinamica proteica nelle cellule vive
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Presentiamo un protocollo sperimentale e un flusso di lavoro di analisi dei dati per eseguire la spettroscopia di correlazione incrociata a fluorescenza a doppio colore (FCCS) combinata con il trasferimento di energia di risonanza di Förster (FRET) per studiare la dinamica del recettore di membrana nelle cellule vive utilizzando le moderne tecniche di etichettatura a fluorescenza.
Abstract
Presentiamo un protocollo e un flusso di lavoro per eseguire la spettroscopia di correlazione incrociata a fluorescenza a doppio colore (FCCS) combinata con il trasferimento di energia di risonanza di Förster (FRET) per studiare la dinamica dei recettori di membrana nelle cellule vive utilizzando le moderne tecniche di etichettatura a fluorescenza. Nella FCCS bicolore, dove le fluttuazioni dell'intensità di fluorescenza rappresentano l'"impronta digitale" dinamica della rispettiva biomolecola fluorescente, possiamo sondare la co-diffusione o il legame dei recettori. FRET, con la sua elevata sensibilità alle distanze molecolari, funge da noto "nanoruler" per monitorare i cambiamenti intramolecolari. Nel loro insieme, i cambiamenti conformazionali e i parametri chiave come le concentrazioni dei recettori locali e le costanti di mobilità diventano accessibili in contesti cellulari.
Gli approcci quantitativi di fluorescenza sono impegnativi nelle cellule a causa degli elevati livelli di rumore e della vulnerabilità del campione. Qui mostriamo come eseguire questo esperimento, comprese le fasi di calibrazione utilizzando il recettore β2-adrenergico (β2AR) etichettato con eGFP e SNAP-tag-TAMRA. Una procedura di analisi dei dati passo-passo viene fornita utilizzando software open source e modelli facili da personalizzare.
La nostra linea guida consente ai ricercatori di svelare le interazioni molecolari delle biomolecole nelle cellule vive in situ con elevata affidabilità nonostante i limitati livelli di segnale-rumore negli esperimenti sulle cellule vive. La finestra operativa di FRET e in particolare FCCS a basse concentrazioni consente l'analisi quantitativa in condizioni quasi fisiologiche.
Introduzione
La spettroscopia di fluorescenza è uno dei principali metodi per quantificare la dinamica proteica e le interazioni proteina-proteina con minima perturbazione in un contesto cellulare. La spettroscopia di correlazione a fluorescenza confocale (FCS) è uno dei potenti metodi per analizzare la dinamica molecolare in quanto è sensibile a singola molecola, altamente selettiva e compatibile con le cellule vive1. Rispetto ad altri approcci orientati alla dinamica, FCS ha un intervallo di tempo misurabile più ampio che va da ~ ns a ~ s, soprattutto coprendo le scale temporali veloci che sono spesso inaccessibili con metodi basati sull'imaging. Inoltre, fornisce anche selettività spaziale in modo che la dinamica molecolare di membrana, citoplasmatica e nucleo possa essere facilmente distinta 2. Pertanto, il lampeggiamento molecolare, la concentrazione locale media e il coefficiente di diffusione possono essere analizzati quantitativamente con FCS. Le dinamiche intermolecolari come il legame diventano facilmente accessibili quando si sonda la co-diffusione di due specie molecolari nella spettroscopia di correlazione incrociata a fluorescenza (FCCS) analisi3,4,5 in un approccio a doppio colore.
Il principale principio alla base della spettroscopia di correlazione è l'analisi statistica delle fluttuazioni di intensità emesse da biomolecole etichettate fluorescentemente che si diffondono dentro e fuori da un fuoco laser (Figura 1A). Le funzioni di correlazione automatica o incrociata risultanti possono quindi essere ulteriormente analizzate mediante adattamento della curva per derivare eventualmente le costanti di tasso di interesse. In altre parole, i metodi statistici FCS e FCCS non forniscono tracce di singole molecole come nel tracciamento di singole particelle, ma un modello dinamico o "impronta digitale" di un campione sondato ad alta risoluzione temporale. Se combinato con il trasferimento di energia di risonanza di Förster (FRET), la dinamica intramolecolare come i cambiamenti conformazionali può essere monitorata contemporaneamente in una configurazione confocale comune5,6. FRET sonda la distanza di due fluorofori ed è spesso indicato come un "nanoruler" molecolare. Il trasferimento di energia avviene solo quando le molecole si trovano nelle immediate vicinanze (< 10 nm), lo spettro di emissione del donatore si sovrappone significativamente allo spettro di assorbimento della molecola accettore e l'orientamento del dipolo del donatore e dell'accettore è (sufficientemente) parallelo. Pertanto, la combinazione di FRET e FCCS fornisce una tecnica con una risoluzione spazio-temporale molto elevata. Quando è richiesta la selettività spaziale, la sensibilità e la compatibilità delle cellule vive, FRET-FCCS ha evidenti vantaggi rispetto ad altri metodi come la calorimetria di titolazione isotermica (ITC)7,la risonanza plasmonica di superficie (SPR)8o la risonanza magnetica nucleare (NMR)9,10 per misurare la dinamica e le interazioni proteiche.
Nonostante le capacità e la promessa della spettroscopia di correlazione incrociata a fluorescenza a doppio colore (dc-FCCS), l'esecuzione di dc-FCCS in cellule vive è tecnicamente impegnativa a causa del sanguinamento spettrale o della diafonia tra i canali3,4,della differenza nei volumi confocali dovuta alle linee laser spettralmente distinte3,4,11,del segnale di fondo e del rumore o della limitata fotostabilità dei campioni12, 13,14,15. L'introduzione dell'eccitazione interlacciata a impulsi (PIE) in FCCS è stata una modifica importante per disaccoppiare temporalmente le diverse eccitazioni laser per ridurre la diafonia spettrale tra i canali16. Altri metodi di correzione per contrastare il sanguinamento spettraleattraverso 17,18,19 e correzioni di fondo sono stati anche ben accettati17,18,19. Per dettagli e nozioni di base su FCS, PIE o FRET si rimanda al lettore ai seguenti riferimenti2,4,6,16,20,21,22,23,24.
Qui, vengono presentati tutti gli esperimenti e le analisi di calibrazione necessari insieme ai risultati sperimentali di un prototipo di recettore accoppiato alla proteina G, β recettore 2-adrenergico (β2AR), per tre diversi scenari: (1) molecole monomarcizzate che trasportano un fluoroforo25 "verde" (eGFP) o "rosso" (etichettatura basata su TAG SNAP); (2) un costrutto a doppia etichetta, che porta un SNAP-tag N-terminale e un eGFP intracellulare (NT-SNAP) [in questo caso, entrambe le etichette sono alla stessa proteina. Quindi si prevede una co-diffusione al 100%]; e (3) un campione a doppia etichetta, in cui entrambi i fluorofori si trovano sullo stesso lato della membrana cellulare (CT-SNAP). Trasporta un tag SNAP C-terminale e un eGFP intracellulare. Qui, ancora una volta entrambe le etichette sono alla stessa proteina con di nuovo prevista una co-diffusione al 100%. Poiché entrambe le etichette sono molto vicine l'una all'altra, sullo stesso lato della membrana cellulare, mostra il potenziale per osservare FRET e il comportamento anticor correlato. Tutti i costrutti sono stati trasfettate in cellule dell'ovaio di criceto cinese (CHO) e successivamente etichettati con un substrato fluorescente rosso che è impermeabile alla membrana per il costrutto NT-SNAP e permeabile alla membrana per il costrutto CT-SNAP. Infine, i dati simulati esemplificano l'influenza dei parametri sperimentali sull'anticorrelazione indotta da FRET e l'effetto delle interazioni proteina-proteina sull'ampiezza di co-diffusione.
Pertanto, questo protocollo fornisce una guida completa all'esecuzione del FRET-FCCS combinato nelle cellule viventi per comprendere le dinamiche proteiche e le interazioni proteina-proteina, rendendo consapevoli degli artefatti tecnici / fisici, delle sfide e delle possibili soluzioni.
Protocollo
1. Protocollo sperimentale
- Preparazione del campione
NOTA: Eseguire la semina e la trasfezione cellulare in condizioni sterili.- Posizionare una coverslip pulita per pozzetti in una piastra di coltura a 6 pozzetti e lavare tre volte con soluzione salina sterile tamponata con fosfato (PBS).
NOTA: Il protocollo di pulizia del coverslip è dettagliato nella nota supplementare 1. - A ciascun pozzetti, aggiungere 2 mL del terreno di coltura cellulare completo contenente rosso fenolo (integrato con il 10% di siero bovino fetale (FBS), 100 μg/mL di penicillina e 100 μg/mL di streptomicina) e tenere la piastra da parte.
- Colturare le cellule CHO nello stesso mezzo contenente rosso fenolo a 37 °C e 5% di CO2. Lavare le cellule con 5 ml di PBS per rimuovere le cellule morte.
- Aggiungere 2 ml di tripsina e incubare per 2 minuti a temperatura ambiente (RT).
- Diluire le cellule staccate con 8 mL di mezzo contenente rosso fenolo e mescolare accuratamente mediante pipettaggio.
- Contare le cellule in una camera neubauer e seminare ad una densità di 1,5 x 105 cellule/pozzetti nella piastra di coltura cellulare a 6 pozzetti contenente i coverslip (preparata al punto 1.1.1-1.1.2).
- Lasciare che le cellule crescano in un incubatore (37 °C, 5% CO2)per 24 ore al fine di ottenere circa l'80% di confluenza.
- Diluire 2 μg del DNA vettore desiderato (ad esempio, CT-SNAP o NT-SNAP) e 6 μL del reagente di trasfezione in due provette separate, ciascuna contenente 500 μL del mezzo sierico ridotto per ciascun pozzo e incubare per 5 minuti a RT.
- Mescolare le due soluzioni insieme per ottenere la miscela di trasfezione e incubarla per 20 minuti a RT.
- Nel frattempo, lavare le cellule CHO seminate una volta con PBS sterile.
- Sostituire il PBS con 1 ml / pozzed di mezzo privo di fenolo rosso integrato con FBS al 10% senza antibiotici.
- Aggiungere l'intero 1 mL di miscela di trasfezione a goccia a ciascun pozzo e incubare le cellule durante la notte a 37 °C, in 5% CO2.
- Per l'etichettatura del costrutto SNAP, diluire la soluzione stock di substrato SNAP appropriata in 1 mL del mezzo integrato con FBS al 10% per ottenere una concentrazione finale di 1 μM.
- Lavare le cellule trasfettate una volta con PBS e aggiungere 1 mL per pozzo di 1 μM di soluzione di substrato SNAP. Incubare le cellule per 20 min a 37 °C in 5% CO2.
- Lavare le cellule tre volte con un mezzo privo di fenolo rosso e aggiungere 2 ml per mezzo privo di fenolo fenolo. Incubare le cellule per 30 min a 37 °C in 5% CO2.
- Trasferire successivamente i coverslip di tutti i campioni nella camera di imaging e lavare con un buffer di imaging da 500 μL. Aggiungere un buffer di imaging da 500 μL prima di passare alla configurazione FRET-FCS.
- Posizionare una coverslip pulita per pozzetti in una piastra di coltura a 6 pozzetti e lavare tre volte con soluzione salina sterile tamponata con fosfato (PBS).
- Misure di calibrazione
NOTA: La configurazione FRET-FCS è dotata di un obiettivo ad acqua per microscopio confocale, due linee laser, un sistema TCSPC (Time-Correlated Single Photon Counting), due tubi fotomoltiplicatori ibridi (PMT) e due fotodiodi a valanga (APD) per la raccolta di fotoni e il software di raccolta dati. È molto importante allineare la configurazione ogni volta prima delle misurazioni delle cellule vive. La descrizione dettagliata dell'installazione è disponibile nella nota supplementare 2. Sia i laser che tutti i rivelatori (due PMT e due AFID) sono sempre ON durante le misurazioni, poiché tutte le misurazioni devono essere condotte in condizioni identiche. Per le misure di calibrazione, utilizzare un coverslip dello stesso lotto su cui sono state seminate le cellule, questo diminuisce la variazione nella correzione dell'anello del colletto.- Per regolare la messa a fuoco, il foro stenopeico e la posizione dell'anello del collare, posizionare una soluzione di calibrazione verde da 2 nM su un coperchio di vetro e accendere il laser da 485 nm e 560 nm. Azionare il laser in modalità PIE (Pulsed Interleaved Excitation)16.
- Concentrati sulla soluzione e regola la posizione dell'anello stenopeico e collare in modo tale da ottenere il più alto tasso di conteggio e il più piccolo volume confocale per ottenere la massima luminosità molecolare.
- Ripetere questo processo per i canali rossi con una soluzione di calibrazione rossa da 10 nM e una miscela di entrambe, la soluzione di calibrazione verde e rossa.
- Posizionare la soluzione di DNA da 10 nM su un coperchio di vetro e regolare la messa a fuoco, il foro stenopeico e la posizione dell'anello del colletto in modo tale che la correlazione incrociata tra i canali di rilevamento verde e rosso sia più alta, cioè mostri l'ampiezza più alta.
NOTA: i passaggi 1.2.1 e 1.2.4 potrebbero dover essere ripetuti avanti e indietro per trovare l'allineamento ottimale. Effettuare 3-5 misurazioni da ciascuna soluzione di calibrazione per 30 s - 120 s dopo che la posizione di messa a fuoco, foro stenopeico e anello del collare sono stati allineati in modo ottimale per i canali di rilevamento verde e rosso e il volume di sovrapposizione confocale. - Misurare una goccia di ddH2O, il mezzo di imaging, e una cellula non trasfetta 3-5 volte ciascuno per 30 s - 120 s per determinare i tassi di conteggio in background.
- Raccogliere la funzione di risposta dello strumento con 3-5 misurazioni per 30 s - 120 s. Questo è facoltativo ma altamente raccomandato.
- Misurazioni di cellule vive
- Trova una cella adatta illuminando con la lampada al mercurio e osservando attraverso l'oculare.
NOTA: Le cellule adatte sono vive mostrando la morfologia tipica della rispettiva linea cellulare aderente. La fluorescenza della proteina di interesse, qui un recettore di superficie, è visibile su tutta la superficie. Le cellule meno luminose sono più adatte di quelle più luminose a causa del migliore contrasto in FCS quando un basso numero di molecole sono a fuoco. - Accendere entrambi i laser in modalità PIE e concentrarsi sulla membrana osservando i conteggi massimi al secondo.
NOTA: potrebbe essere necessario ridurre la potenza del laser per i campioni di cella (meno di 5 μW all'obiettivo). Questo dipende dai fluorofori utilizzati e dalla configurazione. - Osserva le curve di correlazione automatica e incrociata dell'eGFP o del tag SNAP etichettato attaccato al β2AR nell'anteprima online del software di raccolta dati e raccogli diverse brevi misurazioni (~ 2 -10) con un tempo di acquisizione compreso tra 60 -180 s.
NOTA: Non eccitare le cellule per lungo tempo continuamente poiché i fluorofori potrebbero sbiancare. Tuttavia, dipenderà dalla luminosità di ciascuna cella, da quanto possono essere lunghe le misurazioni e da quante misurazioni in totale possono essere eseguite.
- Trova una cella adatta illuminando con la lampada al mercurio e osservando attraverso l'oculare.
2. Analisi dei dati
- Esportazione dati
- Esporta le curve di correlazione, G (tc), e i tassi di conteggio, CR, da tutte le misurazioni.
- Fare attenzione a definire correttamente le finestre temporali "prompt" e "delay" e utilizzare l'opzione "microtime gating" nel software di correlazione dei dati.
NOTA: In totale, sono necessarie tre diverse correlazioni: (1) autocorrelazione del canale verde nella finestra temporale del prompt (ACFgp), (2) autocorrelazione dei canali rossi nella finestra temporale di ritardo (ACFrd), e infine (3) la correlazione incrociata del segnale del canale verde nella finestra temporale del prompt con il segnale del canale rosso nella finestra temporale del ritardo (CCFPIE). L'esportazione dei dati viene mostrata passo dopo passo per diversi software nella nota supplementare 3.
- Misure di calibrazione
- Utilizzare le funzioni di autocorrelazione delle soluzioni fluoroforiche verde (ACFgp) e rosso (ACFrd) e adattarle a un modello di diffusione 3D con un termine tripletto aggiuntivo, se necessario (eq. 1) per calibrare la forma e le dimensioni del volume di rilevamento confocale per i due canali di colore utilizzati:
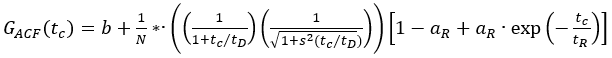 eq. 1
eq. 1
Qui, b è la linea di base della curva, N il numero di molecole a fuoco, tD il tempo di diffusione (in ms) e s = z0/w0 il fattore di forma dell'elemento volume confocale. La tripletta lampeggiante o altra fotofisica è descritta dalla sua ampiezza aR e dal tempo di rilassamento tR.
NOTA: tutte le variabili e i simboli utilizzati all'interno del protocollo sono elencati nella Tabella 1. - Utilizzare i coefficienti di diffusione noti D per lo standard di calibrazione verde26 e rosso27 e i fattori di forma ottenuti sverde e srosso per determinare le dimensioni (larghezza w0 e altezza z0) e il volume Veff dell'elemento volumetrico confocale (eq. 2a-c).
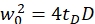 eq. 2a
eq. 2a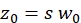 eq. 2b
eq. 2b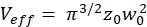 eq. 2c
eq. 2c
NOTA: i modelli per il calcolo del parametro di calibrazione sono forniti come file supplementari (S7). - Calcolare la diafonia spettrale α del segnale di fluorescenza verde (raccolto nei canali 0 e 2) nei canali di rilevamento rossi (canale numero 1 e 3) come rapporto tra i segnali corretti in background (BG) (eq. 3).
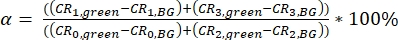
eq. 3 - Determinare l'eccitazione diretta del fluoroforo dell'accettore δ dalla lunghezza d'onda di eccitazione del donatore dal rapporto tra il tasso di conteggio corretto in background delle misurazioni di calibrazione rossa nella finestra temporale "rapida" (eccitazione da laser verde) e il tasso di conteggio corretto in background nella finestra temporale "ritardo" (eccitazione da laser rosso) (eq. 4).
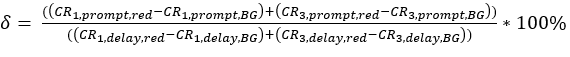
eq. 4 - Calcola la luminosità molecolare B dei fluorofori verdi e rossi (eq. 5a-b) in base ai tassi di conteggio corretti sullo sfondo e al numero ottenuto di molecole a fuoco, N, dal 3D diffusion fit (eq. 1):
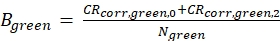 eq. 5a
eq. 5a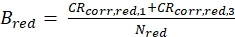 eq. 5b
eq. 5b - Adattare sia ACFgp e ACFrd che CCFPIE del DNA a doppia etichetta al modello di diffusione 3D (eq. 1). Mantenere i fattori di forma ottenuti, sverde e srosso, costanti per ACFgp e ACFrd, rispettivamente. Il fattore di forma per il CCFPIE, sPIE, è di solito tra questi due valori.
NOTA: in una configurazione ideale, sia Veff,verde e Veff, il rosso avrebbero le stesse dimensioni e si sovrapporrebbero perfettamente. - Determinare l'ampiezza al tempo di correlazione zero, G0(tc), in base ai valori trovati del numero apparente di molecole a fuoco (Nverde, Nrosso e NPIE).
- Calcolare il rapporto di ampiezza rGR e rRG per un campione con co-diffusione al 100% di fluorofori verdi e rossi (eq. 6). Tieni presente che NPIE non riflette il numero di molecole a doppia etichetta a fuoco ma riflette solo 1 /G0(tc).
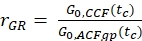 e
e 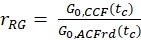 eq. 6
eq. 6
- Utilizzare le funzioni di autocorrelazione delle soluzioni fluoroforiche verde (ACFgp) e rosso (ACFrd) e adattarle a un modello di diffusione 3D con un termine tripletto aggiuntivo, se necessario (eq. 1) per calibrare la forma e le dimensioni del volume di rilevamento confocale per i due canali di colore utilizzati:
- Esperimenti sulle cellule vive
- Per i costrutti con etichetta singola, adattare i campioni di cella a un modello appropriato. Per il recettore di membrana mostrato, la diffusione avviene in modo bimodale con un tempo di diffusione breve e lungo. Inoltre, la fotofisica e il lampeggiamento dei fluorofori devono essere considerati:
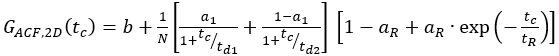 eq. 7
eq. 7
Qui, td1 e td2 sono i due tempi di diffusione richiesti, e un1 è la frazione del primo tempo di diffusione.
NOTA: A differenza delle misurazioni di calibrazione, in cui i coloranti liberi e i filamenti di DNA si diffondono liberamente in tutte le direzioni, il recettore di membrana mostra solo una diffusione 2D lungo le membrane cellulari. Questa differenza tra diffusione 3D e 2D si riflette nel termine di diffusione modificato (confronta eq. 1), dove tD nel caso 2D non dipende dai fattori di forma s dell'elemento di volume confocale. - Calcola la concentrazione c di proteine etichettate verdi o rosse dai rispettivi Eff N e V usando la matematica di base (eq. 8):
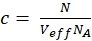 eq. 8
eq. 8
dove NA = numero di Avogadro - Per l'etichetta SNAP N-terminale e l'eGFP intracellulare, montare le due autocorrelazioni (ACFgp e ACFrd) del campione a doppia etichetta utilizzando lo stesso modello dei costrutti a etichetta singola per gli ACF (eq. 7) e il CCFPIE utilizzando un modello di diffusione bimodale (eq. 9):
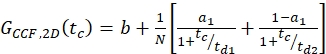 eq. 9
eq. 9
NOTA: Per una descrizione globale del sistema, tutte e tre le curve devono essere adattate congiuntamente: il termine di diffusione è identico per tutte e tre le curve e l'unica differenza è il termine di rilassamento per il CCFPIE. Poiché la fotofisica di due fluorofori è solitamente non correlata, non è richiesto alcun termine di correlazione. Questa assenza di termini di rilassamento si traduce in un PIE CCF piatto a brevi tempi di correlazione. Tuttavia, la diafonia e l'eccitazione diretta dell'accettore a causa del fluoroforo del donatore potrebbero mostrare ampiezze false positive e devono essere attentamente controllate per l'utilizzo delle misurazioni di calibrazione. - Calcola la concentrazione c di proteine etichettate verdi o rosse dai rispettivi Eff N e V usando l'equazione 8.
- Stimare la frazione o la concentrazione, cGR o cRG, di proteine interagenti etichettate verde e rosso dai campioni cellulari utilizzando i fattori di correzione ottenuti dai campioni di DNA, i rapporti di ampiezza rGR e rRG del campione cellulare e le rispettive concentrazioni ottenute (eq. 10).
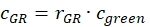 e
e 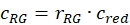 eq. 10
eq. 10 - Per l'etichetta SNAP C-terminale e l'eGFP intracellulare, adattare le due autocorrelazioni (ACFgp e ACFrd) del campione FRET come campioni a singola etichetta (equazione 7) e CCFFRET a un modello di diffusione bimodale contenente un termine anti-correlazione (equazione 11)
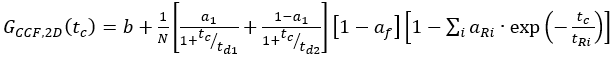 eq. 11
eq. 11
dove af riflette l'ampiezza dell'anti-correlazione totale e aR e tR la rispettiva ampiezza e tempo di rilassamento.
NOTA: In caso di variazioni di fluorescenza anti-correlate dovute a FRET, potrebbero essere necessari uno o più termini anti-correlazione (eq. 11), con conseguente "dip" di CCFFRET a bassi tempi di correlazione coincidenti con un aumento delle due autocorrelazioni (ACFgp e ACFrd). Tuttavia, tieni presente che la fotofisica come il battito delle palpebre triplette potrebbe mascherare il termine anti-correlazione smorzando l'anti-correlazione indotta da FRET. Un'analisi congiunta integrata con metodi FCS filtrati potrebbe aiutare a smascherare il termine anti-correlazione. Inoltre, gli artefatti tecnici derivanti da tempi morti nell'elettronica di conteggio nell'intervallo dei nanosecondi dovrebbero essere esclusi16. Una procedura passo-passo più dettagliata su come eseguire l'analisi in ChiSurf28 e modelli per il calcolo del volume confocale o della luminosità molecolare sono forniti sul repository Github (https://github.com/HeinzeLab/JOVE-FCS) e come file supplementari (Nota supplementare 4 e Nota supplementare 6). Inoltre, gli script python per l'esportazione batch dei dati acquisiti con il software Symphotime in formato .ptu possono essere trovati lì.
- Per i costrutti con etichetta singola, adattare i campioni di cella a un modello appropriato. Per il recettore di membrana mostrato, la diffusione avviene in modo bimodale con un tempo di diffusione breve e lungo. Inoltre, la fotofisica e il lampeggiamento dei fluorofori devono essere considerati:
Risultati
I risultati esemplari della calibrazione e delle misurazioni delle cellule vive sono discussi di seguito. Inoltre, l'effetto di FRET sulle curve di correlazione incrociata è dimostrato sulla base di dati simulati accanto all'effetto dell'interazione proteina-proteina che aumenta l'ampiezza del CCFPIE.
Esportazione dei dati FCS basata su PIE
Negli esperimenti PIE, i dati vengono raccolti nella modalità time-tag time-resolved mode (TTTR)29,30. La Figura 1B mostra gli istogrammi del tempo di arrivo dei fotoni di una misurazione PIE di un filamento di DNA a doppia etichetta sulla configurazione descritta (Nota supplementare 1). La configurazione dispone di quattro canali di rilevamento. L'emissione di fluorescenza viene prima divisa per polarizzazione in direzioni "S" e "P" (riferendosi al piano perpendicolare e parallelo in cui oscilla il campo elettrico di un'onda luminosa). In secondo luogo, ogni direzione di polarizzazione viene quindi divisa in due canali di colore (verde, rosso) prima del rilevamento, risultando in quattro canali (S-verde, S-rosso, P-verde, P-rosso). Nella finestra temporale "prompt", il fluoroforo verde si eccita e il segnale viene rilevato in entrambi i canali verde e rosso a causa di FRET. Nella finestra temporale di ritardo, è visibile solo il fluoroforo rosso (nel canale rosso). Sulla base dei canali di rilevamento e delle finestre temporali "prompt" rispetto a quelle "ritardate", è possibile ottenere almeno cinque diverse curve di correlazione (3 curve di autocorrelazione (ACF) e 2 curve di correlazione incrociata (CCF)) (Figura 1C-D): (1) segnale verde nella finestra temporale di prompt (ACFgp), (2) segnale rosso nella finestra temporale di prompt (nel caso di FRET, ACFrp), e (3) segnale rosso nella finestra temporale di ritardo (ACFrd). Questi ACF riportano la mobilità proteica, la fotofisica (ad esempio, il battito delle triplette lampeggianti) e altri cambiamenti di luminosità correlati al tempo nei fluorofori (ad esempio, a causa di FRET). (4) La correlazione incrociata basata su PIE CCF PIE del segnale verde nella finestra temporale di prompt con il segnale rosso nella finestra temporale di ritardo consente di determinare la frazione di co-diffusione del fluoroforo verde e rosso16. (5) Il FRET CCF FRET basato su FRET del verde con il segnale rosso nella finestra temporale del prompt è correlato alle variazioni di luminosità anticor correlate indotte da FRET nei segnali verde e rosso31,32,33.
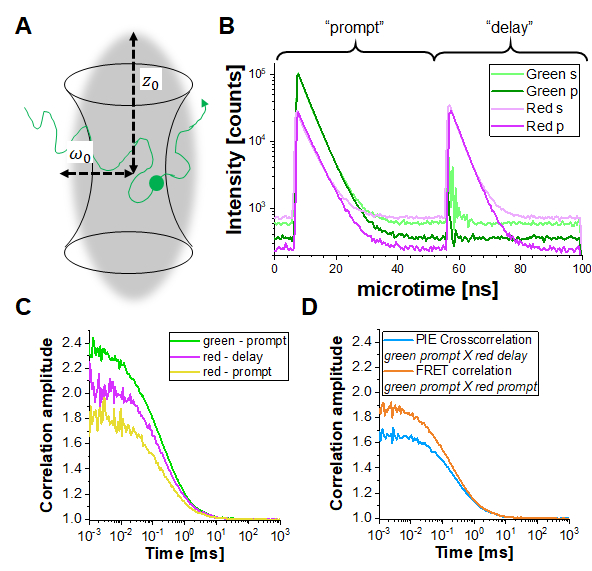
Figura 1: Spettroscopia di correlazione a fluorescenza (cross) basata su eccitazione pulsata (PIE) (F(C)CS). (A)In FCS molecole etichettate con fluorescenza (PIE) si diffondono liberamente dentro e fuori da un volume focale (limitato dalla diffrazione) modellato da un raggio laser focalizzato che induce la fluorescenza all'interno di questo piccolo volume. Le fluttuazioni di intensità risultanti delle molecole che entrano ed escono dal volume sono correlate e forniscono informazioni sulla mobilità delle molecole. (B) In PIE, due diverse linee laser ("prompt" e "delay") vengono utilizzate per eccitare il campione etichettato con due diversi fluorofori ("verde" e "rosso"). La differenza di tempo tra entrambi gli impulsi di eccitazione è adattata alla durata di fluorescenza dei rispettivi fluorofori in modo che uno sia decaduto prima che l'altro sia eccitato. Nel campione a doppia etichetta mostrato, entrambi i fluorofori sono sufficientemente vicini da essere sottoposti al Förster Resonance Energy Transfer (FRET) dal fluoroforo donatore "verde" al fluoroforo accettore "rosso". Pertanto, l'emissione di fluorescenza rossa può essere rilevata nella finestra temporale "rapida" dopo l'eccitazione del donatore verde. Nella configurazioneutilizzata ( Nota supplementare 2), vengono utilizzati due rilevatori per ciascun colore, uno orientato parallelamente all'orientamento del fascio di eccitazione (indicato con "p") e il secondo perpendicolare (indicato con "s"). (C) Tre diverse funzioni di autocorrelazione possono essere determinate in un esperimento PIE: correlazione dei i) segnali del canale verde nella finestra temporale del prompt(ACFgp),ii) segnali del canale rosso nella finestra temporale del prompt(ACFrp)e iii) segnali del canale rosso nella finestra temporale del ritardo(ACFrd). (D) Si possono determinare due diverse funzioni di correlazione incrociata: iv) La correlazione incrociata "PIE"(CCFPIE)con segnali di canale verde nella finestra temporale rapida correlata con i segnali del canale rosso nella finestra di ritardo, dove l'ampiezza di questa curva è correlata alla co-diffusione dei fluorofori; e v) la correlazione incrociata "FRET"(CCFFRET)con i segnali del canale verde nella finestra temporale del prompt correlata con i segnali del canale rosso nella stessa finestra di prompt; qui la forma di questa curva a volte più veloce della diffusione è correlata ai cambiamenti di intensità indotti da FRET. Fare clic qui per visualizzare una versione più grande di questa figura.
Taratura
La figura 2A-B mostra una misura di calibrazione dei fluorofori verdi e rossi che diffondono solo, rispettivamente. Sulla base di un fit con eq. 1 e del noto coefficiente di diffusione Dverde26 e Drosso27 la forma(z0 e w 0)e la dimensione(Veff)del volume di rilevamento sono calcolate utilizzando eq. 2a-c. I risultati di adattamento dell'ACFgp del fluoroforo verde e dell'ACFrd del fluoroforo rosso sono riassunti nella Figura 2C. Entrambi i fluorofori mostrano un tempo di rilassamento aggiuntivo costante di 8,6 μs (18%) e 36 μs (15%), rispettivamente. La luminosità molecolare (eq. 5a-b) del fluoroforo verde e rosso ammonta rispettivamente a 12,5 kHz per molecola e 2,7 kHz per molecola.
Per una stima affidabile delle dimensioni e della forma del volume confocale, nonché della luminosità molecolare, si consiglia di eseguire 3-5 misurazioni per esperimenti di calibrazione e un adattamento congiunto (o globale) di tutte le ripetizioni.
La α di diafonia (Figura 2D, eq. 3) e l'eccitazione diretta dell'accettore da parte del laser verde δ (Figura 2E, eq. 4) per questa coppia di fluorofori si trovano rispettivamente a ~ 15% e ~ 38%.
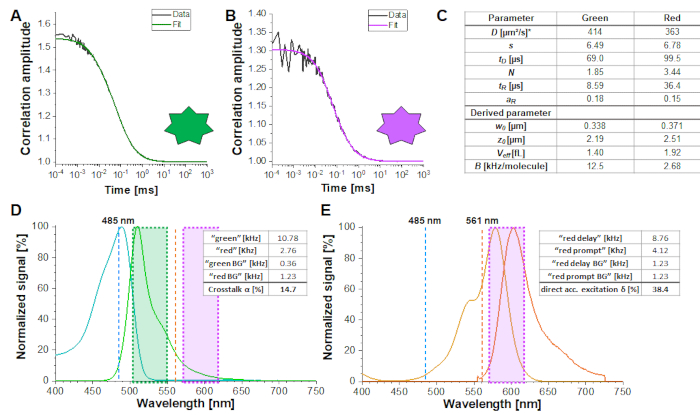
Figura 2: Misure di taratura dello standard di calibrazione verde e rosso a libera diffusione. (A-B) Misura rappresentativa di 60 s di un 2 nM verde (A) e di una misura standard di calibrazione rossa ( B ) da 10 nM (B) montata sul modello di diffusione 3D, compreso un tempo di rilassamento aggiuntivo (eq. 1). La tabella nel pannello (C) mostra i risultati di adattamento e il parametro derivato in base a eq. 2a-c e eq. 5a-b. *I coefficienti di diffusione sono stati presi dalla letteratura26,27. (D) Determinazione della diafonia α del segnale verde nei canali rossi (eq. 3). Lo spettro di eccitazione dello standard verde è mostrato in ciano, lo spettro di emissione in verde. Le linee laser di eccitazione a 485 nm (blu) e 561 nm (arancione) sono mostrate come linee tratteggiate. Le caselle trasparenti verdi e magenta mostrano l'intervallo di emissione raccolto (Nota supplementare 2). (E) Determinazione dell'eccitazione diretta δ del fluoroforo rosso mediante il laser a 485 nm (eq. 4). Il codice colore è identico a (D), l'arancione chiaro e scuro mostrano rispettivamente lo spettro di eccitazione ed emissione dello standard rosso. Fare clic qui per visualizzare una versione più grande di questa figura.
Per determinare e calibrare la sovrapposizione del volume di eccitazione verde e rosso, viene utilizzato un doppio filamento di DNA a doppia etichetta (Figura 3A) come descritto sopra. Qui, i fluorofori sono distanziati di 40 bp l'uno dall'altro in modo tale che nessun FRET possa verificarsi tra i fluorofori verdi e rossi attaccati alle estremità dei doppi filamenti di DNA. La Figura 3B mostra le autocorrelazioni da entrambi i fluorofori in verde (ACFgp) e magenta (ACFrd) e la correlazione PIE-cross, CCFPIE, in ciano. Si noti che per CCFPIE, il segnale nei canali verdi nella finestra temporale del prompt è correlato con il segnale nei canali rossi nella finestra temporale di ritardo16.
Qui si ottiene un coefficiente di diffusione medio per il filamento di DNA di DDNA = 77 μm²/s. Maggiori dettagli sul calcolo sono disponibili nel protocollo passo-passo, Nota supplementare 4. Questo valore si ottiene inserendo nell'equazione2ala dimensione calibrata dei volumi di rilevazione verde e rosso ( Figura 2 ) e i rispettivi tempi di diffusione di ACFgp e ACFrd del filamento di DNA (Figura 3C). Successivamente, utilizzando i valori di correzione ottenuti rGR e rRG e utilizzando eq. 6 in seguito, la quantità di co-diffusione, cioè molecole a doppia etichetta (o complessi proteici in caso di co-trasfezione di due proteine diverse) può essere determinata dai campioni cellulari.
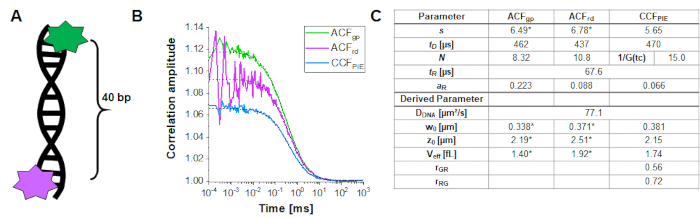
Figura 3: Calibrazione del volume di sovrapposizione verde-rosso utilizzando un campione di DNA. (A) Il filamento di DNA utilizzato per la calibrazione trasporta un fluoroforo di calibrazione verde e uno rosso, con una distanza di 40 bp in mezzo. La distanza tra gli anni deve essere sufficientemente grande da escludere FRET tra i fluorofori. (B) Misurazione rappresentativa di 60 s di una soluzione di DNA 10 nM. Autocorrelazioni da entrambi i fluorofori in verde(ACFgp,standard verde) e magenta(ACFrd,standard rosso) e dalla PIE-crosscorrelation, CCFPIE,in blu. La tabella nel pannello (C) mostra i risultati di adattamento basati sul modello di diffusione 3D incluso un termine di rilassamento aggiuntivo (eq. 1) e il coefficiente di diffusione del parametro derivato del DNA, DDNA (eq. 2a), la dimensione e la forma del volume di sovrapposizione (eq. 2a-c) e i rapporti di correzione rGR e rRG (eq. 6 ). Si prega di notare che i valori per il volume di rilevamento verde e rosso (etichettati con *) sono stati presi dall'adattamento dei singoli fluorofori mostrati nella Figura 2. Fare clic qui per visualizzare una versione più grande di questa figura.
Esperimenti sulle cellule vive
Nella sezione seguente, viene presentata l'analisi di esperimenti di cellule vive per diversi costrutti AR β2. Poiché β2AR è una proteina di membrana, la sua diffusione è in gran parte limitata a una diffusione bidimensionale (Figura 4A) lungo la membrana cellulare (ad eccezione dei processi di trasporto o riciclaggio da o verso la membrana) 2. Con la restrizione alla diffusione 2D il fattore di forma s = z0/w0 in eq. 1 diventa obsoleto risultando in un modello di diffusione semplificato (eq. 9).
Costrutti con etichetta singola: β2AR-IL3-eGFP e NT-SNAP-β2AR
La Figura 4 mostra misure esemplari del costrutto single-label β2AR-IL3-eGFP (Figura 4B), dove eGFP è inserito nel loop intracellulare 3, e il costrutto NT-SNAP-β2AR (Figura 4C), dove il tag SNAP è coniugato al N-terminus di β2AR. Il tag SNAP è etichettato con un substrato superficiale SNAP impermeabile alla membrana. Le curve rappresentative mostrano la media di 4-6 misurazioni ripetute con tempi di acquisizione di 120 - 200 s ciascuna. Le rispettive autocorrelazioni ACFgp e ACFrd del segnale eGFP e SNAP sono montate su un modello di diffusione bidimensionale bimodale (eq. 9). In termini di dinamica veloce, eGFP mostra solo la tripletta attesa lampeggiante a tR1 ~ 9 μs mentre il segnale SNAP richiede due tempi di rilassamento, uno al tipico tempo di lampeggiamento della tripletta di tR1 ~ 5 μs e un secondo a tR2 ~ 180 μs.
La luminosità molecolare dei fluorofori nelle cellule viventi è di 0,8 KHz (eGFP) e 1,7 kHz (SNAP) per molecola nelle condizioni di eccitazione date (eqs. 5a-b). La concentrazione dei costrutti AR β2etichettati incorporati nella membrana cellulare dovrebbe essere nell'intervallo nano-molare e può essere determinata dal numero medio di molecole (eq. 9, Figura 4C)e dalla dimensione del rispettivo volume confocale per il canale verde e rosso (Figura 2) usando eq. 8.
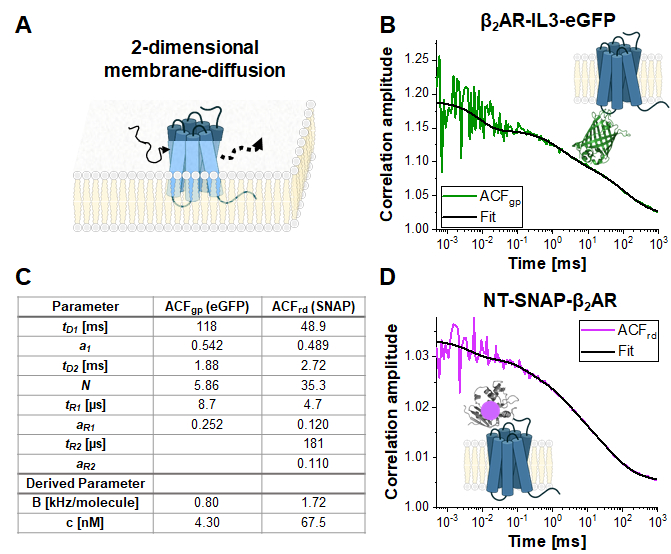
Figura 4: Misura rappresentativa di costrutti a etichetta singola. (A) In questo studio, il recettore di membrana β2AR è stato usato come esempio. In contrasto con i fluorofori e il filamento di DNA utilizzati per la calibrazione, che potrebbero fluttuare liberamente attraverso il volume di rilevamento, le proteine di membrana si diffondono principalmente lateralmente lungo la membrana, descritta come diffusione bidimensionale. (B, D) ACFgp e ACFrd dei costrutti single-label β2AR-IL3-eGFP (B) e NT-SNAP-β2AR (D). Viene mostrata la media di 4-6 misurazioni ciascuna raccolta per 120 - 200 s. La tabella nel pannello (C) mostra i risultati di adattamento dei dati al modello di diffusione bidimensionale bimodale includendo ulteriori termini di rilassamento (eq. 7). Fare clic qui per visualizzare una versione più grande di questa figura.
Costrutto a doppia etichetta: NT-SNAP-β2AR-IL3-eGFP
Nel costrutto a doppia etichetta NT-SNAP-β2AR-IL3-eGFP (corto NT-SNAP), eGFP viene inserito nel loop intracellulare 3 e, il tag SNAP coniugato al N-terminus di β2AR (Figura 5A). In questa configurazione, l'eGFP si trova sul lato interno della membrana e lo SNAP sul lato esterno con distanze troppo grandi per FRET. In un caso ideale, questo costrutto mostrerebbe una co-diffusione al 100% del fluoroforo verde e rosso e nessun segnale FRET. La figura 5B-D mostra due misurazioni dell'NT-SNAP in due celle in due giorni di misurazione diversi. Adattando l'ACFgp e l'ACFrd della misura "migliore" mostrata in Figura 5B con eq. 7 e il CCFPIE con eq. 9, rivela 50-60 molecole a fuoco per l'ACF gp e ACFrd, mentre Napp, quindi 1/G0(tc) ~ 114 per il CCFPIE (Figura 5C ). La concentrazione dei recettori etichettati si trova nell'intervallo ~ 100 nM come determinato con eq. 8. Per determinare la concentrazione media di molecole a doppia etichetta, in primo luogo, viene calcolato il rapporto di G0(tc) (rappresentato da 1 /N(app)) del PIE CCF con ACFgp e ACFrd, rispettivamente , (eq. 6). Successivamente, questi valori, rGRcell= 0,43 e rRGcell = 0,53 vengono confrontati con i valori ottenuti dalla misurazione del DNA (rGR, DNA= 0,51 e rRG, DNA = 0,79 in questo giorno di misurazione). Usando la regola delle proporzioni, un rGRcell= 0,43 dall'ACF gp del segnale eGFP riflette una frazione di co-diffusione (rGRcell/rGR,DNA) di 0,84, dove per l'altro caso di ACFrd del segnale del substrato SNAP, questo valore ammonta a 0,67. La concentrazione media del costrutto NT-SNAP a doppia etichetta può infine essere calcolata in base a eq. 10. Al contrario, nella misurazione mostrata nella Figura 5D da un giorno diverso, la concentrazione dei recettori è piuttosto bassa e i dati molto rumorosi in modo tale che l'intervallo di adattamento è limitato fino a ~ 10 μs. Inoltre, si osserva solo una bassa quantità di co-diffusione (15 - 26%).
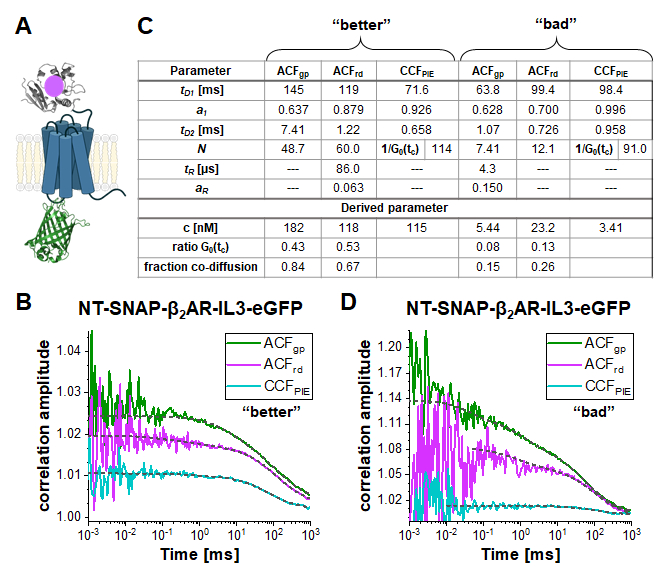
Figura 5: NT-SNAP-β2 2AR-IL3-eGFP con doppia etichetta. (A) Nel costrutto a doppia etichetta, l'eGFP viene inserito nel loop intracellulare 3 e il tag SNAP attaccato al N-terminus di β2AR (NT-SNAP). (B, D) ACFgp, ACFrd e CCFPIE di due misure del costrutto a doppia etichetta. I dati sono adatti a un modello di diffusione bidimensionale bimodale(eq. 9, CCFPIE)e includono termini di rilassamento aggiuntivi(eq. 7, ACFgp e ACFrd). La tabella nel pannello (C) mostra i risultati di adattamento e la concentrazione del parametro derivato (eq. 8), il rapporto tra l'ampiezza di correlazione al tempo di correlazione zero (G0(tc)) e la frazione di molecole co-diffuse (eq. 10). Si noti che le misurazioni sono state acquisite in giorni diversi, quindi sono stati utilizzati fattori leggermente diversi per la correzione dell'ampiezza (B: rGR, DNA = 0,51 e r RG, DNA = 0,79; D: rGR,DNA = 0,51 e rRG,DNA = 0,56). Fare clic qui per visualizzare una versione più grande di questa figura.
Costrutto a doppia etichetta sottoposto a FRET: β2AR-IL3-eGFP-CT-SNAP
Nel costrutto a doppia etichetta β2AR-IL3-eGFP-CT-SNAP (Figura 6A), l'eGFP viene inserito nel loop intracellulare 3 identico al costrutto NT-SNAP-β2AR-IL3-eGFP con il tag SNAP attaccato al C-terminus. Qui, entrambe le etichette si trovano sullo stesso lato della membrana plasmatica delle cellule, in modo che i fluorofori siano nelle immediate vicinanze in modo che FRET si verifichi come indicato dalla durata eGFP spenta (Nota supplementare 5). Considerando la flessibilità di regioni proteiche relativamente non strutturate come il C-terminus34 e almeno due diverse conformazioni proteiche di GPCR35, "high FRET" (HF) o "low FRET" (LF), è stato possibile osservare cambiamenti dinamici nell'efficienza FRET dovuti a cambiamenti di distanza eGFP-SNAP e identificati da un termine anticorrelazione nel FRET CCF (curva arancione nella Figura 6B ). Le fluttuazioni di FRET hanno dimostrato di essere anticor correlate in quanto il recettore può essere solo in uno stato alla volta, HF o LF. L'adattamento congiunto (o globale) di tutte e cinque le curve di correlazione (Figura 6B) rivela ~ 70% di molecole a diffusione lenta a ~ 100 ms mentre il resto si diffonde con ~ 1 ms. Tutte le autocorrelazioni e CCFFRET mostrano termini di rilassamento a 37 μs e 3 μs; quelle correlazioni dominate dal segnale rosso (ACFrp, ACFrd e CCFFRET) mostrano una componente lenta aggiuntiva ~ 50 ms (Figura 6C).
I cambiamenti indotti da FRET sul FRET CCF in condizioni diverse (Figura 6D) sono dimostrati da una serie di simulazioni di un sistema a due stati con un tempo di fluttuazione di 70 μs tra gli stati LF e HF. Al passaggio dallo stato LF a quello HF, si osservano cambiamenti nel segnale anticor correlato nella finestra temporale richiesta: il segnale verde diminuisce e il segnale rosso aumenta (viceversa per la commutazione HF -> LF). Se la commutazione HF-LF avviene su scale temporali più veloci del tempo di diffusione, in altre parole durante il tempo di permanenza della molecola nel fuoco, la velocità può essere derivata dall'anticorrelazione nel CCFFRET6,31,36. Si prega di notare che i processi dinamici più lenti del tempo di diffusione non possono essere osservati in FCS.
In questa dimostrazione, sono stati ipotizzati due diversi scenari FRET, che mostrano un cambiamento moderato o massimo nell'efficienza FRET tra i due stati. Le simulazioni sono state eseguite utilizzando Burbulator37 e considerano l'assenza o la presenza di tripletta lampeggiante e l'aumento della quantità di crosstalk del donatore nei canali rossi. Il termine di diffusione è stato modellato come una distribuzione bimodale con il 30% di molecole a diffusione rapida a tD1 = 1 ms e il resto delle molecole che si diffondono lentamente con tD2 = 100 ms. In totale, 107 fotoni sono stati simulati in un volume 3D di forma gaussiana con w0 = 0,5 μm e z0 = 1,5 μm, una dimensione della scatola di 20 e NFCS = 0,01.
La Figura 6E-F mostra i risultati della simulazione per il FRET cross-correlation CCFFRET indotto per il contrasto FRET moderato (Figura 6E) e massimo FRET (Figura 6F) in assenza (linee solide) e presenza di triplette lampeggianti (linee tratteggiate). L'anti-correlazione indotta da FRET può essere facilmente vista nella Figura 6F. L'effetto "smorzamento" sull'aggiunta di un ulteriore stato tripletta riduce l'ampiezza di correlazione (Figura 6E-F)38,39.
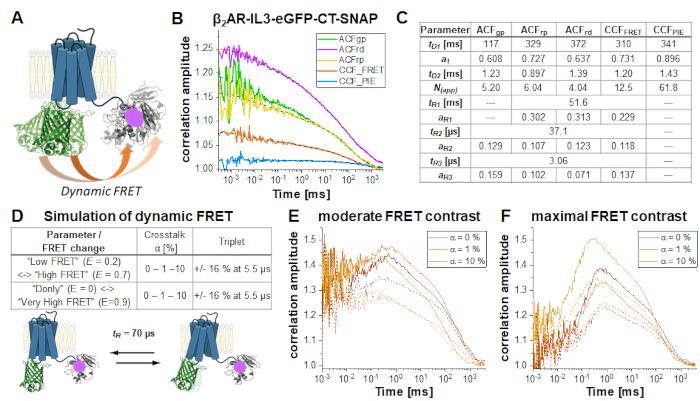
Figura 6: Simulazione di un campione a doppia etichetta che mostra FRET dinamico. (A) Doppia etichetta β2AR con un eGFP inserito nel circuito intracellulare 3 e un tag SNAP C-terminale. Entrambi i fluorofori sono abbastanza vicini da subire FRET e mostrano cambiamenti nell'efficienza FRET se il recettore subisce dinamiche proteiche. (B) Autocorrelazione (ACFgp, ACFrp e ACFrd, si adattano a eq. 7) e curve di correlazione incrociata (CCFFRET (eq. 7) e CCFPIE (eq. 9)) di una misura di esempio. La tabella nel pannello (C) mostra i risultati di adattamento. (D-F) Per mostrare l'influenza del parametro sperimentale sul termine di anticorrelazione previsto, indotto da FRET, sono state eseguite 12 simulazioni, in cui sono state modellate la variazione dell'efficienza FRET (piccola o grande), la diversa quantità di crosstalk del donatore nei canali accettori (0%, 1% o 10%) e l'assenza e la presenza di tripletta lampeggiante. La frazione di equilibrio di entrambi gli stati FRET è stata assunta a 50:50 e i loro tassi di cambio sono stati aggiustati in modo tale che il tempo di rilassamento ottenuto tR = 70 μs. Maggiori dettagli sulle simulazioni si vedono nel testo. (E) CCFFRET della simulazione risulta con un moderato contrasto FRET e in assenza di diafonia (arancione scuro), 1% diafonia (arancione) e 10% di diafonia (arancione chiaro). Le linee continue mostrano risultati in assenza di triplette, linee tratteggiate in presenza di tripletta. (F) CCFFRET dei risultati della simulazione con massimo contrasto FRET. Il codice colore è identico a (E). Fare clic qui per visualizzare una versione più grande di questa figura.
Tuttavia, nella simulazione più simile alle condizioni sperimentali (α = 10%, tripletta lampeggiante del 15% e moderato contrasto FRET, linea gialla tratteggiata nella Figura 6E), il termine anticorrelazione è quasi diminuito. La Figura 7 mostra il risultato dell'analisi di questi dati simulati utilizzando le informazioni codificate negli istogrammi del tempo di arrivo dei fotoni (cioè la durata della fluorescenza) mediante Fluorescence Lifetime Correlation Spectroscopy (FLCS)17,19 o FCS filtrato per specie (fFCS)18. Qui, le vite di fluorescenza delle specie conosciute HF e LF (Figura 7A) vengono utilizzate per generare pesi o "filtri" (Figura 7B) che vengono applicati durante la procedura di correlazione. Nelle curve di correlazione tra specie e correlazioni incrociate ottenute (Figura 7C-D) l'anticorrelazione può essere chiaramente osservata.
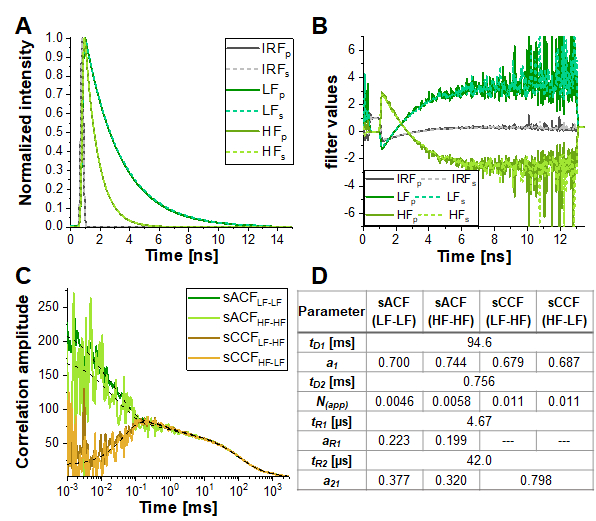
Figura 7: FcS filtrato a vita può aiutare a scoprire le fluttuazioni basate sulla dinamica proteica nell'efficienza FRET in campioni con diafonia elevata, lampeggiante tripletta significativa o altre proprietà fotofisiche o sperimentali che mascherano l'anticorrelazione indotta da FRET nel FRETCCF. Qui, l'approccio è mostrato esemplare per i dati mostrati nella Figura 6E per la simulazione contenente il 10% di diafonia e il 5% di tripletta lampeggiante. (A) Modelli di decadimento dell'intensità di fluorescenza normalizzati per le due specie FRET (verde chiaro e verde scuro per FRET alto e basso, rispettivamente) e IRF (grigio). Il modello per il canale di rilevamento parallelo è mostrato in linee continue, linee tratteggiate per il canale di rilevamento perpendicolare. (B) La funzione di ponderazione o "filtro" sono stati generati in base ai modelli mostrati in (A), il codice colore è identico a (A). Si prega di notare che solo il segnale nei canali di rilevamento verdi, e quindi la tempra del donatore indotta da FRET, è considerato qui. (C) Si ottengono quattro diverse correlazioni specie-selettive: le autocorrelazioni specie-specie dello stato FRET basso (sACFLF-LF, verde scuro) e dello stato FRET alto (sACFHF-HF, verde chiaro), e le due correlazioni specie-cross tra il FRET basso allo stato FRET alto (sCCFLF-HF, arancione scuro) e viceversa (sCCFHF-LF , arancione). L'sCCF mostra chiaramente l'anticorrelazione nell'intervallo μs. Le linee nere tratteggiate mostrano le vestibilità. sACF erano adatti con eq. 9 e sCCF con eq. 11. La tabella nel pannello (D) mostra i risultati di adattamento. Fare clic qui per visualizzare una versione più grande di questa figura.
Ampiezza del CCFPIE per studiare l'interazione proteina-proteina (PPI)
Infine, un caso d'uso comune per FCS basato su PIE nelle cellule vive è quello di studiare l'interazione tra due diverse proteine. Qui, il parametro di lettura è l'ampiezza del CCFPIE, o più precisamente il rapporto tra le ampiezze di autocorrelazione ACFgp e ACFrd per l'ampiezza di CCFPIE. Per mostrare l'effetto dell'aumento della co-diffusione su CCFPIE,sono state eseguite simulazioni basate sui due costrutti mono-etichetta, β2AR-IL3-eGFP e NT-SNAP-β2AR (Figura 8A). La Figura 8B mostra come l'ampiezza di CCFPIE aumenta quando la frazione di molecole co-diffusenti cambia dallo 0% al 100%. Si prega di notare che è stata aggiunta una diafonia dell'1% del segnale verde nei canali rossi nella finestra temporale di ritardo con i componenti di diffusione altrimenti modellati come mostrato sopra.
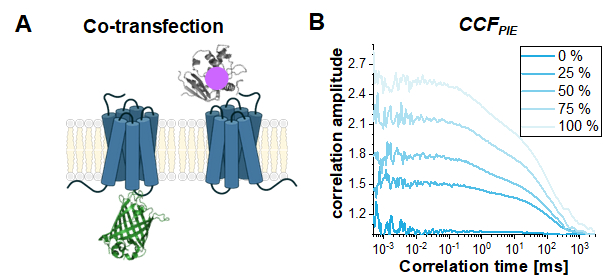
Figura 8: Il CCFPIE può essere utilizzato per studiare l'interazione di due proteine. (A) Qui è stato simulato uno studio di co-trasfezione di β2AR-IL3-eGFP con NT-SNAP-β2AR (che porta un'etichetta SNAP "rossa"). (B) Per una quantità crescente di molecole co-diffuse (0% (blu scuro) -> 100% (azzurro)) aumenta l'ampiezza G(tc). Il termine di diffusione è stato nuovamente modellato come una distribuzione bimodale con il 30% di molecole a diffusione rapida a tD1 = 1 ms e il resto delle molecole che si diffondono lentamente con tD2 = 100 ms. Inoltre, è stata aggiunta l'1% di diafonia del segnale verde nella finestra temporale di ritardo rossa. Fare clic qui per visualizzare una versione più grande di questa figura.
| Simbolo | Significato (unità comune) | |||
| α | diafonia del fluoroforo verde dopo l'eccitazione verde nei canali di rilevamento rossi (%) | |||
| a1 | frazione del primo componente di diffusione nel modello di diffusione bimodale dei recettori di membrana | |||
| af | ampiezza totale del termine anticorrelazione | |||
| aR | ampiezza della fotofisica / tripletta lampeggiante | |||
| b | baseline / offset di una curva di correlazione | |||
| B | luminosità molecolare di un fluoroforo ((kilo-)conta per molecola e secondo) | |||
| BG | sfondo (ad es. da un campione di riferimento appropriato: ddH2O, buffer, cella non trasfetta, ecc.) | |||
| c | concentrazione | |||
| CR | frequenza di conteggio (KHz o (kilo-) conteggi al secondo) | |||
| δ | eccitazione diretta del fluoroforo rosso dopo eccitazione verde (%) | |||
| D | coefficiente di diffusione (μm²/s) | |||
| G(tc) | funzione di correlazione | |||
| N | numero di molecole a fuoco | |||
| NA | Numero di Avogadro (6.022*1023 Mol-1) | |||
| rGR, rRG | rapporto di ampiezza della funzione di autocorrelazione verde o rossa alla funzione di correlazione incrociata basata su PIE | |||
| s | fattore di forma dell'elemento volumetrico confocale | |||
| tc | tempo di correlazione (di solito in millisecondi) | |||
| tD | tempo di diffusione (di solito in millisecondo o microsecondo) | |||
| tR | tempo di rilassamento della fotofisica (di solito in microsecondi) | |||
| tT | tempo di rilassamento della tripletta lampeggiante (di solito in microsecondo) | |||
| l0 | mezza larghezza dell'elemento volumetrico confocale (μm) | |||
| z0 | mezza altezza dell'elemento volumetrico confocale (μm) | |||
Tabella 1: Elenco delle variabili e delle abbreviazioni. Per l'uso di simboli e definizioni negli esperimenti di fluorescenza e FRET, si raccomandano le linee guida della comunità FRET40.
FASCICOLI SUPPLEMENTARI:
SuppNote1_Coverslip pulizia.docx fare clic qui per scaricare questo file.
SuppNote2_Confocal installazione.docx fare clic qui per scaricare questo file.
SuppNote3_Data esportare.docx Fare clic qui per scaricare questo file.
SuppNote4_FCCS l'analisi della calibrazione utilizzando ChiSurf.docx Fare clic qui per scaricare questo file.
SuppNote5_Fluorescence istogrammi a vita.docx Fare clic qui per scaricare questo file.
S6_Scripts.zip Fare clic qui per scaricare questo file.
S7_Excel_templates.zip Fare clic qui per scaricare questo file.
Discussione
Le tecniche FCS nei GPCR consentono di valutare la mobilità e le interazioni dei recettori all'interno delle cellule vive41. Il vantaggio della tecnica FRET-FCS è che, insieme alla mobilità, è possibile studiare la dinamica conformazionale dei GPCR. Tuttavia, l'esecuzione di FRET-FCS in cellule vive è impegnativa e richiede cellule che mostrino un'espressione bassa (o massimamente moderata) della proteina di interesse etichettata fluorescentemente, una configurazione ben calibrata e una buona pipeline per analizzare i dati. Qui, in primo luogo, vengono discussi i punti critici nella preparazione del campione e nella procedura sperimentale per quanto riguarda i punti di vista biologici, spettroscopici e tecnici.
Le fasi sperimentali critiche includono la minimizzazione dello sfondo e dell'autofluorescenza (utilizzando coverslip ampiamente puliti e mezzi privi di fenolo-rosso), l'ottimizzazione delle condizioni di trasfezione (ad esempio, quantità di DNA plasmidico e tempo dopo la trasfezione) per ottenere bassi livelli di espressione e un'etichettatura efficiente. Naturalmente, è anche fondamentale garantire che la funzione della proteina etichettata non sia ostacolata. Pertanto, negli esperimenti di cellule vive, la decisione per la strategia di etichettatura e la posizione dell'etichetta è spesso presa a favore di proteine fluorescenti o tag SNAP / CLIP attaccati al flessibile N- o C-terminus42,43. Strategie di etichettatura alternative come l'inserimento di un amminoacido innaturale con una catena laterale reattiva per l'etichettatura con un fluoroforo organico sono emerse negli ultimi anni44.
Per il PIE-FCS bicolore, dove deve essere studiata solo l'interazione di due molecole di interesse, i fluorofori possono essere selezionati da una grande varietà di proteine fluorescenti consolidate o substrati SNAP/CLIP. Qui, dal punto di vista della spettroscopia, l'obiettivo dovrebbe essere quello di selezionare una coppia tale che si verifichi una piccola diafonia o eccitazione diretta dell'accettore. Inoltre, i fluorofori selezionati dovrebbero essere fotostabili e mostrare poco o nessun sbiancamento nelle condizioni sperimentali scelte. Si consiglia di selezionare fluorofori nell'intervallo spettrale rosso in quanto (1) lo sfondo di autofluorescenza dalla cellula è ridotto e (2) la luce di eccitazione è di lunghezza d'onda più lunga, quindi meno fototossica14. Il fotosableching può essere ridotto al minimo conducendo prima una cosiddetta "serie di potenze", in cui la potenza del laser viene aumentata gradualmente e si osserva la luminosità molecolare. L'intervallo di intensità di eccitazione ottimale si trova nell'intervallo lineare dei risultati45.
Se le due etichette dovrebbero riportare anche la dinamica conformazionale delle proteine attraverso FRET allora la scelta dei fluorofori disponibili è più ristretta. Qui, la possibile distanza minima / massima tra i due fluorofori dovrebbe essere stimata in anticipo, ad esempio, in base alle strutture disponibili o alle dimensioni molecolari, e una coppia di fluorofori selezionata con un raggio di Förster ragionevole R0 tale che FRET possa effettivamente verificarsi20.
Qui, eGFP e un tag SNAP sono stati scelti per l'etichettatura, e il tag SNAP è stato etichettato con un substrato superficiale intracellulare o impermeabile alla membrana. Gli spettri sono simili a quelli mostrati in Figura 2C-D. Questa combinazione di fluorofori mostra un'elevata diafonia dell'eGFP nei canali di rilevamento rossi e l'eccitazione diretta dell'accettore del substrato SNAP mediante l'eccitazione verde nella finestra temporale immediata e si traduce in un significativo segnale "falso" nei canali rossi nella finestra temporale del prompt. Idealmente, entrambi i valori, cross talk e eccitazione diretta dell'accettore, non dovrebbero superare il 5%5,6,38. Tuttavia, con un raggio di Förster di 57 Å, è ideale per sondare la distanza tra le etichette nel βcostrutto 2AR-IL3-eGFP-CT-SNAP come può essere valutato dalla durata eGFP spenta (Nota supplementare 5).
Tecnicamente, come per qualsiasi esperimento di spettroscopia di fluorescenza, il dispositivo dovrebbe essere ben allineato e dovrebbe possedere fonti di eccitazione adeguate, filtro di emissione e rivelatori sensibili. Per evitare artefatti dal rivelatore dopo l'applicazione sulla scala temporale μs, dovrebbero essere presenti almeno due rilevatori di ciascun colore, che possono essere correlati in modo incrociato. Nella moderna elettronica di conteggio dei singoli fotoni correlata al tempo, il tempo morto della scheda di rilevamento nell'intervallo di tempo ns difficilmente gioca un ruolo a causa dei canali di routing indipendenti, tuttavia, potrebbe essere controllato come proposto da Müller et al 16 a condizione che l'intervallo di tempo di interesse si trovi nell'intervallo di tempo sub-μs / ns. Inoltre, per risoluzioni temporali ancora più elevate nell'intervallo ps, ogni canale di rilevamento dovrebbe essere raddoppiato, cioè dovrebbero essere utilizzati quattro rilevatori per colore, per bypassare anche i tempi morti del rilevatore2,15,29,46. Mentre la durata media della fluorescenza può essere stimata utilizzando il rilevamento della fluorescenza non polarizzata, per l'analisi della distanza (~ distribuzione) tra i fluorofori l'emissione deve essere raccolta in base alla polarizzazione. Ciò è dovuto al fatto che l'efficienza del trasferimento di energia in FRET si basa sull'orientamento dei due fluorofori. Informazioni più dettagliate possono essere trovate qui20,28,47. Infine, negli esperimenti PIE, la distanza tra l'impulso prompt e quello di ritardo è fondamentale e dovrebbe essere scelta in modo tale che l'intensità di fluorescenza dei fluorofori sia stata in gran parte decaduta (Figura 1B). Una regola comune è quella di posizionare i due impulsi 5 volte la durata di fluorescenza a parte, cioè per eGFP con una durata di fluorescenza di 2,5 ns la distanza dovrebbe essere di 12,5 ns ad almeno22.
Dopo aver dettagliato tutte le considerazioni per la procedura sperimentale, i dati e la loro analisi vengono discussi in modo più dettagliato. Come accennato nella sezione protocollo, l'allineamento del setup deve essere controllato quotidianamente, compresa l'analisi delle misure di calibrazione. I dati mostrati nella Figura 2A-C, ad esempio, mostrano una componente di rilassamento aggiuntiva nell'intervallo 8-40 μs. È noto che il tipico lampeggiamento della tripletta del fluoroforo di calibrazione verde nell'intervallo 2-10μs 13,15,48. La componente di rilassamento lento richiesta in tutte le curve del campione di DNA (Figura 3C), troppo lenta per lampeggiare la tripletta effettiva, potrebbe derivare da interazioni del DNA con i fluorofori39. Tuttavia, questo componente non sarebbe previsto in CCFPIEe molto probabilmente deriva da una diafonia residua. Pertanto, è altamente consigliabile eseguire l'analisi dei campioni di calibrazione direttamente prima di procedere agli esperimenti cellulari per giudicare la qualità dell'allineamento del giorno.
La corretta calibrazione del volume di sovrapposizione confocale richiede un campione con co-diffusione al 100% dell'etichetta verde e rossa. Qui viene utilizzato dna a doppio filamento etichettato fluorescentemente. Entrambi i filamenti di DNA possono essere personalizzati per avere i fluorofori desiderati alla distanza richiesta l'uno dall'altro. I fili progettati possono essere ricotti con alta resa. Tuttavia, good laboratory practice consiglia di controllare l'integrità e il grado di etichettatura dei filamenti di DNA mediante elettroforesi su gel di acarosio e di misurare lo spettro di assorbimento. Inoltre, la resa dell'assemblaggio a doppio filamento deve essere controllata in quanto questa misurazione di calibrazione si basa in modo critico sul presupposto che vi sia una co-diffusione del 100% del verde con l'etichetta rossa. Nel caso in cui l'ipotesi non sia valida, potrebbe essere necessario applicare i fattori di correzione16,22. Nelle misurazioni di taratura mostrate nella Figura 2 e nella Figura 3, è stato ottenuto un volume di rilevamento di 1,4 fL e 1,9 fL nel canale verde e rosso, rispettivamente. Questa differenza di dimensioni è prevista per un setup con volumi di eccitazione quasi limitati alla diffrazione (Nota supplementare 2). In questa condizione, la dimensione del volume di eccitazione scala con la lunghezza d'onda di eccitazione. Questo a sua volta spiega le diverse ampiezze di correlazione osservate nella Figura 3B. I fattori di correzione derivati rGR = 0,56 e rRG = 0,72 sono corretti per questa discrepanza dimensionale e potenziale sovrapposizione non perfetta dei due volumi di eccitazione3,4.
Figura 4, Figura 5, Figura 6e Figura 7 mostrano il flusso di lavoro di uno studio basato su PIE-F(C)CS volto a comprendere la dinamica conformazionale delle proteine. In primo luogo, i due costrutti mono-etichetta β2AR-IL3-eGFP e NT-SNAP-β2AR servono come controlli per caratterizzare le proprietà fluorofore nelle cellule in assenza del rispettivo altro fluoroforo (Figura 4). Successivamente, il costrutto a doppia etichetta NT-SNAP-β2AR-IL3-eGFP che trasporta un tag SNAP rivolto verso l'esterno della cellula e un eGFP sul lato citoplasmatico funge da controllo "co-diffusione al 100%" (Figura 5). L'ultimo costrutto, β2AR-IL3-eGFP-CT-SNAP, trasporta entrambi i fluorofori sul lato citoplasmatico e abbastanza vicini tra loro per sottoporsi a FRET. Anche in questo caso, ci si aspetterebbe una co-diffusione al 100% in tandem con fluttuazioni di intensità anti-correlate nel segnale dei canali verde e rosso nella finestra temporale immediata, cioè dopo l'eccitazione del donatore, a causa della dinamica delle proteine che influenza l'efficienza FRET31,32,33. Questa dinamica potrebbe apparire come anti-correlazione nel FRET CCF (Figura 6-7).
Tutti i costrutti GPCR β2AR mostrano la diffusione bimodale sulla membrana cellulare (Figura 4A). Mentre il β2AR-IL3-eGFP mostra solo la tripletta attesa lampeggiante (Figura 5B)13,15, NT-SNAP-β2AR mostra un ulteriore tempo di rilassamento lento ( Figura5C-D). È probabile che tR2 possa derivare da substrato SNAP non legato. Ciò potrebbe essere chiarito da ulteriori esperimenti, ad esempio misurando anche la diffusione e le proprietà fotofisiche del substrato SNAP utilizzato in una soluzione acquosa. Da notare, un semplice esperimento per distinguere tra tempi di diffusione e di rilassamento è quello di cambiare il foro stenopeico dell'assetto confocale, cioè aumentando il volume effettivo: mentre i tempi di diffusione aumentano con l'aumentare dei volumi effettivi, i termini di rilassamento sono inalterati13. Quando si determina la concentrazione di proteina fluorescente (FP) in base ai risultati di adattamento, tenere presente che gli FP in generale subiscono un processo di maturazione, in cui infine si forma il cromoforo12. Questo tempo di maturazione può differire da FP a FP oltre alla fotofisica che dipende dall'ambiente chimico locale13,15. Pertanto, la concentrazione proteica effettiva presente nel campione riportato da FCS è solitamente sottostimata, il che può essere corretto se la frazione di FP non fluorescenti può essere determinata nell'esperimento. Infine, è consigliabile controllare gli spettri fluorofori nelle cellule vive per correggere i valori di α e δ, se necessario, poiché la maggior parte dei fluorofori reagisce sensibile al loro ambiente13,15,48. Lo sfondo da sottrarre è determinato dal segnale raccolto nelle cellule non trasfettate. Inoltre, l'autocorrelazione del rispettivo altro canale di colore e del CCFPIE deve essere controllata per essere in grado di identificare i falsi segnali (Nota supplementare 4 - Figura 30).
Le due misurazioni dal NT-SNAP-β2AR-IL3-eGFP (Figura 5D), dove i fluorofori si trovano su lati diversi della membrana, sono state acquisite in giorni diversi e mostrano l'importanza delle statistiche nella fluorescenza a singola molecola risolta nel tempo. Qui, i diversi risultati possono essere dovuti al diverso grado di etichettatura: in una cella il più alto grado di etichettatura e la media delle misurazioni hanno provocato un rumore relativamente basso (Figura 5B), mentre dall'altra cella, solo due misurazioni potevano essere raccolte (Figura 5A). Oltre a raccogliere una quantità sufficiente di dati, è fondamentale valutare i risultati in modo tempestivo e forse ottimizzare la strategia di etichettatura. Quando si progettano gli esperimenti, è importante ricordare che FRET è sensibile, ma limitato a distanze fino a 10 nm e "cieco" altrimenti. Nel nostro caso, questa "cecità" è indicata dalla durata inalterata della fluorescenza eGFP (Nota supplementare 5). Nel β2ar-IL3-eGFP-CT-SNAP(Figura 6A),fret può essere individuato dalla durata eGFP spenta (nota supplementare 5). Tuttavia, non si osserva alcun termine di anticorrelazione (Figura 6B), il che significa che FRET non è fluttuante o in una scala temporale più lenta del tempo di diffusione. Sono richiesti fino a tre termini di rilassamento aggiuntivi in ACFgp, ACFrp, ACFrd e CCFFRET (Figura 6C). La componente lenta in ACFrp, ACFrd e CCFFRET potrebbe essere dovuta allo sbiancamento dell'accettore e, naturalmente, influenza il valore ottenuto della diffusione lenta trovata in queste curve (~ 350 ms rispetto a 117 ms in ACFgp). tD nel canale rosso dovrebbe essere leggermente più grande che nel canale verde a causa dei volumi confocali di dimensioni diverse (Figura 2) - ma solo da un fattore paragonabile alla differenza di dimensioni. Il tempo di rilassamento molto veloce di 3 μs riflette il battito trecente dei fluorofori13,15,48,mentre il tempo di rilassamento più lento di 37 μs potrebbe essere dovuto a FRET: allo stesso modo, poiché FRET induce un'anticorrelazione nel FRETCCF,si prevedono correlazioni positive nelle autocorrelazioni31,32,33. La presenza di questo termine come "positivo" nel CCFFRET e la sua presenza nell'ACFrd potrebbero essere spiegate con la diafonia alta e dovrebbero essere ulteriormente chiarite. Si noti che il CCFPIE è piatto a brevi tempi di correlazione come previsto.
D'altra parte, va notato che il verificarsi di FRET in un sistema di interesse porta a effetti non lineari sulle curve di correlazione6. La luminosità molecolare, ad esempio, di una molecola scala nell'ampiezza di correlazione al quadrato e ogni stato FRET (e le molecole sempre presenti senza un recettore attivo) mostra una diversa luminosità molecolare. Infatti, FRET diminuisce la concentrazione apparente di molecole verdi rilevate (cioè aumenta l'ampiezza ACFgp) e il numero di molecole rosse (determinato dal prompt rosso) è sovrastimato5. Entrambi gli effetti influenzano la quantità di interazione derivata sia da CCFFRET che da CCFPIE. Tuttavia, l'analisi globale come mostrato ad esempio per la dinamica intramolecolare di Calmodulin 31,32 o Syntaxin33 può rivelare la dinamica delle proteine. Se accuratamente calibrata, l'efficienza media fret può essere estratta dalle relative ampiezze CCFPIE e ACF22, mentre gli stati limite potrebbero essere determinati dall'analisi della distribuzione della vita di fluorescenza del donatore33.
Considerando il fatto che negli esperimenti di cellule vive con grandi fluorofori come eGFP il contrasto FRET è probabilmente ancora più basso di quanto ipotizzato per le simulazioni mostrate in Figura 6 e che l'eccitazione diretta dell'accettore non è stata aggiunta nella simulazione, potrebbe spiegare perché l'identificazione dell'anticorrelazione negli esperimenti di cellule vive è molto impegnativa. Un'alternativa di analisi promettente si basa sulla raccolta delle informazioni codificate negli istogrammi del tempo di arrivo del fotone(Figura 1B)accessibili grazie alla raccolta di dati di conteggio dei singoli fotone correlati al tempo29,30. Se la durata di fluorescenza (~pattern) delle due (o più) specie (FRET) all'interno del campione è nota (Figura 7A), è possibile scegliere "filtro" o pesi che vengono applicati durante il processo di correlazione (Figura 7B)17,18,19. Le curve di correlazione così ottenute, non rappresentano più la correlazione dei canali di rilevazione ma piuttosto le correlazioni auto- o incrociate tra due specie diverse (FRET), così rinominate in specie-ACF (sACF) o specie-CCF (sCCF). Applicando questo approccio ai dati simulati con contrasto FRET moderato, diafonia alta e tripletta lampeggiante si recupera il termine anticorrelazione (Figura 7C-D). Tuttavia, va notato che i tempi di rilassamento possono essere ottenuti ma la relazione con l'ampiezza è persa18. Questo approccio è stato applicato in precedenza in esperimenti su cellule vive, ad esempio per studiare l'interazione di EGFR con il suo antagonista49 o per separare la fluorescenza da proteine attaccate a varianti eGFP con durata di fluorescenza eccezionalmente breve e lunga50.
Mentre le misurazioni FRET basate su PIE in proteine purificate sono ampiamente utilizzate per studiare la dinamica delle proteine3622, nelle cellule vive si concentra sulla comprensione delle interazioni proteina-proteina. Questo approccio è stato applicato per studiare la regolazione dell'attività della MAP chinasi nel lievito51 o per risolvere l'interazione delle proteine di membrana con il loro partner di legame citosolico come riassunto in questo recente articolo52. Qui, possono sorgere complicazioni quando una significativa diafonia dei fluorofori verdi è ancora presente nella finestra temporale di ritardo dei canali rossi o del segnale rosso nei canali verdi nella finestra temporale del prompt. Il primo potrebbe essere causato da un ritardo insufficiente dell'impulso rosso rispetto all'impulso verde mentre entrambi gli effetti derivano da spettri di eccitazione ed emissione troppo fortemente sovrapposti dei fluorofori scelti. Si raccomanda di controllare attentamente i rispettivi costrutti etichettati come singoli e correggere le ampiezze PIE CCF false positive, specialmente nelle celle in cui l'autofluorescenza con una durata di fluorescenza molto breve potrebbe essere un altro fattore di complicazione22.
Per concludere, l'approccio FRET-FCS qui descritto ha un grande potenziale per comprendere le interazioni proteina-proteina e le dinamiche proteiche nelle cellule vive a concentrazioni fisiologiche vicine. In questo protocollo, l'attenzione è stata posta sulle misurazioni di calibrazione richieste e sull'analisi quantitativa necessaria da eseguire durante le misurazioni delle cellule vive. A tal fine, sono state mostrate diverse misurazioni di cellule vive integrate da simulazioni. Le simulazioni forniscono la comprensione generale qui in quanto il parametro potrebbe essere variato sistematicamente con modelli di adattamento su misura che descrivono la mobilità specifica e le proprietà fotofisiche dei rispettivi dati. L'analisi è stata eseguita con strumenti software open source con un ampio protocollo passo-passo e modelli facili da adattare. Infine, i progressi tecnici, e quindi la disponibilità di sistemi PIE-FCS stabili pronti per l'acquisto insieme alla diffusione di software open source per l'analisi dei dati, renderanno questa tecnica sempre più accessibile per una comunità di ricerca più ampia per svelare l'interazione e le dinamiche proteiche nelle cellule vive con la massima sensibilità.
Divulgazioni
Gli autori non hanno conflitti da dichiarare.
Riconoscimenti
Questo progetto è stato sostenuto dalla Deutsche Forschungsgemeinschaft (SFB/TR 240, numero di progetto 374031971, progetto INF) a J.B. e K.G.H.
Ringraziamo il Rudolf Virchow Center per il supporto finanziario e core unit Fluorescence Imaging per il supporto tecnico. Inoltre, ringraziamo Ashwin Balakrishnan per l'accurata correzione di bozze.
Materiali
| Name | Company | Catalog Number | Comments |
| 1x Telescope in 4f configuration with five lenses | Qioptiq, Rhyl, UK | G063126000 | Optics |
| 2x Band pass filters Brightline | AHF, Tübingen, Germany | HC 525/50 and HC 600/52 | Filter |
| 2x Dichroic beam splitter | AHF, Tübingen, Germany | HC BS F38-573 | Filter |
| 6-well culture plate Nunc | Thermo Scientific (Waltham, USA) | 140675 | Reagent |
| Alexa Fluor 488 NHS Ester (green calibration standard) | Invitrogen, Life Technologies (Carlsbad, USA) | A20000 | Reagent |
| Alexa Fluor 568 NHS Eater (red calibration standard) | Invitrogen, Life Technologies (Carlsbad, USA) | A20003 | Reagent |
| ASI stage PZ-2000 XYZ | Visitron Systems GmbH, Puchheim, Germany | WK-XYB-PZ-IX71 | Microscope Parts |
| Attofluor Cell Chamber, 35 mm diameter for 25 mm round coverslips | Invitrogen, Life Technologies (Carlsbad, USA) | A7816 | Glass coverslip holder |
| Avalanche photodiode Perkin Elmer (SPCM-AQR-14) | Laser Components GmbH, Olching, Germany | SPCM-AQR-14 | Single photon counting detector |
| Beamsplitter | Newport, Darmstadt, Germany | 10FC16PB.3 | Filter |
| Biorender (Software) | Science Suite Inc - o/a BioRender (Toronto, Canada) | --- | Software used to create GPCR sketch, https://app.biorender.com/ |
| Chinese hamster ovary (CHO) cell line | ATCC | CCL-61 | Cell lines |
| ChiSurf (Data analysis Software) | Thomas-Otavio Peulen, Department of Bioengineering and Therapeutic Sciences, University of California, San Francisco, USA | --- | tttrlib-based software to analyze fluorescence correlation data and fluorescence decay histograms, https://github.com/Fluorescence-Tools/chisurf Tutorial: https://www.youtube.com/watch?v=k9NgYbyLyXk&t=2s Ref: Peulen et al. J Phys Chem B. 121 (35), 8211-8241, (2017) |
| Chloroform | Sigma-Aldrich (St. Louis, USA) | 472476-2.5L | Reagent |
| DMSO | AppliChem GmbH (Darmstadt, Germany) | A3672,0250 | Reagent |
| DNA strand (40 bp fluorophore distance) | IBA Lifesciences GmbH (Göttingen, Germany) | --- | Reagent, 5’ CGC ACT GAA CAG CAT ATG ACA CGC GAT AGG CTA TCC TGC AGT ACG CT(Alexa568)C AGG 3’, 3’ GCG TGA CT(Alexa488)T GTC GTA TAC TGT GCG CTA TCC GAT AGG ACG TCA TGC GAG TCC 5’ |
| Dulbecco’s Modified Eagle Medium: Nutrient Mixture F12 (with and without phenol red) | GIBCO, Life Technologies (Carlsbad, USA) | P04-41250, P04-41650 | Reagent |
| Ethanol (absolute) | Sigma-Aldrich (St. Louis, USA) | 34852-1L-M | Reagent |
| Erythrosin B,Dye content >=95 % | Sigma-Aldrich (St. Louis, USA) | 200964-5G | Reagent, Instrument Response function, solve in EtOH to 10 mg/mL |
| Fetal Bovine Serum (FBS) | Biochrom (Berlin, Germany) | S 0615 | Reagent |
| Fluorescence Light Source X-Cite 120 Q | Excelitas Technologies, Ontario, Canada | XI120-Q-5060 | Microscope Parts |
| Fluorescent SNAP-substrate cell : SNAP Cell TMR- STAR | New England BioLabs (Frankfurt am Main, Germany) | S9105S | Reagent |
| Fluorescent SNAP-substrate surface : DY-549 | New England BioLabs (Frankfurt am Main, Germany) | S9112S | Reagent |
| Glass coverslips (Dimensions: diameter 24 mm, thickness 0.13 - 0.16 mm) | Marienfeld-Superior (Lauda-Königshofen, Germany) | 111640 | Reagent |
| Laser Controller | Picoquant, Berlin, Germany | 910020 (PDL 828-S "SEPIA II") | Optics |
| Laser lines (480 nm and 560 nm) | Picoquant, Berlin, Germany | 912485 (LDH-D-C-485), 912561 (LDH-D-TA-560) | Optics |
| Lipofectamine 2000 | Invitrogen, Life Technologies (Carlsbad, USA) | 11668-019 | Reagent |
| MFD suite (Software) | AG Seidel, Heinrich-Heine-University Duesseldorf, Germany | --- | Software package for analysis of single-molecule fluorescence experiments including e.g. Kristine (correlation of tttr data), Burbulator (simulation of single-molecule experiment), https://www.mpc.hhu.de/software/3-software-package-for-mfd-fcs-and-mfis |
| Mounted Achromatic Doublet, ARC: 400-700 nm, f=150 mm, D=25.4 mm | Thorlabs, Bergkirchen, Germany | AC254-150-A-ML | Second part of Beam expander |
| Neubauer Chamber (deepness 0.1 mm) | Marienfeld-Superior (Lauda-Königshofen, Germany) | 640110 | Reagent |
| Olympus IX 71 stand | Olympus, Hamburg, Germany | IX2-ILL100 | Microscope Parts |
| Opti-MEM (Reduced-Serum Medium) | GIBCO, Life Technologies (Carlsbad, USA) | 31985-047 | Reagent |
| Penicillin/Streptomycin | Sigma-Aldrich (St. Louis, USA) | 049M4857V | Reagent |
| Phosphate-buffered Saline (PBS) | GIBCO, Life Technologies (Carlsbad, USA) | 14190144 | Reagent |
| Pinhole (50 µM) | Newport, Darmstadt, Germany | PNH-50 | Pinhole |
| PMT Hybrid-40 | Picoquant, Berlin, Germany | 932200 (PMA Hybrid 40) | Single photon counting detector |
| Python scripts (Software) | Katherina Hemmen, Rudolf-Virchow Center for Integrative and Translational Imaging, University Wuerzburg, Germany | --- | Collection of self-written Python scripts based on tttrlib (https://github.com/Fluorescence-Tools/tttrlib) used to (1) determine the average count rates, (2) correlate the data and (3) build fluorescence decay histograms, https://github.com/HeinzeLab/JOVE-FCS |
| Quad band beamsplitter (zt405/473-488/561/640 rpc phase r uf1) | AHF, Tübingen, Germany | F73-421PH | Filter |
| Single mode fiber polarization keeping, NA = 0.08 with collimator | Picoquant, Berlin, Germany | 02126 | Optics |
| Sodium Hydroxide (NaOH) | Carl Roth (Karlsruhe, Germany) | 6771.1 | Reagent |
| SymPhotime x64 Software (Data collection and data export software) | Picoquant, Berlin, Germany | 931073 (SPT64-1+2 single user ) | Time-tag time-resolved (tttr) data collection at the self-built FCCS setup, data export |
| Time-Correlated Single Photon Counting (TCSPC) system Hydraharp 400 | Picoquant, Berlin, Germany | 930010 (Hydraharp 400) | Optics |
| Trypsin-EDTA | Sigma-Aldrich (St. Louis, USA) | T4299-100ml | Reagent |
| Unmounted Achromatic Doublets, ARC: 400 - 700 nm, D=12.7 mm, F=-20 mm | Thorlabs, Bergkirchen, Germany | ACN127-020-A | First part of Beam expander |
| Water immersion objective (UPlanSApo 60x/1.20 W) | Olympus, Hamburg, Germany | UPLSAPO60XW | Objective |
Riferimenti
- Hess, S. T., Huang, S. H., Heikal, A. A., Webb, W. W. Biological and chemical applications of fluorescence correlation spectroscopy: A review. Biochemistry. 41 (3), 697-705 (2002).
- Haustein, E., Schwille, P. Ultrasensitive investigations of biological systems by fluorescence correlation spectroscopy. Methods. 29 (2), 153-166 (2003).
- Bacia, K., Kim, S. A., Schwille, P. Fluorescence cross-correlation spectroscopy in living cells. Nature Methods. 3 (2), 83-89 (2006).
- Bacia, K., Schwille, P. Practical guidelines for dual-color fluorescence cross-correlation spectroscopy. Nature Protocols. 2 (11), 2842-2856 (2007).
- Kohl, T., Heinze, K. G., Kuhlemann, R., Koltermann, A., Schwille, P. A protease assay for two-photon crosscorrelation and FRET analysis based solely on fluorescent proteins. Proceedings of the National Academy of Sciences. 99 (19), 12161-12166 (2002).
- Sahoo, H., Schwille, P. FRET and FCS--friends or foes. Chemphyschem. 12 (3), 532-541 (2011).
- Wang, Y., Wang, G., Moitessier, N., Mittermaier, A. K. Enzyme Kinetics by Isothermal Titration Calorimetry: Allostery, Inhibition, and Dynamics. Frontiers in Molecular Bioscience. 7, 583826 (2020).
- Yanase, Y., et al. Surface plasmon resonance for cell-based clinical diagnosis. Sensors (Basel). 14 (3), 4948-4959 (2014).
- Freedberg, D. I., Selenko, P. Live cell NMR. Annual Review of Biophysics. 43, 171-192 (2014).
- Nishida, N., Ito, Y., Shimada, I. In situ structural biology using in-cell NMR. Biochimica et Biophysica Acta General Subjects. 1864 (2), 129364 (2020).
- Schwille, P., Meyer-Almes, F. J., Rigler, R. Dual-color fluorescence cross-correlation spectroscopy for multicomponent diffusional analysis in solution. Biophysical Journal. 72 (4), 1878-1886 (1997).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15 (1), 47-51 (2018).
- Haupts, U., Maiti, S., Schwille, P., Webb, W. W. Dynamics of fluorescence fluctuations in green fluorescent protein observed by fluorescence correlation spectroscopy. Proceedings of the National Academy of Sciences. 95 (23), 13573-13578 (1998).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Widengren, J., Mets, U., Rigler, R. Photodynamic properties of green fluorescent proteins investigated by fluorescence correlation spectroscopy. Chemical Physics. 250 (2), 171-186 (1999).
- Müller, B. K., Zaychikov, E., Bräuchle, C., Lamb, D. C. Pulsed interleaved excitation. Biophysical Journal. 89 (5), 3508-3522 (2005).
- Böhmer, M., Wahl, M., Rahn, H. -. J., Erdmann, R., Enderlein, J. Time-resolved fluorescence correlation spectroscopy. Chemical Physics Letters. 353 (5), 439-445 (2002).
- Felekyan, S., Kalinin, S., Sanabria, H., Valeri, A., Seidel, C. A. M. Filtered FCS: Species Auto- and Cross-Correlation Functions Highlight Binding and Dynamics in Biomolecules. Chemphyschem. 13 (4), 1036-1053 (2012).
- Kapusta, P., Wahl, M., Benda, A., Hof, M., Enderlein, J. Fluorescence lifetime correlation spectroscopy. Journal of Fluorescence. 17 (1), 43-48 (2007).
- Algar, W. R., Hildebrandt, N., Vogel, S. S., Medintz, I. L. FRET as a biomolecular research tool-understanding its potential while avoiding pitfalls. Nature Methods. 16 (9), 815-829 (2019).
- Elson, E. L., Magde, D. Fluorescence Correlation Spectroscopy .1. Conceptual Basis and Theory. Biopolymers. 13 (1), 1-27 (1974).
- Hendrix, J., Lamb, D. C. Pulsed interleaved excitation: principles and applications. Methods Enzymol. 518, 205-243 (2013).
- Magde, D., Elson, E. L., Webb, W. W. Fluorescence correlation spectroscopy. II. An experimental realization. Biopolymers. 13 (1), 29-61 (1974).
- Thompson, N. L., Lakowicz, J. R. . Topics in Fluorescence Spectroscopy. , 337-378 (1991).
- Cole, N. B. Site-specific protein labeling with SNAP-tags. Current protocols in protein science. 73, 1-16 (2013).
- Petrásek, Z., Schwille, P. Precise measurement of diffusion coefficients using scanning fluorescence correlation spectroscopy. Biophysical Journal. 94 (4), 1437-1448 (2008).
- Siegel, A. P., Baird, M. A., Davidson, M. W., Day, R. N. Strengths and Weaknesses of Recently Engineered Red Fluorescent Proteins Evaluated in Live Cells Using Fluorescence Correlation Spectroscopy. International Journal of Molecular Sciences. 14 (10), 20340-20358 (2013).
- Peulen, T. O., Opanasyuk, O., Seidel, C. A. M. Combining Graphical and Analytical Methods with Molecular Simulations To Analyze Time-Resolved FRET Measurements of Labeled Macromolecules Accurately. The Journal of Physical Chemistry B. 121 (35), 8211-8241 (2017).
- Wahl, M., Rahn, H. J., Gregor, I., Erdmann, R., Enderlein, J. Dead-time optimized time-correlated photon counting instrument with synchronized, independent timing channels. Review of Scientific Instruments. 78 (3), 033106 (2007).
- Wahl, M., et al. Scalable time-correlated photon counting system with multiple independent input channels. Review of Scientific Instruments. 79 (12), 123113 (2008).
- Price, E. S., Aleksiejew, M., Johnson, C. K. FRET-FCS Detection of Intralobe Dynamics in Calmodulin. The Journal of Physical Chemistry B. 115 (29), 9320-9326 (2011).
- Price, E. S., DeVore, M. S., Johnson, C. K. Detecting intramolecular dynamics and multiple Forster resonance energy transfer states by fluorescence correlation spectroscopy. The Journal of Physical Chemistry B. 114 (17), 5895-5902 (2010).
- Margittai, M., et al. Single-molecule fluorescence resonance energy transfer reveals a dynamic equilibrium between closed and open conformations of syntaxin 1. Proceedings of the National Academy of Sciences. 100 (26), 15516-15521 (2003).
- Cherezov, V., et al. High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science. 318 (5854), 1258-1265 (2007).
- Manglik, A., et al. Structural Insights into the Dynamic Process of beta2-Adrenergic Receptor Signaling. Cell. 161 (5), 1101-1111 (2015).
- Olofsson, L., et al. Fine tuning of sub-millisecond conformational dynamics controls metabotropic glutamate receptors agonist efficacy. Nature Communications. 5 (1), 5206 (2014).
- Kalinin, S., Valeri, A., Antonik, M., Felekyan, S., Seidel, C. A. Detection of structural dynamics by FRET: a photon distribution and fluorescence lifetime analysis of systems with multiple states. The Journal of Physical Chemistry B. 114 (23), 7983-7995 (2010).
- Hom, E. F. Y., Verkman, A. S. Analysis of coupled bimolecular reaction kinetics and diffusion by two-color fluorescence correlation spectroscopy: Enhanced resolution of kinetics by resonance energy transfer. Biophysical Journal. 83 (1), 533-546 (2002).
- Widengren, J., Schweinberger, E., Berger, S., Seidel, C. A. M. Two new concepts to measure fluorescence resonance energy transfer via fluorescence correlation spectroscopy: Theory and experimental realizations. Journal of Physical Chemistry A. 105 (28), 6851-6866 (2001).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-a multi-laboratory benchmark study. Nature Methods. 15 (9), 669-676 (2018).
- Briddon, S. J., Kilpatrick, L. E., Hill, S. J. Studying GPCR Pharmacology in Membrane Microdomains: Fluorescence Correlation Spectroscopy Comes of Age. Trends in Pharmacological Sciences. 39 (2), 158-174 (2018).
- Barak, L. S., et al. Internal trafficking and surface mobility of a functionally intact beta2-adrenergic receptor-green fluorescent protein conjugate. Molecular Pharmacology. 51 (2), 177-184 (1997).
- Calebiro, D., et al. Single-molecule analysis of fluorescently labeled G-protein-coupled receptors reveals complexes with distinct dynamics and organization. Proceedings of the National Academy of Sciences. 110 (2), 743 (2013).
- Nikić, I., Kang, J. H., Girona, G. E., Aramburu, I. V., Lemke, E. A. Labeling proteins on live mammalian cells using click chemistry. Nature Protocols. 10 (5), 780-791 (2015).
- Robert, T. Y., Haibing, T. Measuring protein dynamics in live cells: protocols and practical considerations for fluorescence fluctuation microscopy. Journal of Biomedical Optics. 19 (9), 1-24 (2014).
- Felekyan, S., et al. Full correlation from picoseconds to seconds by time-resolved and time-correlated single photon detection. Review of Scientific Instruments. 76 (8), 083104 (2005).
- Forster, T. Zwischenmolekulare Energiewanderung Und Fluoreszenz. Annalen Der Physik. 2 (1-2), 55-75 (1948).
- Widengren, J., Mets, U., Rigler, R. Fluorescence Correlation Spectroscopy of Triplet-States in Solution - a Theoretical and Experimental-Study. Journal of Physical Chemistry. 99 (36), 13368-13379 (1995).
- Chen, J., Irudayaraj, J. Fluorescence lifetime cross correlation spectroscopy resolves EGFR and antagonist interaction in live cells. Analytical Chemistry. 82 (15), 6415-6421 (2010).
- Stefl, M., Herbst, K., Rubsam, M., Benda, A., Knop, M. Single-Color Fluorescence Lifetime Cross-Correlation Spectroscopy In Vivo. Biophysical Journal. 119 (7), 1359-1370 (2020).
- Maeder, C. I., et al. Spatial regulation of Fus3 MAP kinase activity through a reaction-diffusion mechanism in yeast pheromone signalling. Nature Cell Biololy. 9 (11), 1319-1326 (2007).
- Christie, S., Shi, X., Smith, A. W. Resolving Membrane Protein-Protein Interactions in Live Cells with Pulsed Interleaved Excitation Fluorescence Cross-Correlation Spectroscopy. Accounts of Chemical Research. 53 (4), 792-799 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon