Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Прямое сравнение гиперспектрального стимулированного рамановского рассеяния и когерентной рамановской микроскопии против Стокса для химической визуализации
В этой статье
Резюме
В этой статье непосредственно сравниваются разрешение, чувствительность и контрасты визуализации стимулированного комбинационного рассеяния (SRS) и когерентного анти-Стоксовского рамановского рассеяния (CARS), интегрированные в одну и ту же платформу микроскопа. Результаты показывают, что CARS имеет лучшее пространственное разрешение, SRS дает лучшие контрасты и спектральное разрешение, и оба метода имеют одинаковую чувствительность.
Аннотация
Стимулированное рамановское рассеяние (SRS) и когерентная микроскопия против стоксовского рамановского рассеяния (CARS) являются наиболее широко используемыми технологиями когерентного рамановского рассеяния. Гиперспектральная визуализация SRS и CARS предлагает рамановскую спектральную информацию на каждом пикселе, что позволяет лучше разделять различные химические составы. Хотя оба метода требуют двух лазеров возбуждения, их схемы обнаружения сигналов и спектральные свойства совершенно различны. Целью этого протокола является выполнение гиперспектральной визуализации SRS и CARS на одной платформе и сравнение двух методов микроскопии для визуализации различных биологических образцов. Метод спектральной фокусировки используется для получения спектральной информации с помощью фемтосекундных лазеров. При использовании стандартных химических образцов сравниваются чувствительность, пространственное разрешение и спектральное разрешение SRS и CARS в одинаковых условиях возбуждения (т.е. мощность на образце, время выдержки пикселя, объективная линза, энергия импульса). Контрасты изображений CARS и SRS для биологических образцов сопоставляются и сравниваются. Прямое сравнение характеристик CARS и SRS позволит оптимально выбрать модальность для химической визуализации.
Введение
Явление комбинационного рассеяния впервые наблюдалось в 1928 году К. В.Раманом 1. Когда падающий фотон взаимодействует с образцом, может спонтанно произойти событие неупругого рассеяния, при котором изменение энергии фотона соответствует вибрационному переходу анализируемых химических веществ. Этот процесс не требует использования химической метки, что делает его универсальным инструментом для химического анализа без этикеток, сводя к минимуму возмущение образца. Несмотря на свои преимущества, спонтанное комбинационное рассеяние страдает от низкого поперечного сечения рассеяния (обычно 1011 ниже, чем инфракрасное [ИК] поперечное сечение поглощения), что требует длительного времени получения для анализа2. Таким образом, стремление повысить чувствительность процесса рамановского рассеяния имеет важное значение для продвижения рамановских технологий для визуализации в режиме реального времени.
Одним из эффективных способов значительного повышения чувствительности комбинационного рассеяния являются когерентные процессы комбинационного рассеяния (CRS), для которых обычно используются два лазерных импульса для возбуждения молекулярных колебательных переходов 3,4. Когда разность энергии фотонов между двумя лазерами соответствует колебательным модам молекул образцов, будут генерироваться сильные рамановские сигналы. Двумя наиболее часто используемыми процессами CRS для визуализации являются когерентное анти-Стоксовское рамановское рассеяние (CARS) и стимулированное рамановское рассеяние (SRS)5. За последние два десятилетия технологические разработки продвинули методы микроскопии CARS и SRS, чтобы стать мощными инструментами для количественной оценки без маркировки и выяснения химических изменений в биологических образцах.
Химическая визуализация с помощью микроскопии CARS может быть датирована 1982 годом, когда лазерное сканирование было впервые применено для получения изображений CARS, продемонстрированных Duncan et al6. Модернизация микроскопии CARS была значительно ускорена после широкого применения лазерной сканирующей многофотонной флуоресцентной микроскопии7. Ранняя работа группы Xie с использованием лазеров с высокой частотой повторения превратила CARS в высокоскоростную, без маркировки, химическую платформу визуализации для характеристики молекул в биологических образцах 8,9,10. Одной из основных проблем для визуализации CARS является наличие нерезонансного фона, который снижает контрастность изображения и искажает рамановский спектр. Было предпринято много усилий, чтобы либо уменьшить нерезонансный фон 11,12,13,14,15, либо извлечь резонансные рамановские сигналы из спектров CARS 16,17. Еще одним достижением, которое значительно продвинуло эту область, является гиперспектральная визуализация CARS, которая позволяет осуществлять спектральное отображение на каждом пикселе изображения с улучшенной химической селективностью 18,19,20,21.
Стимулированное рамановское рассеяние (SRS) является более молодой технологией визуализации, чем CARS, хотя она была обнаружена ранее22 года. В 2007 году сообщалось о микроскопии SRS с использованием лазерного источника23 с низкой частотой повторения. Вскоре несколько групп продемонстрировали высокоскоростную визуализацию SRS с использованием лазеров с высокой частотой повторения 24,25,26. Одним из основных преимуществ микроскопии SRS перед CARS является отсутствие нерезонансного фона27, хотя другие фоны, такие как кросс-фазовая модуляция (XPM), переходное поглощение (TA), поглощение двух фотонов (TPA) и фототермический (PT) эффект, могут возникать с SRS28. Кроме того, сигнал SRS и концентрация образца имеют линейные отношения, в отличие от CARS, который имеет квадратичную зависимость сигнал-концентрация29. Это упрощает химическую количественную оценку и спектральное размешивание. Многоцветная и гиперспектральная SRS развивалась в различных формах 30,31,32,33,34,35,36, причем спектральная фокусировка является одним из самых популярных подходов для химической визуализации 37,38.
Как CARS, так и SRS требуют фокусировки накачки и лазерных лучей Стокса на образец, чтобы соответствовать вибрационному переходу молекул для возбуждения сигнала. Микроскопы CARS и SRS также имеют много общего. Однако физика, лежащая в основе этих двух процессов, и обнаружение сигналов, участвующих в этих технологиях микроскопии, имеют различия 3,39. CARS представляет собой параметрический процесс, который не имеет чистой энергетической связи фотон-молекула3. SRS, однако, является непараметрическим процессом и способствует передаче энергии между фотонами и молекулярными системами27. В CARS генерируется новый сигнал на анти-Стоксовой частоте, в то время как SRS проявляется как передача энергии между накачкой и лазерными лучами Стокса.
Сигнал CARS удовлетворяет Eq (1)28.
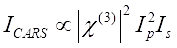 (1)
(1)
Между тем, сигнал SRS может быть записан как Eq (2)28.
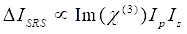 (2)
(2)
Здесь Ip, I s, ICARS и ΔISRS — это интенсивности пучка насоса, луча Стокса, сигнала CARS и сигналов SRS соответственно. χ(3) — нелинейная оптическая восприимчивость образца третьего порядка, представляющая собой комплексное значение, состоящее из реальной и воображаемой частей.
Эти уравнения выражают спектральные профили и зависимость концентрации сигнала CARS и SRS. Различия в физике приводят к разрозненным схемам обнаружения для этих двух технологий микроскопии. Обнаружение сигнала в CARS обычно включает спектральное разделение вновь генерируемых фотонов и обнаружение с помощью фотоумножителя (PMT) или устройства с зарядовой связью (CCD); для SRS обмен энергией между насосом и пучками Стокса обычно измеряется высокоскоростной модуляцией интенсивности с использованием оптического модулятора и демодуляцией с использованием фотодиода (PD) в паре с блокирующим усилителем.
Хотя в последние годы было опубликовано много технологических разработок и приложений как в областях CARS, так и SRS, на одной и той же платформе не проводилось систематического сравнения двух методов CRS, особенно для гиперспектральной МИКРОСКОПИИ CARS и SRS. Прямые сравнения чувствительности, пространственного разрешения, спектрального разрешения и возможностей химического разделения позволят биологам выбрать наилучшую модальность для количественной оценки химических веществ. В этом протоколе приведены подробные шаги по созданию мультимодальной платформы визуализации с гиперспектральными модальностями CARS и SRS на основе фемтосекундной лазерной системы и спектральной фокусировки. Эти два метода были сопоставлены в прямом направлении для спектрального разрешения, чувствительности обнаружения, пространственного разрешения и контрастов изображений клеток.
протокол
1. Инструментальная настройка для гиперспектральной визуализации CRS
ПРИМЕЧАНИЕ: Генерация сигнала CRS требует использования мощных (т.е. класса 3B или класса 4) лазеров. Протоколы безопасности должны быть соблюдены, и надлежащие средства индивидуальной защиты (СИЗ) должны носиться в любое время при работе на таких высоких пиковых мощностях. Перед экспериментированием ознакомьтесь с надлежащей документацией. Этот протокол фокусируется на проектировании траектории луча, щебетании фемтосекундных импульсов и оптимизации условий визуализации. Общая оптическая компоновка этого гиперспектрального микроскопа CRS показана на рисунке 1. Конфигурация, показанная здесь, является одной из многих существующих конфигураций для микроскопии CRS. Система микроскопии CRS, используемая в этом протоколе, построена на фемтосекундном лазерном источнике с двойным выходом и лазерном сканирующем микроскопе.
- Убедитесь, что лазерный источник обеспечивает две фемтосекундные импульсные цепи (ширина 120 fs) с частотой повторения 80 МГц, включая фиксированную длину волны на 1045 нм, используемую в качестве пучка Стокса, и перестраиваемую длину волны от 680 до 1 300 нм, используемую в качестве пучка накачки. Синхронизируйте выходные импульсы с оптической разностью задержки. Используйте рамку микроскопа для создания платформы визуализации.
- Проектирование траектории луча
- Чтобы контролировать мощность лазера на образце, используйте комбинацию полуволновой пластины и поляризационного луча (PBS) для каждого лазерного луча.
- Установите акустооптический модулятор (AOM) на траектории лазерного луча Стокса. Сфокусируйте луч с помощью объектива с фокусным расстоянием 150 мм на AOM и вспомните выход0-го порядка с объективом с фокусным расстоянием 400 мм.
- Используйте ту же пару объективов (фокусные расстояния 150 мм и 400 мм), чтобы расширить луч накачки в соответствии с размером лазерного луча с Stokes.
- Поместите объективы с фокусным расстоянием 400 мм в траектории насоса и луча Стокса на отдельные одномерные ступени трансляции для точной настройки расхождения луча и оптимизации размера луча перед входом в микроскоп.
- Направляйте пучок насоса с помощью прямоугольного отражающего зеркала, установленного на моторизованной ступени трансляции для настройки оптической задержки. Если луч Стокса нуждается в оптической задержке, поместите эти компоненты в его траекторию луча.
- Позвольте объединить оба луча в дихроичном зеркале с длиной волны отсечки ~ 1000 нм (между длинами волн насоса и Стокса), так что луч Стокса будет проходить через дихроичное зеркало, в то время как луч насоса отражается дихроичным зеркалом. Отправьте коллинеарно комбинированные лазерные лучи в микроскоп.
- Чтобы чирикать насос и балки Стокса, разместите стеклянные стержни на их лучевых дорожках. Подробности см. в шаге 1.5.
- Чтобы подтвердить правильное выравнивание и размер луча, используйте диафрагмы радужной оболочки после дихроичного зеркала и перед микроскопом. В частности, установите один в положении, близком к, а другой на расстоянии от дихроичного зеркала, чтобы подтвердить хорошее выравнивание и перекрытие луча. Используйте карту ИК-просмотра или ИК-просмотрщик для визуализации луча во время выравнивания.
- Используйте быстрый PD и осциллограф, чтобы приблизительно измерить оптическую задержку между импульсами насоса и Стокса. Запустите осциллограф, взяв пробу лазерного импульса.
- Заблокируйте пучку насоса и возьмите образец балки Стокса. Увеличьте масштаб одного из импульсов и наведите на него вертикальный курсор, чтобы отметить его временное положение на осциллографе.
- Разблокируйте балку насоса и заблокируйте балку Стокса. Переведите стадию задержки до тех пор, пока импульсы насоса образца не выровняются во времени с отмеченным положением.
- Лазерный сканирующий микроскоп
- Для вертикальной конфигурации микроскопа отправьте комбинированные лазерные лучи через перископ, чтобы подняться на соответствующий уровень, прежде чем достичь 2D-зеркал сканирования гальво.
- Измерьте размер лазерного луча перед микроскопом и установите правильную пару линз после зеркал гальво, чтобы расширить лазерный луч, чтобы наилучшим образом соответствовать размеру входного зрачка объектива.
- Постройте систему 4-f, используя две линзы, с задней диафрагмой объектива и центром двух зеркал гальво, являющихся сопряженными плоскостями. В качестве альтернативы можно использовать два отдельных зеркала 1D galvo с двумя системами объективов 4-f для лазерного сканирования.
- После конденсатора спроектируйте 2-дюймовое откидное зеркало для отражения лазерных лучей для сбора сигнала. Расположите линзу диаметром 2 в пути передаваемого луча, чтобы полностью собирать и фокусировать сигналы передачи на детекторы.
- Направляйте сигналы CARS на PMT с дихроичным зеркалом, имеющим отсечку на 776 нм, и позволяйте передаваемым сигналам SRS обнаруживаться PD. Используйте полосовой фильтр (655/30 нм) перед PMT для отклонения остаточных лазерных импульсов возбуждения. Используйте фильтр коротких частот (980 нм короткого прохода) перед PD, чтобы заблокировать попадание луча Стокса в детектор.
- Для обнаружения сигнала CARS подключите предусилитель и преобразователь тока-напряжения после PMT и перед отправкой сигнала в систему сбора данных. Отрегулируйте напряжение PMT для оптимизации контрастности сигнала и изображения.
- Используйте генератор функций для модуляции AOM на частоте 1-10 МГц и используйте ту же частоту, что и эталон для демодуляции блокировки. Используйте блокирующий усилитель для извлечения сигналов SRS перед сбором данных.
- Сбор и отображение данных
- Выполняйте сбор данных с помощью карты цифрового сбора данных (DAQ) в сочетании с клеммным блоком.
- Используйте аналоговые выходы DAQ для управления зеркалами galvo и аналоговыми входами для получения сигнала.
- Используйте программное обеспечение, написанное Lab, на основе LabVIEW с одновременным многоканальным дисплеем для просмотра и сохранения изображений в режиме реального времени (см. Дополнительный файл).
- Чирикание фемтосекундного источника и измерение спектрального разрешения
ПРИМЕЧАНИЕ: Для достижения хорошего спектрального разрешения с использованием спектральной фокусировки стеклянные стержни используются для введения дисперсий и щебетания лазерных импульсов от фемтосекунды до пикосекунды. Для достижения наилучшего спектрального разрешения скорость чирпирования пучка насоса должна быть равна скорости луча Стокса. Для этой лазерной системы наилучшее спектральное разрешение может быть достигнуто путем щебетания выходных лазерных импульсов ~ 120 fs до 3,4 л.с. для накачки и 1,8 л.с. для Stokes. Это чиркание достигается с помощью комбинации 4 + 1 (четыре в комбинированном луче, один только в луче Стокса) комбинации стеклянных стержней 150 мм (SF-57), как описано ниже, и должно достигать спектрального разрешения 15 см-1 . Длительность импульса может быть измерена с помощью автокоррелятора.- Вставьте один стеклянный стержень толщиной 150 мм только в траекторию луча Стокса.
- Вставьте два стеклянных стержня диаметром 150 мм в комбинированный тракт насоса/балки Стокса после дихроичного делителя балок. Чтобы увеличить щебетание, позвольте комбинированным лазерным лучам дважды пройти два стеклянных стержня, поместив диэлектрическое зеркало на один конец стержней.
- Для измерения спектрального разрешения подготовьте стандартный химический (например, диметилсульфоксид [DMSO]) образец, зажатый между двумя стеклянными крышками, и отсканируйте стадию задержки до тех пор, пока не будет достигнут максимальный сигнал.
- Переместите оптическую задержку на 1000 мкм в направлении красного смещения. Затем выполните 200 кадров со скоростью 10 мкм/шаг в направлении синего смещения, чтобы собрать стек гиперспектральных изображений.
- Чтобы преобразовать номера кадров в волновые числа, выполните линейную регрессию с использованием симметричного (2 913 см-1) и асимметричного (2 994 см-1) C-H, простирающегося от DMSO и соответствующих им номеров кадров40.
- Используйте сигнал XPM для измерения профиля интенсивности спектральной фокусировки. Наполовину закройте диафрагму на конденсаторе и переместите фокус на пустую крышку. Соберите такое же количество шагов, как и для гиперспектральных SRS. Чтобы измерить нерезонансный фон CARS, сосредоточьтесь на стеклянной крышке и соберите такое же количество шагов для гиперспектральных измерений CARS.
- Оптимизация отношения сигнал/шум (SNR) изображений
- Подготовьте химический образец для выравнивания системы. Выполните процедуру, описанную в шаге 3.1 для подготовки образца.
ПРИМЕЧАНИЕ: DMSO является хорошим выбором, потому что это обычное лабораторное химическое вещество с сильными рамановскими сигналами и хорошо разделенными симметричными и асимметричными пиками C-H. - Поместите образец на ступень микроскопа и добавьте воду или иммерсионное масло, если это необходимо для объектива или конденсатора. Правильно переместите край капли DMSO в поле зрения и отрегулируйте объектив для лучшей фокусировки. Центрируйте конденсатор с помощью метода41 подсветки Кёлера. Полностью откройте диафрагму на конденсаторе.
- Настройте длину волны пучка насоса до 800 нм (1 045 нм Стокса), чтобы нацелиться на пик 2,913 см-1 CH3 . Установите мощность насоса и пучка Стокса на ~30 мВт перед микроскопом, отрегулировав полуволновую пластину (~ 10 мВт мощности в плоскости образца).
- Для SRS установите коэффициент усиления блокирующего усилителя равным ~10 с константой времени 7 мкс (при использовании времени выдержки пикселя 10 мкс). Убедитесь, что константа времени меньше, чем время ожидания пикселя. Используйте Demod R для выхода AUX для сигналов SRS.
- Для АВТОМОБИЛЕЙ отправьте выход PMT на предусилитель и преобразователь тока-напряжения. Используйте DAQ для получения выходных данных из конвертера.
- Задайте параметры получения изображений в программном обеспечении для сбора. Используйте число пикселей 200 x 200 с размером сканирования ~100 x 100 мкм2. Убедитесь, что изображение содержит как каплю DMSO, так и пустую область.
- Отсканируйте образец и проверьте изображение на экране компьютера. Сканируйте моторизованную стадию задержки в пучке Стокса/насоса, отслеживая изображения в режиме реального времени. Сканируйте задержку до тех пор, пока сигнал не станет максимальным.
- Переместите каплю DMSO, чтобы охватить все поле зрения, и проверьте, центрирован ли максимум сигнала постоянного тока на изображении (сигнал зависит от пучка насоса). Отрегулируйте положение пучка насоса через зеркало или смещение напряжения в программном обеспечении для визуализации.
- После оптимизации постоянного тока отрегулируйте зеркала луча Стокса до тех пор, пока сигнал переменного тока не будет максимизирован, отрегулировав пороговое значение для отображения насыщенности ~ 50%. Проверьте, центрирована ли насыщенность изображения. Если нет, тонкая настройка зеркал только в луче Стокса. Отслеживайте сигнал во время выравнивания в виде обратной связи в режиме реального времени о качестве выравнивания.
- Чтобы определить SNR, выберите небольшую область изображения DMSO и измерьте среднее значение. Для шума выберите небольшую область в пустой области изображения и определите как среднее среднее значение, так и стандартное отклонение. Вычтите среднее значение шума из среднего значения сигнала и разделите результаты на стандартное отклонение пустой области.
- Если расчетный SNR недостаточно высок (обычно 800-1000 для SRS и >10 000 для CARS при напряжении PMT 0,4 В с этой комбинацией мощности), проверьте и повторно оптимизируйте перекрытие луча, размеры пучка и положение ступени задержки, тонкую настройку AOM и изменение частоты модуляции генератора функций до получения ожидаемого SNR.
- Подготовьте химический образец для выравнивания системы. Выполните процедуру, описанную в шаге 3.1 для подготовки образца.
2. Анализ изображений и обработка данных
- Анализ SNR
- Откройте программное обеспечение ImageJ. Чтобы импортировать сохраненный образец .txt файла DMSO, щелкните Файл | Импорт | текстовое изображение | Открыто.
- После импорта изображения нажмите клавиши CTRL+SHIFT+C , чтобы открыть функцию яркости и контрастности (B&C). Чтобы найти максимальный сигнал образца, нажимайте кнопку auto в B &C , пока область образца DMSO не станет насыщенной.
- Щелкните инструмент выделения овала на интерфейсе ImageJ и выделите небольшую область насыщенной области DMSO. После выделения нажмите клавишу M , чтобы измерить среднее и стандартное отклонение выбранной области.
- Для измерения фона отрегулируйте бары в функции B &C до тех пор, пока не будет наблюдаться сигнал пустой области. Щелкните овальную область и выделите область фона того же размера, что и на шаге 2.1.3. Убедитесь, что выбранный регион не содержит DMSO. Нажмите M , чтобы измерить статистику выбранной области.
- Рассчитайте SNR в соответствии с шагом 1.6.10.
- Обработка гиперспектральных изображений CRS
- Импортируйте файл .txt в соответствии с шагом 2.1.1. После импорта нажмите на image | Стеки | Инструменты | Монтаж в стек... , чтобы преобразовать файл в стек изображений.
- Прокрутите монтаж до тех пор, пока не будет виден первый пик DMSO. Выберите регион в DMSO и нажмите на Image | Стек | Построение профиля оси Z для отображения интенсивности и спектра чисел кадров. Чтобы извлечь необработанные спектральные данные, нажмите на список и скопируйте данные профиля.
- Чтобы преобразовать восстановленный спектр в волновые числовые единицы, выполните линейную регрессию, как описано в шаге 1.5.5.
- Фитинг для измерения спектрального разрешения
ПРИМЕЧАНИЕ: Функции Лоренца используются для соответствия спектрам SRS и CARS28.- Откройте программное обеспечение для подгонки, затем скопируйте и вставьте данные линейной регрессии в программу. Чтобы подогнать данные SRS, выделите данные, а затем постройте их в виде точечной диаграммы.
- Подтяните вверх точечный график. Нажмите на | анализа Пики и базовые | Несколько пиковых | Откройте диалоговое окно , чтобы вызвать анализатор пиков. При подтягивании проверьте, что входом является текущий график и измените пиковую функцию на Лоренциан (Lorentz).
- Дважды щелкните каждый из двух пиков DMSO на графике, чтобы выделить области, которые должны быть установлены. Затем нажмите « Открыть NLfit», чтобы открыть окно установки . Нажмите кнопку «Подогнать до схода», а затем OK, чтобы увидеть сводку коэффициентов подгонки в табличной таблице (см. Eq (3)).
ПРИМЕЧАНИЕ: Приведенное ниже уравнение показывает формат функции Лоренца в программном обеспечении. A 1/2 - амплитуды фитинговых пиков,w 1/2 - ширина установленных пиков, а значения x01/02 - центры установленных пиков. Независимая переменная равна x, а зависимая переменная — y.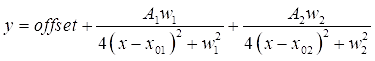 (3)
(3) - Для спектральной установки CARS нажмите на Анализ | Монтажные | Нелинейная кривая подгонки | Откройте диалоговое окно. Выберите категорию: новая , чтобы определить новую функцию для CARS. Используйте двухпиковую функцию подгонки CARS, определенную ниже (см. Eq (4)) для спектральной установки CARS.
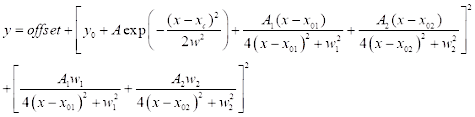 (4)
(4)
- Определение пространственного разрешения
ПРИМЕЧАНИЕ: Перед этим шагом важно знать преобразование между размером пикселя при определенном увеличении, числом пикселя и размером шага в мкм. Это может быть выполнено путем использования образца известного диаметра, который больше ожидаемого разрешения изображения, измерения его линейного профиля и установки функции Гаусса для определения полной ширины при половинном максимальном значении (FWHM). Могут использоваться мишени разрешения или однородные образцы, такие как полимерные шарики.- Получите изображение клеток или частиц полимера диаметром менее 200 нм.
- Используйте ImageJ, чтобы провести линию по самой маленькой частице на изображении.
- Нажмите клавишу K , чтобы построить профиль интенсивности.
- Щелкните список во всплывающем окне и скопируйте информацию в соответствующее программное обеспечение.
- Составьте профиль в программном обеспечении для подгонки и используйте гауссовскую подгонку (нажмите на Анализ | Монтажные | Нелинейная кривая подгонки | Открыть диалоговое | Категория: Основные функции; Функция: Гаусс).
- Считывание ширины пика после подгонки. Используйте преобразование пикселя в размер для получения фактического разрешения микроскопа.
3. Подготовка образцов для гиперспектральной визуализации CRS
- Подготовка слайдов изображений и химических образцов
- Поместите кусок двусторонней ленты на крышку и вырежьте небольшую прямоугольную форму ленты из середины помещенной ленты, чтобы создать открытую область для размещения образца.
- Пипетку 1-2 мкл чистого ДМСО и дозируют капельку в центре вакансии.
- Осторожно поместите верхнюю крышку и осторожно прижмите края обшивки, чтобы герметизировать камеру, убедившись, что образец DMSO не соприкасается с краями ленты.
- Для экспериментов по чувствительности готовят серийные разведения ДМСО в оксиде дейтерия (D2O) с получением диапазона концентраций 50%-0%. Возьмите 1-2 мкл каждого раствора и подготовьте прессованные образцы, как описано выше.
- Клеточная подготовка
- Посейте клетки в 35-миллиметровую посуду со стеклянным дном (или больше) в модифицированной орлиной среде Dulbecco (DMEM) с 10% фетальной бычьей сывороткой (FBS) и 1% пенициллином / стрептомицином.
- Инкубируют клетки в инкубационной камере при 37 °C с 5% атмосферой CO2 в течение ночи или дольше до тех пор, пока не будет достигнута ~50%-80% слияние.
- Визуализируйте живые клетки непосредственно или зафиксируйте клетки 10% раствором формалина для визуализации.
Результаты
Сравнение спектрального разрешения
На рисунке 2 сравнивается спектральное разрешение гиперспектральной микроскопии SRS (рисунок 2A) и CARS (рисунок 2B) с использованием образца DMSO. Для спектра SRS были применены две функции Лоренца (?...
Обсуждение
Протокол, представленный здесь, описывает конструкцию мультимодального микроскопа CRS и прямое сравнение между визуализацией CARS и SRS. Для конструкции микроскопа критическими шагами являются пространственное и временное перекрытие пучка и оптимизация размера пучка. Рекомендуется испо...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было поддержано стартап-фондом факультета химии Университета Пердью.
Материалы
| Name | Company | Catalog Number | Comments |
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25x36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
Ссылки
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены