Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre İçi Vezikül Rüptürünün İşlevini İncelemek İçin Fotodinamik Bir Yaklaşım
Bu Makalede
Özet
AlPcS2a aracılı kromofor yardımlı lazer inaktivasyonu (CALI), canlı hücrelerde hücre içi veziküllerin (IV'ler) uzaysal zamansal hasarını incelemek için güçlü bir araçtır.
Özet
Hücre içi veziküller (IV'ler), veziküllerin sitoplazmaya endositozu ile oluşur. IV oluşumu, IV membranlarının geçirgenliği ve endozom ve lizozomların oluşumu yoluyla çeşitli sinyal yolaklarının aktive edilmesinde rol oynar. IV'lerin oluşumunu ve IV regülasyonunu kontrol etmedeki materyalleri incelemek için kromofor yardımlı lazer inaktivasyonu (CALI) adı verilen bir yöntem uygulanır. CALI, membran geçirgenliği tarafından indüklenen sinyal yolunu incelemek için görüntüleme tabanlı bir fotodinamik metodolojidir. Yöntem, seçilen organelin mekansal zamansal manipülasyonunun bir hücrede geçirgenleştirilmesine izin verir. CALI yöntemi, endozomların ve lizozomların geçirgenliği yoluyla spesifik molekülleri gözlemlemek ve izlemek için uygulanmıştır. IV'lerin membran rüptürünün, galektin-3 gibi glikan bağlayıcı proteinleri seçici olarak işe aldığı bilinmektedir. Burada, protokol, IV rüptürünün AlPcS2a tarafından indüklenmesini ve bozulmuş lizozomları etiketlemek için bir belirteç olarak galektin-3'ün kullanılmasını açıklar; bu, IV membran rüptürünün aşağı akış etkilerini ve çeşitli durumlar altında aşağı akış etkilerini incelemede yararlıdır.
Giriş
Bir tür hücre içi vezikül (IV) olan endozomlar, endositoz tarafından oluşturulur ve daha sonra lizozomlara olgunlaşır. IV'lerin oluşumunda çeşitli hücre içi sinyal yolları rol oynar; Ek olarak, farklı içsel ve dışsal uyaranlar IV'lere zarar verebilir (örneğin, patojenler enfeksiyon sırasında sınırlı zardan kaçabilir ve sitoplazma1'e girebilir). Buna genellikle endositotik veziküllerinrüptürü eşlik eder 2. Bu nedenle, IV'leri hedefleme ve zarar verme teknikleri ilgili çalışmalarda kullanılabilir3.
Fotodinamik terapi (PDT), tümörleri veya patojenleri öldürerek hastalıklarla mücadele etmek için ışığa bağımlı bir terapidir4. PDT'de, hedeflenen hücreler, ışık aydınlatmasıile lokal olarak aktive edilebilen fotosensitizörler adı verilen toksik olmayan kromoforlarla etiketlenir 5,6. Fotosensitizörler ışıktan enerjiyi emer ve uyarılmış bir singlet durumuna dönüşür ve uzun ömürlü uyarılmış üçlü duruma yol açar. Üçlü durumun fotosensitizörleri elektron veya enerji transferine uğrayabilir ve oksijen varlığında reaktif oksijen türleri (ROS) oluşturabilir ve aydınlatma bölgesi7 içindeki etiketli hücreleri mekansal olarak yok edebilir. Sonuç, ışığın gücüne bağlı olarak değişir8. Fotosensitizörlerin konsantrasyonunu ve ışık aydınlatmasının yoğunluğunu kontrol ederek, hedeflenen biyomoleküller, kromofor yardımlı ışık inaktivasyonu (CALI)9 olarak adlandırılan hücre lizisi olmadan seçici olarak inaktive edilebilir. Çeşitli hücre altı hedefleri seçici olarak etiketleyebilen fotosensitizörlerin önemli ölçüde gelişmesiyle CALI, nükleotidler ve proteinler gibi küçük biyomoleküllerin yanı sıra mitokondri ve endo-lizozomlar 3,10,11,12,13 gibi organeller için biyomoleküllerin ışık aracılı inaktivasyonunu kontrol etmek için değerli bir araç haline gelmiştir.
CALI ile karşılaştırıldığında, lizozomal hasar için bakteriyel toksin 14,15 ve Leu-Leu-OMe16 tedavisi gibi membranları bozmak için kimyasal veya fiziksel yöntemler de kullanılır. Bununla birlikte, bu yöntemler hücreler içindeki IV'lerin toplu bozulmasını gösterir. CALI'de sağlam fotosensitizörler (yani, Al(III) ftalosiyanin klorür disülfonik asit (AlPcS2a)) kullanılır; Endositoz yoluyla lizozomları hedef alan AlPcS2a, kontrollü bir bölgede endozomları veya lizozomları parçalamak için kullanılır17. AlPcS2a, plazma zarındaki lipitlere bağlanan ve endositoz yoluyla içselleştirilen ve sonunda endositik yol18 aracılığıyla lizozom içinde biriken hücre zarı geçirimsiz ftalosiyanin bazlı bir kromofordur. Yakın kızılötesi spektral bir bölgedeki ışığı emer ve uyarılmış AlPcS2a 18 tarafından üretilen büyük bir ROS olan singlet oksijen üretir. Singlet oksijeninin hızla bozunması, hücrelerdeki küçük bir bölgede (yaklaşık 10-20 nm) difüzyon ve reaksiyon mesafesini sınırlar19. AlPcS2a inkübasyon ve ışık aydınlatmasının süresini ayarlayarak, IV'lerin hücre altı bir alandaki hasarının mekansal zamansal kontrolüne izin verilir. Bu nedenle CALI, IV hasarının sonuçlarını ve IV'lerin oluşumunu ve düzenlenmesini incelemek için güçlü bir araç haline gelir.
Bu çalışmada, AlPcS2a'yı fotosensitizör olarak kullanan spesifik bir CALI protokolü ele alınmıştır. Bu protokol, endozomlar ve lizozomlar da dahil olmak üzere çeşitli IV tiplerine uygulanabilir ve membran rüptürü sonrası takip yanıtlarını incelemek için kullanılabilir. Lizozom rüptüründen sonra ortaya çıkan florofor konjuge galektin-316,20 eksprese eden HeLa hücreleri bu protokolü göstermek için kullanılır.
Protokol
1. AlPcS2a stok hazırlama
- 10 mg AlPcS2a'yı 400 μL 0.1 M NaOH içinde çözün. Çözünürlüğü artırmak için, çözeltiyi 50 ° C'de ve vortekste ısıtın.
- Çözeltiyi 4 mL fosfat tamponlu salin (PBS) ile karıştırın. Ardından, çözünmeyen çökeltileri gidermek için çözeltiyi 0,22 μm'lik bir filtre ile filtreleyin.
- Çözeltinin konsantrasyonunu bir UV-Vis spektrofotometresi ile ölçün. AlPcS2a'nın 672 nm'deki yok olma katsayısı 4 x 104 cm-1 M-1'dir. 1 mM çözeltisi oluşturmak için AlPcS2a çözümünü PBS ile seyreltin. 1 mL aliquots yapın ve -20 ° C'de saklayın.
2. Transfeksiyon
NOT: Gal3-GFP, lizozomal rüptürün canlı hücre görüntülemesi için bir gösterge olarak uygulanır.
- DMEM'de HeLa hücre kültürünü% 10 Fetal Sığır Serumu (FBS) ile destekleyin. Hücreleri PBS ile yıkadıktan sonra, hücreleri deneyin, daha sonra% 10 FBS ile desteklenmiş DMEM'deki hücreleri yeniden askıya alın.
NOT: Yöntem, HeLa ve A549 hücre satırları da dahil olmak üzere ekli hücre satırlarının çoğu için geçerlidir. Prensip olarak, süspansiyon hücrelerini test etmemesine rağmen, CALI testleri onlarla yapılabilir. - 300 ng Gal3-GFP plazmidini 25 μL indirgenmiş serum ortamında seyreltin ve ardından 0.6 μL P3000 reaktifi ekleyin. Yavaşça karıştırın. 0.45 μL Lipofectamine 3000 reaktifini 25 μL indirgenmiş serum ortamında seyreltin. Yavaşça karıştırın.
- Oda sıcaklığında 5 dakika inkübe edin. Seyreltilmiş DNA ve seyreltilmiş Lipofectamine 3000'i karıştırın ve ardından oda sıcaklığında 10 dakika inkübe edin.
- DNA-Lipofectamine karışımını, 3 x 105 askıya alınmış HeLa hücrelerini ve 200 μL DMEM +% 10 FBS'yi karıştırın ve ardından hücreleri 35 mm'lik bir cam düğme kabının merkezi cam bölgesine tohumlayın.
3. AlPcS2a boyama
- Hücre bağlanmasına izin vermek için, hücreleri en az 4 saat boyunca% 5 CO2 ile birlikte verilen inkübatörde 37 ° C'de inkübe edin.
- 1 μM AlPcS2a çözeltisi oluşturmak için DMEM'deki AlPcS 2a'yı %10 FBS ile birlikte seyreltin. AlPcS2a içeren ortamı 37 °C su banyosunda önceden ısıtın. Kültür ortamını AlPcS2a içeren ortamla değiştirin.
- Hücreleri 37 ° C'de inkübe edin, gece boyunca% 5 CO2 ile birlikte verilen inkübatörde (16-18 saat).
- Ertesi gün, hücre dışı AlPcS2a'yı çıkarmak için hücreleri PBS ile iki kez yıkayın. Ortamı taze ortamla değiştirin ve daha sonra endositik yol boyunca kalan boyanın lizozomlara birikmesine izin vermek için 4 saat boyunca 37 ° C'de inkübe edin.
NOT: Endozomları boyamak için, DMEM'de 1 μM AlPcS2a'daki hücreleri 37 ° C'de 15 dakika boyunca% 10 FBS içeren inkübe edin. Daha sonra, hücreleri PBS ile iki kez yıkayın ve görüntülemeden önce önceden ısıtılmış ortamda inkübe edin.
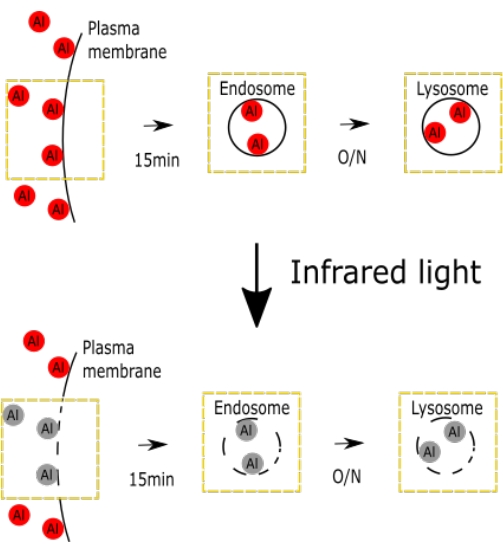
Şekil 1. AlPcS2a ile seçici IV hasarını temsil eden şematik bir figür. Şekil, seçici IV hasarının şematiklerini göstermektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
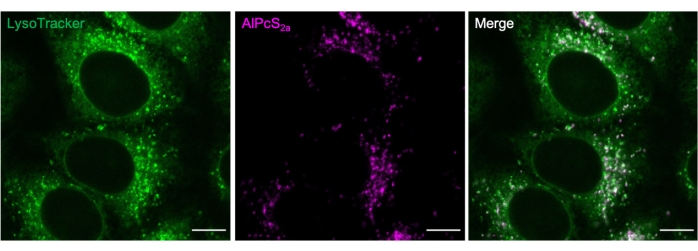
Şekil 2. AlPcS2a ile lizozomal boyama. HeLa hücrelerinde 1 μM AlPcS2a ile gece boyunca etiketlenen lizozomlar, 50 nM yeşil floresan boya ile pozitif boyanır. Ölçek çubuğu: 10 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
4. Örnek görüntüleme ve ışık aydınlatması
NOT: Tek bir hücrenin hücre altı bölgesinde veya bir kültür kabındaki tüm AlPcS2a etiketli hücrelerde IV hasarı gerçekleştirilebilir. Tüm kültür kabının toplu olarak aydınlatılması, biyokimyasal çalışmalar da dahil olmak üzere bu hasarın nicel olarak incelenmesine izin verir.
- Aşağıda açıklandığı gibi, tek bir hücre içindeki lizozomlara zarar vererek tek hücreleri manipüle edin.
- Kültür kabını konfokal mikroskop sahnesine yerleştirin. Heyecan verici GFP ve AlPcS2a için sırasıyla 488 nm ve 561 nm lazerleri kullanın.
- Hasar görmek üzere seçilen AlPcS2a etiketli veziküller üzerinde 5 x 5 μm2 ilgi alanını (ROI) daire içine alın.
- Pulse, 70 tekrar için 0,21 mW'lık 633 nm lazer ile yatırım getirisini aydınlatır. Lizozomal membran geçirgenliğinin bir göstergesi olarak Gal3 puncta oluşumunu izleyin.
- Aşağıda açıklandığı gibi bir kültür kabındaki etiketli tüm hücrelere zarar verin.
- Kültür tabağını bir platforma yerleştirin. Çanağı 660 nm kolimasyonlu LED ışığı ile aydınlatın (yakın kızılötesi ışık, AlPcS2a'nın uyarma spektrumunda ideal bir temeldir).
- Kültür kabını mikroskop üzerine yerleştirin ve adım 4.1.3'te belirtildiği gibi membran geçirgenliği göstergelerini izleyin.
- Aşağıdaki göstergeleri kullanarak IV'lerin yaralanmasını değerlendirin.
- Endozom veya lizozom içeriği, IV rüptürü üzerine sitozole maruz kalan en yüksek glikozile edilir. Bunları, galektin-1, galektin-3, galektin-8 ve galektin-916,20 dahil olmak üzere sitozolik glikan bağlayıcı galektinler kullanarak hızla etiketleyin.
- Yaranın boyutu,21'de tarif edildiği gibi membran geçirimsiz boyanın salınması ile belirlenebilir.
- Endozomlar ve lizozomlar arasındaki fark, luminal pH değerleridir. Lizozomal rüptür, FITC-dekstran3 gibi pH'a duyarlı boya kullanılarak ölçülebilen luminal pH'ı bozar.
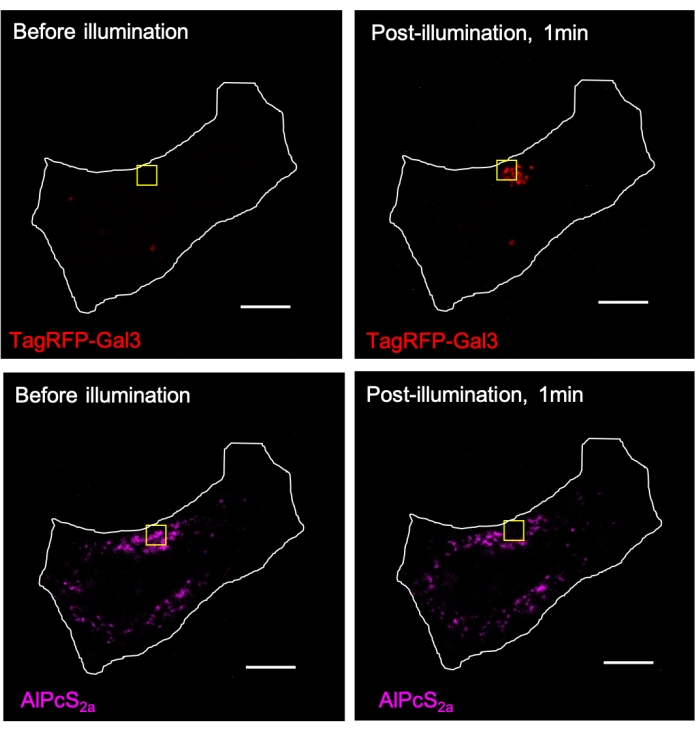
Şekil 3. AlPcS2a aracılı CALI, aydınlatma bölgesindeki lizozomlara TagRFP-galektin-3'ün (Gal3) yerel olarak işe alınmasını indükler. TagRFP-galektin-3 eksprese edilen HeLa hücrelerindeki lizozomlar, 1 μM AlPcS2a ile gece boyunca boyandı, ardından sarı kare içinde yakın kızılötesi ışıkla (633 nm) aydınlatmaya odaklandı. Sarı kare içindeki AlPcS2a sinyali, TagRFP-galektin-3 punkta oluşumu ile birlikte fotoağartılır. Ölçek çubuğu: 10 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Sonuçlar
Endozom ve lizozom da dahil olmak üzere IV'ün AlPcS2a kaynaklı hasarını temsil eden şematik bir şekil gösterilmiştir (Şekil 1).
Ticari olarak temin edilebilen belirteçler, AlPcS2a boyama koşullarını belirlemek için kullanılabilir. Örneğin, AlPcS2a puncta ve yeşil floresan boya22 kolokalizasyon (Şekil 2).
Florofor etiketli galektin-...
Tartışmalar
AlPcS2a plazma zarına bağlanır, daha sonra endositoz tarafından içselleştirilir ve sonunda lizozomlarda birikir. AlPcS2a böylece inkübasyon süresini ayarlayarak hücre altı bölmelerde lokalize edilebilir. Bu metodolojinin bir sınırlaması, IV'lerin sadece bir alt popülasyonunun AlPcS2a tarafından endositoz yoluyla etiketlenebilmesidir, çünkü ER ve Golgi aparatı gibi IV'lerin başka birçok membran kaynağı vardır. Ek olarak, AlPcS2a'nın erken veya geç end...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, araştırma desteği için IBMS, Academia Sinica Inflammation Core Facility'ye teşekkür etmek istiyor. Çekirdek tesis, Academia Sinica Çekirdek Tesisi ve Yenilikçi Enstrüman Projesi (AS-CFII-111-213) tarafından finanse edilmektedir. Yazarlar, görüntü edinimine yardımcı oldukları için Biyomedikal Bilimler Enstitüsü (IBMS), Academia Sinica (AS) Ortak Ekipman Çekirdek Tesisi'ne teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Al(III) Phthalocyanine Chloride Disulfonic acid (AlPcS2a) | Frontier Scientific | P40632 | |
| Culture dish | ibidi | 812128-200 | |
| Culture Medium | DMEM supplemented with 10% FBS and 100 U/mL penicillin G and 100 mg/mL Streptomycin | ||
| DMEM | Gibco | 11965092 | |
| FBS | Thermo Fisher Scientific | A4736301 | |
| Gal3-GFP plasmid | addgene | ||
| Lipofectamine 3000 kit | Thermo Fisher Scientific | L3000008 | |
| LysoTracker Green DND-26 | Thermo Fisher Scientific | L7526 | green fluorescent dye |
| Multiwall plate | perkinelmer | PK-6005550 | |
| NaOH | Thermo Fisher Scientific | Q15895 | |
| OptiMEM | Thermo Fisher Scientific | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140163 | |
| Phosphate-Buffered Saline (PBS) | Gibco | 21600-069 | 137 mM NaCl, 2.7 mM KCl, 10mM Na2HPO4, 1.8 mM KH2PO4 |
| Cell line | |||
| HeLa Cell Line | ATCC | CCL-2 | The methods are applicable for most of the attached cell lines. Conditions must be determined individually. |
| Equipments | |||
| 0.22 µm Filter | Merck | SLGV013SL | |
| Collimated LED Light (660nm) | Thorlabs | M660L3-C1 and DC2100 | Near-infared light is ideal base on the excitation spectrum of AlPcS2a. |
| Confocal microscopy | Carl Zeiss | LSM 780 | An incubation system is required for long-term imaging. |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ||
| Red LED light | Tholabs | M660L4-C1 |
Referanslar
- Cossart, P., Helenius, A. Endocytosis of viruses and bacteria. Cold Spring Harbor Perspectives in Biology. 6 (8), 016972 (2014).
- Daussy, C. F., Wodrich, H. 34;Repair me if you can": membrane damage, response, and control from the viral perspective. Cells. 9 (9), 2042 (2020).
- Hung, Y. H., Chen, L. M., Yang, J. Y., Yang, W. Y. Spatiotemporally controlled induction of autophagy-mediated lysosome turnover. Nature Communications. 4, 2111 (2013).
- Sharma, S. K., et al. Photodynamic therapy for cancer and for infections: what is the difference. Israel Journal of Chemistry. 52 (8-9), 691-705 (2012).
- Kübler, A. C. Photodynamic therapy. Medical Laser Application. 20 (1), 37-45 (2005).
- De Rosa, F. S., Bentley, M. V. Photodynamic therapy of skin cancers: sensitizers, clinical studies and future directives. Pharmaceutical Research. 17 (12), 1447-1455 (2000).
- Hamblin, M. R. New photosensitizers for photodynamic therapy. Biochemical Journal. 473 (4), 347-364 (2016).
- Lavie, G., et al. A photodynamic pathway to apoptosis and necrosis induced by dimethyl tetrahydroxyhelianthrone and hypericin in leukaemic cells: possible relevance to photodynamic therapy. British Journal of Cancer. 79 (3-4), 423-432 (1999).
- Jay, D. G. Selective destruction of protein function by chromophore-assisted laser inactivation. Proceedings of the National Academy of Sciences. 85 (15), 5454-5458 (1988).
- Grate, D., Wilson, C. Laser-mediated, site-specific inactivation of RNA transcripts. Proceedings of the National Academy of Sciences. 96 (11), 6131-6136 (1999).
- Lin, J. Y., et al. Optogenetic inhibition of synaptic release with chromophore-assisted light inactivation (CALI). Neuron. 79 (2), 241-253 (2013).
- Hsieh, C. W., Yang, W. Y. Triggering mitophagy with photosensitizers. Methods in Molecular Biology. 1880, 611-619 (2019).
- Yang, J. Y., Yang, W. Y. Spatiotemporally controlled initiation of Parkin-mediated mitophagy within single cells. Autophagy. 7 (10), 1230-1238 (2011).
- Molinari, M., et al. Vacuoles induced by Helicobacter pylori toxin contain both late endosomal and lysosomal markers. Journal of Biological Chemistry. 272 (40), 25339-25344 (1997).
- Prince, L. R., et al. Subversion of a lysosomal pathway regulating neutrophil apoptosis by a major bacterial toxin, pyocyanin. Journal of Immunology. 180 (5), 3502-3511 (2008).
- Aits, S., et al. Sensitive detection of lysosomal membrane permeabilization by lysosomal galectin puncta assay. Autophagy. 11 (8), 1408-1424 (2015).
- Prasmickaite, L., Hogset, A., Berg, K. Evaluation of different photosensitizers for use in photochemical gene transfection. Photochemistry and Photobiology. 73 (4), 388-395 (2001).
- Berg, K., et al. Photochemical internalization: a novel technology for delivery of macromolecules into cytosol. Cancer Research. 59 (6), 1180-1183 (1999).
- Moan, J., Berg, K. The photodegradation of porphyrins in cells can be used to estimate the lifetime of singlet oxygen. Photochemistry and Photobiology. 53 (4), 549-553 (1991).
- Thurston, T. L., Wandel, M. P., von Muhlinen, N., Foeglein, A., Randow, F. Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion. Nature. 482 (7385), 414-418 (2012).
- Repnik, U., et al. L-leucyl-L-leucine methyl ester does not release cysteine cathepsins to the cytosol but inactivates them in transiently permeabilized lysosomes. Journal of Cell Science. 130 (18), 3124-3140 (2017).
- Griffiths, G., Hoflack, B., Simons, K., Mellman, I., Kornfeld, S. The mannose 6-phosphate receptor and the biogenesis of lysosomes. Cell. 52 (3), 329-341 (1988).
- Jia, J., et al. Galectin-3 Coordinates a cellular system for lysosomal repair and removal. Developmental Cell. 52 (1), 69-87 (2020).
- Chu, Y. P., Hung, Y. H., Chang, H. Y., Yang, W. Y. Assays to monitor lysophagy. Methods in Enzymology. 588, 231-244 (2017).
- Nguyen, L., Madsen, S. J., Berg, K., Hirschberg, H. An improved in vitro photochemical internalization protocol for 3D spheroid cultures. Lasers in Medical Science. 36 (8), 1567-1571 (2021).
- Daugelaviciene, N., et al. Lysosome-targeted photodynamic treatment induces primary keratinocyte differentiation. Journal of Photochemistry and Photobiology. B, Biology. 218, 112183 (2021).
- Hong, M. H., et al. Intracellular galectins control cellular responses commensurate with cell surface carbohydrate composition. Glycobiology. 30 (1), 49-57 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır