Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Doğuştan İmmün Hücre Ölümünü Değerlendirmek için Kaspaz Aktivasyonunun Değerlendirilmesi
Bu Makalede
Özet
Bu protokol, piroptoz, apoptoz, nekroptoz ve PANoptoz gibi hücre ölüm yollarının başlatılmasını belirlemek için hem in vitro hem de in vivo (in fareler) enfeksiyon, steril hakaretler ve kanser modellerine yanıt olarak kaspaz aktivasyonunu (kaspaz-1, kaspaz-3, kaspaz-7, kaspaz-8, kaspaz-9 ve kaspaz-11) değerlendirmek için kapsamlı bir yöntemi açıklamaktadır.
Özet
Doğuştan gelen bağışıklık, patojenlere ve steril hakaretlere yanıt olarak kritik ilk savunma hattını sağlar. Bu yanıtın önemli bir mekanik bileşeni, enfekte olmuş veya hasar görmüş hücreleri ortadan kaldırmak ve bağışıklık tepkilerini yaymak için doğuştan gelen immün programlanmış hücre ölümünün (PCD) başlatılmasıdır. Bununla birlikte, aşırı PCD inflamasyon ve patoloji ile ilişkilidir. Bu nedenle, PCD'nin aktivasyonunu ve düzenlenmesini anlamak, doğuştan gelen immün yanıtları karakterize etmenin ve hastalık spektrumunda yeni terapötik hedeflerin belirlenmesinin merkezi bir yönüdür.
Bu protokol, genellikle apoptoz, pirotoz, nekroptoz ve PANoptoz dahil olmak üzere çeşitli PCD yolaklarıyla ilişkili bir sistein bağımlı proteaz ailesi olan kaspazları izleyerek doğuştan gelen immün PCD aktivasyonunu karakterize etmek için yöntemler sağlar. İlk raporlarda kaspaz-2, kaspaz-8, kaspaz-9 ve kaspaz-10 apoptozda başlatıcı kaspazlar ve kaspaz-3, kaspaz-6 ve kaspaz-7 efektör kaspazlar olarak karakterize edilirken, daha sonraki çalışmalarda inflamatuar kaspazlar, kaspaz-1, kaspaz-4, kaspaz-5 ve kaspaz-11 pirotozu tetiklemektedir. Daha önce tanımlanmış PCD yolları boyunca kaspazlar ve diğer doğuştan gelen bağışıklık ve hücre ölümü molekülleri arasında kapsamlı bir çapraz konuşma olduğu, doğuştan gelen bağışıklık ve PCD'nin mekanik anlayışında önemli bir bilgi boşluğunu tanımladığı ve PANoptozun karakterizasyonuna yol açtığı bilinmektedir. PANoptoz, diğer hücre ölüm yollarından kaspazlar da dahil olmak üzere bileşenleri entegre eden PANoptozom kompleksleri tarafından düzenlenen benzersiz bir doğuştan gelen immün inflamatuar PCD yoludur.
Burada, çeşitli uyaranlara yanıt olarak kaspazların aktivasyonunu değerlendirmek için yöntemler sunulmaktadır. Bu yöntemler, PCD yolaklarının hem in vitro hem de in vivo karakterizasyonuna izin verir, çünkü aktif kaspazlar, optimal antikorlar ve lekelenme koşulları kullanılarak batı lekelenmesi ile görselleştirilebilen proteolitik bölünmeye uğrar. Aynı hücresel popülasyondan çoklu kaspazların aktivasyonunun değerlendirilmesine izin veren ve PCD süreçlerinin kapsamlı bir karakterizasyonunu sağlayan bir protokol ve batı lekeleme iş akışı oluşturulmuştur. Bu yöntem, sağlık ve hastalıktaki hücresel süreçler boyunca PCD yollarını değerlendirmek için gelişim, homeostaz, enfeksiyon, inflamasyon ve kanserdeki araştırma alanlarına uygulanabilir.
Giriş
Doğuştan gelen bağışıklık sistemi, enfeksiyon sırasında ve doku hasarı ve homeostazdaki değişiklikler gibi steril uyaranlara yanıt olarak ilk savunma hattı olarak işlev görür. Hücre yüzeyindeki ve sitoplazmadaki doğuştan gelen bağışıklık sensörleri, enflamatuar sinyal yollarını ve hücresel yanıtları tetiklemek için patojen veya hasarla ilişkili moleküler paternlere (sırasıyla PAMP'ler veya DAMP'ler) yanıt verir. Doğuştan gelen bağışıklık tepkisinin kilit süreçlerinden biri, enfekte olmuş veya hasarlı hücreleri çıkarmak ve daha fazla doğuştan gelen ve adaptif bağışıklık tepkilerini yönlendirmek için hücre ölümünün indüklenmesidir. Programlanmış hücre ölümü (PCD), türler arasında oldukça korunmuş bir süreçtir ve doğuştan gelen bir bağışıklık mekanizması olarak evrimsel önemini vurgulamaktadır.
Tüm hücre tiplerinde aktive edilebilen birkaç doğuştan gelen immün PCD yolu vardır. Kaspazlar, geleneksel olarak enflamatuar olmayan apoptoz yolunun yanı sıra pirotoz, nekroptoz ve PANoptosis 1,2,3,4,5 gibi enflamatuar PCD yolları da dahil olmak üzere birçok PCD yolunda kritik olan, yüksek oranda korunmuş, hücre içi, sistein bağımlı proteazların önemli bir ailesidir. . İyi tanımlanmış 11 insan ve 10 murin kaspazı ve fonksiyonel olabilen psödo-kaspazlar vardır ve çoğu aktivasyon için bölünme gerektiren inaktif monomerik veya dimerik pro-kaspazlar olarak yapısal olarak ifade edilir 6,7. Kaspazlar ayrıca multiprotein komplekslerinin işe alınması ve oluşumu için önemli alanlar içerir. Bunlar arasında kaspaz-1, kaspaz-2, kaspaz-4, kaspaz-5, kaspaz-9 ve kaspaz-11'de bulunabilen kaspaz aktivasyon ve işe alım alanı (CARD) veya kaspaz-8 ve kaspaz-10'da bulunan ölüm efektör alanı (DED) bulunur. Hem proteolitik aktiviteleri hem de multiprotein kompleksleri oluşturma yetenekleri sayesinde, kaspazlar doğuştan gelen immün PCD'nin kritik itici güçleridir.
Doğuştan gelen immün PCD'de kaspazların rolü ilk olarak apoptozda tanımlanmıştır; burada başlatıcı kaspazlar, kaspaz-2, kaspaz-8, kaspaz-9 ve kaspaz-10, cellat kaspazları, kaspaz-3, kaspaz-6 ve kaspaz-7'yi aktive ederekhücre ölümünü 8,9,10,11,12 olarak yönlendirmiştir. Başlatıcı kaspazlar çeşitli sinyal kaskadları ile aktive edilebilir; ekstrinsik yolak, hücre dışı ligandın neden olduğu ölüm reseptörü sinyallemesi yoluyla kaspaz-8'i aktive eder ve intrinsik yolak, mitokondriyal bütünlüğün bozulması yoluyla kaspaz-9'u aktive eder13. Aktif başlatıcı kaspazlar, aktif formlarını üretmek için cellat kaspazlarının büyük ve küçük katalitik alt birimlerini ayıran bağlayıcıyı ayırır. Cellat, daha sonra hücreyi parçalamak için substratlarını parçalara ayırır, bu da DNA bozulmasına, zar ağartmasına, nükleer parçalanmaya ve apoptotik cisimlerin salınmasına neden olur14,15. Bu süreç tipik olarak, ölmekte olan hücrelerin efferositoz16 ile derhal temizlenmesiyle birleştiğinde, litik olmayan ve enflamatuar olmayan bir hücre ölümü formunda sona erer. Bununla birlikte, efferositozdaki kusurlar veya fagositik hücrelerin eksikliği, apoptotik hücrelerin birikmesine neden olabilir ve bu da daha sonra litik ve enflamatuar hücre ölümüne maruz kalır17,18.
Kaspaz-1 (insan ve fare), kaspaz-4 ve kaspaz-5 (insan) ve kaspaz-11 (fare) dahil olmak üzere enflamatuar kaspazların, pirotoz adı verilen bir inflamatuar doğuştan gelen immün PCD (iii-PCD) formu sırasında aktive olduğu keşfedilmiştir. Kaspaz-1 aktivasyonu, sitozolik doğuştan gelen bir bağışıklık sensörü, bir adaptör molekülü (bir CARD [ASC] içeren apoptozla ilişkili leke benzeri protein) ve kaspaz-1 içeren multiprotein kompleksleri olan enflamatuarların oluşumu ile ilişkilidir. Bu kompleksin oluşumu, kaspaz-1'in aktif formunu serbest bırakmak için yakınlık aracılı otoproteolize maruz kalmasına izin verir, bu da pro-inflamatuar sitokinler interlökin (IL)-1β ve IL-18 ve gözenek oluşturan molekül gasdermin D (GSDMD) 19,20,21,22,23 dahil olmak üzere hedef substratları parçalayabilir. . Kaspaz-11, kaspaz-4 ve kaspaz-5, lipopolisakkarit (LPS) 19,20 gibi PAMP'leri algıladıktan sonra enflamatuarın yukarı akış oluşumu olmadan GSDMD'yi aktive edebilir. Bu kaspazlar dimerizasyona uğrar, ardından oligomerizasyon ve sitozolik LPS'ye bağlandıktan sonra aktivasyon için kendi kendine bölünmeye uğrar, bu da IL-1β ve IL-18 olgunlaşmasını indüklemek için kanonik olmayan enflamatuar aktivasyon24,25,26 ve hücreye özgü bir şekilde kaspaz-1 aktivasyonuna yol açar 20. Bu pro-inflamatuar sitokinlerin olgunlaşması ve salınması, bu kaspazları "enflamatuar" olarak karakterize eder. Ek olarak, apoptotik kaspaz-8'in enflamatuar lokalize olduğu ve apoptotik ve piroptotik süreçler arasında bir bağlantı sağladığı bulunmuştur. Çalışmalar, apoptotik kaspaz-8'in nekroptoz adı verilen başka bir PCD formunu düzenlemek için de kritik olduğunu bulmuştur. Kaspaz-8 kaybı, nekrotozun III-PCD yolunu 27,28,29,30,31,32,33,34,35 yönlendirmek için spontan reseptör ile etkileşime giren serin-treonin kinaz 3 (RIPK3) aracılı karışık soy kinaz etki alanı benzeri psödokinaz (MLKL) aktivasyonu ile sonuçlanır.
Kaspazlar tarihsel olarak başlattıkları hücre ölümünün türüne göre "apoptotik" veya "enflamatuar" olarak sınıflandırılmış olsa da, artan kanıtlar, doğuştan gelen immün PCD yolları arasında kaspazlar 3,4 yoluyla kapsamlı bir çapraz konuşma olduğunu göstermektedir. Örneğin, enflamatuarlardan gelen inflamatuar kaspaz-1, apoptotik kaspaz-7'yi kanonik aktivasyon bölgesi34'te ayırır. Kaspaz-1 aktivasyonu ayrıca poli (ADP-riboz) polimeraz 1 (PARP1) 36 gibi apoptotik substratların bölünmesine de yol açabilir. GSDMD'den yoksun hücrelerde, kaspaz-1 ayrıca kaspaz-3 37,38'i de parçalayabilir. Ek olarak, kanonik olarak apoptotik kaspaz-3, PCD17,18'i indüklemek için gasdermin E'yi (GSDME) parçalayabilir ve ayrıca GSDM'yi inaktif bir form40'a işleyebilir. Ayrıca, enflamatuar komplekse kaspaz-8 alımı 39,40,41,42,43,44,45 olarak gözlemlenmiştir ve kaspaz-8, kanonik ve kanonik olmayan enflamatuar aktivasyonun önemli bir düzenleyicisidir39. Birçok enflamatuar durumda kaspaz-8 ve kaspaz-1 için örtüşen ve gereksiz roller de vardır ve piroptotik, apoptotik ve nekroptetik bileşenlerin aktivasyonu ile karakterize doğuştan gelen immün PCD, hastalık spektrumunda 39,46,47,48,49,50 oranında ortaya çıkar.
Enflamatuar ve apoptotik kaspazlar arasındaki bu çapraz konuşmaya dayanarak, doğuştan gelen bağışıklık ve PCD'nin mekanik anlayışında önemli bir boşluk tespit edildi ve PANoptozun keşfine yol açtı. PANoptoz, patojenlere, PAMP'lara, DAMP'lere ve homeostazdaki değişikliklere yanıt olarak aktive olan ve PANoptozomlar tarafından düzenlenen benzersiz bir III-PCD şeklidir - diğer hücre ölüm yollarından bileşenleri entegre eden çok yönlü makromoleküler kompleksler 44,50,51,52,53,54,55 . PANoptozdaki biyolojik etkilerin toplamı tek başına piroptoz, apoptoz veya nekroptoz ile tek başına 3,4,35,36,39,46,47,48 ile açıklanamaz, çünkü PANoptoz, kaspaz-1, kaspaz-11, kaspaz-8, kaspaz-9, kaspaz-3 ve / veya kaspaz-7 dahil olmak üzere çoklu kaspazların aktivasyonu ile karakterize edilir. bağlama bağlı olarak 44,48,49,50,51,52,53,54,56,57,58,59,60,61,62 . PANoptoz, bulaşıcı ve enflamatuar hastalıkların yanı sıra kanserler ve kanser tedavilerinde giderek daha fazla rol oynamaktadır 3,4,35,36,39,44,46,47,48,49,50,51,52,53 ,54,56
,57,58,59,60,61,62,63,64,65,66.
Apoptoz, piroptoz, nekroptoz ve PANoptoz dahil olmak üzere hücre ölüm yolakları boyunca kaspazların temel rolü göz önüne alındığında, aktivasyonlarını karakterize etmek ve PCD yollarının tam karmaşıklığını anlamak için teknikler geliştirmek önemlidir. Buradaki protokol, hücreleri uyarmak ve kaspazların sonraki aktivasyonunu ölçmek için bir yöntemi detaylandırmaktadır (Şekil 1). Bu yöntem, genellikle aktivasyonları için gerekli olan kaspazların proteolitik bölünmesini, onları incelemek için bir araç olarak kullanır. Batı lekelenmesi yoluyla, protein boyutları belirlenebilir, bu da inaktif pro-kaspazların ve bunların aktif, parçalanmış formlarının net bir şekilde görselleştirilmesine ve farklılaştırılmasına izin verir.
Bu protokolün başlıca avantajları, 1) PCD aktivasyonunu daha doğru bir şekilde belirlemek için tek bir endojen hücre popülasyonundan paralel olarak çoklu kaspazların aktivasyonunu değerlendirme yeteneği ve 2) kapsamlı eğitim veya pahalı ekipman gerektirmeyen nispeten basit laboratuvar tekniklerinin kullanılmasıdır. Önceki protokoller, kültür süpernatantlarında, hücre ve doku lizatlarında, mikroskopi yoluyla tüm hücrelerde ve in vivo 67,68,69,70,71'de kaspaz aktivasyonunu izlemek için batı lekeleme, floresan muhabirleri veya antikor boyama yöntemini kullanmıştır, ancak bu teknikler genellikle bir numunede sadece bir veya iki kaspazı izler. Ayrıca, bölünme üzerine floresan kaspaz bölünme bölgeleri içeren sentetik peptit substratları, hücre veya doku lizatlarında kaspaz aktivasyonunu izlemek için kullanılmış olsa da, bu substratlar genellikle birden fazla kaspaz tarafından parçalanabilir ve bu da bu sistemdeki bireysel kaspazların spesifik aktivasyonunu belirlemeyi zorlaştırır. Ek olarak, floresan muhabirlerin veya diğer etiket tabanlı yöntemlerin kullanımı yerine batı lekelenmesinin kullanılması, araştırmacıların muhabir genleriyle spesifik hücre çizgileri oluşturmak yerine endojen hücreleri kullanmalarına izin verir. Endojen hücrelerin kullanılmasının, birçok ölümsüzleştirilmiş hücre çizgisinin anahtar hücre ölüm molekülleri72,73'te eksik olması da dahil olmak üzere sonuçları etkileyebilecek birçok avantajı vardır. Ek olarak, endojen hücrelerin kullanılması, tek bir soy yerine makrofajlar, epitel hücreleri ve endotel hücreleri gibi çeşitli hücre tiplerinin değerlendirilmesine izin verir. Batı lekelemesi aynı zamanda büyük, pahalı ekipmanlara veya karmaşık kurulumlara ihtiyaç duymadan dünyanın dört bir yanındaki laboratuvarlarda gerçekleştirilebilen nispeten basit ve uygun maliyetli bir tekniktir.
Bu protokol, diğer enflamatuar sinyal yolaklarındaki iskele rolleri ve işlevleri de dahil olmak üzere kaspazların hem hücre ölümüne bağımlı hem de hücre ölümünden bağımsız işlevlerini anlamak için biyoloji genelinde yaygın olarak uygulanabilir74. Bu yöntemin uygulanması, doğuştan gelen immün PCD yolaklarının ve hastalıklar ve koşullar arasında enflamatuar sinyalleşmenin incelenmesinde birleşik bir yaklaşıma izin verir ve bu protokol, gelecekteki terapötik stratejilerin gelişimini bilgilendirecek kritik düzenleyici süreçleri ve mekanik bağlantıları tanımlamak için kullanılabilir.
Protokol
Hayvan kullanımı ve prosedürleri, St. Jude Çocuk Araştırma Hastanesi Hayvanların Kullanımı ve Bakımı Komitesi tarafından onaylanmıştır.
1. Çözümlerin hazırlanması
- L929 şartlandırılmış medyayı hazırlayın.
- Plaka 1 × 50 mL L929 kültür ortamı içeren 182cm2 doku kültürü şişesinde 106 L929 hücresi (bkz. Malzeme Tablosu) (ortamın hazırlanması için bakınız).
- Nemlendirilmiş bir inkübatördeki hücreleri% 5 CO2 ile 37 ° C'de büyütün.
- 7 gün sonra, süpernatanı toplayın ve 0,45 μm'lik bir filtre kullanarak filtreleyin. 50 mL alikot hazırlayın (dondurulmuş alikotları 1 yıla kadar -80 ° C'de saklayın).
- 500 mL kemik iliği kaynaklı makrofaj (BMDM) kültür ortamı hazırlayın (Tablo 1).
- 500 mL BMDM stimülasyon ortamı hazırlayın (Tablo 1).
- Enfeksiyon için 500 mL ortam hazırlayın (Tablo 1).
- 100 mL'lik 1 M Tris tamponu hazırlayın (Tablo 1).
- 4x sodyum dodesil sülfat (SDS) tamponu hazırlayın (Tablo 1).
- 1 mL'lik 1 M 1,4-dithiothreitol hazırlayın (DTT, Tablo 1).
- 40 mL kaspaz lizis tamponu hazırlayın (Tablo 1).
- 100 mL'lik 1,5 M Tris tamponu hazırlayın (Tablo 1).
- 100 mL'lik %10'luk (ağırlık/hacim) bir SDS çözeltisi hazırlayın (Tablo 1).
- 50 mL'lik 2x radyoimmünopresipitasyon testi (RIPA) tamponu hazırlayın (Tablo 1).
- 5 mg/mL'lik bir LPS çözeltisi hazırlayın (Tablo 1).
- 0,5 M ATP çözeltisi hazırlayın (Tablo 1).
- Batı lekelenme çözeltilerini hazırlayın.
- 1 L 5x çalışan tampon stoğu hazırlayın (Tablo 1).
- 1 L 10x transfer tampon stoğu hazırlayın (Tablo 1).
- Ara 20 ile 1 L Tris tamponlu salin hazırlayın (TBST, Tablo 1).
- 100 mL'lik %5'lik (ağırlık/hacim) yağsız süt bloke edici çözelti hazırlayın (Tablo 1).
- Birincil antikor çözeltilerini hazırlayın.
- 10 mL kaspaz-1 primer antikoru hazırlayın (Tablo 1).
- 10 mL kaspaz-11 primer antikoru hazırlayın (Tablo 1).
- 10 mL kaspaz-3 primer antikoru hazırlayın (Tablo 1).
- 10 mL kaspaz-7 primer antikoru hazırlayın (Tablo 1).
- 10 mL kaspaz-8 primer antikoru hazırlayın (Tablo 1).
- 10 mL kaspaz-9 primer antikoru hazırlayın (Tablo 1).
- 10 mL HRP konjuge β-aktin primer antikoru hazırlayın (Tablo 1).
- İkincil antikor çözeltilerini hazırlayın.
- 10 mL anti-tavşan sekonder antikoru hazırlayın (Tablo 1).
- 10 mL anti-fare sekonder antikoru hazırlayın (Tablo 1).
- 10 mL anti-sıçan sekonder antikoru hazırlayın (Tablo 1).
2. Kemik iliği kaynaklı makrofajların izole edilmesi
NOT: Bu protokol için, sağlam PCD yolaklarına sahip 6-10 haftalık vahşi tip fareler veya PCD düzenleyicileri, efektörleri veya silinmiş veya değiştirilmiş molekülleri olan mutant fareler kullanılabilir.
- Bir CO 2 odasındaki fareyi,2-3 dakika boyunca kafes hacminin% 10 -% 30'unun yerini alan bir akış hızına sahip bir fareyi ötenazileştirin. Ardından, servikal çıkık gibi ikincil bir ötenazi yöntemi uygulayın. Uygun olan her yerde tesis, kurum ve devlete özgü tüm ek yönergelere ve düzenlemelere uyun.
- Arka bacak kemiklerini almak için fareyi inceleyin.
- Fareyi sırtına sabitleyin, böylece karın açığa çıkar. Arka bacakları ve karnı sterilize etmek için% 70 (hacim / hacim) etanol ile püskürtün.
DİKKAT: Etanol yanıcıdır. Açık alevlerden uzak tutun. - Karnın orta hattında bir kesi yapmak için makas kullanın; femurları görünür kılmak için bacaklara doğru kesmeye devam edin.
- Sağ arka bacağınızı alın ve cildi vücuttan orta çizgiye doğru çekin. Adduktör kaslarını orta çizgiye doğru keserek bacağı vücuttan ayırın; daha sonra bacağı kalça eklemi ve omurga arasında kesin. Daha sonra, pençeyi ayak bileğine distal olarak kesin ve cildi soyarak ve baldır dokusunu soymak için hafifçe açılmış makas kullanarak kemikten fazla dokuyu çıkarın.
- Bacağı% 70 (hacim / hacim) etanol ile ıslatılmış bir havluya yerleştirin ve tibia ve femuru diseke edin.
- Tibia ve femuru her biri ayrı bir forseps seti ile sıkıştırın. Tibiayı diz ekleminin doğal yönüne nazikçe bastırın; bu, tibianın dizde kırılmasına neden olur.
- Kalan asılı dokuları çıkarmak için gerekirse forseps ve diseksiyon makası kullanın. Tibiayı etanolle ıslatılmış havluya yerleştirerek daha sonra kullanmak üzere saklayın.
- Femuru aynı şekilde, dizinden kopararak toplayın.
- Sol bacağın vücuttan çıkarması ve tibia ve femuru diseke etmesi için yukarıdaki 3. ve 4. adımları tekrarlayın.
- Kemiklere% 70 (hacim / hacim) etanol püskürtün.
- Kemikleri% 70 (hacim / hacim) etanol ile ıslatılmış temiz bir havluya yerleştirerek, havludaki etli kısmı sıkarak ve fazla dokuyu çıkarmak için havluyu kemiğe sürtünerek temizleyin.
- Fareyi sırtına sabitleyin, böylece karın açığa çıkar. Arka bacakları ve karnı sterilize etmek için% 70 (hacim / hacim) etanol ile püskürtün.
- Hem femurlar hem de tibiaslar temizlendikten sonra, dört kemiğin hepsine% 70 (hacim / hacim) etanol püskürtün. Kemikleri steril bir Petri kabında toplayın ve 10 mL BMDM kültür ortamı ile tabaktaki medyayı hafifçe sallayarak durulayın.
- 10 mL'lik bir şırıngayı 10 mL taze BMDM kültür ortamı ile doldurun ve 25 G'lik bir iğne takın.
- Forseps kullanarak tibiayı alın; Ardından, ayak bileği eklemini ~ 45 ° açıyla kesin.
- Kemik iliğini tibiadan yıkayın.
- Tibia'yı, tibianın dar ucu aşağı bakacak şekilde 50 mL'lik bir tüp üzerinde tutun. Medyayı doldurulmuş şırıngadan tibia üzerine dağıtın.
- İğneyi (ilk başta nazikçe) iliğin üst ucuna yerleştirin ve ortamı dağıtın.
- İğneyi çıkarın ve tekrar takın. Ortamı dağıtmak ve iğneyi iliğe taşımak için kısa, yüksek basınçlı itmeler kullanın.
- Medya kemiğin altından dışarı akmaya başladığında, hücreleri temizlemeye devam etmek için kısa, yüksek basınçlı itmeler kullanın. Bu işlem sırasında kemiğin rengini izleyin ve kemik beyaz olduğunda atın.
- Bunu her iki tibia için de yapın.
- Femurlar için yukarıdaki 5. ve 6. adımları tekrarlayın, tibia ayak bileği ekleminde kesildiği gibi kalça ekleminde kesin. İlik yıkanırken BMDM kültür ortamını toplamak için aynı 50 mL tüpü kullanın.
- Dört kemiğin tamamı yıkandıktan sonra, iliği ve medyayı 50 mL'lik tüpten 10 mL'lik bir şırınga üzerindeki 18 G'lik bir iğneden 3 kat yukarı ve aşağı aspire edin, iliği dağıtmak için her seferinde tüpün kenarlarını durulayın.
- BMDM kültür ortamı ile 50 mL tüpteki son hacmi 30 mL'ye ayarlayın ve hücrelerin tamamen askıya alındığından emin olun.
- BMDM kültür ortamını 50 mL tüpten filtrelemek için 70 μm hücre süzgeci kullanın.
- Kemik iliği progenitör hücrelerini içeren ortaya çıkan hücre süspansiyonunu, her birine 10 mL (veya ~ 20 × 106 hücre) ekleyerek üç adet 150 mm doku kültürü kabına yerleştirin. Ardından, her yemeğe ek olarak 10 mL BMDM kültür ortamı ekleyin. 37 °C'de nemlendirilmiş bir inkübatörde inkübe edin.
3. BMDM'lerin ayırt edilmesi ve deneyler için kaplama yapılması
- Kaplanmış kemik iliği progenitör hücrelerini 3 gün boyunca 37 ° C'de inkübe edin. Ardından, her bir tabağı çıkarın ve ilave 5-8 mL BMDM kültür ortamı ekleyin (Tablo 1). 37 °C'de inkübatöre geri dönün.
- İlk kaplamadan sonraki 5. günde, her bir tabağı çıkarın ve ilave 5 mL BMDM kültür ortamı ekleyin. 37 °C'de inkübatöre geri dönün.
- 6. günde, her bir tabağı çıkarın ve medyayı atın. Ardından, bir kez yıkamak için 10 mL soğuk (4 °C'de saklanan) PBS ekleyin. 10 mL soğuk PBS yıkamayı atın. Ardından, her yemeğe 10 mL taze, soğuk PBS ekleyin ve her yemeği 5 dakika boyunca buz üzerinde kuluçkaya yatırın.
- Bir hücre kazıyıcı kullanarak, hücreleri her üç tabaktaki hücreleri 50 mL'lik bir tüpe yavaşça kazıyın. Hücreleri 5 dakika boyunca 4 ° C'de 270 × g'da yavaşça aşağı doğru döndürün; sonra süpernatantı atın.
- 20 mL BMDM kültür ortamı ekleyin, peleti yeniden askıya almak için yukarı ve aşağı pipet ekleyin ve hücreleri sayın.
NOT: Her farenin yaklaşık 60 × 10 6-100 × 106 hücre vermesi beklenir. - İstenilen in vitro hücre ölümü / inflamasyon stimülasyon testi için 12 kuyucuklu plaka düzenini planlayın. Kuyu başına 1 × 106 hücre plakalamayı planlayın. Planlanan her stimülasyon için, en az üç biyolojik replikasyon ve kaspaz lizis tamponunda hasat edilecek bir dizi kuyu ve RIPA tamponunda hasat edilecek ikinci bir kuyu seti ekleyin.
- Plaka 1 × 12 delikli plakalarda kuyu başına 1 mL BMDM kültür ortamında 106 hücre. Hücre ölümü / inflamasyon değerlendirmesine geçmeden önce 37 ° C'de nemlendirilmiş bir inkübatörde gece boyunca kültür. Gece boyunca inkübasyondan sonra, ortamı çıkarın ve hücreleri yıkamak için her bir kuyucuğa 1 mL ılık (37 ° C) PBS ekleyin.
- PBS yıkamasını çıkarın ve antibiyotiklerle 500 μL BMDM stimülasyon ortamı (bakteriyel olmayan stimülasyonlar yapıyorsanız) veya antibiyotiksiz BMDM stimülasyon ortamı (bakteriyel stimülasyonlar yapıyorsanız) ekleyin (Tablo 1). İn vitro stimülasyon / enfeksiyon için adım 4'e geçmeden önce 2 saat boyunca inkübe edin.
4. Hücreleri uyarmak veya enfekte etmek
DİKKAT: Bu protokolde yer alan ajanlar potansiyel olarak patojeniktir ve ilgili kurumsal ve resmi makamların onayı ile bir biyogüvenlik seviye 2 (BSL2) tesisinde uygun önlemlerle ele alınmalıdır.
- İlgilenilen tetikleyici ile hücre ölümünü aktive etmek için BMDM'leri uyarın.
NOT: Bu protokolün amaçları doğrultusunda, influenza A virüsü (IAV), herpes simpleks virüsü 1 (HSV1), Francisella novicidave LPS + ATP örnek olarak kullanılır, ancak diğer tetikleyiciler kullanılabilir.- Örnek stimülasyon 1: IAV ile enfekte (A / Porto Riko / 8/34, H1N1 [PR8]) (Hoffmann ve ark.75'e göre inşa edilmiştir; enfeksiyon çokluğu [MOI] tayini için viral titre, MDCK hücrelerinde bir plak testi ile hesaplanır):
- Denklem (1) ve denklem (2) kullanarak 20 plak oluşturan birimin (PFU) çokluğunda enfeksiyon için gereken virüs hacmini (MOI) hesaplayın:

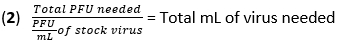

- Ortamı BMDM'lerden çıkarın ve hücreleri 500 μL PBS ile bir kez yıkayın. Her bir kuyucuğa ısıl inaktive (HI)-FBS olmadan yüksek glikozlu DMEM'de 450 μL IAV (20 MOI) ekleyin. Emilimi sağlamak için plakaları nemlendirilmiş bir inkübatörde 1 saat boyunca 37 ° C'de inkübe edin.
- Plakaları çıkarın ve 50 μL HI-FBS ekleyin. Plakaları inkübatöre 37 °C'de geri getirin. Toplam 12 saat boyunca inkübe edin.
- Denklem (1) ve denklem (2) kullanarak 20 plak oluşturan birimin (PFU) çokluğunda enfeksiyon için gereken virüs hacmini (MOI) hesaplayın:
- Örnek stimülasyon 2: HSV1 ile enfekte (HF suşu; daha önce tarif edildiği gibi kültürlenmiş44; MOI tayini için viral titre, Vero hücrelerinde bir plak testi ile hesaplanır):
- Yukarıdaki IAV enfeksiyonu bölümündeki 1. adımdaki denklem (1) ve denklem (2)'yi kullanarak 10 PFU'luk bir MOI'de enfeksiyon için gereken virüs hacmini hesaplayın.

- Ortamı BMDM'lerden çıkarın. Her bir kuyucuğa HI-FBS olmadan yüksek glikozlu DMEM'de 450 μL HSV1 (MOI 10) ekleyin. Emilimi sağlamak için plakaları nemlendirilmiş bir inkübatörde 1 saat boyunca 37 ° C'de inkübe edin.
- Plakaları çıkarın ve 50 μL HI-FBS ekleyin. Plakaları inkübatöre 37 °C'de geri getirin. Toplam 12 saat boyunca inkübe edin.
- Yukarıdaki IAV enfeksiyonu bölümündeki 1. adımdaki denklem (1) ve denklem (2)'yi kullanarak 10 PFU'luk bir MOI'de enfeksiyon için gereken virüs hacmini hesaplayın.
- Örnek stimülasyon 3: F. novicida (U112 suşu; daha önce tarif edildiği gibikültürlenmiş 44 BBL Triptikaz Soya Suyunda 37 ° C'de aerobik koşullar altında bir gecede% 0.2 L-sistein ile desteklenmiştir. Daha sonra, taze ortamı boş olarak kullanarak 600 nm'de optik yoğunluğu (OD) almadan önce bakterileri 37 ° C'de 1:10 oranında taze ortamda 4 saat daha alt kültüre alın. 1'lik bir OD değeri, mL başına 1 × 109 koloni oluşturan birime (CFU) eşittir.)
- Denklem (3) ve denklem (4) kullanarak 50 CFU'luk bir MOI'de enfeksiyon için gereken F. novicida hacmini hesaplayın:

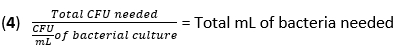
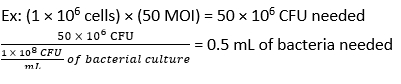
- Her bir kuyucuğa antibiyotik kullanmadan BMDM stimülasyon ortamına 500 μL F. novicida (MOI 50) ekleyin. Emilimi sağlamak için plakaları nemlendirilmiş bir inkübatörde 4 saat boyunca 37 ° C'de inkübe edin.
- Hücreleri ısıtılmış (37 ° C) PBS ile üç kez yıkayın ve 50 μg / mL gentamisin içeren 500 μL BMDM stimülasyon ortamı ekleyin. Plakaları inkübatöre 37 °C'de geri getirin. Gece boyunca inkübe edin (16 saat).
- Denklem (3) ve denklem (4) kullanarak 50 CFU'luk bir MOI'de enfeksiyon için gereken F. novicida hacmini hesaplayın:
- Örnek stimülasyon 4: LPS + ATP ile uyarın.
- Her bir kuyucuğa 100 ng/mL LPS içeren antibiyotiklerle 500 μL BMDM stimülasyon ortamı ekleyin (Tablo 1). Plakaları nemlendirilmiş bir inkübatörde 3,5 saat boyunca 37 ° C'de inkübe edin.
- Her bir kuyucuğa 5 μL 0,5 M ATP stok çözeltisi (Tablo 1) ekleyin. Plakaları inkübatöre 37 °C'de geri getirin. 30 dakika boyunca inkübe edin.
- Örnek stimülasyon 1: IAV ile enfekte (A / Porto Riko / 8/34, H1N1 [PR8]) (Hoffmann ve ark.75'e göre inşa edilmiştir; enfeksiyon çokluğu [MOI] tayini için viral titre, MDCK hücrelerinde bir plak testi ile hesaplanır):
5. Kaspaz batı lekelerinde kullanılmak üzere kombine süpernatant ve protein lizatın toplanması
- 4 saat, 12 saat veya 16 saat inkübasyondan sonra (spesifik zamanlama kullanılan tetiğe bağlıdır), plakayı inkübatörden çıkarın.
- Süpernatanın 150 μL'sini çıkarın; bunu diğer süpernatant analizler için atın veya saklayın (örneğin, enzime bağlı immünosorbent testi [ELISA]). Kalan süpernatanı çıkarmayın.
- Kuyucuk başına 50 μL kaspaz lizis tamponu + 100 μL 4x SDS tamponunu birleştirerek protein toplama çözeltisini oluşturun (Tablo 1). Ardından, karışımın her bir oyuğa 150 μL ekleyin.
- Her bir kuyucuk için, lize hücreleri ve süpernatan toplamak için karışımı yukarı ve aşağı pipetleyin. Pipetleme sırasında, hücreleri bozmak için pipet ucu ile kuyunun dibini de kazıyın. Kazıma ve pipetlemeden sonra, protein lizatını etiketli 1,5 mL tüplere toplayın.
- Tüm tüpleri 12 dakika boyunca 100 ° C'ye ısıtmak için bir ısı bloğu kullanın.
- Çözünmeyen her türlü bileşeni oda sıcaklığında 30 s için 14.500 × g'da santrifüj yaparak pelet edin.
NOT: Bu bir duraklama noktasıdır – kombine süpernatant ve protein lizatlarından elde edilen protein hemen kullanılabilir veya kullanıma hazır olana kadar -20 ° C'de 2 aya kadar veya -80 ° C'de 6 aya kadar saklanabilir.
6. Kaspaz batı lekelerinde kullanılacak protein lizatının toplanması
- 4 saat, 12 saat veya 16 saat inkübasyondan sonra (spesifik zamanlama kullanılan tetiğe bağlıdır), plakayı inkübatörden çıkarın. Tüm süpernatanları kaldırın; bunu diğer süpernatant analizleri (örneğin, ELISA) için atın veya saklayın.
- 2x RIPA stok çözeltisini (Tablo 1) eşit miktarda deiyonize suda seyrelterek 1x RIPA tamponunu oluşturun. Daha sonra, bir fosfataz inhibitörü tableti ve bir proteaz inhibitörü tableti ekleyin ve çözünmelerine izin verin. Her bir kuyucuğa 150 μL 1x RIPA tamponu ve 50 μL 4x SDS ekleyin.
- Her bir kuyucuk için, lize hücreleri toplamak için karışımı yukarı ve aşağı pipetleyin. Pipetleme sırasında, hücreleri bozmak için pipet ucu ile kuyunun dibini de kazıyın. Kazıma ve pipetlemeden sonra, protein lizatını etiketli 1,5 mL tüplere toplayın.
- Tüm tüpleri 12 dakika boyunca 100 ° C'ye ısıtmak için bir ısı bloğu kullanın.
- Çözünmeyen her türlü bileşeni oda sıcaklığında 30 s için 14.500 × g'da santrifüj yaparak pelet edin.
NOT: Bu bir duraklama noktasıdır – protein lizatları hemen kullanılabilir veya kullanıma hazır olana kadar -20 ° C veya -80 ° C'de saklanabilir.
7. Yukarıdaki adımları izleyerek BMDM'lerden veya doku homojenatlarından toplanan lizatları kullanarak batı lekelenmesinin yapılması
NOT: Doku kullanılıyorsa, elle veya güç tahrikli bir doku homojenizatörü aracılığıyla homojenize edilebilir. Simpson76 protokolü, doku homojenizasyonunun ayrıntılı bir tanımını sağlar.
- 1x çalışan tampon hazırlayın: 5x çalışan tampon stoğunun 200 mL'sini (Tablo 1) ve 800 mL deiyonize suyu birleştirin. Bu 1x çalışan arabelleği her denemeden hemen önce yapın.
- Elektroforez aparatını 10 kuyucuklu% 12 (ağırlık / hacim) poliakrilamid jel ile hazırlayın. Elektroforez aparatını 1x çalışma tamponu ile doldurun. Ardından, jel tarağını çıkarın.
NOT: Her numune için kaspaz-1, kaspaz-11, kaspaz-3, kaspaz-7, kaspaz-8 ve kaspaz-9'u analiz etmek için altı jele ihtiyaç duyulacaktır. - Kaspaz-1, kaspaz-3, kaspaz-7 ve kaspaz-8 lekeleri için, kaspaz lizis tamponunda veya doku homojenatında kombine süpernatant ve protein lizatının 30 μL'sini kullanmayı planlayın. Kaspaz-11 ve kaspaz-9 lekeleri için, RIPA tamponunda veya doku homojenatında 20 μL protein lizatı kullanmayı planlayın. Numuneler -20 ° C veya -80 ° C'de depolanmışsa, önce onları buz üzerinde çözün.
- Tüm numuneler için, yüklemeden önce 5 dakika boyunca 100 °C'ye ısıtın ve 4 °C'de 30 s için 14.500 × g'da santrifüj yapın. Ardından, numunenin 20 veya 30 μL'sini yavaşça her şeride yükleyin. Diğer şeritlere herhangi bir numune taşmasından kaçının. Altı kaspazın tümünü aynı anda değerlendirmek için, uygun numuneleri altı jelin her birine yüklemek için aynı prosedürü kullanın.
- Elektroforez aparatını güç kaynağına bağlayın. Ardından, jel çalışmasına başlamak için gücü 20 dakika boyunca 80 V'a ayarlayın ve ardından gücü 45-60 dakika boyunca 130 V'a ayarlayın.
- Boya önünü dikkatlice izleyin ve boya cephesi jelin altındayken ancak jelden henüz itilmediğinde gücü kapatın.
- Jel çalışırken, 700 mL deiyonize su, 100x transfer tamponu stoğunun 100 mL'sini (Tablo 1) ve 200 mL metanolü birleştirerek 1x transfer tamponu hazırlayın. 1x çözümünü her seferinde taze yapın.
NOT: Metanol yanıcı olduğundan dikkatli olun. Transfer tamponu hazırlığını açık alevlerden uzakta gerçekleştirin. - Jel sökücüyü kullanarak jeli elektroforez aparatından nazikçe çıkarın.
- Her jel için bir transfer yığını ayarlayın.
- Bir PVDF membranını 1 dakika boyunca metanole batırarak aktive edin.
- İki parça filtre kağıdını, jeli ve PVDF membranını transfer tamponunda 5 dakika önceden ıslatın. PVDF membranını ve jelini bu 5 dakikalık inkübasyon sırasında ayrı kaplarda saklayın.
- Transfer yığınını yarı kuru sistem üzerine monte edin. Alt platin anot tarafından başlayarak, bir parça filtre kağıdı, PVDF membranı, jel ve son olarak bir parça filtre kağıdı yerleştirin. Hava kabarcıklarını katmanlar arasında yavaşça yuvarlayın veya bastırın ve sistemin üst kısmını kapatın. Daha fazla ilerlemeden önce güvenlik kapağının sabitlendiğinden emin olun.
- Güç kaynağına bağlayın. Gücü 45 dakika boyunca 25 V'a ayarlayın.
- Transfer tamamlandıktan sonra, transfer yığınını sökün ve membranı toplayın; kare bir Petri kabına (kuluçka tepsisi) yerleştirin.
- %5 (ağırlık/hacim) yağsız süt çözeltisinin 15 mL'sini ekleyerek membran blokajı gerçekleştirin (Tablo 1). Membranı sallanan bir çalkalayıcı üzerinde 1 saat boyunca oda sıcaklığında 50 rpm ila 70 rpm'de inkübe edin.
NOT: Bu bir duraklama noktasıdır – membran 1 saat sonra çıkarılabilir veya gece boyunca 4 °C'de bloke edici çözeltide saklanabilir. - 1 saat veya gece boyunca inkübasyondan sonra, bloke edici çözeltiyi çıkarın. Seyreltilmiş antikor çözeltisinden 10 mL (anti-kaspaz-1 antikoru, anti-kaspaz-11 antikoru, kombine anti-kaspaz-3 ve anti-yarıklı kaspaz-3 antikoru, kombine anti-kaspaz-7 ve anti-yarıklı kaspaz-7 antikoru, kombine anti-kaspaz-8 ve anti-yarıklanmış kaspaz-8 antikoru veya anti-kaspaz-9 antikoru) ekleyin (Tablo 1). Oda sıcaklığında 2 saat veya gece boyunca 4 ° C'de (16 saat) inkübe etmek için 50 rpm ila 70 rpm'de sallanan bir çalkalayıcıya yerleştirin.
- Antikor çözeltisini toplayın (3x'e kadar tekrar kullanın veya atın) ve 10 dakika boyunca oda sıcaklığında 50 rpm ila 70 rpm'de sallanan bir çalkalayıcı üzerindeki membrana 15 mL TBST (Tablo 1) ekleyerek yıkayın. TBST'yi atın.
- 14. adımı takiben yıkamayı 15 mL TBST ile toplam 3 kat tekrarlayın.
- Seyreltilmiş sekonder HRP-konjuge antikor çözeltisinin 10 mL'sini ekleyin (kaspaz-3, kaspaz-7, kaspaz-8 veya kaspaz-9'a karşı primer antikorlarla boyanmış lekeler için anti-tavşan; kaspaz-1'e karşı birincil antikor ile boyanmış lekeler için anti-fare; kaspaz-11'e karşı birincil antikor ile boyanmış lekeler için anti-fare) (Tablo 1). 1 saat boyunca oda sıcaklığında 50 rpm ila 70 rpm'de sallanan bir çalkalayıcı üzerinde kuluçkaya yatırın.
- Antikor çözeltisini çıkarın ve membrana 15 mL TBST ekleyerek 50 rpm ila 70 rpm'de oda sıcaklığında 10 dakika boyunca sallanan bir çalkalayıcı üzerinde yıkayın. TBST'yi atın.
- Yıkamayı 17. adımı takiben 15 mL TBST ile toplam 3 kat tekrarlayın.
- Membrana 10 mL'lik yüksek hassasiyetli HRP substratı ekleyin. Karanlıkta oda sıcaklığında 1 dakika bekletin.
- Membranı substrattan çıkarın. Aksesuar beyaz trans tepsisi alt konuma yerleştirilmiş bir kemilüminesans görüntüleyici kullanarak doğrudan görüntülemeye devam edin. Otomatik pozlama modunu kullanarak membranı pozlayın (genellikle ~ 1-2 dakikalık pozlama süresi).
- Kaspaz-9 veya kaspaz-11 lekelenmesinden membranı kullanarak (yani, RIPA lizat numuneleri içeren bir membran), 10 mL sıyırma tamponu ekleyin ve 5 dakika boyunca oda sıcaklığında 50 rpm ila 70 rpm'de sallanan bir çalkalayıcı üzerinde inkübe edin.
- Sıyırma tamponunu atın ve membrana 15 mL TBST ekleyerek 50 rpm ila 70 rpm'de oda sıcaklığında 10 dakika boyunca sallanan bir çalkalayıcı üzerinde yıkayın. TBST'yi atın.
- 22. adımı takiben yıkamayı 15 mL TBST ile toplam 3x tekrarlayın.
- 15 mL'lik %5 (ağırlık/hacim) yağsız süt çözeltisi ekleyerek membran blokajı gerçekleştirin. Membranı sallanan bir çalkalayıcı üzerinde 1 saat boyunca oda sıcaklığında 50 rpm ila 70 rpm'de inkübe edin.
NOT: Bu bir duraklama noktasıdır – membran 1 saat sonra çıkarılabilir veya gece boyunca 4 °C'de bloke edici çözeltide saklanabilir. - 1 saat veya gece boyunca inkübasyondan sonra, bloke edici çözeltiyi çıkarın. Seyreltilmiş anti-β-aktin (HRP-konjuge edilmiş) antikor çözeltisinden 10 mL ekleyin. Oda sıcaklığında 1,5 saat boyunca inkübe etmek için 50 rpm ila 70 rpm'de sallanan bir çalkalayıcıya yerleştirin.
- Antikor çözeltisini çıkarın ve membrana 15 mL TBST ekleyerek 50 rpm ila 70 rpm'de oda sıcaklığında 10 dakika boyunca sallanan bir çalkalayıcı üzerinde yıkayın. TBST'yi atın.
- Yıkamayı, adım 26'yı takiben 15 mL TBST ile toplam 3x tekrarlayın.
- Membrana 10 mL standart hassasiyetli HRP substratı ekleyin. Karanlıkta oda sıcaklığında 1 dakika bekletin.
- Aksesuar beyaz trans tepsisi alt konuma yerleştirilmiş bir kemilüminesans görüntüleyici kullanarak doğrudan görüntülemeye devam edin. Otomatik pozlama modunu kullanarak membranı pozlayın (genellikle <1 dakikalık pozlama süresi).
Sonuçlar
PANoptoz, çok sayıda bakteriyel, viral ve fungal enfeksiyona ve diğer enflamatuar uyaranlara ve ayrıca kanser hücrelerinde 44,48,49,50,51,52,53,54,56,57,58,60,61,62 yanıt olarak gözlenmiştir.
Tartışmalar
Kaspaz bölünmesi ve aktivasyonunun izlenmesi, doğuştan gelen immün yanıtın bir parçası olarak doğuştan gelen immün PCD aktivasyonunun en kapsamlı resimlerinden birini sağlar. Burada açıklanan protokol, IAV, HSV1 ve F. novicida...
Açıklamalar
T.-D.K. Pfizer'in danışmanıdır.
Teşekkürler
Kanneganti laboratuvarı üyelerine yorum ve önerileri için teşekkür ederiz ve bilimsel düzenleme desteği için J. Gullett, PhD'ye teşekkür ederiz. Laboratuvarımızdaki çalışmalar Ulusal Sağlık Enstitüleri (NIH) tarafından AI101935, AI124346, AI160179, AR056296 ve CA253095 (T.-D.K.) ve Amerikan Lübnan Suriye İlişkili Hayır Kurumları (T.-D.K.) tarafından desteklenmektedir. İçerik yalnızca yazarların sorumluluğundadır ve Ulusal Sağlık Enstitüleri'nin resmi görüşlerini temsil etmek zorunda değildir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | Millipore | SCHVU05RE | |
| 10 mL syringe | BD Biosciences | 309604 | |
| 12% polyacrylamide gel with 10 wells | Bio-Rad | 4561043 | |
| 12-well plate | Corning | 07-200-82 | |
| 18 G needle | BD Biosciences | 305195 | |
| 25 G needle | BD Biosciences | 305122 | |
| 50 mL tube | Fisher Scientific | 50-809-218 | |
| 70 μm cell strainer | Corning | 431751 | |
| 150 mm tissue culture dishes | Corning | 430597 | |
| 182-cm2 tissue culture flask | Genesee Scientific | 25-211 | |
| Accessory white trans tray | Cytiva | 29-0834-18 | |
| Anti–caspase-1 antibody | AdipoGen | AG-20B-0042-C100 | |
| Anti–caspase-11 antibody | Novus Biologicals | NB120-10454 | |
| Anti–caspase-3 antibody | Cell Signaling Technology | 9662 | |
| Anti–caspase-7 antibody | Cell Signaling Technology | 9492 | |
| Anti–caspase-8 antibody | Cell Signaling Technology | 4927 | |
| Anti–caspase-9 antibody | Cell Signaling Technology | 9504 | |
| Anti–cleaved caspase-3 antibody | Cell Signaling Technology | 9661 | |
| Anti–cleaved caspase-7 antibody | Cell Signaling Technology | 9491 | |
| Anti–cleaved caspase-8 antibody | Cell Signaling Technology | 8592 | |
| Anti-mouse HRP-conjugated secondary antibody | Jackson ImmunoResearch Laboratories | 315-035-047 | |
| Anti-rabbit HRP-conjugated secondary antibody | Jackson ImmunoResearch Laboratories | 111-035-047 | |
| Anti-rat HRP-conjugated secondary antibody | Jackson ImmunoResearch Laboratories | 112-035-003 | |
| Anti–β-Actin antibody (C4) HRP | Santa Cruz | sc-47778 HRP | |
| ATP | InvivoGen | tlrl-atpl | |
| BBL Trypticase Soy Broth | BD Biosciences | 211768 | |
| Bead bath | Chemglass Life Sciences | CLS-4598-009 | |
| Biophotometer D30 | Eppendorf | 6133000010 | |
| BME | Sigma | M6250 | |
| Bromophenol blue | Sigma | BO126 | |
| Cell scrapers | CellTreat Scientific Products | 229315 | |
| Chemiluminescence imager (Amersham 600) | Cytiva | 29083461 | |
| CO2 chamber | VetEquip | 901703 | |
| Cuvettes | Fisher Scientific | 14-955-129 | |
| Dissecting scissors | Thermo Fisher Scientific | 221S | |
| DMEM | Thermo Fisher Scientific | 11995-073 | |
| DTT | Sigma | 43815 | |
| Eelectrophoresis apparatus | Bio-Rad | 1658004 | |
| Ethanol | Pharmco | 111000200 | |
| Fetal bovine serum | Biowest | S1620 | |
| Filter paper | Bio-Rad | 1703965 | |
| Forceps | Fisher Scientific | 22-327379 | |
| Francisella novicida (U112 strain) | BEI Resources | NR-13 | |
| Gel releaser | Bio-Rad | 1653320 | |
| Gentamycin | Gibco | 15750060 | |
| Glycerol | Sigma | G7893 | |
| Glycine | Sigma | G8898 | |
| HCl | Sigma | H9892 | |
| Heat block | Fisher Scientific | 23-043-160 | |
| Herpes simplex virus 1 (HF strain) | ATCC | VR-260 | |
| High glucose DMEM | Sigma | D6171 | |
| Human anti–caspase-1 antibody | R&D Systems | MAB6215 | |
| Human anti–caspase-8 antibody | Enzo | ALX-804-242 | |
| Humidified incubator | Thermo Fisher Scientific | 51026282 | |
| Image analysis software | ImageJ | v1.53a | |
| IMDM | Thermo Fisher Scientific | 12440-053 | |
| Influenza A virus (A/Puerto Rico/8/34, H1N1 [PR8]) | constructed per Hoffmann et al. | ||
| L929 cells | ATCC | CCL-1 | cell line for creating L929-conditioned media |
| L-cysteine | Thermo Fisher Scientific | BP376-100 | |
| Luminata Forte Western HRP substrate | Millipore | WBLUF0500 | standard-sensitivity HRP substrate |
| MDCK cells | ATCC | CCL-34 | cell line for determining IAV viral titer |
| Methanol | Sigma | 322415 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002401 | |
| Non-essential amino acids | Gibco | 11140050 | |
| Nonfat dried milk powder | Kroger | ||
| NP-40 solution | Sigma | 492016 | |
| PBS | Thermo Fisher Scientific | 10010023 | |
| Penicillin and streptomycin | Sigma | P4333 | |
| Petri dish | Fisher Scientific | 07-202-011 | |
| PhosSTOP | Roche | PHOSS-RO | |
| Power source | Bio-Rad | 164-5052 | |
| Protease inhibitor tablet | Sigma | S8820 | |
| PVDF membrane | Millipore | IPVH00010 | |
| Rocking shaker | Labnet | S2035-E | |
| SDS | Sigma | L3771 | |
| Sodium chloride | Sigma | S9888 | |
| Sodium deoxycholate | Sigma | 30970 | |
| Sodium hydroxide | Sigma | 72068 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Square Petri dish | Fisher Scientific | FB0875711A | |
| Stripping buffer | Thermo Fisher Scientific | 21059 | |
| Super Signal Femto HRP substrate | Thermo Fisher Scientific | 34580 | high-sensitivity HRP substrate |
| Tabletop centrifuge | Thermo Fisher Scientific | 75004524 | |
| Trans-Blot semi-dry system | Bio-Rad | 170-3940 | |
| Tris | Sigma | TRIS-RO | |
| Tween 20 | Sigma | P1379 | |
| Ultrapure lipopolysaccharide (LPS) from E. coli 0111:B4 | InvivoGen | tlrl-3pelps | |
| Vero cells | ATCC | CCL-81 | cell line for determining HSV1 viral titer |
Referanslar
- Alnemri, E. S., et al. Human ICE/CED-3 protease nomenclature. Cell. 87 (2), 171 (1996).
- Man, S. M., Kanneganti, T. D. Converging roles of caspases in inflammasome activation, cell death and innate immunity. Nature Reviews Immunology. 16 (1), 7-21 (2016).
- Gullett, J. M., Tweedell, R. E., Kanneganti, T. D. It's all in the PAN: Crosstalk, plasticity, redundancies, switches, and interconnectedness encompassed by PANoptosis underlying the totality of cell death-associated biological effects. Cells. 11 (9), 1495 (2022).
- Pandian, N., Kanneganti, T. D. PANoptosis: A unique innate immune inflammatory cell death modality. Journal of Immunology. 209 (9), 1625-1633 (2022).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Shi, Y. Caspase activation: Revisiting the induced proximity model. Cell. 117 (7), 855-858 (2004).
- Galluzzi, L., Lopez-Soto, A., Kumar, S., Kroemer, G. Caspases connect cell-death signaling to organismal homeostasis. Immunity. 44 (2), 221-231 (2016).
- Fernandes-Alnemri, T., Litwack, G., Alnemri, E. S. CPP32, a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1 beta-converting enzyme. Journal of Biological Chemistry. 269 (49), 30761-30764 (1994).
- Tewari, M., et al. Yama/CPP32 beta, a mammalian homolog of CED-3, is a CrmA-inhibitable protease that cleaves the death substrate poly(ADP-ribose) polymerase. Cell. 81 (5), 801-809 (1995).
- Nicholson, D. W., et al. Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis. Nature. 376 (6535), 37-43 (1995).
- Stennicke, H. R., et al. Pro-caspase-3 is a major physiologic target of caspase-8. Journal of Biological Chemistry. 273 (42), 27084-27090 (1998).
- Twiddy, D., Cohen, G. M., Macfarlane, M., Cain, K. Caspase-7 is directly activated by the approximately 700-kDa apoptosome complex and is released as a stable XIAP-caspase-7 approximately 200-kDa complex. Journal of Biological Chemistry. 281 (7), 3876-3888 (2006).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. D. Caspases in cell death, inflammation, and pyroptosis. Annual Reviews of Immunology. 38, 567-595 (2020).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British Journal of Cancer. 26 (4), 239-257 (1972).
- Taylor, R. C., Cullen, S. P., Martin, S. J. Apoptosis: Controlled demolition at the cellular level. Nature Reviews Molecular Cell Biology. 9 (3), 231-241 (2008).
- Morioka, S., Maueröder, C., Ravichandran, K. S. Living on the edge: Efferocytosis at the interface of homeostasis and pathology. Immunity. 50 (5), 1149-1162 (2019).
- Wang, Y., et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin. Nature. 547 (7661), 99-103 (2017).
- Rogers, C., et al. Cleavage of DFNA5 by caspase-3 during apoptosis mediates progression to secondary necrotic/pyroptotic cell death. Nature Communications. 8, 14128 (2017).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., Gao, W., Shao, F. Pyroptosis: Gasdermin-mediated programmed necrotic cell death. Trends in Biochemical Sciences. 42 (4), 245-254 (2017).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Aglietti, R. A., et al. GsdmD p30 elicited by caspase-11 during pyroptosis forms pores in membranes. Proceedings of the National Academy of Sciences of the United States of America. 113 (28), 7858-7863 (2016).
- Hagar, J. A., Powell, D. A., Aachoui, Y., Ernst, R. K., Miao, E. A. Cytoplasmic LPS activates caspase-11: implications in TLR4-independent endotoxic shock. Science. 341 (6151), 1250-1253 (2013).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Lamkanfi, M., et al. Targeted peptidecentric proteomics reveals caspase-7 as a substrate of the caspase-1 inflammasomes. Molecular & Cellular Proteomics. 7 (12), 2350-2363 (2008).
- Kalai, M., et al. Tipping the balance between necrosis and apoptosis in human and murine cells treated with interferon and dsRNA. Cell Death & Differentiation. 9 (9), 981-994 (2002).
- Li, C., et al. Development of atopic dermatitis-like skin disease from the chronic loss of epidermal caspase-8. Proceedings of the National Academy of Sciences of the United States of America. 107 (51), 22249-22254 (2010).
- Kovalenko, A., et al. Caspase-8 deficiency in epidermal keratinocytes triggers an inflammatory skin disease. Journal of Experimental Medicine. 206 (10), 2161-2177 (2009).
- Kang, T. B., et al. Caspase-8 serves both apoptotic and nonapoptotic roles. Journal of Immunology. 173 (5), 2976-2984 (2004).
- Oberst, A., et al. Catalytic activity of the caspase-8-FLIP(L) complex inhibits RIPK3-dependent necrosis. Nature. 471 (7338), 363-367 (2011).
- Kaiser, W. J., et al. RIP3 mediates the embryonic lethality of caspase-8-deficient mice. Nature. 471 (7338), 368-372 (2011).
- Zhang, H., et al. Functional complementation between FADD and RIP1 in embryos and lymphocytes. Nature. 471 (7338), 373-376 (2011).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Hitomi, J., et al. Identification of a molecular signaling network that regulates a cellular necrotic cell death pathway. Cell. 135 (7), 1311-1323 (2008).
- Malireddi, R. K., Ippagunta, S., Lamkanfi, M., Kanneganti, T. D. Cutting edge: Proteolytic inactivation of poly(ADP-ribose) polymerase 1 by the Nlrp3 and Nlrc4 inflammasomes. Journal of Immunology. 185 (6), 3127-3130 (2010).
- Tsuchiya, K., et al. Caspase-1 initiates apoptosis in the absence of gasdermin D. Nature Communications. 10 (1), (2019).
- Taabazuing, C. Y., Okondo, M. C., Bachovchin, D. A. Pyroptosis and apoptosis pathways engage in bidirectional crosstalk in monocytes and macrophages. Cell Chemical Biology. 24 (4), 507-514 (2017).
- Gurung, P., et al. FADD and caspase-8 mediate priming and activation of the canonical and noncanonical Nlrp3 inflammasomes. Journal of Immunology. 192 (4), 1835-1846 (2014).
- Man, S. M., et al. Inflammasome activation causes dual recruitment of NLRC4 and NLRP3 to the same macromolecular complex. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7403-7408 (2014).
- Man, S. M., et al. Salmonella infection induces recruitment of Caspase-8 to the inflammasome to modulate IL-1beta production. Journal of Immunology. 191 (10), 5239-5246 (2013).
- Van Opdenbosch, N., et al. Caspase-1 engagement and TLR-induced c-FLIP expression suppress ASC/caspase-8-dependent apoptosis by inflammasome sensors NLRP1b and NLRC4. Cell Reports. 21 (12), 3427-3444 (2017).
- Pierini, R., et al. AIM2/ASC triggers caspase-8-dependent apoptosis in Francisella-infected caspase-1-deficient macrophages. Cell Death & Differentiation. 19 (10), 1709-1721 (2012).
- Lee, S., et al. AIM2 forms a complex with pyrin and ZBP1 to drive PANoptosis and host defence. Nature. 597 (7876), 415-419 (2021).
- Sagulenko, V., et al. AIM2 and NLRP3 inflammasomes activate both apoptotic and pyroptotic death pathways via ASC. Cell Death & Differentiation. 20 (9), 1149-1160 (2013).
- Lukens, J. R., et al. Dietary modulation of the microbiome affects autoinflammatory disease. Nature. 516 (7530), 246-249 (2014).
- Gurung, P., Burton, A., Kanneganti, T. D. NLRP3 inflammasome plays a redundant role with caspase 8 to promote IL-1beta-mediated osteomyelitis. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 4452-4457 (2016).
- Kuriakose, T., et al. ZBP1/DAI is an innate sensor of influenza virus triggering the NLRP3 inflammasome and programmed cell death pathways. Science Immunology. 1 (2), (2016).
- Malireddi, R. K. S., et al. TAK1 restricts spontaneous NLRP3 activation and cell death to control myeloid proliferation. Journal of Experimental Medicine. 215 (4), 1023-1034 (2018).
- Malireddi, R. K. S., et al. Innate immune priming in the absence of TAK1 drives RIPK1 kinase activity-independent pyroptosis, apoptosis, necroptosis, and inflammatory disease. Journal of Experimental Medicine. 217 (3), (2020).
- Christgen, S., et al. Identification of the PANoptosome: A molecular platform triggering pyroptosis, apoptosis, and necroptosis (PANoptosis). Frontiers in Cellular and Infection Microbiology. 10, 237 (2020).
- Malireddi, R. K. S., et al. RIPK1 distinctly regulates Yersinia-induced inflammatory cell death, PANoptosis. Immunohorizons. 4 (12), 789-796 (2020).
- Zheng, M., Karki, R., Vogel, P., Kanneganti, T. D. Caspase-6 is a key regulator of innate immunity, inflammasome activation, and host defense. Cell. 181 (3), 674-687 (2020).
- Karki, R., et al. ADAR1 restricts ZBP1-mediated immune response and PANoptosis to promote tumorigenesis. Cell Reports. 37 (3), 109858 (2021).
- Wang, Y., et al. Single cell analysis of PANoptosome cell death complexes through an expansion microscopy method. Cellular and Molecular Life Sciences. 79 (10), 531 (2022).
- Malireddi, R. K. S., et al. Inflammatory cell death, PANoptosis, mediated by cytokines in diverse cancer lineages inhibits tumor growth. Immunohorizons. 5 (7), 568-580 (2021).
- Kesavardhana, S., et al. The Zα2 domain of ZBP1 is a molecular switch regulating influenza-induced PANoptosis and perinatal lethality during development. Journal of Biological Chemistry. 295 (24), 8325-8330 (2020).
- Banoth, B., et al. ZBP1 promotes fungi-induced inflammasome activation and pyroptosis, apoptosis, and necroptosis (PANoptosis). Journal of Biological Chemistry. 295 (52), 18276-18283 (2020).
- Karki, R., et al. Interferon regulatory factor 1 regulates PANoptosis to prevent colorectal cancer. JCI Insight. 5 (12), 136720 (2020).
- Zheng, M., et al. Impaired NLRP3 inflammasome activation/pyroptosis leads to robust inflammatory cell death via caspase-8/RIPK3 during coronavirus infection. Journal of Biological Chemistry. 295 (41), 14040-14052 (2020).
- Karki, R., et al. Synergism of TNF-α and IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes. Cell. 184 (1), 149-168 (2021).
- Karki, R., et al. ZBP1-dependent inflammatory cell death, PANoptosis, and cytokine storm disrupt IFN therapeutic efficacy during coronavirus infection. Science Immunology. 7 (74), (2022).
- Jiang, W., Deng, Z., Dai, X., Zhao, W. PANoptosis: A new insight into oral infectious diseases. Frontiers in Immunology. 12, 789610 (2021).
- Chi, D., et al. Real-time induction of macrophage apoptosis, pyroptosis, and necroptosis by Enterococcus faecalis OG1RF and two root canal isolated strains. Frontiers in Cellular and Infection Microbiology. 11, 720147 (2021).
- Lin, J. F., et al. Phosphorylated NFS1 weakens oxaliplatin-based chemosensitivity of colorectal cancer by preventing PANoptosis. Signal Transduction and Targeted Therapy. 7 (1), 54 (2022).
- Song, M., et al. Self-assembled polymeric nanocarrier-mediated co-delivery of metformin and doxorubicin for melanoma therapy. Drug Delivery. 28 (1), 594-606 (2021).
- Boucher, D., Chan, A., Ross, C., Schroder, K. Quantifying caspase-1 activity in murine macrophages. Methods in Molecular Biology. 1725, 163-176 (2018).
- Boucher, D., Duclos, C., Denault, J. B. General in vitro caspase assay procedures. Methods in Molecular Biology. 1133, 3-39 (2014).
- Kaushal, V., Herzog, C., Haun, R. S., Kaushal, G. P. Caspase protocols in mice. Methods in Molecular Biology. 1133, 141-154 (2014).
- Swacha, P., Gekara, N. O., Erttmann, S. F. Biochemical and microscopic analysis of inflammasome complex formation. Methods in Enzymology. 625, 287-298 (2019).
- Talley, S., et al. A caspase-1 biosensor to monitor the progression of inflammation in vivo. Journal of Immunology. 203 (9), 2497-2507 (2019).
- Pelegrin, P., Barroso-Gutierrez, C., Surprenant, A. P2X7 receptor differentially couples to distinct release pathways for IL-1beta in mouse macrophage. Journal of Immunology. 180 (11), 7147-7157 (2008).
- Yu, J. W., et al. Cryopyrin and pyrin activate caspase-1, but not NF-kappaB, via ASC oligomerization. Cell Death & Differentiation. 13 (2), 236-249 (2006).
- Henry, C. M., Martin, S. J. Caspase-8 acts in a non-enzymatic role as a scaffold for assembly of a pro-inflammatory "FADDosome" complex upon TRAIL stimulation. Molecular Cell. 65 (4), 715-729 (2017).
- Hoffmann, E., Neumann, G., Kawaoka, Y., Hobom, G., Webster, R. G. A DNA transfection system for generation of influenza A virus from eight plasmids. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 6108-6113 (2000).
- Simpson, R. J. Homogenization of mammalian tissue. Cold Spring Harbor Protocols. (7), (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır