A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج تأثير الغضروف القابل للتكرار لتوليد هشاشة العظام بعد الصدمة في الأرنب
* These authors contributed equally
In This Article
Summary
يمكن الاعتماد على نموذج تأثير اللقمة الفخذية الإنسية المفتوحة في الأرانب لدراسة هشاشة العظام بعد الصدمة (PTOA) والاستراتيجيات العلاجية الجديدة للتخفيف من تطور PTOA. يولد هذا البروتوكول عيبا غضروفيا معزولا في اللقمة الفخذية الإنسية الخلفية في الأرانب باستخدام برج إسقاط قائم على العربة برأس صدم.
Abstract
هشاشة العظام بعد الصدمة (PTOA) مسؤولة عن 12٪ من جميع حالات هشاشة العظام في الولايات المتحدة. يمكن أن يبدأ PTOA بحدث صادم واحد ، مثل الحمل عالي التأثير الذي يعمل على الغضروف المفصلي ، أو عن طريق عدم استقرار المفصل ، كما يحدث مع تمزق الرباط الصليبي الأمامي. لا توجد علاجات فعالة لمنع PTOA حاليا. يعد تطوير نموذج حيواني موثوق به ل PTOA أمرا ضروريا لفهم الآليات التي يستمر بها تلف الغضروف بشكل أفضل والتحقيق في استراتيجيات العلاج الجديدة للتخفيف من تطور PTOA. يصف هذا البروتوكول نموذج تأثير لقمة الفخذ الأرنب المفتوح القائم على برج الإسقاط للحث على تلف الغضروف. قدم هذا الطراز أحمال ذروة تبلغ 579.1 ± 71.1 نيوتن ، وضغوط ذروة تبلغ 81.9 ± 10.1 ميجا باسكال مع حمل من الوقت إلى الذروة يبلغ 2.4 ± 0.5 مللي ثانية. كان للغضروف المفصلي من اللقمة الفخذية الإنسية المتأثرة (MFCs) معدلات أعلى من الخلايا المبرمج (p = 0.0058) ويمتلك درجات أعلى في الجمعية الدولية لأبحاث هشاشة العظام (OARSI) تبلغ 3.38 ± 1.43 مقارنة ب MFCs المقابلة غير المتأثرة (0.56 ± 0.42) ، وأسطح الغضاريف الأخرى للركبة المتأثرة (p < 0.0001). لم يتم الكشف عن فروق في درجات OARSI بين الأسطح المفصلية غير المتأثرة (p > 0.05).
Introduction
يعد الفصال العظمي التالي للصدمة (PTOA) سببا رئيسيا للإعاقة في جميع أنحاء العالم ، ويمثل 12٪ -16٪ من هشاشة العظام المصحوبة بأعراض (OA) 1. المعيار الذهبي الحالي لإدارة هشاشة العظام في المرحلة النهائية هو رأب مفاصل الركبةوالورك الكلي 2 أو إيثاق المفصل ، كما في حالة التهاب المفاصل الظنبوبي أو تحت الكاحل في المرحلة النهائية. على الرغم من نجاحه إلى حد كبير ، إلا أن تقويم المفاصل يمكن أن يكون له مضاعفات مكلفة ومرضية3. بالإضافة إلى ذلك ، فإن تقويم المفاصل أقل رغبة في المرضى الذين تقل أعمارهم عن 50 عاما ، نظرا لانخفاض معدل بقاء الزرع الخالي من المراجعة بنسبة 77٪ -83٪ 4,5. حاليا ، لا توجد علاجات معتمدة من إدارة الغذاء والدواء لمنع أو تخفيف تطور PTOA.
يؤثر PTOA على المفصل بأكمله ، بما في ذلك النسيج الزليلي والعظم تحت الغضروف والغضروف المفصلي. يتميز بتنكس الغضروف المفصلي ، والالتهاب الزليلي ، وإعادة تشكيل العظام تحت الغضروف ، وتشكيل النابتات العظمية 6,7. يتطور النمط الظاهري ل PTOA عبر عملية معقدة من التفاعل بين الغضروف والغشاء الزليلي والعظم تحت الغضروف. الفهم الحالي هو أن إصابة الغضروف تؤدي إلى تحرير مكونات المصفوفة خارج الخلية (ECM) مثل الكولاجين من النوع 2 (COL2) و aggrecan (ACAN). شظايا مكونات ECM هذه مؤيدة للالتهابات وتسبب زيادة إنتاج IL-6 و IL-1β وأنواع الأكسجين التفاعلية. يعمل هؤلاء الوسطاء على الخلايا الغضروفية ، مما يتسبب في زيادة تنظيم مصفوفة البروتينات المعدنية (MMPs) ، مثل MMP-13 ، التي تؤدي إلى تدهور الغضروف المفصلي مع تقليل تخليق المصفوفة أيضا ، مما يؤدي إلى بيئة تقويضية شاملة للغضروف المفصلي8. بالإضافة إلى ذلك ، هناك أدلة على زيادة موت الخلايا الغضروفية المبرمج في هشاشة العظام الأولية و PTOA9،10. يحدث خلل الميتوكوندريا بعد التحميل فوق الفسيولوجي للغضروف11،12،13،14 ، مما قد يؤدي إلى زيادة موت الخلايا الغضروفية12،15. ارتبط موت الخلايا الغضروفية المحسن بزيادة استنفاد البروتيوغليكان وهدم الغضروف وقد ثبت أنه يسبق التغيرات في الغضروف وإعادة تشكيل العظام تحت الغضروف16،17،18.
كما هو الحال مع معظم الأمراض البشرية ، هناك حاجة إلى نماذج موثوقة ومتعدية من PTOA لزيادة فهم الفيزيولوجيا المرضية للمرض واختبار علاجات جديدة. تم استخدام الكبيرة مثل الخنازير والأنياب في نماذج الكسر والتأثير داخل المفصل ل PTOA17,19 ، لكنها مكلفة. النماذج الحيوانية الأصغر ، مثل الفئران والجرذان والأرانب أقل تكلفة وتستخدم لدراسة PTOA الناتجة عن زعزعة استقرار المفاصل ، والتي تتضمن عادة الاستئصال الجراحي للرباط الصليبي الأمامي (ACL) و / أو تعطيل الغضروف المفصلي الإنسي20،21،22،23،24،25. على الرغم من أن صدمة المفاصل يمكن أن تؤدي إلى عواقب مختلفة ، بما في ذلك إصابة الرباط26 ، إلا أن الحمل الزائد الميكانيكي للغضروف يحدث في جميع الحالات تقريبا.
هناك أدلة ناشئة على أن علم الأمراض وراء تطور PTOA بعد عدم استقرار الرباط (كما هو الحال في استئصال الرباط الصليبي الأمامي) وإصابة الغضروف الحادة يرجع إلى آليات متميزة27. لذلك ، من المهم تطوير نماذج للإصابة المباشرة بالغضروف. يوجد حاليا عدد محدود من نماذج التأثير التي تولد إصابة عظمية غضروفية أو غضروفية في الجرذان والفئران28,29. ومع ذلك ، فإن غضروف الفئران ليس مناسبا تماما لتوليد عيوب غضروفية معزولة. وذلك لأن الغضروف المفصلي للفأر يبلغ سمكه 3-5 طبقات خلايا فقط ويفتقر إلى مناطق الغضاريف السطحية والشعاعية والانتقالية المنظمة ، بالإضافة إلى طبقة الغضروف المتكلسة السميكة الموجودة في البشر الكبيرة. تعرض نماذج الفئران أيضا دقة تلقائية لعيوب الغضروف الجزئي30,31. ومن ثم ، اخترنا الأرنب لنموذج الارتطام هذا لأن سمك الغضروف وتنظيمه متشابهان مع تلك الخاصة بالبشر ، وهو أصغر نموذج حيواني سيسمح بتوصيل تأثير غضروفي متسق ينتج عنه PTOA. استخدمت النماذج الجراحية المفتوحة السابقة لتأثير اللقمة الفخذية في الأرنب البندول32 ، وجهاز انحشار الغضروف المحمول بنابض 33 ، وبرج الإسقاط الذي سمح بإنشاء تصادم خاص بالأرانب34. ومع ذلك ، تفتقر هذه الدراسات إلى البيانات في الجسم الحي. أبلغ آخرون عن بيانات في الجسم الحي باستخدام أجهزةالتأثير 35 القائمة على البندول ، والهوائية36 ، و37 المحملة بنابض10 ، وتظهر هذه الدراسات معدلا مرتفعا من التباين في ذروة الإجهاد ومعدلات التحميل بين الطرق. ومع ذلك ، يفتقر المجال إلى نهج ثابت لنمذجة صدمة الغضروف الحادة بشكل موثوق في الجسم الحي.
يستخدم البروتوكول الحالي نظاما قائما على برج الإسقاط لتقديم تأثير ثابت على اللقمة الإنسية الخلفية لركبة الأرنب. يتم استخدام نهج خلفي للركبة لكشف اللقمة الفخذية الإنسية الخلفية. ثم يتم وضع دبوس شتاينمان عبر اللقمات الفخذية من الإنسي إلى الجانبي بما يتماشى مع سطح المفصل ويتم تثبيته على المنصة. بمجرد تأمينها ، يتم تسليم حمولة إلى اللقمة الفخذية الإنسية الخلفية. تسمح هذه الطريقة بتوصيل تلف الغضروف المتسق إلى السطح الحامل للوزن لعظم الفخذ البعيد للأرنب.
Protocol
تم تنفيذ الإجراء التالي بموافقة من اللجنة المؤسسية لرعاية واستخدام في كلية الطب بجامعة إنديانا (IACUC). تم إجراء جميع جراحات البقاء على قيد الحياة في ظل ظروف معقمة ، على النحو المبين في إرشادات المعاهد الوطنية للصحة. تمت إدارة مخاطر الألم والعدوى باستخدام المسكنات والمضادات الحيوية المناسبة لتحسين النتائج الناجحة. تم استخدام ذكور الأرانب البيضاء النيوزيلندية الناضجة هيكليا ، والتي يتراوح وزنها بين 3.0 و 4.0 كجم ، في هذه الدراسة.
1. تصنيع برج الإسقاط
- قم بإنشاء رسومات CAD لمكونات برج الإسقاط والمنصة الأساسية والآلية لتأمين دبوس Steinman (الأشكال التكميلية 1-14).
- شراء المكونات المتاحة تجاريا (انظر جدول المواد).
- شراء أجزاء الجهاز من الجهاز أو إعطاء رسومات CAD إلى ميكانيكي لتصنيعها.
ملاحظة: يلزم وجود ميكانيكي عالي الدقة يتمتع بقدرة تصنيع الأدوات لتصنيع طرف التصادم الذي يبلغ قطره 3 مم (الشكل التكميلي 1 ، الجزء 20 والأشكال التكميلية 13،14). كان للوجه المؤثر لرأس الصدمة انحناءات 7.14 ملم و 5.56 ملم في المستويين السهمي والإكليلي ، على التوالي ، لتتوافق مع انحناء لقمة الأرنب الإنسي35 (الأشكال التكميلية 13،14). - قم بتجميع الأجزاء بحيث يتكون برج الإسقاط من عربة تسير على قضيبين عموديين عبر محامل كروية خطية ثابتة المحاذاة ، وتدعم المنصة الأساسية الأرنب وتؤمن دبوس Steinman (الشكل 1 والشكل 2).
ملاحظة: يتميز العارضة العرضية للعربة لهذا التصميم بصلابة انحناء مساوية لتلك الموجودة في برج الإسقاطالسابق 38 بمستوى اهتزاز مقبول.
2. إعداد
- وزن الأرنب وتخديره باستخدام 2.5 ملغ/كغ من الفاكسالون و0.15 ملغ/كغ من الميدازولام العضلي (انظر جدول المواد). ضع مرهم العين على كلتا العينين بعد الحث. الحفاظ على التخدير باستخدام ~ 2٪ -3٪ إيزوفلوران. يجب إعطاء البوبرينورفين SR (0.1 ملغ/كغ) SQ للتسكين والإنروفلوكساسين (10 ملغ/كغ) في الفترة المحيطة بالجراحة. بدلا من البوبرينورفين ، يمكن إعطاء مضادات الالتهاب غير الستيروئيدية مثل كاربروفين ، 4 مجم / كجم أو ميلوكسيكام ، 0.2 - 0.3 مجم / كجم أو كيتوبروفين ، 3 مجم / كجم كحقن SQ.
- حلق الطرف الخلفي للأرنب من الكاحل إلى المؤخرة. يتم حث الحذر الشديد في إزالة شعر الأرانب لمنع تلوث الشق. من المهم استخدام مجموعة من ماكينات قص شعر الأرانب المخصصة والحادة.
- ضع كتلة الساق الأمامية المصنوعة من الفولاذ المقاوم للصدأ (الشكل التكميلي 1 ، الجزء رقم 2 ، والشكل التكميلي 4) أسفل نهاية منصة التأثير وقم بتغطية المنصة بوسادة تدفئة. ضع عظم الأرنب (أي المعرض) على وسادة التدفئة. ضع نتوءا مبطنا تحت الورك المقابل.
- تأكد من أن الطرف الجراحي لديه الركبة في المنتصف ويستريح على كتلة البولي إيثيلين (الشكل 2A1). استخدم الشريط الحريري لسحب الذيل برفق والعكس من طرف المنطوق.
- امسح موقع الجراحة بالكلوروهيكسيدين وشاش معقم غارق في الكحول بنسبة 70٪. افرك موقع الجراحة ، بدءا من الركبة الخلفية ، بمسح دائري للخارج. كرر 3 مرات على الأقل مع الدعك الطازجة ، وتنتهي مع 70 ٪ من الكحول.
- ضع قفازا معقما على القدم الجراحية حتى الكاحل ولفها بغلاف متماسك معقم.
- قم بثني موقع الجراحة بشكل معقم بثلاث ستائر: واحدة مباشرة تحت الطرف الجراحي والآخران لتغطية بقية الجسم. تأمين الستائر مع المشابك منشفة.
3. التعرض الجراحي
ملاحظة: قبل الجراحة والتأثير ، يجب تحديد الوزن وارتفاع السقوط الذي يؤدي إلى تلف الغضروف المرئي دون كسر عظمي تحت الغضروف تجريبيا للسلالة المحددة والعمر والجنس للأرنب.
- جس موقف الرضفة من الأمام لتقدير موضع مفصل الركبة ، الذي يقع بعيدا عن الرضفة. باستخدام شفرة 15 ، قم بعمل شق 3-4 سم على طول الجانب الخلفي للركبة الممتدة من مستوى القطب العلوي للرضفة بعيدا.
- أداء تشريح حاد وحاد من خلال اللفافة السطحية الأساسية. تطوير الفاصل الزمني بين الجلد الإنسي والساق الإنسي بشكل جانبي. ضع جهاز Weitlaner ذاتي الاحتفاظ في هذا الفاصل الزمني (انظر جدول المواد).
- ستصبح طبقة اللفافة الثانوية مرئية فوق الشريان الصافن والوريد. تشريح الجانبي إلى الصافن وتراجع الأوعية الدموية الإنسي ومجمع المعدة الخلفي بشكل جانبي.
ملاحظة: احرص على عدم قطع هذه الأوعية الدموية. في حالة تلف هذا الشريان ، تأكد من الربط المناسب ، حيث يمكن أن تحدث صدمة نزفية بعد الجراحة.
- ستصبح طبقة اللفافة الثانوية مرئية فوق الشريان الصافن والوريد. تشريح الجانبي إلى الصافن وتراجع الأوعية الدموية الإنسي ومجمع المعدة الخلفي بشكل جانبي.
- تشريح بعيدا حتى يتم التعرف على فابيلا صغيرة متحركة فوق اللقمة الفخذية الإنسية الخلفية. إجراء بضع المفصل لتعبئة فابيلا فوق الجانبي ، وفضح اللقمة الفخذية الإنسية الكامنة. قم بإزالة الأنسجة الرخوة برفق عن طريق التشريح الحاد والحاد لكشف الجانب الخلفي من لقمة الفخذ الإنسي. استخدم جهاز التثبيت الذاتي Freer و Cricket (انظر جدول المواد) لسحب الأنسجة الرخوة عند هذا المستوى.
- مع إبقاء اللقمة مكشوفة ، قم بدفع دبوس شتاينمان 0.062 بوصة (انظر جدول المواد) عبر عظم الفخذ البعيد ، بدءا من الجانب العلوي من اللقمة الفخذية الإنسية وتمركز في الاتجاه الأمامي الخلفي للقمة الفخذية الإنسية ، على بعد حوالي 5 مم من الجانب الخلفي لللقمة.
- قم بدفع السلك بشكل جانبي عبر العظم والجلد الجانبي بالتوازي مع سطح المفصل باستخدام محرك دبوس Steinman الذي يعمل بالبطارية. سيضمن ملامسة اللقيمة الجانبية المسار المناسب لدبوس شتاينمان.
- قم بإزالة المبعدات وأغلق الجلد بخياطة بوليسورب 3-0 (انظر جدول المواد) بطريقة جري. تغطية شق مع الشاش معقمة.
4. تأثير اللقمة الفخذية
- قم بإزالة الستارة الموجودة أسفل الطرف الجراحي وقم بتأمين دبوس Steinman بمنصة تأثير ارتفاع قابلة للتخصيص والتعديل. أولا ، ضع الجانب السفلي القابل لتعديل الارتفاع من جهاز تثبيت دبوس Steinman أسفل الدبوس (الشكل 2A2). تأكد من أن السلك مواز للأرض على هذه المنصة عن طريق ضبط ارتفاعات المسمار حسب الحاجة.
- بعد التأكد من أن دبوس Steinman مواز للأرض ، ضع الجانب اللولبي العلوي للمنصة الآمنة (الشكل 2A3) على الجانب اللولبي السفلي للقطعة القابلة لضبط الارتفاع. تأكد من تثبيت دبوس Steinman بإحكام عن طريق شد الشريط العلوي في الجزء القابل للتعديل بارتفاع منخفض من منصة تثبيت الدبوس (الشكل 2A2).
- بمجرد تثبيت دبوس Steinman على المنصة ، قم بإزالة الخيط وإعادة فتح الشق. فضح اللقمة الفخذية الإنسية مع Weitlaner و rebusess الكريكيت التي تحتفظ بها. قد تكون هناك حاجة إلى فرير إضافي لسحب الأنسجة الرخوة الإضافية من مسار طرف الصدمة (الشكل 2 ب).
- امسح برج الإسقاط بمطهر معتمد. قم بتوصيل رأس الصدمة المعقم مقاس 3 مم (الشكل 2A4) بعربة برج الإسقاط. أحضر برج الإسقاط فوق الطرف الجراحي وضع قاعدته (الشكل 2A6) أسفل منصة التصادم (الشكل 3 أ).
- اخفض الصدمة برفق (الشكل التكميلي 2 ، الجزء 20 ، والشكل التكميلي 13) على مركز اللقمة الفخذية الإنسية الخلفية. تأكد من عدم وجود أنسجة رخوة في مسار الصدم.
- حرك الأرنب أو البرج حسب الحاجة للتأكد من تمركز رأس الصدمة فوق اللقمة الفخذية الإنسية الخلفية (الشكل 3 ب). في أي وقت يتم فيه نقل الأرنب أو إعادة وضعه ، يجب تقييم موقع الجراحة بحثا عن أي فواصل محتملة للعقم وإعادة تعقيم المنطقة إذا لزم الأمر.
- بمجرد ضمان المسار المناسب ، قم بتثبيت البرج على المنصة باستخدام مشابك التبديل (الشكل 2A5 ، انظر جدول المواد).
- يتم تطبيق جرعة واحدة من عقار ألفاكسالون الوريدي (0.5-0.7 ملغ/كغ) قبل 5-10 دقائق من الصدمة للحصول على تخدير أعمق دون زيادة التخدير المستنشق.
ملاحظة: عدم وجود منعكس الجفن ، وسحب الدواسة ، ومنعكس الصيوان يدل على تخدير أعمق. يساعد هذا التخدير العميق على منع ردود الفعل المحتملة للأطراف أثناء وضعها في الجهاز وأثناء الاصطدام.
تنبيه: إذا تم إعطاؤه بسرعة كبيرة ، يمكن أن يسبب الفاكس وحده انقطاع النفس العابر ونقص الأكسجة في الأرانب ويجب إعطاؤه ببطء على مدى 1-2 دقيقة. في حالة حدوث نقص الأكسجة ، تأكد من الأوكسجين الكافي واستعادة العناصر الحيوية قبل المتابعة. - اضبط جهاز الصدمة على برج الإسقاط على الارتفاع المطلوب فوق لقمة الفخذ الإنسي. بالنسبة لتجميع النقل الحالي ، بما في ذلك المحامل ، بكتلة 1.41 كجم ، يبلغ ارتفاعها 7 سم.
ملاحظة: تم تحديد ارتفاع برج الإسقاط من الدراسات التجريبية على أنسجة الجثث. أدى هذا الارتفاع إلى تلف الغضروف المرئي ولكن ليس كسر العظام تحت الغضروف للأرانب في هذه الدراسة. - انقر فوق الزر "ابدأ " في برنامج الحصول على بيانات LabVIEW (ملف الترميز التكميلي 1) قبل تحرير توقف المغزل مباشرة (الشكل التكميلي 2 ، البند رقم 14) لتحرير العربة والسماح لها بالسقوط تحت قوة الجاذبية.
ملاحظة: سيجمع برنامج الحصول على البيانات البيانات من خلية تحميل (الشكل 1 و6) موضوعة بين جهاز التصادم والحامل ومقياس تسارع (الشكلان 1 و7) أثناء الارتطام عند kHz 100 باستخدام حاسوب محمول متصل بوحدة للحصول على البيانات. - ضع ملف txt الذي تم إنشاؤه بواسطة برنامج الحصول على البيانات في نفس المجلد باستخدام رمز تحليل بيانات Matlab (ملف الترميز التكميلي 2) وقم بتشغيل رمز تحليل البيانات لتصفية البيانات الأولية وحساب معلمات التأثير.
- تأكد من تحديد الحمل الأقصى. تعتبر النقطة الزمنية المرتبطة وقت التشوه الأقصى والسرعة الصفرية.
ملاحظة: ستقوم التعليمات البرمجية لتحليل البيانات بتحليل كافة ملفات txt في المجلد والإبلاغ عن النتائج لكل ملف. ستحدد التعليمات البرمجية بداية ونهاية التأثير بناء على التغييرات في بيانات وقت التحميل. سيتم دمج البيانات من مقياس التسارع عدديا لحساب السرعة ودمجها مرة أخرى لحساب الإزاحة. سيحسب رمز تحليل البيانات عدديا الدافع والشغل والطاقة الحركية من الصيغ التالية:
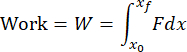

حيث F هي القوة المقاسة بواسطة مستشعر الحمل ، x 0 و t 0 هما الإزاحة والوقت في بداية التأثير ، و x و tf هما الإزاحة والوقت في نهاية التأثير. سيتم حساب معدل التحميل عدديا كمتوسط dσ / dt في مرحلة تحميل التأثير. سيتم حساب إجهاد الذروة بقسمة حمل الذروة على منطقة التلامس لرأس المصدم. - قم بإجراء تصور لسطح الغضروف لتحديد ما إذا كان قد حدث تلف مناسب للغضروف (الشكل 4 أ).
5. إغلاق موقع الجراحة
- قم بإزالة برج الإسقاط من فوق الطرف المنطوق. ضع جميع الأدوات الجراحية المستخدمة جانبا وقم بتغييرها إلى قفازات معقمة جديدة.
ملاحظة: نظرا لأن برج الإسقاط ليس معقما ، يجب الآن اعتبار جميع الأدوات المستخدمة حتى التأثير ملوثة. - أعد وضع ستارة معقمة على الطرف السفلي واحصل على مبعدات ذاتية معقمة غير مستخدمة.
- إعادة كشف اللقمة الفخذية الإنسية وري موقع الجراحة تماما ب 50-60 مل من المحلول الملحي المعقم.
- أغلق الكبسولة الخلفية بخياطة بوليسورب 5-0 ، متبوعة بإغلاق الجلد بخياطة أحادية السورب 4-0 (انظر جدول المواد).
- حقن 2 مل من يدوكائين / بوبيفاكايين للتسكين الموضعي حول الشق داخل الأدمة.
- قم بإزالة دبوس Steinman باستخدام مجموعة برامج تشغيل الطاقة (انظر جدول المواد) عن طريق التأرجح لتقليل إصابة الأنسجة الرخوة.
- قم بتلبيس الجرح بضمادة غير لاصقة ، متبوعة بشريط لاصق. قم بإجراء أشعة سينية للطرف الجراحي لضمان عدم حدوث كسر ووضع الدبوس المناسب (الشكل 4 ب).
6. إدارة ما بعد الجراحة
- أعد الأرنب إلى قفصه وراقبه على بطانيات ساخنة حتى يتعافى من التخدير (~ 25 دقيقة).
- استمر في مراقبة الأرانب عن كثب لعدة أيام بعد الجراحة للتأكد من أنها تلتئم بشكل صحيح وتستعيد حركتها. تطبيق إينروفلوكساسين (10 ملغ/ كغ) لمدة 2 أيام بعد الجراحة للوقاية من العدوى. يجب تطبيق تسكين البوبرينورفين SR (0.1 ملغ/ كغ) تحت الجلد كل 2-3 أيام بعد الجراحة وحسب الحاجة. بدلا من البوبرينورفين ، مضادات الالتهاب غير الستيروئيدية مثل كاربروفين ، 4 ملغ / كغ SQ يوميا ، ميلوكسيكام ، 0.2 - 0.3 ملغ / كغ SQ يوميا حتى 3 أيام أو كيتوبروفين ، 3 ملغ / كغ SQ يوميا يمكن أن تدار 3-5 أيام بعد الجراحة وحسب الحاجة.
ملاحظة: لقد نجحنا في منع تفكك الجروح بعد العملية الجراحية ، بسبب لعق الأرانب أو مضغها ، مع وضع سراويل حديثي الولادة البشرية على الأطراف الخلفية39. إذا مضغ الأرنب من خلال البنطال ، فقد يتم وضع طوق إليزابيثي (انظر جدول المواد) لمنع مضغ الشق.
7. التقييم النسيجي
- في 16 أسبوعا بعد الإصابة ، قم بحصاد الركبتين من الأرانب الرحيمة ، وقم بتثبيتها في 10٪ فورمالين محايد مخزن لمدة 48 ساعة ، متبوعا بتضمين البارافين وتقسيمه إلى شرائح بسمك 5 ميكرومتر.
- بعد إزالة البارافين والإماهة ، قم بتلطيخ الأقسام ب safranin O أخضر سريع وفقا للبروتوكولات القياسية40,41.
- قم بإجراء مقايسة وضع العلامات الطرفية لنهاية النقايات deoxynucleotidyl dUTP (TUNEL) على الأقسام باستخدام مجموعة الكشف عن موت الخلايا المبرمج الكروموجيني TUNEL باتباع تعليمات الشركة المصنعة ، الملطخة بالهيماتوكسيلين42 (انظر جدول المواد).
النتائج
تمت مراقبة نجاح هذا الإجراء مباشرة بعد التأثير عن طريق تصور اللقمة من قبل الجراح (الشكل 4 أ) والتصوير الشعاعي لضمان عدم حدوث كسر (الشكل 4 ب). هناك خطر من فشل التأثير الذي يؤدي إلى كسر أثناء العملية في اللقمة. كان هذا عادة بسبب وضع دبوس شتاينمان بشكل غير صحيح (
Discussion
يهدف هذا الإجراء الجراحي إلى إحداث تلف غضروفي ثابت على السطح الحامل للوزن لقمة الفخذ الإنسي للأرنب في نموذج PTOA. ميزة هذا الإجراء هي أن النهج الخلفي للركبة يسمح بالتصور المباشر للقمة الفخذية الإنسية الخلفية الكاملة ، ويمكن إجراؤها في حوالي 37 دقيقة (الجدول 2). وتجدر الإشارة أيضا إلى...
Disclosures
يقدم رومان ناتولي محاضرات ل AO Trauma North America ، وهو محرر قسم لتقارير هشاشة العظام الحالية ، وتلقى إتاوات الكتب المدرسية من Morgan و Claypool. يتلقى تود ماكينلي إتاوات من Innomed. المؤلفون الباقون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل برنامج البحوث الطبية الذي تمت مراجعته من قبل وزارة الدفاع - جائزة البحث التي بدأها الباحث W81XWH-20-1-0304 من نشاط اكتساب البحوث الطبية للجيش الأمريكي ، من قبل NIH NIAMS R01AR076477 وبرنامج التدريب الشامل للعضلات الهيكلية T32 من المعاهد الوطنية للصحة (AR065971) ومن قبل NIH NIAMS Grant R01 AR069657. يود المؤلفون أن يشكروا كيفن كار على تقديم خبرته في التصنيع والتصنيع لهذا المشروع ، ودرو براون ومركز إنديانا لصحة الجهاز العضلي الهيكلي لأنسجة العظام للمساعدة في علم الأنسجة.
Materials
| Name | Company | Catalog Number | Comments |
| Flat head screw | McMaster-Carr | 92210A194 | Stainless steel hex drive flat head screw, 8-32, 1/2" |
| #15 scalpel blades | McKesson | 1029066 | Scalpel McKesson No. 15 Stainless Steel / Plastic Classic Grip Handle Sterile Disposable |
| 1/2”-20 threaded rod | McMaster-Carr | 99065A120 | 1/2”-20 threaded rod |
| 10 mL syringe | McKesson | 1031801 | For irrigation; General Purpose Syringe McKesson 10 mL Blister Pack Luer Lock Tip Without Safety |
| 3 mL syringe | McKesson | 1031804 | For lidocaine/bupiviacaine injection; General Purpose Syringe McKesson 3 mL Blister Pack Luer Lock Tip Without Safety. |
| 3-0 polysorb | Ethicon | J332H | 3-0 Vircryl, CT-2, 1/2 circle, 26 mm, tapered |
| 4-0 monosorb | Ethicon | Z397H | 4-0 PDS 2, FS-2, 3/8 circle, 19mm, cutting edge |
| 5-0 polysorb | Med Vet International | NC9335902 | Med Vet International 5-0 ETHICON COATED VICRYL C-3 |
| Accelerometer | Kistler | 8743A5 | Accelerometer |
| Adson-Browns Forceps | World precision tools | 500177 | Adson-Brown Forceps, 12 cm, Straight, TC Jaws, 7 x 7 Teeth |
| Alfaxalone | Jurox | 49480-002-01 | Alfaxan Multidose by Jurox : 10 mg/mL |
| Buprenorphine | Par Pharmaceuticals | 42023-0179-05 | Buprenorphine HCL injection: 0.3 mg/mL |
| Butorphanol | Zoetis | 54771-2033 | Butorphanol tartrate 10mg/ml by Zoetis |
| Chlorhexidine Hand Scrub | BD | 371073 | BD E-Z Scrub 107 Surgical Scrub Brush/Sponge, 4% CHG, Red |
| Collet | STRYKER | 14023 | Stryker 4100-62 wire Collet 0.28-0.71'' |
| Cordless Driver handpiece | STRYKER | OR-S4300 | Stryker 4300 CD3 Cordless Driver 3 handpiece |
| Cricket Retractors | Novosurgical | G3510 21 | 2x Heiss (Holzheimer) Cross Action Retractor |
| Dissector Scissors | Jorvet labs | J0662 | Aesculap AG, Metzenbaum, Scissors, Straight 5 3/4″ |
| Elizabethian Collar | ElizaSoft | 62054 | ElizaSoft Elizabethan Recovery Collar |
| Enrofloxacin | Custom Meds | Enrofloxacin compounded by Custom Meds | |
| Eye Ointment | Pivetal | 46066-753-55 | Pivetal Articifical Tears- recently recalled |
| Face-mount shaft collar | McMaster-Carr | 5631T11 | Face-mount shaft collar |
| Fast green | Millipore Sigma | F7258 | Fast green |
| Freer | Jorvet labs | J0226Q | Freer elevator |
| Head screw -1 | McMaster-Carr | 91251A197 | Black-oxide alloy steel socket head screw, 8-32, 3/4" |
| Head screw -2 | McMaster-Carr | 92196A194 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -3 | McMaster-Carr | 92196A146 | Stainless steel socket head screw, 8-32, 1/2" |
| Head screw -4 | McMaster-Carr | 92196A151 | Stainless steel socket head screw, 6-32, 3/4" |
| Hematoxylin Solution, Gill No. 1 | Millipore Sigma | GHS132-1L | Hematoxylin Solution, Gill No. 1 |
| Hex nut | McMaster-Carr | 91841A007 | Stainless steel hex nut, 6-32 |
| Hold-down toggle clamp | McMaster-Carr | 5126A71 | Hold-down toggle clamp |
| Impact device | n/a | n/a | custom made |
| Impact platform | n/a | n/a | custom made |
| K-wires | Jorvet Labs | J0250A | JorVet Intramedullary Steinman Pins, Trocar-Trocar 1/16" x 7" |
| Lab View | National Instruments | n/a | n/a |
| Load cell | Kistler | 9712B5000 | Load cell |
| MATLAB | The MathWorks Inc. | n/a | n/a |
| Microscope | Leica | DMi-8 | Leica DMi8 microscope with LAS-X software |
| Midazolam | Almaject | 72611-749-10 | Midazolam Hydrochloride injection: 5mg/ml by Almaject |
| milling machine depth stops | McMaster-Carr | 2949A71 | Clamp-on milling machine depth stops |
| Mobile C-arm | Philips | 718095 | BV Pulsera, Mobile C-arm |
| Mounted linear ball bearing | McMaster-Carr | 9338T7 | Mounted linear ball bearing |
| Needle Driver | A2Z Scilab | A2ZTCIN39 | TC Webster Needle Holder Smooth Jaws 5", Premium |
| Pentobarbital | Vortech | 0298-9373-68 | Pentobarbital 390 mg/mL by Vortech |
| Safranin O | Millipore Sigma | HT90432 | Safranin O |
| Small Battery pack | STRYKER | NS014036 | 6212 Small Battery pack- 9.6 V |
| Steel rod, 2’ | McMaster-Carr | 89535K25 | Steel rod, 2’ |
| Sterile Saline | ICU Medical | 6139-22 | AquaLite Solution Pour Bottles, 250 mL |
| Stryker 6110-120 System 6 Battery Charger | STRYKER | OR-S6110-120 | |
| Surgical gloves | McKesson | 1044729 | Surgical Glove McKesson Perry Size 6.5 Sterile Pair Latex Extended Cuff Length Smooth Brown Not Chemo Approved |
| Surgical gown | McKesson | 1104452 | Non-Reinforced Surgical Gown with Towel McKesson Large Blue Sterile AAMI Level 3 Disposable |
| Suture scissors | Jorvet Labs | J0910SA | Super Cut Scissors, Mayo, Straight, 5 1/2″ |
| TUNEL staining kit | ABP Bioscience | A049 | TUNEL Chromogenic Apoptosis Detection Kit |
| Weitlaner Retractors | Fine Science Tools | 17012-11 | 2x Weitlaner-Locktite Retractors |
References
- Thomas, A. C., Hubbard-Turner, T., Wikstrom, E. A., Palmieri-Smith, R. M. Epidemiology of posttraumatic osteoarthritis. Journal of Athletic Training. 52 (6), 491-496 (2017).
- Pasquale, M. K., et al. Healthcare Utilization and costs of knee or hip replacements versus pain-relief injections. American Health Drug Benefits. 8 (7), 384-394 (2015).
- Yao, J. J., et al. Direct Inpatient medical costs of operative treatment of periprosthetic hip and knee infections are twofold higher than those of aseptic revisions. Journal of Bone and Joint Surgery America. 103 (4), 312-318 (2021).
- Anatone, A. J., et al. Decreased implant survival is associated with younger patients undergoing total knee arthroplasty. HSS Journal. 18 (2), 290-296 (2022).
- Stone, B., Nugent, M., Young, S. W., Frampton, C., Hooper, G. J. The lifetime risk of revision following total knee arthroplasty : a New Zealand Joint Registry study. The Bone and Joint Journal. 104-B (2), 235-241 (2022).
- Chen, D., et al. Osteoarthritis: toward a comprehensive understanding of pathological mechanism. Bone Research. 5, 16044 (2017).
- Robinson, W. H., et al. Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis. Nature Review Rheumatology. 12 (10), 580-592 (2016).
- Perez-Garcia, S., et al. Profile of matrix-remodeling proteinases in osteoarthritis: impact of fibronectin. Cells. 9 (1), 40 (2019).
- Hashimoto, S., Ochs, R. L., Komiya, S., Lotz, M. Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis. Arthritis Rheumatology. 41 (9), 1632-1638 (1998).
- Natoli, R. M., Athanasiou, K. A. Traumatic loading of articular cartilage: Mechanical and biological responses and post-injury treatment. Biorheology. 46 (6), 451-485 (2009).
- Coleman, M. C., Brouillette, M. J., Andresen, N. S., Oberley-Deegan, R. E., Martin, J. M. Differential effects of superoxide dismutase mimetics after mechanical overload of articular cartilage. Antioxidants (Basel). 6 (4), 98 (2017).
- Goodwin, W., et al. Rotenone prevents impact-induced chondrocyte death. Journal of Orthopaedic Research. 28 (8), 1057-1063 (2010).
- Wolff, K. J., et al. Mechanical stress and ATP synthesis are coupled by mitochondrial oxidants in articular cartilage. Journal of Orthopaedic Research. 31 (2), 191-196 (2013).
- Delco, M. L., Bonnevie, E. D., Bonassar, L. J., Fortier, L. A. Mitochondrial dysfunction is an acute response of articular chondrocytes to mechanical injury. Journal of Orthopaedic Research. 36 (2), 739-750 (2018).
- Coleman, M. C., Ramakrishnan, P. S., Brouillette, M. J., Martin, J. A. Injurious loading of articular cartilage compromises chondrocyte respiratory function. Arthritis Rheumatology. 68 (3), 662-671 (2016).
- Bobinac, D., Spanjol, J., Zoricic, S., Maric, I. Changes in articular cartilage and subchondral bone histomorphometry in osteoarthritic knee joints in humans. Bone. 32 (3), 284-290 (2003).
- Coleman, M. C., et al. Targeting mitochondrial responses to intra-articular fracture to prevent posttraumatic osteoarthritis. Science Translational Medicine. 10 (427), eaan5372 (2018).
- Heraud, F., Heraud, A., Harmand, M. F. Apoptosis in normal and osteoarthritic human articular cartilage. Annals of Rheumatological Diseases. 59 (12), 959-965 (2000).
- Narez, G. E., Fischenich, K. M., Donahue, T. L. H. Experimental animal models of post-traumatic osteoarthritis of the knee. Orthopedic Reviews (Pavia). 12 (2), 8448 (2020).
- Fischenich, K. M., et al. Chronic changes in the articular cartilage and meniscus following traumatic impact to the lapine knee. Journal of Biomechanics. 48 (2), 246-253 (2015).
- Isaac, D. I., Meyer, E. G., Kopke, K. S., Haut, R. C. Chronic changes in the rabbit tibial plateau following blunt trauma to the tibiofemoral joint. Journal of Biomechanics. 43 (9), 1682-1688 (2010).
- Wei, F., et al. Post-traumatic osteoarthritis in rabbits following traumatic injury and surgical reconstruction of the knee. Annals of Biomedical Engineering. 50 (2), 169-182 (2022).
- Terracciano, R., et al. Quantitative high-resolution 7T MRI to assess longitudinal changes in articular cartilage after anterior cruciate ligament injury in a rabbit model of post-traumatic osteoarthritis. Osteoarthritis and Cartilage Open. 4 (2), 100259 (2022).
- Huang, K., Cai, H. L., Zhang, P. L., Wu, L. D. Comparison between two rabbit models of posttraumatic osteoarthritis: A longitudinal tear in the medial meniscus and anterior cruciate ligament transection. Journal of Orthopaedic Research. 38 (12), 2721-2730 (2020).
- Sun, Z. B., Peng, H. Experimental Study on the prevention of posttraumatic osteoarthritis in the rabbit knee using a hinged external fixator in combination with exercises. Journal of Investigative Surgery. 32 (6), 552-559 (2019).
- Gardner, M. J., et al. The incidence of soft tissue injury in operative tibial plateau fractures: a magnetic resonance imaging analysis of 103 patients. Journal of Orthopedic Trauma. 19 (2), 79-84 (2005).
- Dilley, J. E. B. . M. A., Roman, N., McKinley, T. O., Sankar, U. Post-traumatic osteoarthritis: A review of pathogenic mechanisms and novel targets for mitigation. Bone Reports. 18, 101658 (2023).
- Seol, D., et al. Effects of knockout of the receptor for advanced glycation end-products on bone mineral density and synovitis in mice with intra-articular fractures. Journal of Orthopedic Research. 36 (9), 2439-2449 (2018).
- Furman, B. D., et al. Joint degeneration following closed intraarticular fracture in the mouse knee: a model of posttraumatic arthritis. Journal of Orthopedic Research. 25 (5), 578-592 (2007).
- Glasson, S. S., Chambers, M. G., Van Den Berg, W. B., Little, C. B. The OARSI histopathology initiative - recommendations for histological assessments of osteoarthritis in the mouse. Osteoarthritis Cartilage. 18 Suppl 3, S17-S23 (2010).
- McCoy, A. M. Animal models of osteoarthritis: comparisons and key considerations. Veterinary Pathology. 52 (5), 803-818 (2015).
- Fening, S. D., Jones, M. H., Moutzouros, V., Downs, B., Miniaci, A. Method for Delivering a controlled impact to articular cartilage in the rabbit knee. Cartilage. 1 (3), 211-216 (2010).
- Leucht, F., et al. Development of a new biomechanically defined single impact rabbit cartilage trauma model for in vivo-studies. Journal of Investigative Surgery. 25 (4), 235-241 (2012).
- Vrahas, M. S., Smith, G. A., Rosler, D. M., Baratta, R. V. Method to impact in vivo rabbit femoral cartilage with blows of quantifiable stress. Journal of Orthopedic Research. 15 (2), 314-317 (1997).
- Borrelli, J., Burns, M. E., Ricci, W. M., Silva, M. J. A method for delivering variable impact stresses to the articular cartilage of rabbit knees. Journal of Orthopedic Trauma. 16 (3), 182-188 (2002).
- Milentijevic, D., Rubel, I. F., Liew, A. S., Helfet, D. L., Torzilli, P. A. An in vivo rabbit model for cartilage trauma: a preliminary study of the influence of impact stress magnitude on chondrocyte death and matrix damage. Journal of Orthopedic Trauma. 19 (7), 466-473 (2005).
- Alexander, P. G., et al. An In vivo lapine model for impact-induced injury and osteoarthritic degeneration of articular cartilage. Cartilage. 3 (4), 323-333 (2012).
- Bonitsky, C. M., et al. Genipin crosslinking decreases the mechanical wear and biochemical degradation of impacted cartilage in vitro. Journal of Orthopedic Research. 35 (3), 558-565 (2017).
- Bartley, K. A., Johnson, C. H. Human Infant pants for postoperative protection during social housing of new zealand white rabbits (Oryctolagus cuniculus). Journal of the American Association for Laboratory Animal Science. 58 (4), 510-516 (2019).
- Lillie, R. D., Fullmer, H. M. . Histopathologic technic and practical histochemistry. , (1976).
- Prophet, E., Mills, B., Arrington, J. B., Sobin, L. H. . Armed Forces Institute of Pathology: Laboratory Methods in Histotechnology. Washington DC: American Registry of Pathology. , (1992).
- Dilley, J. E., et al. CAMKK2 is upregulated in primary human osteoarthritis and its inhibition protects against chondrocyte apoptosis. Osteoarthritis and Cartilage. 31 (7), 908-918 (2023).
- Pritzker, K. P., et al. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis Cartilage. 14 (1), 13-29 (2006).
- Christiansen, B. A., et al. Non-invasive mouse models of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 23 (10), 1627-1638 (2015).
- Borrelli, J., Zaegel, M. A., Martinez, M. D., Silva, M. J. Diminished cartilage creep properties and increased trabecular bone density following a single, sub-fracture impact of the rabbit femoral condyle. Journal of Orthopaedic Research. 28 (10), 1307-1314 (2010).
- Borrelli, J., Silva, M. J., Zaegel, M. A., Franz, C., Sandell, L. J. Single high-energy impact load causes posttraumatic OA in young rabbits via a decrease in cellular metabolism. Journal of Orthopedic Research. 27 (3), 347-352 (2009).
- Borrelli, J., Zhu, Y., Burns, M., Sandell, L., Silva, M. J. Cartilage tolerates single impact loads of as much as half the joint fracture threshold. Clinical Orthopedics and Related Research. 426, 266-273 (2004).
- Karnik, S., et al. Decreased SIRT1 activity is involved in the acute injury response of chondrocytes to ex vivo injurious mechanical overload. International Journal of Molecular Sciences. 24 (7), 6521 (2023).
- Mevel, E., et al. Systemic inhibition or global deletion of CaMKK2 protects against post-traumatic osteoarthritis. Osteoarthritis Cartilage. 30 (1), 124-136 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved