Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
DNA Kararlı-İzotop (DNA-SIP) Probing
Bu Makalede
Özet
DNA kararlı izotop problama özel substratlar kullanma yeteneğine sahip olan mikroorganizmaların aktif toplulukları tanımlamak ve karakterize etmek için bir kültür bağımsız bir yöntemdir. Ağır izotop zenginleştirilmiş substrat Asimilasyon etiketli atomların mikrobiyal biyokütle içine dahil yol açar. Yoğunluk degrade Ultrasantrifügasyon downstream moleküler analizler için işaretli DNA alır.
Özet
DNA stabil izotop (DNA-SIP) problama özellikle hücresel biyokütle içinde karbon yüzeyleri ve besin asimile aktif mikroorganizmaların belirlenmesi için güçlü bir tekniktir. Bunun gibi, bu, yetiştirme bağımsız tekniği, geniş bir yelpazede karasal ve sucul ortamlarda yaşayan farklı toplulukların metabolik fonksiyonu atama için önemli bir yöntem olmuştur. Istikrarlı izotop etiketli bileşikler ile çevresel bir örnek inkübasyon ardından, çıkarılan nükleik asit, nükleik asitlerin farklı yoğunlukları ayrı bir yoğunluk gradiyenti Ultrasantrifügasyon ve sonraki degrade fraksiyonasyon tabi tutulur. Sezyum klorür DNA saflaştırılması sonraki moleküler karakterizasyonu (örneğin parmak izi, mikroarrayler, klon kütüphaneler, metagenomics) DNA etiketli ve etiketlenmemiş alır. Bu vallahi video protokol yoğunluk gradiyenti Ultrasantrifügasyon, degrade fraksiyonasyon ve işaretli DNA kurtarma için protokol görsel olarak adım adım açıklamalar sağlar. Protokol, aynı zamanda örnek SIP veri ve golleri önemli ipuçları içerir ve başarılı bir SIP DNA analizi sağlamak için düşünülmesi gerektiğini uyarıyor.
Protokol
1. Reaktiflerin hazırlanması
DNA SIP gerçek prosedür önceden hazırlanmalıdır reaktiflerin kullanımını gerektirir. Bu bölümde listelenen her reaktif hazırlanması için yönde ve bir önceki SIP protokolü 1 değiştirilmiş.
- SIP gradyanlar hazırlanması için Sezyum klorür (CSCL) çözümü yavaş yavaş son hacim 500 mL distile ve deiyonize su CSCL 603,0 g (GKD 2 O) eriterek 7,163 M CSCL çözüm hazırlayın. 500 ml aşmayacak şekilde dikkatli olun! Karıştırarak ise biraz çözüm Isınma CSCL tüm çözülür yardımcı olacaktır. Mühürlü alikotları nihai çözüm kısım. Bizim laboratuvarda, ortak bir depolama uygulamasına sonra butil kauçuk tıpa ile kıvrımlı mühürlü 125 ml serum şişeleri, 100 mL alikotları hazırlamaktır. Mühürlü alikotları oda sıcaklığında (20 ° C) süresiz olarak saklanabilir. Mühürler, buharlaşma ve CSCL "kabuk" oluşumunu önlemeye yardımcı olur. Üç nüsha 100 mcL alikotları tartılarak, ya da dikkatle CSCL çözümleri için kalibre edilmiş bir dijital refraktometre (örneğin Reichert AR200) kullanarak çözüm yoğunluğu belirleyin. Bir kez başarıyla kalibre Reichert AR200 tutarlı ve birkaç yıl boyunca doğru okumalar sağlar. Oda sıcaklığında (20 ° C), bu çözümün nihai yoğunluğu genellikle 1,88-1,89 g -1 ml arasında değişir. Yoğunluğu biraz yeni bir stok hazırlanan her zaman değişir.
- CSCL 250 g 250 mL steril GKD 2 O su birleştirin - etidyum bromür (EtBr) geçişinde hazırlamak için Sezyum klorür solüsyonu. Kısım 1.1 'de açıklandığı gibi butil kauçuk contalar ile kıvrımlı mühürlü ayrı serum şişeleri içine bu çözüm.
- Gradient Tampon - 1 M Tris-HCl, 3.75 g KCl ve 0.5 M EDTA 1 ml, 400 ml su 50 ml birleştirin. KCl çözülür, daha sonra 500 ml GKD 2 O ekleyin. Filtre sterilize ve otoklav. Nihai çözüm, 0.1 M Tris, 0,1 M KCl ve 1 mM EDTA.
- Polietilen glikol (PEG) solüsyonu steril GKD 2 O su ile toplam hacim 500 mL (% 30 PEG, 1.6 M NaCl) 150 g polietilen glikol 6000 ve 46.8 g NaCl eriterek PEG çözeltisi hazırlayın. Otoklav.
Not: Bu çözüm, otoklav ile iki aşamada ayrılır. Bu ortaya çıktığında çözüm düzgün karışık olabilir ki otoklavlanmış şişe içinde bir heyecan bar dahil. - TE Tampon - 1 M Tris-HCl (pH 8.0) ve 0.5 M EDTA (otoklavlanmış stok çözümleri kullanılarak, 10 mM Tris-HCl (pH 8.0) ve 1 mM EDTA (pH 8.0) steril GKD 2 O su bir çözüm hazırlayın pH 8.0). Filtre sterilize ve otoklav.
- -% 70 Etanol yüksek saflıkta etanol 350 ml, 150 ml steril GKD 2 O su birleştirin.
2. Örnek Kuluçka ve DNA Ekstraksiyon
DNA-SIP inkübasyonlar için, örnekler genellikle ağır izotop karbon (13 C) substrat ile inkübe edilir. Inkübasyon süreleri ve koşulları (örneğin, besin takviyesi, nem, ışık) inkübe örnek substrat türü ve doğasına bağlı olarak değişecektir. Tek karbon bileşikleri 2,3, multi-karbon bileşikler 4,5,6 ve etiketli, azot 7,8 veya oksijen 9 kullanarak çeşitli kullanarak DNA SIP deneyleri başarıyla gerçekleştirilmiştir . Ancak, 15 N-18 O etiketli bileşikler kullanarak bir dezavantajı daha az nitrojen ve oksijen atomları DNA ve karbon atomu göreceli RNA varlığı nedeniyle etiketli nükleik asit azalmış fiziksel ayırma,.
DNA SIP deneyler için kritik kontrol, yerel (örneğin 12 C) substrat ile kurulan benzer bir kuluçka . Bu inkübasyon herhangi bir nükleik asit belirgin etiketleme Ultrasantrifügasyon veya ayırma 10 katkıda DNA G + C içeriği yoğunluk farkı bir dışlayıcı değildi emin olmak için bir sonraki karşılaştırılmasını sağlar . Bu 'hafif' ve 'ağır' DNA karşılaştırması için dondurulmuş numune tutmak için de önemli ve SIP kuluçka boyunca arka planda nüfus değişiklikleri değerlendirmek için bir-substrat kontrolü de dahil olmak üzere değer.
- Etiketli substrat (Şekil 1) içeren microcosms çevre örnekleri inkübe edin. Bizim tecrübelerimize göre, biz örnek gram başına 13 C karbon 5-500 mol arasında asgari bir ortaklık gibi toprak örnekleri 1 gibi yüksek biyokütle içeren örnekler için uygun olacağını bulduk. Topraklarda daha az biyokütle içeren su örnekleri için, 1-100 mol dahil, litre başına 13 C karbon saptanabilir ağır izotop imza 1 verebilir. , Karbon değişiklik miktarı, biyokütle ve asimilasyonu için ek besin ek ihtiyacı içine karbon oranı analiz edilen numunelerin özelliklerine bağlıdır ve hedeflenen o olacakilgi rganisms. Tek bir örnek inkübasyon rehberlerin tüm örnekler için geçerli olmayacaktır. Önemlisi, SIP inkübasyon için kullanılan substrat yoğunluğu ideal normalde yerinde karşılaşılan konsantrasyon mümkün olduğunca yakın olmalıdır; zenginleştirme kültür koşulları 10 deneysel yanlılık bir sonucu olabilir.
- Istikrarlı izotop etiketli substrat örnek inkübasyon sonrasında, titiz bir ekstraksiyon protokolü (PCR veya küçük ekleme klonlama) veya yüksek molekül ağırlıklı klonlama (örneğin büyük eklemek metagenomics) için güvenilir bir enzimatik lizis kullanarak microcosms DNA ayıklayın. RNA co-çıkarma genellikle analizini etkilemez, hem RNA, DNA gibi verim protokolleri kullanılıyor olabilir. Ayıklanan DNA Ultrasantrifügasyon ~ 50 kb çiftinden 1 kısa parçaları kayma olmaz.
- CSCL degrade Ultrasantrifügasyon tüplerin kurulum önce çıkarılan DNA sayısal olarak. Sayısal olarak DNA ekstraksiyon protokolü sadece DNA (örneğin, sütun tabanlı kitler) verimleri eğer bir spektrofotometre kullanarak (örneğin Nanodrop 2000). Alternatif olarak, agaroz jel elektroforez kullanılarak belirlenir.
3. Gradient Çözümler Ultrasantrifügasyon için hazırlanması
Bu prosedür, tüpler ultrasantrifüjdeki DNA ekleyerek içerir. Tam protokol değişecektir ve üreticinin talimatlarına bağlı birden fazla tüp ve rotor türü vardır. Söyledi, biz hafif ve ağır DNA mümkün olan maksimum ayırma sağlamak için iyi bir dikey rotor kullanmanızı öneririz. 5.1 ml QuickSeal Polyallomer tüpleri tutmak için 16 kuyu ile Beckman-Coulter VTi 65,2 rotor kullanımı ve protokol bu şartlar için gereken adımları ve değerlendirmeler sağlayacaktır.
- DNA ultrasantrifüjdeki tüpler 5 mg - 0.5 mg sağlamak için gerekli çıkarılan DNA adım 2.3 'de tespit edilen DNA konsantrasyonları kullanarak, gerekli hacim hesaplamak.
- Gradient Buffer (adım 1.3 'e bakınız) ve ~ 6 ml steril tek kullanımlık 15 ml tüp içinde toplam hacmi 4.8 ml 7,163 M CSCL edilen DNA (5 mg 0.5) birleştirin. Not CSCL çözüm yoğunluğu (adım 1.1 'e bakınız) aynı molarite bile değişebilir. Aşağıdaki denklem Gradient Tampon / DNA karışımı uygun bir karışım oranı üretmek için gerekli ses seviyesini belirlemek için kullanılabilir:
Gradient tampon ve DNA çözüm hacmi (ml) = (CSCL stok solüsyonu yoğunluğu istenen nihai yoğunluğu) x CSCL stok solüsyonu hacmi x 1,52 eklendi
4.80 ml CSCL stok solüsyonu hacmi belirtin. Istenilen nihai yoğunluğu 1,725 g -1 ml olmalıdır. Stok solüsyonu yoğunluğu adım 1.1 'de tespit edildi.
CSCL ve Gradient Tampon / DNA göreli birimleri bir kombine hacim 5.1 ml den daha büyük olmasına neden olacağını unutmayın. Ultrasantrifüjdeki tüpler maksimum hacim kapasitesi (5,1 ml den daha büyük) daha büyük hacimli hazırlanması tamamen tüp doldurmak için yeterli bir çözüm olduğunu sağlayacaktır. - Tersini 10 kez karıştırın. DNA CSCL oda sıcaklığında kararlı.
4. Bir EtBr kontrol Gradient oluşturma (isteğe bağlı)
EtBr DNA ile kompleksleri, UV ışığı altında görünür hale intercalating boya Çünkü numune tüpleri (örneğin Şekil 1) fraksiyonasyon önce degrade oluşumu derhal görsel onay verin, çünkü EtBr içeren kontrol gradyanlar yardımcı olur. EtBr ve 12 C-DNA ve 13 C-DNA (ya da 14 N-DNA ve 15 K-DNA) hem bir karışımını içeren bir kontrol tüpü dahil Ultrasantrifügasyon tamamlanması üzerine tüpler içinde hemen görünüm için bant oluşumu sağlar . Ultrasantrifügasyon veya yanlış programlanmış çalışma koşulları sırasında rüptüre tüp başarısız degrade oluşumuna neden olabilir, çünkü bu çok önemlidir. DNA Bound EtBr DNA yoğunluğu düşürür ve sonuç olarak, farklı bir protokol gradyanlar hazırlamak için takip ediyor. Diğer nükleik asit lekeleri EtBr 11 yerine kullanılan, ancak protokol diğer fluorophores optimizasyonu gerekecektir.
- : Kontrol degrade genomik DNA iki cilt tam istikrarlı izotop ile etiketlenir ve etiket olmadan tek gerektirir. Biz genellikle, 13 C veya 12 C-metan kontrol olarak varlığını kültüre tek karbon kaynağı ya da Methylococcus capsulatus gerginlik Hamamı olarak 13 C veya 12 C-glikoz içeren medya kültürü Sinorhizobium meliloti ya kullanın .
- 5 -10 mg miktarı birleştirin hem 12 C-DNA ve 13 C Gradient Tampon harcanabilir 15 ml vidalı kapaklı tüp içinde 1.00 ml nihai bir hacim-DNA.
- Aynı tüpe 1.00 g katı CSCL ekleyin. Tersine çevirerek karıştırın.
- 110 ul10 mg ml -1 EtBr çözüm ve adım 4.2 'de kullanılan aynı vidalı kapaklı tüpe 1 gr ml -1 CSCL stok solüsyonu 4.3 ml. Çözümün nihai yoğunluğu yaklaşık orijinal CSCL stok solüsyonu.
- EtBr içeren ek bir "boş" kontrol çözümü de adım 4.4 'de oluşturulan çözüm dengelemek için gerekli olacaktır. Gradient Tampon, CSCL 1.00 g, 10 mg ml -1 EtBr çözüm ve 4.3 ml, 1 g ml ayrı bir 15 ml vidalı kapaklı tüp ve tersine çevirerek karıştırın -1 CSCL stok solüsyonu 110 ul 1.00 ml birleştirin .
5. Ultrasantrifügasyon
- Bir ampul ve Pasteur pipeti kullanarak, degrade çözümler adım 3.2 (veya 4.4 adımları EtBr kontrol degrade hazırlanıyor) hazırlanan ultrasantrifüjdeki tüpler dikkatle doldurun. Pasteur pipeti kullanarak tüpleri dikkatlice çözümleri ekleyin. Tüpler, ince bir kalıcı bir kalem ile tüp omzuna etiketleyin. DİKKAT: tüpler tüp boyun tabanına tam olarak dolu olduğunu olun. Yeterince dolu tüpler Ultrasantrifügasyon sırasında patlaması muhtemel.
- Gerekli tüpler örnek çözümleri ile doldurulur, her tüp hassas kitle kaydedin. Çifti tüpler ve 0-10 mg içinde onları dengelemek. Dengeleme için yaklaşık uyumlu çiftleri bulmak ve mümkün olduğunca tüp Boğaz tabanına yakın çözüm düzeyini koruması, dengeli kadar dakika miktarda çözüm ekleyebilir veya kaldırabilirsiniz. Ağırlığındaki tüpler, dengesi için bir tüp sahibi olarak yarıya ters bir 15 ml vidalı kapaklı tüp kullandığını unutmayın.
- Üreticinin talimatlarına göre 'tüp kaban' kullanarak tüpleri Seal.
- Tüpler tersini onları düzgün mühürlü ve orta basınç uygulayarak olduğunu kontrol edin. 0-10 mg içinde sızdırmazlık sonra hala dengeli olup olmadığını kontrol etmek için tüpler tekrar tartılır.
- , Kuyuların temiz ve enkaz veya toz olduğundan emin olmak için dikkatlice her rotor kontrol Ultrasantrifügasyon tüpler sırasında delinme olabilir.
- Tüplerin birbirlerine karşısında dengeli bir çifti ile rotor içine yerleştirin. Ultrasantrifügasyon süreci hasarlı veya silinecek işaretleyici etiketler neden olabilir, çünkü her numunenin rotor konumu kaydedin. Dikkatle üretici tarafından belirtilen rotor kuyu mühür.
- Ultrasantrifüjdeki rotor yükleyin. Ultrasantrifüjdeki kapağını kapatın ve bir vakum uygulamak. VTi 65,2 rotor kullanarak, 44,100 rpm (~ 177.000 xg av), sıcaklık 20 ° C ve Ultrasantrifügasyon süresi 36-40 saat dönme hızını ayarlayabilirsiniz. Vakum, maksimum ivme seçin ve fren kapatmak (yavaşlama kesintiye uğramaması degrade sağlar). Not fren kapatarak çalışma süresi için ek bir 1-2 saat katacak. Ayrıca kısa vadede yeterli bant çözünürlük elde değil unutmayın. Uzun Ultrasantrifügasyon farklı nükleik asit gruplarından daha yüksek çözünürlük kurşun gibi çalışır, tavsiye edilir.
- Ultrasantrifügasyon prosedürünün tamamlanmasından hemen sonra, rotor dikkatlice kaldırmak. Herhangi bir devirme kaçınmak ya da rotor darbeleme, yavaşça tüpler içinde gradyanlar rahatsız etmemek için rotor tüpleri kaldırmak. Nadir durumlarda, bir tüp çalışması sırasında patlama olacak. Eğer öyleyse, diğer tüpler gradyanlar düzgün formu olmadığını bir şansı yoktur. Bir kontrol degrade dahil ise, degrade oluşumu onaylamak için UV ışığı altında bu tüp dikkatli bir şekilde kontrol edin. Degrade kontrol tüpü düzgün biçimde varsa, 5. adımı tekrar etmek iyi olur. Not EtBr kontrol tüpü ve boş kontrolü karanlıkta saklanan ve altı ay için yeniden olabilir. Üreticinin talimatlarına göre patlama tüp çıkarıldıktan sonra rotor dikkatlice temizlemek için özen gösterin. Rotor kuyular çizilmesini önlemek için rotor kuyu temizlemek için metal fırçalar veya aşındırıcı temizleyiciler kullanmayın! Rotor özel fırça ve temizleme solüsyonu Beckman satın alınabilir.
6. Gradient Fraksiyonu
Ultrasantrifüjdeki tüpler DNA kurtarmak için kullanılan iki yöntem vardır: fraksiyonasyon ve iğne çıkarma. Bu protokol sadece fraksiyonasyon tekniği kullanılarak DNA çıkarma süreci anlatacaktır. Çoğu SIP deneyler için, işaretli DNA EtBr ile görüntülendi ve yerine birden fazla numune tüpleri eşdeğer ışık ve ağır kesirler karşılaştırarak tespit edilmelidir, çünkü bu. Bir şırınga pompası çok ultrasantrifüjdeki tüpleri eşit yoğunluk gradiyenti fraksiyonları almak için tavsiye edilir. Biz BSP modeli infüzyon pompası (Braintree Bilimsel Inc.) Kullanın. Düşük-akış peristaltik pompa veya HPLC pompası de kullanılıyor olabilir.
- Steril GKD 2 O koyu mavi bir renk sağlamak için yeterli Bromophenol Mavi boya içeren 60 ml steril bir şırınga doldurun . Şırınga pompası yükleme kolunda şırınga yerleştirin.23-gauge 1 "iğne ve bazı GKD 2 O bu GKD 2 O kaynağı herhangi bir hava kabarcığı fraksiyonasyon süreci olumsuz etkileyeceğini iğne Not sonuna kadar gelmiştir kadar açmak pompa ile donatılmış pompa boru takın.
- Bir kelepçe stand Ultrasantrifügasyon tüpleri sabitleyin. Kelepçesi, tüp deldi CSCL çözüm salınımına neden olur tüpü, basınç tüpü yerinden olma önlemek için yeterince sıkı ama o olun. Pierce iğne. Taze 23 gauge 1 kullanarak tüp tüp dikiş boyunca en altta "En iyi sonuçlar için, delmek, kontrollü, hızlı ve kendinden emin bir şekilde tüp Bu iyi yapmak çok zor, daha önce birkaç kez uygulama Bu ilk örnek tüpleri ile çalışılır.
- Her bir numune için, numune sayısı ve fraksiyonu (ışığa ağır 1-12) gösteren etiketler ile 12 steril 1,5 ml mikrosantrifüj tüpler hazırlamak. Tüp üst üst tüp omzuna dikiş boyunca, pierce, pompa boru (adım 6.1) bağlı iğne kullanma. Mikrosantrifüj tüpler kullanarak degrade çözüm toplayın. Tüpün alt tüp hızlı ve kontrollü bir şekilde delmek için yapılır. Önceden Uygulama ve tüp aracılığıyla geçen ve bir parmak içine zorla iğne önlemek için kontrollü bir çekme hareketi kullanmak için çok dikkatli olun! 12 dakika (425 ul dk -1) 12 x 425 ul kesirler verecektir önceden kalibre edilmiş pompa hızı kullanın .
- Doğru degrade oluşumunu onaylamak için veya bir degrade kesirler yoğunluğu kontrol etmek için analitik bir denge, bir dijital refraktometre (önerilen örneğin Reichert AR200) kullanın. Bu test için numune ~ 50 ul kullanmanız gerekecektir. Biz sık sık fraksiyonasyon için bir denetim görevi ve yoğunluğunun tespiti için bunu kullanmak için bir tüp içinde saf kültür DNA (EtBr kontrol gradyanlar hazırlamak için açıklandığı gibi) içerir. Yoğunlukları ~ 1,725 g ml -1 medyan yoğunluğu ile ~ 1,690-1,760 g ml -1 aralığı bekliyoruz.
7. DNA Yağış
- Çökelme DNA yağış için bir taşıyıcı olarak ilk kez 20 mikrogram doğrusal poliakrilamid ekleyerek bütün fraksiyonları. Tersine çevirerek karıştırın. 2 PEG çözüm hacimleri (adım 1) ve tersine çevirerek karışımı ekleyin. Yağış için bir taşıyıcı (örneğin glikojen veya doğrusal poliakrilamid) degrade hizip DNA kantitatif kurtarma için kritik, ama dikkatli olduğunu unutmayın, bu protokol için yağış için bir taşıyıcı olarak kullanılan glikojen ise kullanılmalıdır. Glikojen hazırlıkları bakteriyel nükleik asit ile kontamine olduğu gösterilmiştir ve kirlenme kolayca SIP degrade kesirler 12 yorumlanması karıştırmayın olabilir.
- Çökelti DNA izin tüpleri 2 saat boyunca oda sıcaklığında bekletin. İsterseniz, tüpler oda sıcaklığında bir gecede terk edilebilir.
- Arka rotor tutarlı bir tüp yönelim dışa bakan tüpleri ile 30 dakika 13.000 g santrifüjleyin. Dikkatlice aspire ve supernatant atın. Bir pelet görünür olmalıdır, ancak bu aşamada görmek için çok zor olabilir. Pelet görselleştirmek yardımcı olmak için, parlak bir ışık kaynağı (örneğin, masa lambası) altında çalışın.
- Pelet 500 ul% 70 etanol ile yıkayın. 13.000 g de 10 dakika boyunca santrifüjleyin. Dikkatlice aspire ve supernatant atın. Genellikle pelet Bu adım için daha görünür olacak, ama daha kolay tüp duvar ilgimiz yoktur.
- Pelet, 15 dakika boyunca oda sıcaklığında kurumaya bırakın.
- (Bkz: adım 1.5) 50 TE tampon ul her pelet askıya alınması. Standart laboratuvar protokollere göre bir agaroz jel üzerinde her fraksiyon 5 ul çalıştırın.
8. Kesir Karakterizasyonu
SIP kuluçka başarısını değerlendirmek için degrade kesirler karakterize etmek için kullanılan yöntem, laboratuvar ekipman ve yer durumu bağlı olarak değişecektir. 16S rRNA gen hedeflemesi için bir parmak izi yöntemi kullanarak terminali restriksiyon parça uzunluk polimorfizmi (T-RFLP) veya denatüre edici gradient jel elektroforezi gibi ortak bir yaklaşım ve yöntemleri (DGGE) (Şekil 1) uygun. Yukarıda açıklanan protokol sonrasında, kesirler 9-11 (~ 1,705-1,720 g ml -1) ve ağır DNA parmak izi ile ilişkili olduğu için ışık DNA kesirler 5-8 (~ 1,720-1,735 g ml -1 içinde ilişkili olduğu bekleyebilirsiniz .) Izotop istikrarlı inkübe örnekleri kesirler 5-8 ile ilişkili Benzersiz parmak izi değil, yerli-substrat inkübe kontrolleri ile özellikle etiketli substrat metabolizması ile belirli organizmaların birbirine bağlayan güçlü bir kanıt sağlar. Yetersiz işaretli DNA bazı uygulamalar (hibridizasyon, metagenomics) kalırsa, birden fazla deplasman amplifikasyon büyük miktarda 13-15 üretmek için kullanılan olabilir ama bu amplifiye DNA 14,16 kimeralar tanıtmak.
9. Sonuçlar
Tipik DNA SIP sonuçları etiketli ve etiketlenmemiş DNA Ultrasantrifügasyon tarafından oluşturulan degrade bir ayrım gösterecektir. İdeal olarak, etiketsiz malzemelerden yüksek molekül ağırlıklı genetik materyal tam çözünürlüğü (örneğin 13 C, 15 N) elde edilecektir. Çözünürlük EtBr kontrol tüplerinde bant oluşumu gözlemleyerek görsel olarak tanık olmak mümkün. Bireysel degrade kesirler bulunan alınan genomik DNA konsantrasyonları doğru degrade oluşumu da onaylamak için de kullanılıyor olabilir.
Bu protokol için, degrade Ultrasantrifügasyon temsilcisi sonuçlar nükleik asit kullanılarak yapılan iki saf kültürlerin (Şekil 2). Fraksiyone degrade buraya dahil S. çıkarılan genomik DNA kullanılarak hazırlanmıştır. meliloti (ATCC 1021) ve 13 C-etiketli M. capsulatus str. Banyosu. Ultrasantrifügasyon, bölme ve DNA kurtarma, etiketlenir ve farklı yoğunlukları (Şekil 2A) ile ilgili degrade kesirleri ayırmak genomik DNA etiketlenmemiş. Etiketlenmemiş DNA kesirler 9-10 yüksek konsantrasyonlarda ise Ağır izotop etiketli DNA kesirler 4-5 görülebilir. Her bir fraksiyon elde edilen DNA denatüre edici gradient jel elektroforezi 17 ve degrade (Şekil 2B) dahil iki organizmalar için uygun ayrık bantlama desenler oluşturulan PCR-amplifiye ürünler ile karakterize edilmiştir. ~ 1.580 değişiyordu kesirler yoğunluğu - 1.759 g ml -1, ve soldan sağa doğru yoğunluğu azalan sırasına göre gösterilmiştir.
Mesafeyi 13 saf C ve 12 C-DNA (Şekil 2) telaffuz edilebilir, çevresel örnek inkubasyon yorumlamak daha zor olsa da. Örneğin, 14 günlük süre için 15 ya 12 C veya 13 C-işaretli glukoz ° C Resolute Bay (Nunavut, Kanada) toprak tundra inkübe Degrade fraksiyonu saflaştırılmış DNA agaroz jel için 7-10 fraksiyonları arasında genomik DNA 'bulaşma' olduğunu göstermiştir hem 12 C ve 13 C-inkubasyon (Şekil 3A ve 3C, sırasıyla). Bu durumda, sadece 13, özellikle mikrobiyal takson biyokütle C-zenginleştirme 16S rRNA genleri, DGGE gibi bir yaklaşımla tespit edilebilir . 12 C-glikoz inkübe toprak DNA tüm degrade fraksiyonları (Şekil 3B) arasında benzer modeller üretir, ancak 13 C-glikoz inkübe örnek benzersiz 5-8 (Şekil 3 boyutlu) fraksiyonları ile ilişkili DGGE parmak izi oluşturulur. Özellikle ilgi çekici olan oklarla gösterilen korunmuş gruplar var. Bu baskın 'phylotype' tüm degrade kesirler ancak 13 C-glikoz inkübe topraktan elde edilen DNA ağır fraksiyonları vardiya tutarlı . Bu bant ve / veya klon kütüphanesi analiz sıralama Müteakip bu özel 16S rRNA gen DNA kimlik onaylamak ve sonraki metagenomic veya kültür temelli yaklaşımlar rehber olacaktır.
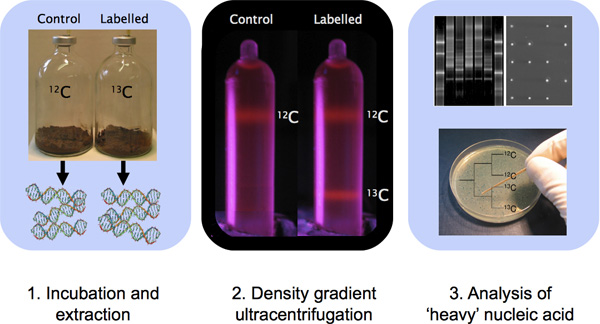
Şekil 1 örnek inkübasyon, DNA izolasyonu, CSCL yoğunluğu degrade Ultrasantrifügasyon ve moleküler tekniklerle DNA karakterizasyonu içeren bir DNA SIP deney Anahat.
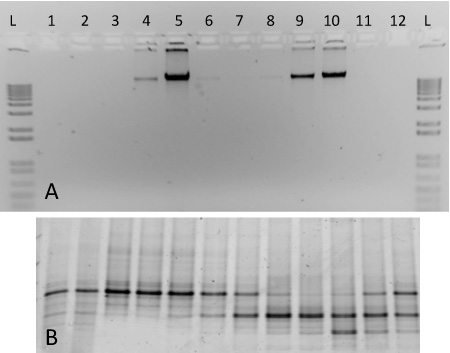
Şekil 2 iki saf kültürlerin DNA da dahil olmak üzere bir SIP degrade fraksiyonasyon sonuçları bekleniyor. (A) 13 C-etiketli M. içeren bir degrade degrade kesirler 1-12 DNA Alikot% 1 agaroz jel üzerinde çalıştırmak capsulatus gerginlik Banyo (kesirler 4-6) ve 12 C-etiketli S. meliloti (8-10 kesirler). 1-kb merdiven, (B) PCR-amplifiye DNA aynı fraksiyonları% 10 DGGE jel üzerinde çalışan karşılaştırma için dahil edilmiştir. Parmak İzi desenleri, örneğin 5 ve 9 fraksiyonları arasında belirgin farklılıklar ortaya koymaktadır.
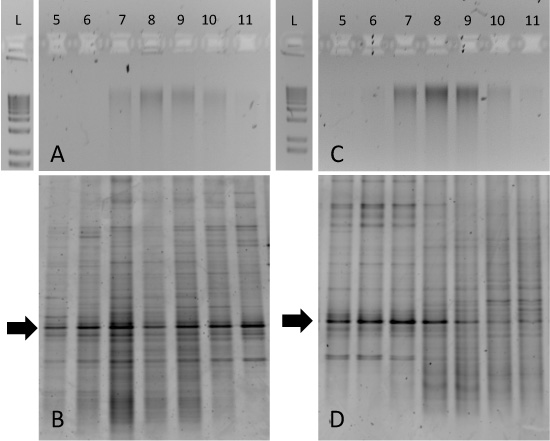
Şekil 3, toprak örneği inkubasyon SIP degrade since sonuçları bekleniyor . Hem 12 C-glikoz değiştirilmiştir toprak (A) ve 13 C-glikoz değiştirilmiştir toprak (C) degrade kesirler alikotları% 1 agaroz jel üzerinde çalışan ve karşılaştırma için 1 kb merdiven dahildir. Sorumlu DGGE Bu örneklerin her biri için parmak izi (B) ve (D). Parmak İzi kesirler kesirler 5-8 (D) 13 C-glikoz değiştirilmiştir örnek özellikle bakteriyel takson zenginleştirilmesi ortaya koymaktadır.
Tartışmalar
Kararlı izotop sondalama deneyleri doğru tasarım arka plan etiketlenmemiş topluluk yukarıdaki işaretli DNA elde etmek için kritik önem taşımaktadır. Inkübasyon sürelerinde, substrat konsantrasyonları, inkübasyon koşulları (örneğin, besin, toprak nem içeriği), çapraz besleme ve çoğaltma örnek ilgili Hususlar başka 10,18 tartışılan ve bir SIP inkübasyon tasarlarken okuyucu bu yayınların başvurun tavsiye edilmiştir. Geçerli protokol, SIP gradyanlar verilerin yorumlanması ile i...
Açıklamalar
Teşekkürler
Bu çalışma Stratejik Proje ve Kanada Doğal Bilimler ve Mühendislik Araştırma Konseyi (NSERC) JDN Discovery Hibeler tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments | |
| Bromophenol Blue | Reagent | Fisher Scientific | BP115-25 | |
| Cesium chloride | Reagent | Fisher Scientific | BP210-500 | |
| Ethanol, reagent grade | Reagent | Sigma-Aldrich | 652261 | |
| Ethidium bromide | Reagent | Sigma-Aldrich | E1510 | |
| Hydrochloric acid | Reagent | Fisher Scientific | 351285212 | |
| Linear polyacrylamide | Reagent | Applichem | A6587 | |
| Polyethylene Glycol 6000 | Reagent | VWR international | CAPX1286L-4 | |
| Potassium Chloride | Reagent | Fisher Scientific | AC42409-0010 | |
| Sodium Chloride | Reagent | Fisher Scientific | S2711 | |
| Sodium Hydroxide pellets | Reagent | Fisher Scientific | S3181 | |
| Tris base | Reagent | Fisher Scientific | BP1521 | |
| Dark Reader | Equipment | Clare Chemical | DR46B | |
| Microcentrifuge | Equipment | Eppendorf | 5424 000.410 | |
| Nanodrop 2000 | Equipment | Fisher Scientific | 361013650 | |
| Infusion pump | Equipment | Braintree Scientific, Inc. | N/A | Model Number: BSP See www.braintreesci.com for ordering details. |
| Tube sealer | Equipment | Beckman Coulter Inc. | 358312 | |
| Ultracentrifuge | Equipment | Beckman Coulter Inc. | ||
| Ultracentrifuge rotor | Equipment | Beckman Coulter Inc. | 362754 | |
| Ultraviolet light source | Equipment | UVP Inc. | 95-0017-09 | Any UV source will suffice |
| Ultraviolet light face shield | Equipment | Fisher Scientific | 114051C | |
| Butyl rubber stoppers, gray | Material | Sigma-Aldrich | 27232 | |
| Centrifuge tubes | Material | Beckman Coulter Inc. | 342412 | |
| Hypodermic needle, 23 gauge, 2” length | Material | BD Biosciences | 305145 | |
| Microfuge tubes, 1.5 mL | Material | DiaMed | AD151-N500 | |
| Open center seals, 20 mm diameter | Material | Sigma-Aldrich | 27230-U | |
| Pasteur pipettes, glass | Material | Fisher Scientific | 13-678-6C | |
| Pipet tips | Material | DiaMed | BPS340-1000 | Catalogue number is for 200 μl tips. 10 or 20 μl tips may be purchased from the same source |
| Pump tubing 1.5 mm bore x 1.5 mm wall | Material | Appleton Woods | ||
| Screw-cap tubes, 15 mL | Material | DiaMed | AD15MLP-S | |
| Serum vials, 125 mL volume | Material | Sigma-Aldrich | Z114014 | |
| Syringe, 60 mL | Material | BD Biosciences | 309653 |
Referanslar
- Neufeld, J. D. DNA stable-isotope probing. Nat. Protocols. 2, 860-866 (2007).
- Neufeld, J. D., Boden, R., Moussard, H., Schäfer, H., Murrell, J. C. Substrate-specific clades of active marine methylotrophs associated with a phytoplankton bloom in a temperate coastal environment. Appl. Environ. Microbiol. 74, 7321-7328 (2009).
- Nercessian, O., Noyes, E., Kalyuzhnaya, M. G., Lidstrom, M. E., Chistoserdova, L. Bacterial populations active in metabolism of C1 compounds in the sediment of Lake Washington, a freshwater lake. Appl. Environ. Microbiol. 71, 6885-6899 (2005).
- Padmanabhan, P. Respiration of 13C-labelled substrates added to soil in the field and subsequent 16S rRNA gene analysis of 13C-labelled soil DNA. Appl. Environ. Microbiol. 69, 1614-1622 (2003).
- Bernard, L. Dynamics and identification of soil microbial populations actively assimilating carbon from 13C-labelled wheat residue as estimated by DNA- and RNA-SIP techniques. Environ. Microbiol. 9, 752-764 (2007).
- Haichar, e. l. Z. a. h. a. r., F, . Identification of cellulolytic bacteria in soil by stable isotope probing. Environ. Microbiol. 9, 625-634 (2007).
- Addison, S., McDonald, I., Lloyd-Jones, G. Stable isotope probing: Technical considerations when resolving 15N-labelled RNA in gradients. J. Microbiol. Meth. 80, 70-75 (2009).
- Buckley, D. H., Huangyutitham, V., Hsu, S. -. F., Nelson, T. A. Stable isotope probing with 15N achieved by disentangling the effects of genome G + C content and isotope enrichment on DNA density. Appl. Environ. Microbiol. 73, 3189-3195 (2007).
- Schwartz, E. Characterization of growing microorganisms in soil by stable isotope probing with H218O. Appl. Environ. Microbiol. 73, 2541-2546 (2007).
- Neufeld, J. D., Dumont, M. G., Vohra, J., Murrell, J. C. Methodological considerations for the use of stable isotope probing in microbial ecology. Microb. Ecol. 53, 435-442 (2007).
- Martineau, C., Whyte, L., Greer, C. Development of a SYBR safe technique for the sensitive detection of DNA in cesium chloride density gradients for stable isotope probing assays. J. Microbiol. Meth. 73, 199-202 (2008).
- Bartram, A. K., Poon, C., Neufeld, J. D. Nucleic acid contamination of glycogen used in nucleic acid precipitation and assessment of linear polyacrylamide as an alternative co-precipitant. Biotechniques. 47, 1019-1022 (2009).
- Chen, Y. Revealing the uncultivated majority: combining DNA stable-isotope probing, multiple displacement amplification and metagenomic analyses of uncultivated Methylocystis in acidic peatlands. Environ. Microbiol. 10, 2609-2622 (2008).
- Neufeld, J. D., Chen, Y., Dumont, M. G., Murrell, J. C. Marine methylotrophs revealed by stable-isotope probing, multiple displacement amplification and metagenomics. Environ. Microbiol. 10, 1526-1535 (2008).
- Kalyuzhnaya, M. High-resolution metagenomics targets specific functional types in complex microbial communities. Nat. Biotechnol. 26, 1029-1034 (2008).
- Binga, E. K., Lasken, R. S., Neufeld, J. D. Something from (almost) nothing: the impact of multiple displacement amplification on microbial ecology. ISME J. 2, 233-241 (2008).
- Green, S. J., Leigh, M. B., Neufeld, J. D., Timmis, K. N. . Microbiology of Hydrocarbon and Lipid Microbiology. , 4137-4158 (2010).
- Neufeld, J. D., Wagner, M., Murrell, J. C. Who eats what, where and when? Isotope-labelling experiments are coming of age. ISME J. 1, 103-110 (2007).
- Gallagher, E., McGuinness, L., Phelps, C., Young, L. Y., Kerkhof, L. J. DNA shortens the incubation time needed to detect benzoate-utilizing denitrifying bacteria by stable-isotope probing. Appl. Environ. Microbiol. 71, 5192-5196 .
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır