Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
ДНК-Stable-Изотопный Зондирование (ДНК-SIP)
В этой статье
Резюме
ДНК-стабильный изотоп зондирования выращивание-независимый метод для определения и характеристики активных сообществ микроорганизмов, способных использовать специфические субстраты. Ассимиляция субстрата обогащенный тяжелым изотопом приводит к включению меченых атомов в микробной биомассы. Ультрацентрифугирования градиента плотности извлекает меченых ДНК для последующих молекулярного анализа.
Аннотация
ДНК-стабильный изотоп зондирования (ДНК-SIP) является мощным средством для идентификации активных микроорганизмов, усваивающих частности подложках углерода и питательных веществ в клеточную биомассу. Таким образом, это выращивание независимый метод был важным методологии присвоения метаболические функции различных общин, населяющих широкий диапазон наземных и водных средах. После инкубации экологические образца со стабильным изотопом меченых соединений, выделенных нуклеиновой кислоты подвергается плотность ультрацентрифугирования градиента и последующего фракционирования градиент на отдельные нуклеиновых кислот разной плотности. Очистка ДНК из хлорида цезия извлекает меченого и немеченого ДНК для последующего молекулярная характеристика (например, отпечатков пальцев, микрочипы, клон библиотеки, metagenomics). Это Юпитер протокола видео обеспечивает визуальную шаг за шагом объяснения протокол для градиента плотности ультрацентрифугирования, фракционирования градиента и восстановления меченых ДНК. Протокол также включает в себя образцы SIP данных и выделяет важные советы и предостережения, которые необходимо учитывать для обеспечения успешной ДНК-SIP анализа.
протокол
1. Подготовка реагентов
ДНК-SIP требует использования реагентов, которые должны быть подготовлены до начала фактической процедуры. Направления подготовки каждого реагента, перечислены в этом разделе и изменяются от предыдущего протокола SIP 1.
- Хлорид цезия (CsCl) решение для подготовки SIP градиентов - Подготовка 7,163 М CsCl решение, постепенно растворяясь 603,0 г CsCl в дистиллированной и деионизированной воды (DDH 2 O) до конечного объема 500 мл. Будьте осторожны, чтобы не превышать 500 мл! Потепление решение слегка помешивая поможет растворить все CsCl. Алиготе окончательное решение в запечатанных аликвоты. В нашей лаборатории, обычной практикой хранения заключается в подготовке 100-мл порции в 125-мл сыворотки пузырьки, которые затем опрессовки запечатанный с пробками бутиловый каучук. Запечатанных аликвоты могут храниться бесконечно при комнатной температуре (20 ° С). Печатей помочь предотвратить испарение и CsCl "корочка" образования. Определить плотность раствора путем взвешивания трех экземплярах 100-мкл аликвоты, или с помощью цифрового рефрактометра (например, Reichert AR200), которые были тщательно продуманы для CsCl решений. После калибровки успешно, Reichert AR200 является последовательной и обеспечивает точные показания в течение нескольких лет. При комнатной температуре (20 ° С), конечная плотность этого раствора обычно составляет от 1.88-1.89 г мл -1. Плотность меняется незначительно каждый раз новые акции подготовлены.
- Цезий раствора хлорида для подготовки градиенты с этидий бромид (EtBr) - Объединение 250 г CsCl с 250 мл стерильной воды DDH 2 O. Алиготе это решение в отдельных сыворотке флаконов, которые были опрессовки запечатанный бутил резиновые уплотнения, как описано в п. 1.1.
- Градиент буфера - Объединение 50 мл 1 М Трис-HCl, 3,75 г хлорида калия и 1 мл 0,5 М ЭДТА до 400 мл воды. Растворите KCl, затем добавить DDH 2 O до 500 мл. Фильтр-стерилизовать и автоклав. Окончательное решение является 0,1 М Трис, 0,1 М KCl и 1 мМ ЭДТА.
- Полиэтиленгликоль (ПЭГ) решение - Подготовка PEG решение, растворяя 150 г полиэтиленгликоля 6000 и 46,8 г NaCl в стерильной воде DDH 2 O в общем объеме 500 мл (30% ПЭГ, 1,6 М NaCl). Автоклав.
Примечание: Это решение разделяется на две фазы с автоклавированием. Включите мешалку в автоклаве бутылку так что решение может быть должным образом смешиваются, когда это происходит. - ТЕ-буфера - Подготовка раствора 10 мМ Трис-HCl (рН 8,0) и 1 мМ ЭДТА (рН 8,0) в стерильной воде DDH 2 O, используя автоклавного растворы 1 М Трис-HCl (рН 8,0) и 0,5 М ЭДТА ( рН 8,0). Фильтры стерилизовать и автоклав.
- 70% этанола - Объединение 350 мл этанола высокой чистоты с 150 мл стерильной воды DDH 2 O.
2. Инкубационный проб и выделения ДНК
Для ДНК-SIP инкубации, образцы, как правило, инкубировали с тяжелым изотопом углерода (13 С) подложки. Инкубационный период и условия (например, питательных добавок, влаги, света) будет варьироваться в зависимости от типа образца, которые выдерживают и природы подложки. ДНК-SIP эксперименты были успешно выполнены с использованием различных отдельных соединений углерода 2,3, мульти-углеродные соединения 4,5,6 и использовании меченого азота или кислорода 7,8 9. Тем не менее, недостаток использования N-15 или 18 O-меченых соединений является снижение физической разделения меченых нуклеиновых кислот, в первую очередь из-за наличия меньше атомов азота и кислорода в ДНК и РНК по сравнению с атомами углерода.
Критических контрольных для ДНК-SIP экспериментов идентичны инкубации создан с носителями (например, 12 С) подложки. Это инкубации обеспечивает последующее сравнение обеспечить, чтобы любые очевидной маркировки нуклеиновой кислоты не артефакт ультрацентрифугирования или G + C содержания плотность различия в ДНК, способствует разделению 10. Кроме того, важно держать замороженными образец материала для сравнения с "огонь" и "тяжелых" ДНК, и стоит в том числе не-подложка контроля для оценки изменений фона населения на всей инкубации SIP.
- Инкубируйте проб окружающей среды в микрокосм содержащие меченого субстрата (рис. 1). По нашему опыту, мы обнаружили, что минимальное включение между 5-500 мкмоль 13 С углерода на грамм образца будут пригодны для образцов, содержащих высокие биомассы, таких как образцы почв 1. Для водных образцов, содержащих менее, чем биомассы почвы, 1-100 мкмоль включены 13 С углерода на литр может дать обнаружены тяжелые изотопные подписи 1. Количество углерода, поправки, доля углерода включены в биомассу и потребность в дополнительных питательных кроме того, для усвоения все будет зависеть от характеристик образцов, анализ и целевое оrganisms интересов. Единый набор руководящих принципов инкубации образца не будут применимы для всех образцов. Важно отметить, что концентрация субстрата использовали для инкубации SIP в идеале должно быть как можно ближе к концентрации, обычно возникающие на месте; экспериментальные смещение может быть следствием обогащения культуры условия 10.
- После инкубации образца со стабильным изотопом меченого субстрата, извлекать ДНК из микрокосмы использованием строгого протокола экстракции (для ПЦР или небольшой клонирования вставки) или доверенные ферментативного лизиса для высокой молекулярной массой клонирования (например, большие вставки metagenomics). РНК совместного извлечения как правило, не влияет на анализ, поэтому протоколы, которые дают РНК, а также ДНК может быть использована. Ультрацентрифугирования извлеченной ДНК не будет сдвига фрагментов короче, чем ~ 50 пар кб 1.
- Количественная извлечения ДНК до настройки CsCl труб ультрацентрифугирования градиента. Количественная ДНК с использованием спектрофотометра (например Nanodrop 2000), если добыча протокол дает только ДНК (например, колонка основе комплектов). Кроме того, количественно использованием электрофореза в агарозном геле.
3. Подготовка градиента решения для ультрацентрифугирования
Эта процедура включает в себя добавление ДНК ультрацентрифуге труб. Есть больше чем один тип труб и ротор так точное протокол будет меняться и будет зависеть от инструкции производителя. Тем не менее, мы рекомендуем использовать вертикальным ротором и для обеспечения максимально возможного разделения легкой и тяжелой ДНК. Мы используем Beckman Coulter-ВТИ 65,2 ротор с 16 скважин для проведения 5,1 мл пробирок QuickSeal Polyallomer и протокол обеспечит шаги и соображения для этих условий.
- Использование ДНК концентрациях определяется в пункте 2.3, расчет необходимого объема добываемого ДНК, которые необходимо предоставить 0,5 мкг - 5 мкг ДНК в ультрацентрифуге труб.
- Комбинат извлечения ДНК (0,5 - 5 мкг) с градиентом буфера (см. шаг 1.3) и 4,8 мл 7,163 М CsCl с общим объемом ~ 6 мл в стерильные одноразовые 15-мл трубки. Обратите внимание, что плотность CsCl решение может меняться даже в то же молярности (см. шаг 1.1). Следующее уравнение может быть использовано для определения объема буфера Градиент / ДНК смесь, которая требуется для генерации соответствующих соотношении:
Градиент буфера и раствора ДНК объем (мл) = (CsCl маточного раствора плотность - желаемой конечной плотности) х Объем CsCl маточного раствора добавил х 1,52
Укажите объем CsCl маточного раствора на 4,80 мл. Желаемой конечной плотности должна быть 1,725 г мл -1. Плотность исходного раствора была определена в шаге 1.1.
Отметим также, что относительные объемы CsCl и градиент буфера / ДНК приведет к совокупный объем составляет более 5,1 мл. Подготовка объемах, превышающих максимальную емкость объемом ультрацентрифуге труб (более 5,1 мл) обеспечит, что есть достаточное решение, чтобы полностью заполнить трубу. - Смешайте путем обращения в 10 раз. ДНК стабилен при комнатной температуре в CsCl.
4. Создание градиента EtBr управления (опция)
Потому что это EtBr интеркалирующих красителя, что комплексы с ДНК, что делает его видимым под УФ-светом, контроль градиенты содержащие EtBr полезны, потому что они обеспечивают немедленное визуальное подтверждение градиентом формирование до фракционирования образцов труб (например, рисунок 1). Включение контроль трубки, содержащей EtBr и смесь того и другого 12 C-ДНК и 13 С-ДНК (или 14 N-ДНК и 15 Н-ДНК) позволяет немедленно визуализации группа образование в трубах после завершения ультрацентрифугирования. Это важно, поскольку разрыв трубки во время ультрацентрифугирования или неправильно запрограммированы условия запуска может привести к образованию градиента не удалось. Связанные с ДНК, EtBr снижает плотность ДНК и, как следствие, другой протокол следует подготовить градиентов. Обратите внимание, что другие нуклеиновые кислоты пятна могут быть использованы вместо EtBr 11, но протокол требует оптимизации с другими флуорофоров.
- Контроль градиента требует двух томах геномной ДНК: одна полностью помечены стабильного изотопа и один без этикетки. Обычно мы используем либо Sinorhizobium meliloti культивировали в среде, содержащей 13 C-12 или С-глюкозы в качестве единственного источника углерода, или Methylococcus capsulatus штамм ванн культивировались в присутствии 13 C-12 или С-метана в качестве нашего контроля.
- Комбинат 5 -10 мкг количества как 12 C-ДНК и 13 C-ДНК с градиентом буфера в конечном объеме 1,00 мл в одноразовых 15-мл завинчивающейся крышкой трубки.
- Добавить 1,00 г твердого CsCl к той же трубе. Смешайте по инверсии.
- Добавить 110 мклпо 10 мг мл -1 EtBr раствора и 4,3 мл 1 г мл -1 CsCl маточного раствора к тому же завинчивающейся крышкой трубки, используемые в шаге 4.2. Окончательный плотность раствора будет приблизительно у исходного CsCl маточного раствора.
- Дополнительных "пустых" контроль раствор, содержащий EtBr также будут обязаны в противовес решение, созданное в шаге 4.4. Комбинат 1,00 мл градиент буфера, 1,00 г CsCl, 110 мкл 10 мг мл -1 EtBr раствора и 4,3 мл 1 г мл -1 CsCl маточного раствора в отдельную 15 мл завинчивающейся крышкой трубки и микс от инверсии.
5. Ультрацентрифугирования
- Использование лампы и пипетки Пастера внимательно заполните ультрацентрифуге труб с градиентом растворов, приготовленных в п. 3.2 (или шаги 4,4, если подготовка градиент EtBr контроля). Аккуратно добавить решений для труб С помощью пипетки Пастера. Этикетка трубки на трубку плечом с тонким перманентным маркером. ВНИМАНИЕ: Убедитесь, что трубы заполнены именно к основанию трубки шеи. Недостаточно заполнены трубы могут лопнуть во время ультрацентрифугирования.
- Когда все необходимые трубы заполнены образцы решений, записывать точные масса каждой трубки. Пара труб и сбалансировать их с точностью до 0-10 мг. Для балансировки, найти практически сравнялась пар и добавить или удалить незначительное количество раствора, пока они не сбалансированы, сохраняя уровень раствора как можно ближе к основанию трубки шеи насколько это возможно. Обратите внимание, что для взвешивания труб, мы используем перевернутый 15-мл завинчивающейся крышкой трубки, разрезанные пополам, как трубка держатель для баланса.
- Уплотнение труб с помощью «трубки цилиндр" в соответствии с инструкциями производителя.
- Убедитесь, что трубы запечатан должным образом, обратив их и применяя умеренным давлением. Взвесьте трубы снова, чтобы проверить, что они все еще балансирует после уплотнения в пределах 0-10 мг.
- Проверьте каждый ротор также тщательно, чтобы гарантировать, что скважины чистыми и свободными от мусора и пыли, которые могли бы прокол труб во время ультрацентрифугирования.
- Вставьте трубки в ротор с сбалансированной пары противоположных друг другу. Запись ротора расположение каждого образца, потому ультрацентрифугирования процесса может привести к маркеру этикетки должны быть повреждены или стерты. Тщательно уплотнение ротора скважин, как указано производителем.
- Загрузите ротор в ультрацентрифуге. Закрыть дверь ультрацентрифуге и применять вакуум. При использовании VTI 65,2 ротор, установить скорость вращения 44100 оборотов в минуту (~ 177 000 мкг пр.), температура 20 ° С, и ультрацентрифугирования время 36-40 часов. Выберите вакуум, максимальное ускорение и отключить тормоза (обеспечивает градиент не нарушена замедление). Обратите внимание, что отключение тормоза добавят дополнительные 1-2 часа, чтобы во время выполнения. Также отметим, что более короткое время запустить, не может достичь достаточной разрешающей группы. Длинные пробежки ультрацентрифугирования рекомендуется, так как они приводят к большим разрешением различных нуклеиновых кислот полосы.
- Сразу же после завершения процедуры ультрацентрифугирования, удалить ротор тщательно. Как избежать любого наклона или натыкаясь ротора, аккуратно удалить из трубы ротора чтобы не потревожить градиентов внутри труб. В редких случаях трубка лопнет во время запуска. Если это так, есть шанс, что градиенты в других трубах не образуется нормально. Если контроль градиент был включен, проверьте эту трубку осторожно под ультрафиолетовым светом, чтобы подтвердить градиент образования. Если градиент не сформирована должным образом в контрольную пробирку, то лучше повторить все действия 5. Обратите внимание, что EtBr трубки контроля и его пустым контроль может храниться в темном месте и использовать повторно на срок до шести месяцев. Позаботьтесь, чтобы очистить ротор тщательно в соответствии с инструкциями изготовителя раз взрыв трубка была удалена. Не используйте металлические щетки или абразивные чистящие средства для очистки ротора скважин для того, чтобы избежать царапин на ротор скважин! Ротор конкретных щетками и чистящего раствора можно приобрести у Бекман.
6. Градиент Фракционирование
Есть два метода, которые в настоящее время используется для восстановления ДНК из ультрацентрифуге труб: фракционирования и иглы добычи. Этот протокол будет только описать процесс извлечения ДНК с использованием фракционирования техники. Это потому, что для большинства экспериментов SIP, меченых ДНК не могут быть визуализированы с EtBr и должны, а не быть обнаружены путем сравнения эквивалентной легких и тяжелых фракций из нескольких труб образца. Шприцевой насос, настоятельно рекомендуется получить равные доли градиент плотности от ультрацентрифуге труб. Мы используем настой BSP модель насоса (Braintree Научно Inc.) Малым расходом перистальтического насоса или насоса ВЭЖХ также может быть использован.
- Заполните стерильные 60-мл шприц стерильным DDH 2 O, содержащих достаточное бромфенола синего красителя обеспечить темно-синий цвет. Место шприца по загрузке рука шприцевой насос.Прикрепите насос трубки оснащены 23 калибра 1 "иглу и включить насос, пока некоторые DDH 2 O пришло до конца иглы. Обратите внимание, что все воздушные пузырьки в этот запас DDH 2 O отрицательно скажется на процессе фракционирования.
- Зафиксируем одну из ультрацентрифугирования труб зажим стенда. Убедитесь, что зажим достаточно тугой, чтобы предотвратить трубку от вытесняется, но не так, что давление на трубе приведет к освобождению CsCl решение, когда трубка пронзили. Пирс в самом низу трубки по трубке шов с использованием свежей 23 калибр 1 "иглы. Для достижения наилучших результатов проколоть трубки в контролируемой, быстро и уверенно. Это очень трудно делать хорошо, практика несколько раз, прежде чем это первая попытка с образцами труб.
- Для каждого образца, готовить 12 стерильные пробирки на 1,5 мл микроцентрифужных с этикетками с указанием количества образца и фракция (1-12; тяжело света). Использование иглы прилагается к насосу труб (шаг 6.1), проколоть в верхней части трубки на верхнем плече трубки, по шву. Сбор градиента решения с использованием микроцентрифужных труб. В исполнении для нижней части трубы, трубки пронизывают быстро и контролируемым образом. Практика заранее и быть очень внимательным, чтобы использовать контролируемые потянув движения, чтобы предотвратить принудительное игле проходить через трубку и в палец! Использование ранее калиброванный подачи насоса, что позволит получить 12 х 425 мкл фракций за 12 минут (425 мкл мин -1).
- Использование цифрового рефрактометра (например, Reichert AR200; рекомендуется) или аналитические весы, чтобы проверить плотность фракций от одного градиента, чтобы подтвердить надлежащее формирование градиента. Вам нужно будет использовать ~ 50 мкл образца для этого теста. Мы часто включают в себя чистые культуры ДНК в одной трубе (как описано для подготовки градиенты EtBr контроля) в качестве контроля для фракционирования и использовать его для определения плотности. Ожидайте плотности в пределах от ~ 1.690-1.760 г мл -1, со средней плотностью ~ 1,725 г мл -1.
7. ДНК осадков
- Осадок ДНК из всех фракций, добавьте сначала 20 мкг линейный полиакриламид в качестве носителя для осадков. Смешайте по инверсии. Добавить 2-х томах раствора ПЭГ (см. шаг 1) и микс от инверсии. Обратите внимание, что носитель для осадков (например, гликогена или линейный полиакриламид) имеет решающее значение для количественного восстановления ДНК из градиент фракций, но осторожность следует использовать, если гликогена используется в качестве носителя для осадков для этого протокола. Гликоген препаратов было показано, что загрязненные бактериальных нуклеиновых кислот и загрязнение может легко ввести в заблуждение интерпретация SIP градиент фракций 12.
- Оставьте труб при комнатной температуре в течение 2 часов, чтобы позволить ДНК, чтобы осадок. При необходимости трубки можно оставить на ночь при комнатной температуре.
- Центрифуга при 13000 г в течение 30 минут с задней трубы наружу по последовательной ориентации трубки в ротор. Тщательно аспирации и отбросить супернатант. Гранулы должны быть видны, но может быть очень трудно увидеть на данном этапе. Работа в рамках яркого источника света (например, настольная лампа) для оказания помощи в визуализации гранул.
- Вымойте гранул с 500 мкл 70% этанола. Центрифуга при 13000 г в течение 10 минут. Тщательно аспирации и отбросить супернатант. Гранулы, как правило, более заметны для этого шага, но будет дистанцироваться от стенки трубы более легко.
- Разрешить гранул сушить при комнатной температуре в течение 15 минут.
- Приостановить каждая гранула в 50 мкл ТЕ-буфера (см. шаг 1.5). Выполните 5 мкл каждой фракции на агарозном геле в соответствии со стандартными протоколами лабораторных условиях.
8. Доля Характеристика
Метод используется для характеристики градиент фракций для оценки успеха инкубации SIP будет варьироваться в зависимости от лаборатории и наличие оборудования. Использование метода снятия отпечатков пальцев для целевого гена 16S рРНК общий подход и методы, такие как терминал полиморфизма длины рестрикционных фрагментов (Т-ПДРФ) или градиент денатурирующих электрофореза геля (DGGE) соответствуют (рис. 1). После протокол, описанный выше, ожидать света ДНК, чтобы быть связано с фракциями 9-11 (~ 1.705-1.720 г мл -1) и тяжелые отпечатки пальцев ДНК, чтобы быть связаны в течение долей 5-8 (~ 1.720-1.735 г мл -1 ). Уникальные отпечатки пальцев связана с фракциями 5-8 стабильных изотопов инкубировали образцам, но не с носителями подложки инкубировали управления обеспечивает сильную доказательства причастности конкретных организмов с метаболизмом частности меченого субстрата. Если недостаточное меченых ДНК остается для некоторых приложений (гибридизация, metagenomics), несколько усиления перемещения могут быть использованы для производства больших количествах 13-15, но это может ввести в химеры амплифицированной ДНК 14,16.
9. Результаты
Типичные ДНК-SIP результаты продемонстрируют разделение меченого и немеченого ДНК в градиенте образована ультрацентрифугирования. В идеале, полное разрешение высокой молекулярной массой генетический материал (например, 13 C, 15 N) из немеченого материалы будут достигнуты. Разрешение может быть свидетелем визуально, наблюдая за группой образование в трубах EtBr контроля. Концентрации полученных геномной ДНК, содержащиеся в отдельных фракциях градиента также может быть использована для подтверждения правильного формирования градиента.
Для этого протокола, мы включили представителя результаты градиент ультрацентрифугирования осуществляется с использованием нуклеиновых кислот из двух чистых культур (рис. 2). Фракционированного градиент включены был подготовлен на основе геномной ДНК, выделенной из С. meliloti (ATCC 1021), и 13 С-меченного М. capsulatus ул. Бат. После центрифугирования, фракционирования и ДНК восстановление, меченого и немеченого геномной ДНК разделиться на соответствующих фракций градиента с различными плотностями (рис. 2А). Тяжелых изотопов меченых ДНК можно наблюдать в фракций 4-5, в то время как немеченых ДНК находится в высоких концентрациях в долях 9-10. ДНК из каждой фракции характеризуется денатурирующих электрофореза гель градиента 17 и ПЦР-амплифицированных продуктов порожденной дискретной полосы моделей, соответствующих двум организмов, включенных в градиент (рис. 2В). Плотность фракций колебалась от ~ 1,580 - 1,759 г мл -1, и они приведены в порядке уменьшения плотности слева направо.
Хотя выделение чистого 13 С-12 и С-ДНК может быть выражен (рис. 2), экологические инкубации образца могут быть более трудными для интерпретации. Например, мы инкубировали тундровых почв от Решительный Bay (Нунавут, Канада), либо с 12 C-13 или С-меченой глюкозы для 14-дневного срока при 15 ° C. Агарозном гелях очищенную ДНК фракция градиента показал, что геномная ДНК была «смазывают» по фракции 7-10 и для 12 C и 13 C-инкубации (рис. 3А и 3С, соответственно). В этом случае, 13 C-обогащения биомассы от конкретных таксонов микробной может быть определено только с подхода, такие как DGGE из 16S рРНК генов. 12 С-глюкозы инкубировали ДНК почве порождает аналогичные тенденции во всех фракциях градиента (рис. 3В), но и 13 С-глюкозы инкубировали образец порожденных DGGE отпечатки пальцев, которые однозначно связаны с фракциями 5-8 (рис. 3D). Особый интерес представляют сохраняется полос, указанных стрелками. Это доминирующий phylotype "был одинаковым во всех фракциях, но градиент переходит на более тяжелые фракции для ДНК, полученной из 13 С-глюкозы инкубировали почвы. Последующие секвенирования ДНК этой полосы и / или клон библиотеки анализа подтвердят личность этого специфического гена 16S рРНК и направленность последующих метагеномных или выращивание подходов.
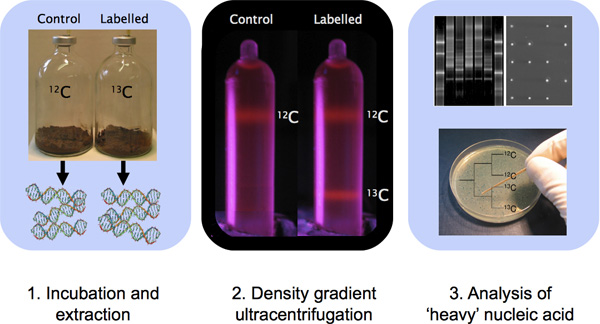
Рисунок 1. Очерк ДНК-SIP эксперимент с образцом инкубации, выделение ДНК, CsCl ультрацентрифугирования градиента плотности и ДНК-характеристику с молекулярными методами.
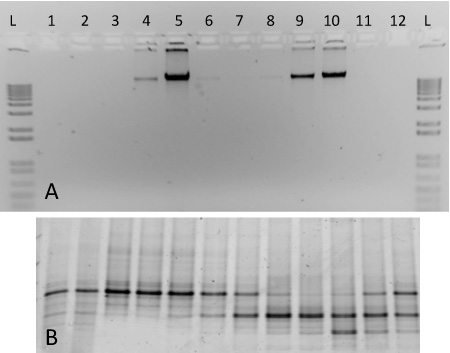
Рисунок 2. Ожидаемые результаты для фракционирования градиент SIP, включая ДНК из двух чистых культур. (А) Аликвоты ДНК из градиент фракций 1-12 проводились на 1% агарозном геле с градиентом, содержащая 13 C меченного М. capsulatus штамм ванны (фракции 4-6) и 12 C меченного С. meliloti (фракции 8-10). 1-кб лестницы включены для сравнения (B) ПЦР-амплифицированной ДНК из той же фракции были выполнены на 10% DGGE геля. Отпечатков пальцев модели выявить четкие различия между фракциями 5 и 9, например.
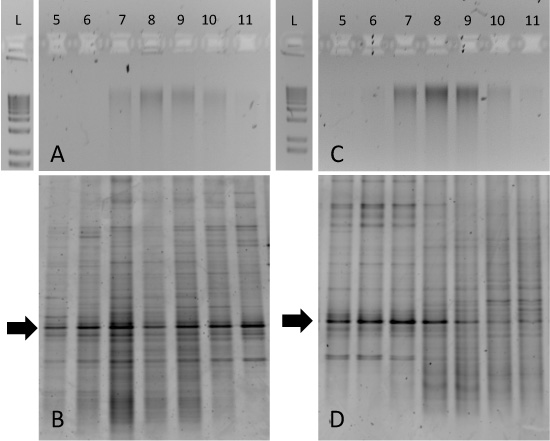
Рисунок 3. Ожидаемые результаты для SIP градиент фракционирования от инкубации образца почвы. Аликвоты градиент от обеих фракций 12 С-глюкозы поправками почвы (А) и 13 С-глюкозы поправками почве (С) проводились на 1% агарозном гелях и 1-кб лестница включена для сравнения. Корреспондент отпечатки пальцев DGGE для каждого из этих образцов представлены в (В) и (D). Снятие отпечатков пальцев фракций показывает обогащение частности бактериальных таксонов в 13 С-глюкозы поправками образца фракции 5-8 (D).
Обсуждение
Правильное проектирование стабильных изотопов зондирования экспериментов имеет решающее значение для получения меченых ДНК выше фона немеченого сообщества. Соображения, связанные с образцом времени инкубации, субстрат концентрации, условия инкубации (например, питательных веществ...
Раскрытие информации
Благодарности
Эта работа была поддержана стратегических проектов и Discovery Гранты JDN от естествознания и техники Научно-исследовательский совет Канады (NSERC).
Материалы
| Name | Company | Catalog Number | Comments | |
| Bromophenol Blue | Reagent | Fisher Scientific | BP115-25 | |
| Cesium chloride | Reagent | Fisher Scientific | BP210-500 | |
| Ethanol, reagent grade | Reagent | Sigma-Aldrich | 652261 | |
| Ethidium bromide | Reagent | Sigma-Aldrich | E1510 | |
| Hydrochloric acid | Reagent | Fisher Scientific | 351285212 | |
| Linear polyacrylamide | Reagent | Applichem | A6587 | |
| Polyethylene Glycol 6000 | Reagent | VWR international | CAPX1286L-4 | |
| Potassium Chloride | Reagent | Fisher Scientific | AC42409-0010 | |
| Sodium Chloride | Reagent | Fisher Scientific | S2711 | |
| Sodium Hydroxide pellets | Reagent | Fisher Scientific | S3181 | |
| Tris base | Reagent | Fisher Scientific | BP1521 | |
| Dark Reader | Equipment | Clare Chemical | DR46B | |
| Microcentrifuge | Equipment | Eppendorf | 5424 000.410 | |
| Nanodrop 2000 | Equipment | Fisher Scientific | 361013650 | |
| Infusion pump | Equipment | Braintree Scientific, Inc. | N/A | Model Number: BSP See www.braintreesci.com for ordering details. |
| Tube sealer | Equipment | Beckman Coulter Inc. | 358312 | |
| Ultracentrifuge | Equipment | Beckman Coulter Inc. | ||
| Ultracentrifuge rotor | Equipment | Beckman Coulter Inc. | 362754 | |
| Ultraviolet light source | Equipment | UVP Inc. | 95-0017-09 | Any UV source will suffice |
| Ultraviolet light face shield | Equipment | Fisher Scientific | 114051C | |
| Butyl rubber stoppers, gray | Material | Sigma-Aldrich | 27232 | |
| Centrifuge tubes | Material | Beckman Coulter Inc. | 342412 | |
| Hypodermic needle, 23 gauge, 2” length | Material | BD Biosciences | 305145 | |
| Microfuge tubes, 1.5 mL | Material | DiaMed | AD151-N500 | |
| Open center seals, 20 mm diameter | Material | Sigma-Aldrich | 27230-U | |
| Pasteur pipettes, glass | Material | Fisher Scientific | 13-678-6C | |
| Pipet tips | Material | DiaMed | BPS340-1000 | Catalogue number is for 200 μl tips. 10 or 20 μl tips may be purchased from the same source |
| Pump tubing 1.5 mm bore x 1.5 mm wall | Material | Appleton Woods | ||
| Screw-cap tubes, 15 mL | Material | DiaMed | AD15MLP-S | |
| Serum vials, 125 mL volume | Material | Sigma-Aldrich | Z114014 | |
| Syringe, 60 mL | Material | BD Biosciences | 309653 |
Ссылки
- Neufeld, J. D. DNA stable-isotope probing. Nat. Protocols. 2, 860-866 (2007).
- Neufeld, J. D., Boden, R., Moussard, H., Schäfer, H., Murrell, J. C. Substrate-specific clades of active marine methylotrophs associated with a phytoplankton bloom in a temperate coastal environment. Appl. Environ. Microbiol. 74, 7321-7328 (2009).
- Nercessian, O., Noyes, E., Kalyuzhnaya, M. G., Lidstrom, M. E., Chistoserdova, L. Bacterial populations active in metabolism of C1 compounds in the sediment of Lake Washington, a freshwater lake. Appl. Environ. Microbiol. 71, 6885-6899 (2005).
- Padmanabhan, P. Respiration of 13C-labelled substrates added to soil in the field and subsequent 16S rRNA gene analysis of 13C-labelled soil DNA. Appl. Environ. Microbiol. 69, 1614-1622 (2003).
- Bernard, L. Dynamics and identification of soil microbial populations actively assimilating carbon from 13C-labelled wheat residue as estimated by DNA- and RNA-SIP techniques. Environ. Microbiol. 9, 752-764 (2007).
- Haichar, e. l. Z. a. h. a. r., F, . Identification of cellulolytic bacteria in soil by stable isotope probing. Environ. Microbiol. 9, 625-634 (2007).
- Addison, S., McDonald, I., Lloyd-Jones, G. Stable isotope probing: Technical considerations when resolving 15N-labelled RNA in gradients. J. Microbiol. Meth. 80, 70-75 (2009).
- Buckley, D. H., Huangyutitham, V., Hsu, S. -. F., Nelson, T. A. Stable isotope probing with 15N achieved by disentangling the effects of genome G + C content and isotope enrichment on DNA density. Appl. Environ. Microbiol. 73, 3189-3195 (2007).
- Schwartz, E. Characterization of growing microorganisms in soil by stable isotope probing with H218O. Appl. Environ. Microbiol. 73, 2541-2546 (2007).
- Neufeld, J. D., Dumont, M. G., Vohra, J., Murrell, J. C. Methodological considerations for the use of stable isotope probing in microbial ecology. Microb. Ecol. 53, 435-442 (2007).
- Martineau, C., Whyte, L., Greer, C. Development of a SYBR safe technique for the sensitive detection of DNA in cesium chloride density gradients for stable isotope probing assays. J. Microbiol. Meth. 73, 199-202 (2008).
- Bartram, A. K., Poon, C., Neufeld, J. D. Nucleic acid contamination of glycogen used in nucleic acid precipitation and assessment of linear polyacrylamide as an alternative co-precipitant. Biotechniques. 47, 1019-1022 (2009).
- Chen, Y. Revealing the uncultivated majority: combining DNA stable-isotope probing, multiple displacement amplification and metagenomic analyses of uncultivated Methylocystis in acidic peatlands. Environ. Microbiol. 10, 2609-2622 (2008).
- Neufeld, J. D., Chen, Y., Dumont, M. G., Murrell, J. C. Marine methylotrophs revealed by stable-isotope probing, multiple displacement amplification and metagenomics. Environ. Microbiol. 10, 1526-1535 (2008).
- Kalyuzhnaya, M. High-resolution metagenomics targets specific functional types in complex microbial communities. Nat. Biotechnol. 26, 1029-1034 (2008).
- Binga, E. K., Lasken, R. S., Neufeld, J. D. Something from (almost) nothing: the impact of multiple displacement amplification on microbial ecology. ISME J. 2, 233-241 (2008).
- Green, S. J., Leigh, M. B., Neufeld, J. D., Timmis, K. N. . Microbiology of Hydrocarbon and Lipid Microbiology. , 4137-4158 (2010).
- Neufeld, J. D., Wagner, M., Murrell, J. C. Who eats what, where and when? Isotope-labelling experiments are coming of age. ISME J. 1, 103-110 (2007).
- Gallagher, E., McGuinness, L., Phelps, C., Young, L. Y., Kerkhof, L. J. DNA shortens the incubation time needed to detect benzoate-utilizing denitrifying bacteria by stable-isotope probing. Appl. Environ. Microbiol. 71, 5192-5196 .
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены