JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
DNA 안정 - 동위 원소 (DNA - SIP) 탐색
요약
DNA 안정 - 동위 원소 탐색 특정 기판을 활용 능력이 미생물의 활성 커뮤니티를 식별하고 특징을 재배 독립 방법입니다. 무거운 동위 원소의 농축 기판의 동화는 미생물 바이오 매스로 분류 원자의 결합에 이르게한다. 밀도 기울기 ultracentrifugation은 하류 분자 분석을위한 DNA 라벨을 검색합니다.
초록
DNA 안정 - 동위 원소 (DNA - SIP) 프로빙 세포 바이오 매스로 특정 탄소 기판과 영양소 동화 활성 미생물을 식별을위한 강력한 기법입니다. 따라서,이 재배 독립적인 기술은 지상파 및 수생 환경에서 광범위한 거주 다양한 커뮤니티에 신진 대사 기능을 할당을위한 중요한 방법론을했습니다. 안정 동위 원소 - 라벨 화합물과 환경 샘플의 부화에 따라 추출 핵산은 다양한 밀도의 핵산을 분리하는 밀도 기울기 ultracentrifugation 이후 기울기 분별 (분리)를 받게됩니다. 세슘 염화에서 DNA의 정화는 이후 분자 특성 (예 : 지문, microarrays, 클론 라이브러리, metagenomics)의 DNA를 표시하고 unlabelled 검색합니다. 이 조브 비디오 프로토콜은 밀도 기울기 ultracentrifugation, 그라데이션 분류 및 라벨 DNA의 복구를위한 프로토콜의 시각을 단계별로 설명을 제공합니다. 프로토콜은 샘플 SIP 데이터와 하이라이트 중요한 팁을 포함하고 성공 DNA - SIP 분석을 보장하기 위해 고려되어야한다는주의.
프로토콜
1. 시약의 준비
DNA - SIP는 실제 절차의 사전에 준비되어야 시약의 사용을 필요로합니다. 각 시약 준비에 대한 지침은이 섹션에 나열되어 있으며 이전 SIP 프로토콜 1 일부터 변경됩니다.
- SIP의 그라디언트를 준비 세슘 염화물 (CsCl) 솔루션 - 점차적으로 500 ML의 최종 볼륨에 증류수 및 탈이온수에 CsCl의 603.0 g (ddH 2 O)를 용해하여 7.163 M CsCl 솔루션을 준비합니다. 500 ML을 초과하지 않도록주의! 교반하면서 약간 솔루션을 온난 화하면 CsCl의 모든 디졸브 도움이 될 것입니다. 밀폐 aliquots의 최종 해결책 '나누어지는. 저희 연구실에서는 일반적인 저장 연습 다음 부틸 고무 stoppers과 방해 - 봉인된 125 - ML 혈청 튜브에 100 ML aliquots을 준비하는 것입니다. 밀폐 aliquots은 실내 온도 (20 ° C)에서 무한정 저장할 수 있습니다. 물개가 증발과 CsCl "지각"형성을 방지. 세중의 100 μL aliquots 무게에 의해, 또는 신중하게 CsCl 솔루션에 대한 보정이되어 버린 디지털 굴절계 (예 : 레이처트 AR200)을 사용하여 솔루션의 밀도를 결정합니다. 일단 성공적으로 보정, 레이처트 AR200 일관성이 있으며, 몇 년간에 대한 정확한 수치를 제공합니다. 실온 (20 ° C)에서이 솔루션의 최종 농도는 일반적으로 1.88-1.89 g ML -1에서 범위. 밀도가 약간 새로운 주식이 준비 때마다 다릅니다.
- 무균 ddH 2 O 물 250 ML과 CsCl의 250g을 결합 - ethidium 브로마이드 (EtBr)로 그라디언트를 준비 세슘 염화물 솔루션입니다. 으로 1.1에서 설명한 부틸 고무 밀봉과 방해 - 봉인되었을 별도의 혈청 튜브로 나누어지는이 솔루션입니다.
- 그라데이션 버퍼 - 1 M 트리스 - HCL, 3.75 g KCl 0.5 M EDTA (에틸렌 다이아 민 테트라 초산) 및 1 ML 물 400 ML에 50 ML을 결합합니다. KCl을 디졸브 후, 500 ML에 ddH 2 O를 추가합니다. 필터 - 소독 및 압력솥. 최종 솔루션은 0.1 M 트리스, 0.1 M KCl, 1 MM EDTA (에틸렌 다이아 민 테트라 초산)입니다.
- 폴리에틸렌 글리콜 (PEG) 솔루션 - 500 ML (30 % PEG, 1.6 M NaCl)의 총 볼륨 살균 ddH 2 O 물의 폴리에틸렌 글리콜 6000 및 NaCl의 46.8 g의 150g을 해소하여 PEG 용액을 준비합니다. 압력솥.
참고 :이 솔루션은 autoclaving 두 단계로 분리시킵니다. 이 문제가 발생하면 솔루션이 제대로 혼합 수 있도록 autoclaved 병에 저어 표시줄을 포함합니다. - TE 버퍼 - 1 M 트리스 - HCL (산도 8.0)와 0.5 M EDTA (에틸렌 다이아 민 테트라 초산) (의 autoclaved 재고 솔루션을 사용하여 살균 ddH 2 O 물 10 MM 트리스 - HCL (산도 8.0) 1 MM EDTA (에틸렌 다이아 민 테트라 초산) (산도 8.0)의 솔루션을 준비 산도 8.0). 소독과 압력솥을 필터링합니다.
- 70 % 에탄올 - 살균 ddH 2 O 물 150 ML과 고순도 에탄올 350 ML을 결합합니다.
2. 샘플 보육 및 DNA 추출
DNA - SIP의 incubations 경우, 샘플은 일반적으로 무거운 - 동위 원소 탄소 (13 C) 기판과 incubated 있습니다. 부화 기간 및 조건 (예 : 영양 보완, 수분, 빛)는 incubated는 샘플의 종류와 기판의 특성에 따라 달라집니다. DNA - SIP 실험이 성공적으로 단일 탄소 화합물 2,3, 다중 탄소 화합물 4,5,6, 그리고 라벨 질소 또는 산소 7,8 9를 사용 다양한 사용하여 수행되었습니다. 그러나, 15 N - 또는 18 O - 표시된 화합물을 사용하는 단점 적은 질소와 DNA와 탄소 원자에 상대적으로 RNA의 산소 원자의 존재로 인해 주로 분류 핵산의 감소 물리적 분리입니다.
DNA - SIP 실험에 대한 중요한 제어 네이티브 (예 : 12 C) 기판으로 설립 동일 인큐베이션입니다. 이 부화는 핵산의 명백한 라벨이 ultracentrifugation 또는 별거 10 기여 DNA의 G + C 함량 밀도 차이의 유물되지 않았음을 보장하기 위해 후속 비교를 제공합니다. 그것은 '빛'과 '무거운'DNA 비교를위한 냉동 샘플 자료를 유지하는 것도 중요하고, SIP 보육 전반에 걸쳐 배경 인구 변화를 평가하기 위해 노 기판 제어를 포함하는 가치.
- 분류 기판 (그림 1)이있는 microcosms 환경 샘플을 품어. 우리의 경험에서 우리는 샘플의 g 당 13의 C 탄소 500-500 μmol 사이의 최소 설립 이러한 토양 샘플 1로 높은 바이오 매스를 포함하는 시료에 적합한 것으로 나타났습니다. 토양보다 바이오 매스를 포함한 수생 샘플, 통합 중 1-100 μmol 리터 당 13 C 탄소가 감지 대형 원소 서명 하나를 얻을 수 있습니다. 탄소 개정의 금액은, 바이오 매스와 동화에 대한 보충 영양뿐만 아니라에 대한 요구 사항에 포함 탄소 비율은 분석되는 시료의 특성에 의존하고 대상 O 것입니다관심 rganisms. 샘플 보육 지침의 단일 집합은 모든 샘플에 대해 적용되지 않습니다. 중요한, SIP 보육에 사용되는 기판 농도적으로 최대한 일반적으로 현장에서 발생 농도하는 것입니다, 실험 편견 농축 문화 조건 10 결과 수 있습니다.
- 안정 - 동위 원소 분류 기판과 샘플의 부화에 따라 엄격한 추출 프로토콜 (PCR 또는 소규모 삽입 복제) 또는 높은 분자량의 복제 (예 : 대형 삽입 metagenomics)에 대한 신뢰할 수있는 효소 용해를 사용 microcosms에서 DNA를 추출. RNA가 공동 추출은 일반적으로 분석에 영향을 미치지 않습니다뿐만 DNA로 RNA를 얻을 것을 프로토콜이 사용 될 수 있습니다. 압축이 풀린 DNA의 ultracentrifugation는 ~ 50 이하 쌍 1보다 짧은 단편 전단하지 않습니다.
- CsCl 기울기 ultracentrifugation 튜브의 설정 이전에 추출한 DNA를 계량. 추출 프로토콜은 DNA (예 : 열 기반 키트) 산출 경우 분광 광도계 (예 : Nanodrop 2000)를 사용 DNA를 계량. 또는 아가로 오스 겔 전기 영동을 사용하여 계량.
3. Ultracentrifugation에 대한 그라디언트 솔루션 준비
이 절차는 튜브를 초원 심 분리기에 DNA을 추가 포함됩니다. 정확한 프로토콜이 다를 수 있으며 제조 업체의 지침에 따라 있도록 튜브와 로터 이상의 한 종류가 있습니다. 그 말은, 우리는 빛과 무거운 DNA의 가능한 최대 분리를 보장하기 위해 수직 잘 로터의 사용을 권장합니다. 우리는 5.1 ML QuickSeal의 Polyallomer 튜브를 들고 16 웰스와 베크맨 - 쿨터 Vti 65.2 로터를 사용하여 프로토콜은 이러한 조건에 해당하는 단계와 고려 사항을 제공합니다.
- 초원 심 분리기 튜브의 DNA 5 μg - 단계 2.3에서 결정된 DNA의 농도를 사용하여, 0.5 μg을 제공하는 데 필요한 DNA의 추출에 필요한 볼륨을 계산합니다.
- 그라데이션의 버퍼 (단계 1.3 참조) 및 멸균 일회용 15 ML 튜브 ~ 6 ML의 총 볼륨 7.163 M CsCl의 4.8 ML과 - 추출된 DNA (5 μg 0.5)를 결합합니다. CsCl 용액의 밀도 (단계 1.1 참조) 같은 molarity라도 달라질 수 있습니다. 다음 방정식은 적절한 혼합 비율을 생성하는 데 필요한 그라데이션 버퍼 / DNA 혼합물의 볼륨을 결정하는 데 사용할 수 있습니다 :
그라데이션 버퍼와 DNA 솔루션 볼륨 (ML) = (CsCl 주식 솔루션 밀도 - 원하는 최종 농도) CsCl 재고 솔루션의 X 볼륨 X 1.52을 추가
4.80 ML에 CsCl 주식 솔루션의 볼륨을 지정합니다. 원하는 최종 밀도는 1.725 g ML -1해야합니다. 재고 솔루션 밀도는 1.1 단계에서 산출된 것입니다.
CsCl 및 그라데이션 버퍼 / DNA의 상대 볼륨 이상 5.1 ML의 결합 량이 발생할 것으로도 있습니다. 초원 심 분리기 튜브의 최대 볼륨 용량 (이상 5.1 ML)보다 큰 볼륨을 준비하는 것은 완전히 튜브를 채우기 위해 충분한 해결책이 있는지 확인합니다. - 반전 10 회로 섞는다. DNA는 CsCl의 실온에서 안정됩니다.
4. EtBr 제어 그라디언트 (옵션) 만들기
EtBr은 DNA와 단지가 자외선 아래에서 볼 만드는 것을 intercalating 염색이기 때문에 그들이 이전에 샘플 튜브 (예 : 그림 1)의 분류에 기울기 형성의 즉각적인 시각적 확인을 제공하기 때문에, EtBr을 포함하는 제어 그라디언트 도움이됩니다. EtBr 12 C - DNA와 13 C - DNA (또는 14 N - DNA 15 N - DNA) 모두의 혼합물을 포함하는 제어 튜브 포함하는 ultracentrifugation 완료시 튜브 내에 밴드 형성의 즉각적인 시각화를위한 수 있습니다. ultracentrifugation 또는 부적 절한 프로그램 실행 조건 중에 파열 튜브 실패 기울기 형성이 발생할 수 있기 때문에 이것은 중요합니다. DNA에 바인딩, EtBr은 DNA의 밀도를 감소하고 그 결과로 다른 프로토콜은 그라디언트를 준비하는옵니다. 다른 핵산 얼룩 대신 EtBr 11 사용할 수 있지만, 프로토콜이 다른 fluorophores와 최적화가 필요됩니다.
- 안정 동위 원소와 함께 표시 - 하나 레이블없이 하나 제어 기울기는 게놈 DNA의 두 볼륨을 필요로합니다. 우리는 일반적으로 13 C - 또는 컨트롤로 12 C - 메탄의 존재에 교양 유일한 탄소 소스, 또는 Methylococcus capsulatus 스트레인 목욕 등 13 C - 12 C - 포도당을 포함한 미디어의 교양 Sinorhizobium meliloti 중 하나를 사용합니다.
- 의 5 -10 μg 수량을 결합 모두 12 C - DNA 13 일회용 15 ML 나사 캡 튜브 1.00 ML의 최종 볼륨 그라데이션 버퍼와 C - DNA.
- 같은 튜브에 고체 CsCl의 1.00 g을 추가합니다. 역전로 섞는다.
- 110 μl 추가10 MG ML -1 EtBr 솔루션과 단계 4.2에서 사용되는 동일한 나사 캡 튜브에 1g ML -1 CsCl 주식 솔루션의 4.3 ML니다. 솔루션의 최종 농도는 대략 원래 CsCl 주식 솔루션의 것입니다.
- EtBr을 포함하는 추가적인 "빈"제어 솔루션은 또한 균형을 맞출 단계 4.4에서 만든 솔루션을하셔야합니다. 그라데이션 버퍼, CsCl의 1.00 g, 10 MG ML -1 EtBr 솔루션과 별도의 15 ML 나사 캡 튜브와 역전의 혼합에 1g ML -1 CsCl 주식 솔루션의 4.3 ML 110 μl의 1.00 ML을 결합합니다.
5. Ultracentrifugation
- 전구와 파스퇴르 피펫을 사용하여, 신중하게 그라디언트 솔루션 단계 3.2 (또는 4.4과 같이하면 EtBr 제어 기울기를 준비하는)의 준비와 초원 심 분리기 튜브를 입력하십시오. 조심스럽게 파스퇴르 피펫을 사용하여 튜브에 솔루션을 추가합니다. 멋진 영구 마커와 튜브 어깨에 튜브 라벨. 주의 : 튜브는 튜브 목의 기본을 정확히 채워 있는지 확인합니다. 충분 채워진 튜브 ultracentrifugation 동안 폭발 가능성이있다.
- 필요한 튜브의 모든 샘플 솔루션 가득 경우, 각 튜브의 정확한 질량을 기록합니다. 페어 튜브와 00-10 MG 이내에 균형을. 균형을 위해, 거의 일치하는 쌍을 찾아 그들이 가능한 튜브 목전의 기본에 가까운 솔루션 수준을 유지, 균형까지 솔루션의 분 수량을 추가하거나 제거합니다. 튜브를 무게를 위해, 우리가 균형을위한 튜브 홀더 등 반으로되어 거꾸로 15 ML 나사 캡 튜브를 사용합니다.
- 제조 업체의 지시에 따라 '튜브 토퍼'을 사용하여 튜브를 밀봉합니다.
- 튜브가 반전 그들에 의해 적절하게 봉인하고 적당한 압력을 적용하는 것을 확인하십시오. 그들이 아직도 00-10 MG 이내에 씰링 후 균형있는 것으로 확인 다시 튜브를 달다.
- 우물이 깨끗하고 파편이나 먼지가 무료로되는 것을 보장하기 위해 신중하게 잘 각 로터을 확인 ultracentrifugation 동안 소중히 튜브 수 있습니다.
- 서로 반대 균형 쌍과 회전자에 튜브를 삽입합니다. ultracentrifugation 과정 마커 라벨이 손상되거나 삭제되는 원인이 수 있기 때문에 각각의 샘플의 회전자 위치를 기록합니다. 조심스럽게로 제조 업체가 표시된 회전자 우물을 봉쇄.
- 초원 심 분리기에 회전자를로드합니다. 초원 심 분리기 도어를 닫고 진공을 적용합니다. Vti 65.2 로터를 사용하여 44,100 RPM (~ 177,000 XG AV), 20 36-40시간에 대한 ° C, 그리고 ultracentrifugation 시간에 온도에 회전 속도를 설정하면. 진공, 최대 가속을 선택하고 (감속에 의해 중단되지 그라데이션을 보장합니다) 브레이크를 해제하십시오. 브레이크를 해제하면 런타임에 추가 1-2 시간 추가됩니다. 또한 짧은 실행 시간은 충분한 밴드 해상도를 달성되지 않을 수 있습니다. 그들은 서로 다른 핵산 밴드보다 해상도로 이어질 한 ultracentrifugation의 실행을 권장하고 있습니다.
- 즉시 ultracentrifugation 절차 완료되면 조심스럽게 회전자를 제거합니다. 어떤 틸팅을 피하기 위해 또는 회전자의 지원해주, 부드럽게 튜브 내에서 그라디언트를 방해하지 않도록하기 위해 회전자에서 튜브를 제거합니다. 드문 상황에서 튜브가 실행되는 동안 폭발합니다. 그렇다면, 다른 튜브에 그라디언트가 제대로 형성하지 않았 가능성이 있습니다. 제어 기울기가 포함된 경우, 그라데이션 형성을 확인하기 위해 자외선에 따라 신중하게이 튜브를 확인합니다. 그라디언트가 제어 튜브에서 제대로 형성되지 않은 경우, 5 단계를 모두 반복하는 것이 좋습니다. EtBr 제어 관과 빈 컨트롤이 어둠 속에 저장되며 최대 6 개월까지 재사 용할 수 수 있습니다. 버스트 튜브가 제거되었습니다 일단 제조 업체의 지시에 따라 주의깊게 회전자를 청소하는데주의를 기울여야. 회전자 우물에 흠집을 방지하기 위해 로터 우물을 청소하기 위해 금속 브러시 또는 연마재 클리너를 사용하지 마십시오! 로터 - 특정 브러쉬 청소 솔루션은 베크맨에서 구입하실 수 있습니다.
6. 그라데이션 분별 (분리)
분류 및 바늘 추출 : 현재 초원 심 분리기 튜브에서 DNA를 복구하는 데 사용되는 두 가지 방법이 있습니다. 이 프로토콜은 분류 기법을 사용하여 DNA를 추출하는 과정을 설명합니다. 대부분의 SIP 실험을 위해 레이블이 붙은 DNA는 EtBr과 시각 수없는 대신 여러 개의 샘플 튜브에서 상응하는 빛과 무거운 분수를 비교하여 감지해야하기 때문입니다. 주사기 펌프는 높은 초원 심 분리기 튜브에서 동일한 밀도 기울기 분수를 검색할 것을 권장합니다. 우리는 BSP 모델 주입 펌프 (브레인 트리 과학 주식 회사)를 사용합니다. 낮은 흐름 연동 펌프 또는 HPLC 펌프도 사용할 수 있습니다.
- 무균 ddH 2 O는 진한 파란색 색상을 제공하기 위해 충분한 bromophenol 파란색 염료를 포함과 멸균 60 ML 주사기를 입력합니다. 주사기 펌프의 로딩 팔에 주사기를 놓습니다.23 게이지 1 "바늘과 일부 ddH 2 O이 ddH 2 O 공급 장치에 공기 방울이 부정적인 분획화 과정에 영향을 미칠 것이라는 바늘. 참고 말까지 올 때까지 펌프를 설정 장착되어 펌프 튜빙을 연결합니다.
- 클램프 스탠드에 ultracentrifugation 튜브 중 하나를 수정. 클램프는 튜브가 너였구나는 CsCl 솔루션의 출시를 일으킬 것입니다 관에 같은 것을 강요하지 전이되지 않도록 튜브를 방지하기 위해 충분히 꽉지만 확인합니다. 피어스는 새로운 23 게이지 1을 사용 튜브 경계선을 따라 튜브의 맨 아래는 "바늘이. 최상의 결과를 얻으려면, 피어스는 조절이 빠르고, 그리고 자신감 방식으로 관.이 잘하는 것은 매우 어렵습니다, 전에 몇 번 연습 이것은 첫번째 샘플 튜브를 시도합니다.
- 각 예제, 샘플 번호와 분수를 (; 빛을 무거운 1-12) 표시 라벨 12 멸균 1.5 ML의 microcentrifuge 튜브를 준비합니다. 상단 튜브 어깨에 튜브의 맨 위에는 솔기를 따라, 피어스, 펌프 튜브 (단계 6.1)에 부착된 바늘을 사용합니다. microcentrifuge 튜브를 사용하여 그라디언트 솔루션을 수집합니다. 으로 튜브의 바닥, 신속하고 제어 방식으로 피어스 튜브 수행. 사전 연습 및 튜브 통과로부터 손가락으로 강제 바늘을 방지하기 위해 관리 당기는 운동을 사용하여 매우 조심해야! 12분 (425 μl 분 -1) 12 X 425 μl 분수를 얻을 것입니다 이전에 보정 펌프 속도를 사용합니다.
- 적절한 기울기 형성을 확인하거나 그라디언트에서 분수의 밀도를 확인하는 분석 균형, 디지털 굴절계 (권장 예 레이처트 AR200)를 사용합니다. 이 검사에 대한 샘플 ~ 50 μl를 사용해야합니다. 우리는 종종 분별 (분리)를 제어하는 역할을하고 밀도 결정이를 사용하여 하나의 튜브에서 순수 문화의 DNA를합니다 (EtBr 제어 그라디언트를 준비 설명)가 있습니다. 밀도가 1.725 g ~ ML -1의 평균 밀도와 ~ 1.690-1.760 g ML -1에서 다양한 예정입니다.
7. DNA 강수
- 첫째 강수량을위한 캐리어로 선형 polyacrylamide 20 μg을 추가하여 모든 분수에서 침전물의 DNA. 역전로 섞는다. 2 PEG 솔루션의 볼륨 (1 단계 참조)과 역전의 믹스를 추가합니다. 글리코겐이 프로토콜에 대한 강수량을위한 캐리어로 사용하는 경우 강수량을위한 캐리어 (예 : 글리코겐 또는 선형 polyacrylamide)가 기울기 파벌에서 DNA의 양적 복구를 위해 중요하지만,주의입니다 참고 사용해야합니다. 글리코겐 준비는 세균의 핵산으로 오염으로 표시되었으며 오염 쉽게 SIP 기울기 분수 12 해석을 혼동하실 수 있습니다.
- 침전물에 DNA을 허용하기 위해 2 시간 동안 실온에서 튜브를 남겨주세요. 원하는 경우, 튜브는 실온에서 하룻밤 남아있을 수 있습니다.
- 회전자의 일관성 튜브 오리 엔테이션을 위해 바깥쪽을 직면하고있는 튜브의 뒤에 30 분 13,000g에서 원심 분리기. 조심스럽게 기음과 뜨는 폐기하십시오. 펠렛가 표시되어야하지만,이 단계에서 보는 것은 매우 어려울 수 있습니다. 펠렛을 시각화에 도움이 밝은 광원 (예 : 책상 램프)에서 작동합니다.
- 70 % 에탄올 500 μl와 펠렛을 씻으십시오. 10 분 13,000g에서 원심 분리기. 조심스럽게 기음과 뜨는 폐기하십시오. 펠렛은 보통이 단계에 대한 더 볼 수 있지만,보다 쉽게 튜브 벽에서 떼어 놓다 것입니다.
- 펠렛은 15 분 동안 상온에서 건조하도록 허용합니다.
- (단계 1.5 참조) TE 버퍼의 50 μl의 각 펠렛을 일시 중지합니다. 표준 실험실 프로토콜에 따라 아가로 오스 겔 각 분획의 5 μl를 실행합니다.
8. 분수의 특성화
SIP 보육의 성공을 평가하기 위해 그라디언트의 분수를 특성화하는 데 사용되는 방법은 장비의 실험실과 예약 상황에 따라 달라집니다. 16 rRNA 유전자를 타겟팅하는 지문 방법을 사용하면 일반적인 접근 방식과 같은 터미널 제한 조각의 길이 다형성 (T - RFLP) 또는 denaturing 기울기 겔 전기 영동으로 방법 것은 (DGGE) (그림 1) 적합합니다. 프로토콜 위에서 설명한 다음, 분수 9-11 (~ 1.705-1.720 g ML -1)과 무거운 DNA 지문과 연관된 것으로 빛이 DNA가 분수 5-8 (~ 1.720-1.735 g ML -1 내에 관련된 것으로 기대 ). 안정 동위 원소 incubated - 샘플 분수 5-8와 관련된 고유한 지문 아니지만 네이티브 기판 incubated 컨트롤 특정 레이블 기판의 신진 대사와 특정 유기체를 연결하는 강력한 증거를 제공합니다. 부족한 표시 DNA 일부 응용 프로그램 (하이브리드화, metagenomics)에 남아있을 경우, 여러 변위 증폭은 큰 수량에게 13-15를 생산하는 데 사용할 수 있습니다 그러나 이것은 증폭된 DNA 14,16에 chimeras을 도입할 수 있습니다.
9. 검색 결과
일반적인 DNA - SIP 결과 ultracentrifugation에 의해 형성 그라디언트에 표시하고 unlabelled DNA의 분리를 보여줄 것입니다. 이상적으로, unlabelled 소재에서 높은 분자량 유전 물질의 완전한 해상도 (예 : 13 C, 15 N)이 달성됩니다. 해상도는 EtBr 제어 튜브의 밴드 형성을 관찰하여 시각적으로 목격하실 수 있습니다. 개별 기울기 분수에 포함된 주소 게놈 DNA의 농도는 적절한 기울기 형성을 확인하는 데 사용할 수 있습니다.
이 프로토콜을 위해, 우리는 기울기 ultracentrifugation을 대표하는 결과이 순수 문화 (그림 2)에서 핵산을 사용하여 수행이 포함됩니다. fractionated 기울기는 여기에 포함된 것은 S.에서 추출한 게놈 DNA를 사용하여 준비했습니다 meliloti (ATCC 1021), 13 C - 표시된 M. capsulatus의 하위. 바스. 다음 ultracentrifugation, 분류 및 DNA 복구, 표시 및 다양한 밀도 (그림 2A)와 각각의 기울기 분수에 별도의 게놈 DNA를 unlabelled. unlabelled DNA가 분수 9-10 높은 농도에서 발견되는 반면, 무거운 동위 원소 표시 - DNA는 분수 4-5에서 볼 수 있습니다. 각 분획에서 DNA가 denaturing 기울기 겔 전기 영동 17 그라디언트 (그림 2B)에 포함된 두 가지 미생물에 해당하는 개별 banding 패턴을 생성 PCR - 증폭 제품 특징했다. 분수의 밀도는 1.580 ~에서 원거리 - 1.759 g ML -1, 그들은 왼쪽에서 오른쪽으로 밀도를 감소의 순서로 표시됩니다.
순수 13 분리는 C - 12 C - DNA (그림 2) 발음 수있는, 환경 샘플 incubations 해석하는 것이 더 어려울 수 있지만. 예를 들어, 15에서 14 일 기간 동안 중 12 C 또는 13 C - 표시된 포도당 ° C.와 레졸루트 베이에서 토양 (누나 부트, 캐나다)를 툰드라 incubated 정화 기울기 분획 DNA의 아가로 오스의 젤은 게놈 DNA를위한 70-10 분수에 걸쳐 '지저분해 졌네'라고 보여주 모두 12 C - 13 C - incubations (그림 3A와 3C, 각각). 이 경우, 13 특정 미생물 taxa에서 바이오 매스의 C - 농축은 같은 16 rRNA 유전자의 DGGE와 같은 방식으로 결정하실 수 있습니다. 12 C - 포도당 incubated 토양 DNA는 모든 기울기 분수 (그림 3B)에 걸쳐 유사한 패턴을 생성하지만, 13 C - 포도당 incubated 샘플은 고유 분수 5-8 (그림 3D)와 관련된 DGGE 지문을 생성. 특히 관심을 화살표로 표시 보존 밴드입니다. 이 지배 'phylotype는'모든 기울기 분수지만, 13 C - 포도당 incubated 토양에서 얻은 DNA에 대한 무거운 분수에 교대에 걸쳐 일관성이다. 이 밴드 및 / 또는 클론 라이브러리 분석의 순서 이후 DNA는 특정 16 rRNA 유전자의 신원을 확인하고 이후 metagenomic 또는 접근 재배 기반을 안내합니다.
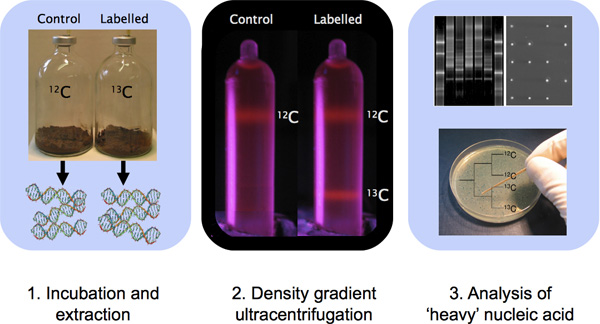
그림 1. 샘플 부화, DNA 추출, CsCl 밀도 기울기 ultracentrifugation 및 분자 기술을 DNA 특성화 관련된 DNA - SIP 실험의 개요.
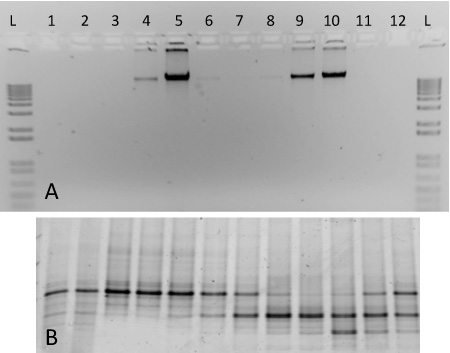
그림 2. 2 순수 문화의 DNA를 포함한 SIP 기울기 분별 (분리)에 대한 결과를 예상. (A) 기울기 분수 1-12에서 DNA의 Aliquots 13 C - 표시된 M.를 포함하는 그라디언트에서 1 % 아가로 오스 겔에서 실행되었습니다 capsulatus 스트레인 목욕 (분수 4-6) 및 12 C - 표시된 S. meliloti (분수 8-10). 1 이하 사다리는 (B) PCR 증폭 DNA - 같은 분수에서 10 % DGGE 젤에서 실행되었습니다 비교 포함되어 있습니다. 지문 패턴은 예를 들어 분수 5 ~ 9 명 사이이고 뚜렷한 차이를 공개.
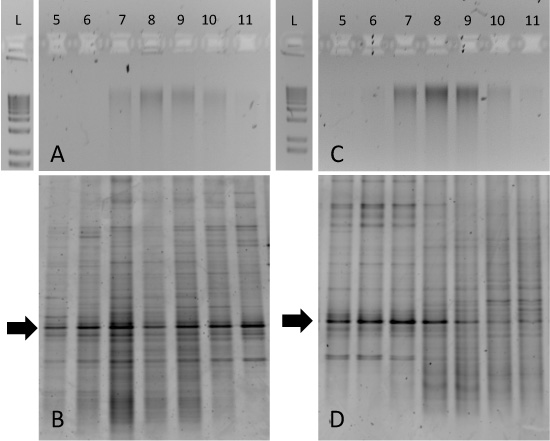
그림 3. 토양 샘플 incubations에서 SIP 기울기 fractionations에 대한 결과를 예상. 모두 12 C - 포도당 개정 토양 (A) 13 C - 포도당 개정 토양 (C)에서 기울기 분수의 Aliquots 1 % 아가로 오스 젤에서 실행되었으며 1 이하 사다리는 비교를 위해 포함됩니다. 이러한 샘플 각 해당 DGGE의 지문 (B)로 표시하고 (D). 아르 분수의 지문은 분수 5-8 (D)에 13 C - 포도당 개정 샘플에서 특정 박테리아 taxa의 농축을 보여줍니다.
토론
안정 동위 원소 탐색 - 실험의 적절한 설계 배경 unlabelled 사회 위의 레이블 DNA를 얻기 위해 매우 중요합니다. 부화 시간, 기판 농도, 배양 조건 (예 : 영양분, 토양 수분 함량), 교차 수유와 복제를 샘플에 관련된 고려 사항은 다른 10,18 논의와 우리는 SIP 부화를 디자인할 때 독자가이 간행물을 참조하는 것이 좋습니다되었습니다. 현재 프로토콜에 관련된, 그것은 SIP 그라디언트에서 데이터의...
공개
감사의 말
이 작품은 전략적 프로젝트와 자연 과학 및 캐나다 공학 연구 협의회 (NSERC)에서 JDN로 디스커버리 기금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments | |
| Bromophenol Blue | Reagent | Fisher Scientific | BP115-25 | |
| Cesium chloride | Reagent | Fisher Scientific | BP210-500 | |
| Ethanol, reagent grade | Reagent | Sigma-Aldrich | 652261 | |
| Ethidium bromide | Reagent | Sigma-Aldrich | E1510 | |
| Hydrochloric acid | Reagent | Fisher Scientific | 351285212 | |
| Linear polyacrylamide | Reagent | Applichem | A6587 | |
| Polyethylene Glycol 6000 | Reagent | VWR international | CAPX1286L-4 | |
| Potassium Chloride | Reagent | Fisher Scientific | AC42409-0010 | |
| Sodium Chloride | Reagent | Fisher Scientific | S2711 | |
| Sodium Hydroxide pellets | Reagent | Fisher Scientific | S3181 | |
| Tris base | Reagent | Fisher Scientific | BP1521 | |
| Dark Reader | Equipment | Clare Chemical | DR46B | |
| Microcentrifuge | Equipment | Eppendorf | 5424 000.410 | |
| Nanodrop 2000 | Equipment | Fisher Scientific | 361013650 | |
| Infusion pump | Equipment | Braintree Scientific, Inc. | N/A | Model Number: BSP See www.braintreesci.com for ordering details. |
| Tube sealer | Equipment | Beckman Coulter Inc. | 358312 | |
| Ultracentrifuge | Equipment | Beckman Coulter Inc. | ||
| Ultracentrifuge rotor | Equipment | Beckman Coulter Inc. | 362754 | |
| Ultraviolet light source | Equipment | UVP Inc. | 95-0017-09 | Any UV source will suffice |
| Ultraviolet light face shield | Equipment | Fisher Scientific | 114051C | |
| Butyl rubber stoppers, gray | Material | Sigma-Aldrich | 27232 | |
| Centrifuge tubes | Material | Beckman Coulter Inc. | 342412 | |
| Hypodermic needle, 23 gauge, 2” length | Material | BD Biosciences | 305145 | |
| Microfuge tubes, 1.5 mL | Material | DiaMed | AD151-N500 | |
| Open center seals, 20 mm diameter | Material | Sigma-Aldrich | 27230-U | |
| Pasteur pipettes, glass | Material | Fisher Scientific | 13-678-6C | |
| Pipet tips | Material | DiaMed | BPS340-1000 | Catalogue number is for 200 μl tips. 10 or 20 μl tips may be purchased from the same source |
| Pump tubing 1.5 mm bore x 1.5 mm wall | Material | Appleton Woods | ||
| Screw-cap tubes, 15 mL | Material | DiaMed | AD15MLP-S | |
| Serum vials, 125 mL volume | Material | Sigma-Aldrich | Z114014 | |
| Syringe, 60 mL | Material | BD Biosciences | 309653 |
참고문헌
- Neufeld, J. D. DNA stable-isotope probing. Nat. Protocols. 2, 860-866 (2007).
- Neufeld, J. D., Boden, R., Moussard, H., Schäfer, H., Murrell, J. C. Substrate-specific clades of active marine methylotrophs associated with a phytoplankton bloom in a temperate coastal environment. Appl. Environ. Microbiol. 74, 7321-7328 (2009).
- Nercessian, O., Noyes, E., Kalyuzhnaya, M. G., Lidstrom, M. E., Chistoserdova, L. Bacterial populations active in metabolism of C1 compounds in the sediment of Lake Washington, a freshwater lake. Appl. Environ. Microbiol. 71, 6885-6899 (2005).
- Padmanabhan, P. Respiration of 13C-labelled substrates added to soil in the field and subsequent 16S rRNA gene analysis of 13C-labelled soil DNA. Appl. Environ. Microbiol. 69, 1614-1622 (2003).
- Bernard, L. Dynamics and identification of soil microbial populations actively assimilating carbon from 13C-labelled wheat residue as estimated by DNA- and RNA-SIP techniques. Environ. Microbiol. 9, 752-764 (2007).
- Haichar, e. l. Z. a. h. a. r., F, . Identification of cellulolytic bacteria in soil by stable isotope probing. Environ. Microbiol. 9, 625-634 (2007).
- Addison, S., McDonald, I., Lloyd-Jones, G. Stable isotope probing: Technical considerations when resolving 15N-labelled RNA in gradients. J. Microbiol. Meth. 80, 70-75 (2009).
- Buckley, D. H., Huangyutitham, V., Hsu, S. -. F., Nelson, T. A. Stable isotope probing with 15N achieved by disentangling the effects of genome G + C content and isotope enrichment on DNA density. Appl. Environ. Microbiol. 73, 3189-3195 (2007).
- Schwartz, E. Characterization of growing microorganisms in soil by stable isotope probing with H218O. Appl. Environ. Microbiol. 73, 2541-2546 (2007).
- Neufeld, J. D., Dumont, M. G., Vohra, J., Murrell, J. C. Methodological considerations for the use of stable isotope probing in microbial ecology. Microb. Ecol. 53, 435-442 (2007).
- Martineau, C., Whyte, L., Greer, C. Development of a SYBR safe technique for the sensitive detection of DNA in cesium chloride density gradients for stable isotope probing assays. J. Microbiol. Meth. 73, 199-202 (2008).
- Bartram, A. K., Poon, C., Neufeld, J. D. Nucleic acid contamination of glycogen used in nucleic acid precipitation and assessment of linear polyacrylamide as an alternative co-precipitant. Biotechniques. 47, 1019-1022 (2009).
- Chen, Y. Revealing the uncultivated majority: combining DNA stable-isotope probing, multiple displacement amplification and metagenomic analyses of uncultivated Methylocystis in acidic peatlands. Environ. Microbiol. 10, 2609-2622 (2008).
- Neufeld, J. D., Chen, Y., Dumont, M. G., Murrell, J. C. Marine methylotrophs revealed by stable-isotope probing, multiple displacement amplification and metagenomics. Environ. Microbiol. 10, 1526-1535 (2008).
- Kalyuzhnaya, M. High-resolution metagenomics targets specific functional types in complex microbial communities. Nat. Biotechnol. 26, 1029-1034 (2008).
- Binga, E. K., Lasken, R. S., Neufeld, J. D. Something from (almost) nothing: the impact of multiple displacement amplification on microbial ecology. ISME J. 2, 233-241 (2008).
- Green, S. J., Leigh, M. B., Neufeld, J. D., Timmis, K. N. . Microbiology of Hydrocarbon and Lipid Microbiology. , 4137-4158 (2010).
- Neufeld, J. D., Wagner, M., Murrell, J. C. Who eats what, where and when? Isotope-labelling experiments are coming of age. ISME J. 1, 103-110 (2007).
- Gallagher, E., McGuinness, L., Phelps, C., Young, L. Y., Kerkhof, L. J. DNA shortens the incubation time needed to detect benzoate-utilizing denitrifying bacteria by stable-isotope probing. Appl. Environ. Microbiol. 71, 5192-5196 .
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유