Method Article
Verimli HLA-Ig Tabanlı Yapay antijen sunan hücrelerin Ex vivo Genleşme
Bu Makalede
Özet
Antijen-spesifik T hücrelerinin indüksiyon ve genişleme için yeni bir DC bağımsız bir yöntem açıklanmıştır. HLA-A2-Ig tabanlı yapay Antijen sunan hücreler (aAPC), HLA-A2 verimli farklı antijen özgüllüğü CTL genişletmek için kısıtlı peptitler ile yüklenir. Bu teknoloji tabanlı CTL evlatlık immünoterapi için büyük bir potansiyele sahiptir.
Özet
En iyi effektör fonksiyonu ile CTL, çeşitli hücre içi enfeksiyonlara ve kansere karşı koruma aracılık kritik rol oynar. Ancak, bireylerin baskılayıcı bağışıklık mikroçevresinin gösterebilir ve aktive CTL aksine, otolog antijen sunan hücreler tolerize eğilimi olabilir veya antijen spesifik CTL anergize. Sonuç olarak, hala deneysel aşamada olmasına rağmen CTL tabanlı evlatlık immünoterapi gibi kanser ve virüs enfeksiyonları gibi çeşitli hastalıklar için umut verici bir tedavi haline gelmifltir. İlk deneylerde ex vivo genişletilmiş CMV (sitomegalovirüs) immün sistemi baskılanmış allojenik kemik iliği nakli hastalarında CMV enfeksiyonu tedavisi için kullanılan spesifik CTL edilmiştir. Bu hastalarda yaşamı tehdit eden CMV viremi ortak, alan hastaların hiçbiri CTL anti-CMV bağışıklık adoptively transfer CTL 1 tarafından kurulmuştur ima, CMV ile ilgili hastalık geliştirmek genişletti. Melanom için umut verici sonuçlar da gözlenmiştir ve diğer kanser türleri 2 için uzatılabilir.
Ex vivo insan CTL teşvik etmek ve genişletmek için birçok yol olmasına karşın, güncel yaklaşımların maliyet ve teknik sınırlamalar ile sınırlıdır . Örneğin, mevcut altın standarttır otolog DC dayanmaktadır. Bu, her bir hastanın önemli bir lökosit sayısı bağış gerektirir ve aynı zamanda çok pahalı ve zahmetli bir iştir. Ayrıca, bu sadece suboptimal effektör fonksiyonu 3 DC genişletilmiş CTL in vitro karakterizasyonu ayrıntılı sahip olduğunu ortaya koymuştur.
Burada, evlatlık immünoterapi (Şekil 1) insan CMV spesifik CTL ex vivo genişlemesi için son derece verimli aAPC tabanlı bir sistem sunuyoruz. AAPC insan HLA-A2-Ig dimer ve anti-CD28mAb 4 hücre ölçekli manyetik boncuk kaplin tarafından yapılmıştır. AAPC yapıldıktan sonra, çeşitli ilgi peptitler ile yüklü ve ay için işlevsel kalır olabilir. Bu raporda, aAPC CMV, pp65 (NLVPMVATV) baskın bir peptit ile yüklendi. AAPC ile bir hafta boyunca sağlıklı bir donörden insan CD8 + CTL saflaştırılmış kültür sonra, CMV spesifik CTL, özgüllüğü% 98 (Şekil 2), dramatik bir şekilde artmış ve 10.000 'den fazla kat güçlendirilmiş olabilir . CMV spesifik CTL gerekiyorsa, daha fazla genişleme aAPC ile tekrarlayan stimülasyonu ile kolayca elde edilebilir. Fenotipik ve fonksiyonel karakterizasyonu bu genişletilmiş hücreleri efektör bellek fenotipi (Şekil 3) TNF ve IFNγ hem de önemli miktarda ve gösterir.
Protokol
1. , HLA-A2-Ig tabanlı aAPC
- Steril borat tamponu hazırlayın
- Borik asit, 0.1M yapmak için suda çözülür. PH 7.0 'ye ayarlayın.
- Filtre 0.22μm steril bir filtre ve mağaza üzerinden 4 ° C
- Steril Boncuk Yıkama tamponu hazırlayın
- 956ml PBS w / o magnezyum veya kalsiyum alın.
- 30ml insan AB serum ekleyin.
- EDTA 2mm son konsantrasyon ekleyin.
- 0.1gsodium azid ekleyin.
- 0.22 mikron steril filtre ve mağaza süzülür 4 ° C
- , Stok, yaklaşık 400 milyon boncuk (boncuk hemasitometre sayılabilir) 1ml Invitrogen M-450 Epoksi boncuk alın, ve steril, vida top cam flakon koymak.
- Boncuklar flakonun tarafına bağlı ise, bir Dynal mıknatıs MPC-1 karşı flakon koyun, aspirasyon ile süpernatantı çıkarın. Boncuk, borat tamponu 1ml ile bir kez yıkayın.
- 1 ml borat tamponu ve HLA-A2-Ig dimer ve anti-insan CD28 mAb (Klon 9.3) 20 mg 20 mg bir karışımı süspanse edin boncuk.
- Boncuk konjugasyon Protein: Rotator Cam şişe koymak ve 4 döndürmek ° C 24 saat.
- MPC-1 mıknatıs tüp yerleştirin ve tüm borat tamponu çıkarın.
- Boncuklar iki kez 1ml Boncuk Yıkama tamponu ile yıkayın.
- 1ml Boncuk Yıkama tamponu boncuk inkübe, 4 döndürmek ° C 24 saat boyunca. Boncuk Yıkama tampon insan AB serum içerdiğinden, boncuklar üzerinde kalan protein bağlanma yeri engeller.
- Cam şişeden süpernatantı 1ml taze Boncuk Yıkama tamponu ile değiştirin.
2. Kalite kontrol aAPC ve peptid yükleme, depolama
- FACS tüpler tampon yıkama 100μl FACS ~ 5 × 10 5 boncuk ekleyin ve anti-fare IgG1-PE 1μl (HLA-A2-Ig Fc bölümünü tanımaz) ve anti-fare IgG2a-FITC 1μl (tanımak leke anti-CD28 mAb Fc parçası). 20 dakika boyunca tampon yıkama FACS boyama sonra, akış sitometresinin (Şekil 4) hemen boyama sonucu tekrar yıkayın ve okuyun.
- Boncuklar üzerine Peptid yükleme: 1 ml steril PBS ile cam flakon boncuklar iki kez yıkayın. 1ml steril PBS ile süspanse edin sonra CMV peptid (1mg/ml) 10μl eklemek
- Hemasitometre boncuk sayın ve tarih ve konsantrasyon ile, tüp etiketi.
- aAPC HLA-A2-Ig dimer üzerine peptid bağlama yeterli zaman tanımak için en az 3 gün, 4 peptid inkübasyon ° C, sonra kullanıma hazır. Boncuk 4 saklanabilir ° C ve en az 6 ay süreyle işlevsel kalır.
3. İnsan CTL izolasyon
- 10 BD Sodyum Heparin Vacutainer tüpler içine sağlıklı HLA-A2 pozitif vericiden ~ 100 ml taze periferik kan toplayın. 21-gauge iğne veya hemoliz önlemek için büyük kullanın.
- 10 dakika boyunca oda sıcaklığında 300xg santrifüjleyin
- Aspirasyon üst plazma tabakasını dikkatlice çıkarın. Plazma kültür ortamı için ek olarak kullanılabilir.
- Steril PBS ile toplanan plazma değiştirin ve steril bir T75 kültür şişelerinde veya 50ml konik tüpler içine kan transferi. Yukarı ve aşağı pipetleme kan PBS ile karıştırın.
- Bir kez tüm kan toplanır, dört ek 50ml konik tüpler hazırlamak ve Ficoll-Paque Plus 15ml ekleyin.
- Yavaş yavaş bindirme Ficoll her tüpün üstüne kan hücreleri 30-35ml. Ficoll ve kan hücreleri arasında arayüz ayrı tutun.
- Oda sıcaklığında 20 dakika 500xg santrifüjleyin. Fren "kapalı" ve katmanları arasında açık bir arayüz sağlamak için mümkün olduğunca düşük ivme açın.
- Seriological pipet kullanarak, dikkatle PBMC tabakası aspire taze 50ml konik tüp içine PBMC toplamak. Tüm PBMC 400xg az 10 dakika süreyle PBS ve spin 30ml eklemek hasat edilir. Süpernatantı atın ve kalan tüm Ficoll kaldırmak için bir kez daha 30ml PBS ile yıkayın.
- Miltenyi insan CD8 + T hücre üretici firmanın protokolüne göre izolasyon kiti kullanılarak CD8 + T hücre izolasyonu geçin. Hücreleri - Bu kit çok CD8 tüketen (genellikle>% 95) CD8 + hücreler için zenginleştirir.
- CD8 + T hücreleri sayın. Beklenen saflığı% 95 daha büyük olmalıdır. Onaylamak ve bu kullanım 2x10 5 hücre CD4/3/8 FACS analizi gerçekleştirmek için. Ya kalan CTL antijen-spesifik aAPC uyarılması için hemen olabilir ya da gelecekte kullanılmak üzere dondurularak muhafaza edilebilir.
4 in vitro aAPC temelli bir kültür sistemi
- Kültür ortamı hazırlayın
- TF (laboratuar 4 T hücre büyüme faktörü) 2X kültür ortamı: tam RPMI orta artı% 5 plazma ve% 8 T hücre büyüme faktörü otolog donör.
- Donör otolog plazma AB serumu ısı ile inaktive edilmiş insan tarafından ikame edilebilir.
- Tam RPMI medyum TF 2X kültür ortamı artı 8 ml 8 ml yeniden süspanse 1 milyon CTL, 1 × 10 6 aAPC, iyice karıştırın.
- Iyi 96 U altındaki doku kültürü plakaları üzerine plaka hücrelere bir multi-kanal pipetter kullanın. (Için de ul 160)
- Kültür hücreleri 37 ° C, 7 gün süreyle% 5 CO 2 incubater. 4 gün 80 ul / TF 2X orta hücrelerin besleyin.
- Hücreler 7 gün hasat edilebilir hazırız. Hasattan sonra, mıknatıs karşı hücreleri yer ve eski aAPC çıkarın.
- Antijen özgüllüğü, üretici firmanın protokolüne göre tetramer boyama ile tespit edilebilir. Fenotip boyama ve hücre içi sitokin boyama önceki çalışmada 3 göre yapılmaktadır.
- Hasat hücreleri aynı koşullar altında tekrar aAPC replated olabilir. Hücre sayısı ve antijen özgüllüğü tekrarlanan stimülasyon sonrasında artması beklenmektedir.
5. Temsilcisi Sonuçlar:
HLA-A2-Ig ve anti-CD28 konjugasyon sonra aAPC bir örnek Şekil 4'te gösterilmiştir. Başarılı protein konjugasyon net bir kayma ile ilgili antikor boyama açıktır. Periferik kan CMV spesifik CTL frekans aAPC aracılı stimülasyon tek bir hafta sonra, genellikle% 0.5-1 iken, özgüllüğü 55 ulaşabilirsiniz -% 93 (Şekil 2 ve 3). Antijen spesifik CTL genişleme farklı bağışçılar arasında çok değişken olabilir, ancak sonuçlar aynı donör içinde tekrarlanabilir. Ekstrapolasyon, CMV hücrelerin genişlemesi habercisi seviyeleri doğrudan ex vivo (veriler gösterilmemiştir) ile karşılaştırıldığında binlerce kat olabilir. Hücre içi sitokin boyama (Şekil 3) Bu genişletilmiş CTL polifonksiyonel ziyade, bitkin, uzun süreli hücre kültürü ve önemli çoğalması.

Şekil 1 allojeneik HKHT evlatlık immünoterapi için insan CTL aAPC ex vivo genişlemesi Temsilcisi akış şeması
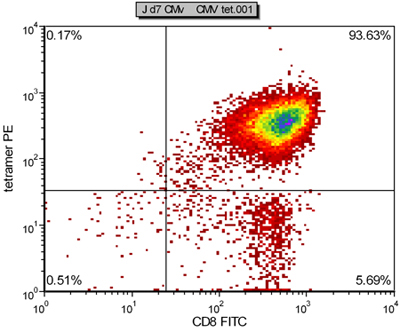
Şekil 2 CMV spesifik CTL bir hafta sonra kültür aAPC tarafından oluşturulan Temsilcisi tetramer boyama sonucu
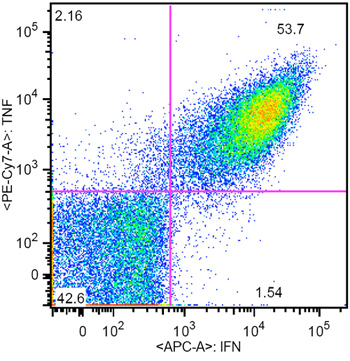
Şekil 3 CMV spesifik CTL aAPC tarafından üretilen Temsilcisi hücre içi sitokin boyama sonuç (CMV özgüllük% 61)
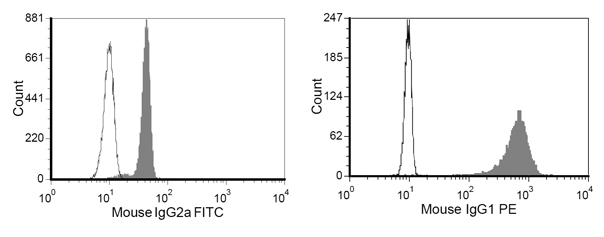
Şekil 4. M-450 Epoksi boncuk Temsilcisi boyama sonucu protein konjugasyon sonra anti-fare IgG1-PE ve anti-fare IgG2-FITC ile boyandı
Tartışmalar
Biz burada açıklamak aAPC sistemi, çeşitli antijenlere karşı insan CTL ex vivo genişlemesi için verimli bir sistem. Özel bakım 96-plaka kültürü, kalitesi ve protein konjugasyon aAPC ve CTL, hatta dağıtım konusunda alınmalıdır. Biz bir milyon kat 4 antijen-spesifik CTL kadar genişletilebilir sırasında fazla 8 hafta boyunca CTL genişletmek mümkün olmuştur bu yaklaşımı kullanarak. Hücre hatları veya diğer acellular platformlarda 5 yararlanarak çeşitli yapay APC sistemleri var olmuştur, ancak her sistem, genişleme ve özgüllüğü konusunda farklı uygulamaları destekleyen ile eşsiz bir profile sahiptir yayınlanan veriler göre . KVK, kalite, miktar olarak önemli olduğundan da önemlisi, sistem tarafından üretilen CMV spesifik CTL polyfunctionality üstün anti-viral etkinliği tanımak bekleniyor.
Açıklamalar
Teşekkürler
Biz Aaron Selya yararlı tartışma için teşekkür etmek istiyorum. Bu çalışma, JS, MO bir pilot hibe ve Johns Hopkins Sıtma Araştırma Enstitüsü, Savunma hibe PC 040.972 Departmanı, Ulusal Sağlık Enstitüsü, hibe AI29575, CA108835, AI077097 tarafından desteklenen
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif | Şirket | Katalog numarası | |
|---|---|---|---|
| Vacutainer tüp (heparin içeren) | Becton Dickinson | 367874 | |
| İnsan CD8 + T hücre izolasyon kiti | Miltenyi | 130-094-156 | |
| Dynabeads M-450 Epoksi | Invitrogen | 140,11 | |
| Dynal MPC-1 Mıknatıs | Invitrogen | 120-01d | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| RPMI medyum 1640 | Gibco | 11875 | |
| HLA-A2-Ig dimer X | Becton Dickinson | 551263 | |
| iTAgMHC tetramer (HLA-A2-CMV)-PE | Beckman Coulter | T20099 | |
| Falcon net bir 96-iyi Microtest plaka | Becton Dickinson | 353077 | |
| Rat anti-fare IgG2a-FITC | Becton Dickinson | 553390 | |
| Keçi anti-fare IgG1-PE | Invitrogen | P21129 | |
| İnsan serum AB tipi | Atlanta biyolojik | S40110 | |
| Fare, anti-insan CD8a-FITC | Sigma-Aldrich | F0772 | |
| Fare anti-insan CD8a APC | Becton Dickinson | 340684 | |
| Fare anti-insan IFNγ-FITC | Becton Dickinson | 340449 | |
| Fare insan anti-TNF-PE | Becton Dickinson | 340512 |
Referanslar
- Walter, E. A. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N Engl J Med. 333, 1038-1038 (1995).
- Rosenberg, S. A. Adoptive cell transfer: a clinical path to effective cancer immunotherapy. Nat Rev Cancer. 8, 3669-3669 (2008).
- Oelke, M. Ex vivo induction and expansion of antigen-specific cytotoxic T cells by HLA-Ig-coated artificial antigen-presenting cells. Nat Med. 9, 619-619 (2003).
- Oelke, M. Artificial antigen-presenting cells: artificial solution for real diseases. Trends Mol Med. 11, 412-412 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır