Method Article
Konfokal Makroskopi kullanarak Postnatal Serebellar Granül Hücre Göç Ex Vivo Görüntüleme
Bu Makalede
Özet
During postnatal cerebellum development, immature granule cells originating from the germinal zone exhibit distinct modalities of migration to reach their final destination and to establish neuronal networks. This protocol describes the preparation of cerebellar slices and the confocal macroscopic approach used to investigate the factors that regulate neuronal migration.
Özet
Doğum sonrası gelişimi sırasında, olgunlaşmamış granül hücreleri (eksitatör internöron) serebellar korteksin iç granüler tabaka ulaşmak için moleküler tabaka ve Purkinje hücre tabakası dış granüler tabakasında teğet göç ve ardından radyal göç gösterirler. Göç süreçlerinde Standart çeşitli serebellar fonksiyonları açıklarına yol hücre ölümü ya da nöronların risklerinin ya uyarır. Merkezcil granül hücre göçü nihai konumuna doğru hücreleri yönlendirmek için böyle kemotaksisinin ve hücre dışı matriks bozulması gibi çeşitli mekanizmalar, içerir, ancak her kortikal katmanda hücre göçü düzenleyen faktörler sadece kısmen bilinmektedir. Bizim yöntemde, akut serebral dilimleri P10 sıçan hazırlanır, granül hücreleri fluoresan bir sitoplazmik bir işaretleyici ile etiketlenir ve dokular 37 ° C'de konfokal makroskopi hücre göçünün gerçek zamanlı izleme başlamadan önce 4 ila 10 saat membran ekler üzerinde kültürlenmiştir içindeCO 2 varlığı. Beyincik farklı kortikal tabakalar halinde kendi göç sırasında, granül hücrelerinin nöronal göç düzenlenmesinde olası rolünü araştırmak için nöropeptid agonistleri veya antagonistleri, proteaz inhibitörleri, hücre içi efektörlerinin veya alkol ya da Methylmercury bile toksik maddelerin bloker maruz kalabilir .
Giriş
Gelişmekte olan beyincik, nöron sekiz farklı tipte ikinci embriyonik haftada ve kemirgenler 1 ikinci doğum sonrası hafta arasında sırayla üretilmektedir. Başlangıçta birincil germinal bölge hareketle, olgun olmayan granül hücreleri (GC), dış granüler tabaka (EGL), ikinci bir germinal bölge 2 üretilebilir son nöronlardır. İlk üç sonrası hafta boyunca, serebellar korteks EGL, moleküler tabakanın (ML) dahil olmak üzere dört katman olarak düzenlenen bir yapraklanmış bir yapıdır, Purkinje hücresi tabakası (PCL) ve iç granüler tabaka (IGL) (Şekil 1). Merkezcil göç, olgunlaşmamış GC'ler, glutamaterjik internöronların sayesinde, yaklaşık 2 gün içinde Igl ulaşır. Üçüncü doğum sonrası haftasında, EGL kaybolur ve IGL yetişkin beyincik granüler tabaka (GL) ne denir oluşturmaktadır. GL, GC'ler yosunlu elyaf ve unipolar fırça hücrelerinden eksitatör sinaptik girişleri alabilir veGolgi hücre aksonlarından inhibitör sinaptik girdiler. ML ise, GC aksonları Purkinje hücreleri, sepet hücreleri, stellat hücreler ve golgi hücrelerinin 2 olmak üzere GABAerjik nöronlar ile sinaps eksitatör yapmak.
Erken doğum sonrası kemirgenler elde edilen akut serebellar dilimleri içinde hücre hareketi Gerçek zamanlı gözlem GC'ler serebellar korteks 3 onların rota boyunca göç yöntemi ve hız değişiklikleri ile eş zamanlı olarak kendi şeklini değiştirmek olduğunu göstermektedir. İlk iki doğum sonrası hafta boyunca, GC öncüleri aktif EGL üstündeki çoğalır. EGL orta kısmında, postmitotic GC'ler onların büyük sürecinde yönünde teğet göç ederler. EGL-ML sınırında, GC'ler onların hareketlerini yavaş hücreler ML içine kısa dikey inen sürecine girmeye başlar. ML yılında GC'ler dikey uzatılmış hücre gövdesi, ince firar süreci ve daha hacimli lider süreci ve Bergmann glial lifleri boyunca radyal göç. IçindePCL, GC'ler kendi hareketini durdurmak ama uzun bir sabit faz (2 saat) sonra, onlar PCL-IGL sınırını geçmeye. Igl yılında GC'ler glial lif desteğinin yokluğunda tabakasının altına doğru göç ederler. Giden süreçte uçları kez IGL-beyaz cevher (WM) sınır, GC'ler yavaş yaklaşmak ve onların hareketini durdurun. Sagital dilim ML, PCL ve Igl göçü radyal adanmıştır ise beyincik enine kesitler EGL de teğet göç çalışmaları için tercih edilmektedir. (Örneğin, somatostatin, PACAP) şimdiye kadar tespit edilmiştir nöropeptid ancak her kortikal katmanda GC göç uzay-zamansal kontrolünde yer alan komple mekanizmalar da dahil olmak üzere GC hareketlerinin bazı düzenleyici faktörler hala büyük ölçüde bilinmeyen 1,4,5,6 vardır.
GC göç acu için izole kültürlü hücreleri veya floresan tespiti için ya iletilen ışık aydınlatma kullanarak video ve konfokal mikroskopi sayesinde son 20 yılda çalışılmıştırte serebellar dilimleri. Başlangıçta lipofilik DII ve son zamanlarda "Hücre Takibi" boyalar ve hücre-ifade floresan proteinleri konfokal ya da iki-fotonlu mikroskopi 7,8 kullanılmıştır. Başarılı deneyler protokol basit ama kolay değil yapmak belirli prosedürlerin sayısına bağlıdır. Özellikle, akut dilimler bir ev yapımı naylon örgü ağı 9 genellikle gözlem sırasında stabilize edilmesi gerekir. ışık aydınlatma şiddeti çoklu tarama konfokal mikroskop yaklaşım tarafından önerilen fototoksisite ve photobleaching önlemek için mümkün olduğunca düşük olması gerekir. Buna ek olarak, sıcaklık ve CO2 nöronal göç etkileyebilir istikrarsızlık beri önemli çevresel parametrelerdir. Kolaylaştırmak ve deneysel prosedürleri rafine etmek, biz, dilim hareketlerini sınırlayan sabit çevre parametreleri sağlar, photobleaching azaltır ve consequ (milimetre mertebesinde) görüş alanını artıran bir konfokal makroskopi protokolü geliştirdikgörüntü analizi yoluyla izlenebilir hücreleri (onlarca) sayısını isteğinizle. Bu durumda, 180 mikron kalınlığında kesitler membran ekler üzerinde kültürlenmiştir ve 6 oyuklu plakalar doğrudan büyük bir inkübasyon odası, sıcaklık ve CO2 kontrolör ve bir sarsıntı kontrol sistemi ile donatılmış bir ticari konfokal macroscope bir 2X objektif altında motorlu aktarılır. Zaman zaman aşımına uğrar ve z-yığınlarının daha sonra birkaç saat ve farmakolojik araçlar üzerinden gerçekleştirilir ya da biyolojik olarak aktif moleküllerin ilave ya da kuluçka ortamı içinde verilebilir. Bu yöntem, aynı zamanda, farklı gelişim aşamalarında serebellum ya da beyin nöron diğer tiplerinin hareketini incelemek için adapte edilebilir.
Protokol
Hayvanlar (erkek veya dişi Wistar sıçanlar) bakım ve laboratuar hayvanlarının kullanımı için Fransız kılavuza göre, doğduğu ve akredite hayvan tesisi (onay B.76-451-04) yetiştirildi. Deneyler Avrupa Topluluğu Konsey Direktifi (22 Eylül 2010/63 / UE 2010) ve Fransa Tarım Bakanlığı uyarınca yetkili müfettişler (MB, DV ve LG) gözetiminde yapılmıştır.
Medya ve Araçlar 1. Hazırlık
- Bir biyolojik güvenlik kabini, MgCI2 olmayan CaCl2 (1.85 g / l) / MgSO 4 (0,9767 g / l) ihtiva eden 10x stok çözeltisinden steril su içinde 1x Hank BSS (HBSS) hazırlanması. HBSS çözeltisi 1x NaHCO 3 (350 ug / ml) ilave et.
- Biyolojik güvenlik kabini içinde, N2 (100X'lik bir stok çözeltiden), ek ve penisilin (100 birim / ml) -streptomycin (0.1 mg / ml) Dulbecco'nun modifiye edilmiş Eagle ortamında (DMEM) besin karışımına solüsyonu ekleyinTüre, F-12 (1: 1).
- Steril koşullarda, DMSO içinde sitoplazmik fluoresan boya olarak adlandırılan hücre izci yeşil bir kısım (25 ul, 2 mM) (1 mg 1.075 mi) hazırlanır. 15 ml konik bir tüp içinde 5 ml DMEM bir kısım ile seyreltilir.
- 4 ° C'de medyayı tutmak için doldurulmuş buz kovası hazırlayın.
- % 70 etanol ile laboratuvar tezgah üstleri ve araçları dekontamine.
P10 Rats adlı Serebellumunda 2. Diseksiyon
- Hızla omurilik başlangıcını almak için kulakların arkasında kavisli işletim makas ile sıçan yavrular (P10) başını kesmek.
- Kellesi başın arka tarafında, ince iris makası ile burun boyun derinin orta hat kesi yapmak ve ince iris makas ve Dumont 3. forseps ile kafatası cilt ayırmak.
- Ince kafatası rostral bölgeye tabanından iki yan kesiler yapmak için ince iris makas kullanın. İki 3. forseps ile disseke kafatası çıkarın. Sutyen ayırınAynı forseps kullanarak kafatası ile herhangi bir bağlılık dan.
- Buz soğukluğunda HBSS ortam 2 ml içeren bir Petri kabı, bir spatula (çapı 35 mm) kaşık ucu ile beyin aktarın.
- Stereomikroskopta aşamasına buz ve transfer dolu büyük bir Petri kabındaki beyin içeren Petri kabı (Ø 100 mm) koyun.
- Bir stereomikroskop altında, iki arasında 3 forseps kullanarak dilaceration ile beyinden beyincik izole. Benzer şekilde, rezidüel omurilik ve pial-membran kaldırmak.
- Bir spatula kaşık ucu ile yeni bir HBSS dolu Petri kabındaki serebellum (Ø 35 mm, 2 ml) aktarın ve buz üzerinde tutmak.
Akut Serebellar Dilimleri 3. hazırlanması
- İki başkanları tarafından belirtildiği gibi stereomicroscope altında, vermis ve sağ hemisfer arasında beyincik kesti standart neşter sapı 3. katı ve 15. cerrahi bıçak ile Şekil 2A ok.
- Mavi bir damla koyunoacrylate vibratome numune disk üzerinde tutkal ve toksik solvent buharının ortadan kaldırmak için 15-25 sn bekleyin.
- Bir spatula kaşık ucu ile kesme beyincik toplayın ve temiz bir kağıt havlu ile fazla HBSS çıkarın.
- Örnek diske yakın beyincik getirin. Örnek diske kesme kenarı sabitleyin ve 10 sn bekleyin.
- Manipülatör ile tampon tepsisine örnek diskini yerleştirin ve böylece beyincik enine ekseni bıçak tutucu dik döndürün. Bir Allen anahtarı ile numune diski sabitleyin ve beyincik kaplıdır kadar hafifçe HBSS orta tampon tepsisini doldurun.
- Yük soğutma banyoya buz ezilmiş.
- Herhangi bir yağ ortadan kaldırmak için% 70 etanol ile bıçak üç kez temizleyin.
- Bıçak tutucu içine bıçağı yerleştirin ve vida sıkma ile sabitleyin.
- Numunenin (kullanıcının görünümü) arka kenarı arkasında bıçak kenarı sağa yerleştirin ve bir başlangıç noktası olarak tanımlayabilirsiniz. İleri kullanın t tanımlamak komutunuO numunenin ön kenarı sonra bitiş noktası.
- 2.5 hızı kesit ve 180 mikron de 8. Seçin kırparak kalınlıkta frekansı kesit seçin. Doku bölümlendirilmeleri başlatın.
- Buz üzerinde tutulmalıdır Petri kabı (Ø 35 mm) HBSS içeren Pasteur pipet ve transfer kesildi geniş çaplı bir camını kullanarak her bölüm Pick up.
- Bıçak ile müdahale sırasında iki 5. forseps kullanarak, beyincik dikkatlice meninksler çıkarın. Beyincik başına 5 dilimleri (Şekil 2B, C), maksimum toplayın.
- Dikkatle stereomicroscope altında iki 5. forseps ile serebellar dilim meninksler çıkarın ve daha sonda yükleme için hafifçe lobülleri ayırın.
Yaşam internöronlar 4. Floresan Boyama
- 6-plaka (kuyu başına maksimum 3 dilim /) için geniş çaplı cam kesildi Pasteur pipeti ile serebellar dilim aktarın. HBSS orta aspire.
- L, 5 ml dilimleri (3 max) inkübefloresan boya oading çözeltisi (10 uM).
- Işıktan korumak için alüminyum folyo ile örtünüz. Hücre etiketleme kolaylaştırmak için oda sıcaklığında 10 dakika boyunca 35 rpm'de bir cayro hareketli tabla üzerine koy.
- Geniş çaplı bir cam kesildi Pasteur pipeti ile, bir Transwell membranı üzerinde Aktarım dilimleri (Şekil 2D 3.0 um gözenek boyutu) takın. Pipet ile yükleme ortamı aspire.
- Parçayı çıkarın ve DMEM 1.9 ml kuyu doldurun. Yuvasını yerine ve doku kapsayacak şekilde dilimin üstüne DMEM 100 ul ekleyin.
- Kuluçka bölmesinde kültür ekleri ML GC'lerin gözlemlemek için yeterli olan, 2 saat boyunca (37 ° C,% 5 CO2) içeren plaka koyun. Insert membran (Şekil 2E) eki izin düz dokuları Lie. Dilimler kurutma değil emin olun.
Konfokal Makroskopi sayesinde 5. ex vivo Görüntüleme
- Olmadan plaka aktarınBir kuvöz içine plastik kapak konfokal macroscope standı bağlı. Macroscope plaka insert bir cam kapağı yerleştirin. 37.0 ° C 'de odanın sıcaklığını tutmak ± 0.5 ° C ve sürekli gaz akımının (% 95 O2,% 5 CO2) plaka ekleme yoluyla, pH sabit tutmak için olan dilim tedarik. Time-lapse deneyden önce 2 ek saat bekleyin.
- Doku dilimleri GC göç görselleştirmek bir X2, kuru amacı ile donatılmış bir konfokal lazer tarama macroscope ile bir lazer diyotu vasıtası ile 488 nm dalga boyu ışık ile hazırlanmasını aydınlanması için (çalışma mesafesi: 39 mm, çap: 58 mm, NA = 0.234), ve 500 'den 530 nm'ye kadar flüoresans emisyon algılar.
- Ince GC'ler hareketini gidermek için, 1,5-2,0 ek bir optik zum faktörü ile görüntüler elde. Tek bir odak düzlemi veya z ekseni boyunca 10 farklı odak düzlemleri kadar 12 saat boyunca her 30 dakika kadar GNS görüntüleri toplayın.
- Gerektiğinde, cam kapağını çıkarın ve GC göç üzerindeki etkilerini incelemek için bir 10 ul pipet ile DMEM biyolojik aktivatörleri veya inhibitörlerinin küçük hacimli (1-10 ul) ekleyin.
6. Hücre Takibi
- Filmin her zaman için, ImageJ Ecart tipi modu ile z-yığın projeksiyonu gerçekleştirin. Kontrast modüle ve ardışık görüntülerin parlaklık seviyesi tespiti ve etiketli GClerin izlemeyi kolaylaştırmak için. Harita (t = 0) referans anlık elle her pozisyon.
- Analiz Parçacık Menüsünde "Manuel izleme" eklentisi kullanın ve time-lapse sırasında her hücre vücudun ağırlık noktasını tıklayarak belirler. Bir elektronik ham izleme verileri aktarın.
- Her hücre ve ilişkili pozisyonlarını belirlemek (PHP kodu ile yazılmış http://primacen.fr) akıllı ev yapımı program ile ImageJ ihraç ham izleme verilerini yeniden düzenleyebilirler. Programı kullanarak, calculatToplam seyahat mesafesi ve her hücre için göç ortalama hızı e. Sınıflandırmak ve aynı programı kullanarak uygun filtrelerin altında kontrol ve tedavi koşullarında hücre göçü özelliklerini karşılaştırmak.
Sonuçlar
Farklı kortikal katmanları 1 (Şekil 1) çapraz olarak erken doğum sonrası beyincik ise, GC'ler kendi modu ve göç hızı önemli değişiklikler gösterirler. Bu bölüm, doğal hücresel ortamda GC göç incelenmesiyle elde edilebilir sonuçlarının örneklerini göstermektedir. Yeşil floresan boya ile etiketlenmiş P10 sıçan serebellar doku dilimleri konfokal macroscope (Şekil 3A) altında incelenir ve biz GC'ler 18 mikron / saat ortalama hız (Şekil 3B, C) ML radyal göç olduğunu göstermektedir. Bugüne kadar, etkileşimlerin rolü / düzenleyici faktörler ve her kortikal katmanda hücre migrasyonu kontrolünde rol oynayan moleküler mekanizmalar da dahil olmak üzere nöronal ve glial hücreler arasındaki iletişimi büyük ölçüde bilinmemektedir. Sonuç olarak, ana sorun bu kortikal tabaka-speci bir rol oynayabilir neuropeptides, nörotransmitter, nörotrofinleri ve hücre dışı matriks bileşenlerini tespit etmektirgöç sürecinde hız fic değişir. Hipofiz adenilat siklaz aktive polipeptit (PACAP) ama aynı zamanda ML ve Igl kemirgenler 7,10,11 ilk iki doğum haftasında, PCL ağırlıklı olarak algılanır. Kültür ortamına PACAP38 (10 -6 M) Uygulama ML GC bir% 79 hız azalmasına neden olmuştur. Örneğin, ML GClerin hareket hızı PACAP38 (Şekil 4A) ve daha sonra 2.5 um / saat kontrol koşullarında 11.9 um / saat arasında düştü. Doku tipi plasminojen etkinleştiricisi (tPA) gibi hücre yapışma molekülleri ya da laminin 12,13 gibi hücre dışı matris (EM) bileşenlerinin bozunmasına neden proteolitik kaskadımn bir üyesi. tPA ve plasminojen, tPA bir alt-tabaka, doğum sonrası serebellum 14,15,16 gelişimi sırasında kortikal katmanları olarak tespit edilir. PAI-1 (10 7 M), endojen tPA bir inhibitörü, verilmesi% 78 GC azaltılabilirML göç. Örneğin, GC'ler PAI-1 (Şekil 4B) ilave edildikten sonra 4.2 um / saat kontrol koşullarında 19.2 um / saat arasında ML geçiş hızı azalır. Bu sonuçlar, PACAP GC hareketleri ve serin proteaz tPA gelişmekte olan sıçan serebellumun ML GClerin göç kolaylaştırdığı direkt bir inhibisyon etkisi gösterdiğini işaret etmektedir.
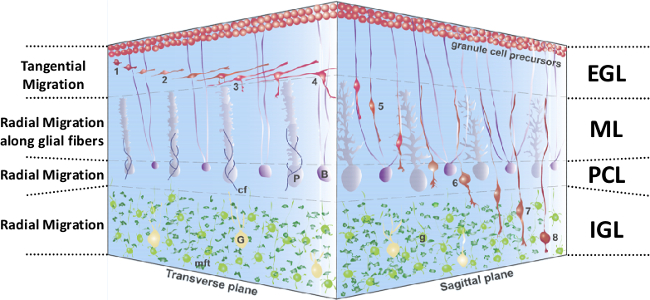
Şekil 1: doğum sonrası beyincik korteksinde GC göç 3D gösterimi. Igl 1-4, EGL GC süreçleri ve teğet göç Uzatma. 5, Bergmann glial lifleri boyunca ML Radyal göç. 6, PCL geçici durağan faz. 7, Glial bağımsız radyal göç. 8, Tamamlama . kırmızı IGL GC GC göç, granül hücrenin; EGLDış granüler tabakası; koyu mor B, Bergmann glia; G, Golgi hücresi, sarı, cf, tırmanma lifleri, mavi, g, postmigratory granül hücrelerinin, açık yeşil, Igl, iç granüler tabaka; mft, yosun tutmuş lif Terminal, koyu yeşil, PCL, Purkinje hücre tabakasının, açık mor P, Purkinje hücresine; ML, moleküler katmanın. Bu şekil 5 ile modifiye edilmiştir.

Şekil 2: P10 serebellar dilim ex vivo kültür (A) P10 sıçandan Dissected Serebellum.. Ölçek çubuğu = 6 mm. Stereomikroskobi ile 180 mikron kalınlığında serebellar dilim yaşam (B) Mikrografik. Ölçek çubuğu = 3 mm. (C) endaha yüksek bir büyütme, beyincik dört kortikal katmanları (EGL, ML, PCL, IGL) zaten ayırt edilebilir. Ölçek çubuğu = 1 mm. Flüoresan etiketleme sonra (D) doku dilimleri 6-çukurlu plaka kültürü ekler (24 mm çapında) yerleştirilir. (E) doku kültürü tedavi polyester membran ile bir kültür ucun şematik. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
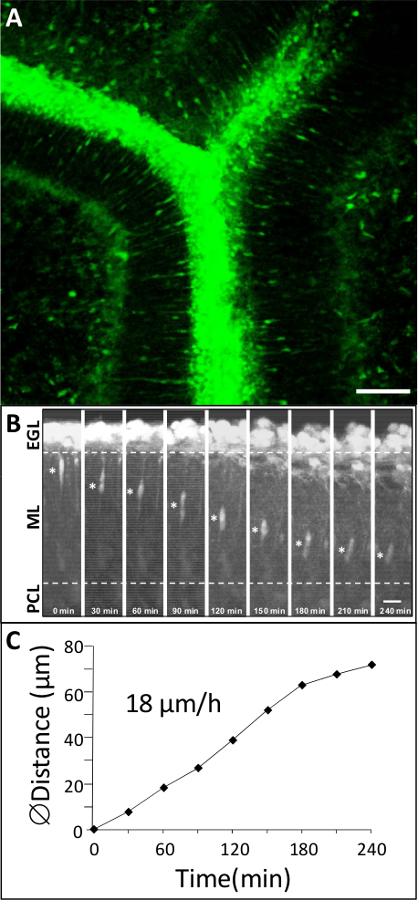
Şekil 3: Sıçan P10 beyincik kortikal tabakalar halinde GC'ler Dinamik göç GC'ler yeşil sitoplazmik floresan boya ile etiketlenmiş edildiği bir P10 sıçan serebellar dilim (A) Macroconfocal görünüm (xyz, 2D projeksiyon).. Ölçek çubuğu 75 mikron =. (B) GC gösteren Time-lapse görüntülemeKontrol koşullarında 4 saat konfokal makroskopi tarafından ML hareketleri. Yıldız (*) sembolü GC soma işaretler. Geçen süre (dk) her fotomikrografisinin alt belirtilir. Ölçek çubuğu 10 mikron =. (C) GC soma tarafından katedilen mesafeye Sıralı değişir.
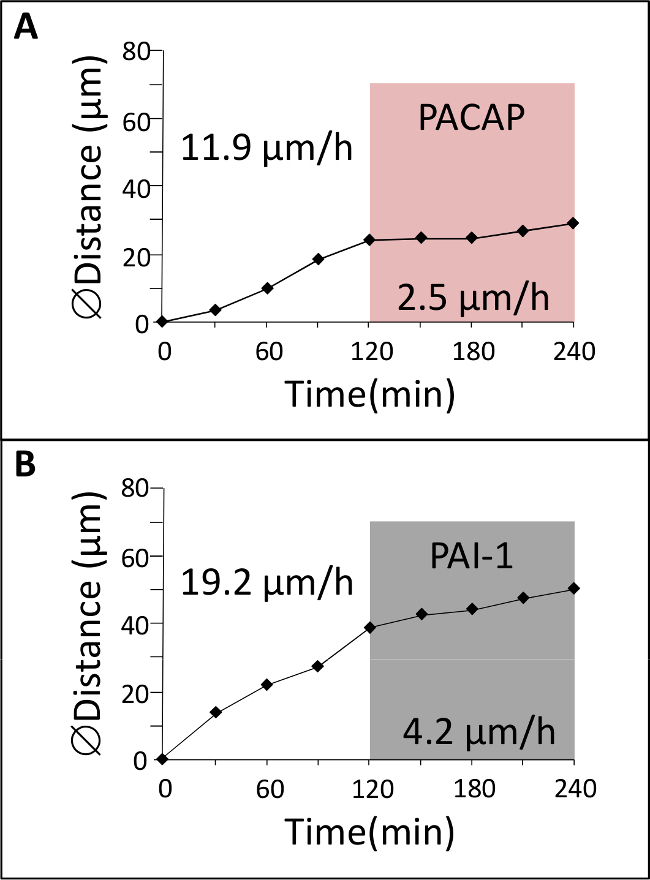
Şekil 4:. GC göç nöropeptid ve proteaz inhibitör (A) GC 2 kontrol koşullarında saat ve konfokal makroskopi göre ML izlenen daha sonra pitüiter adenilat siklaz aktive polipeptid (PACAP) varlığında 2 saat karıştırıldı. (B) GC kontrol koşullarında 2 saat süre ile konfokal makroskopi göre ML izlenen ve daha sonra da plazminojen etkinleştirici inhibitör-1 (PAI-1) varlığında 2 saat karıştırıldı.
Tartışmalar
Bu protokol Transwell sistemi ve konfokal makroskopi yoluyla doğum sonrası gelişimi sırasında hücre göçü incelemek için yeşil floresan boya ile GC floresan etiketleme akut P10 sıçan serebellar dilim kültürü anlatılmaktadır. Bu protokol, 12 saat ve deney sırasında agonistleri veya nöropeptid antagonistler, enzim inhibitörler, hücre sinyal modülatörlerinin veya toksik maddeler de dahil olmak üzere göç faktörlerin düzenlenmesinde olası rollerinin testine kadar bir süre için, hücre göçünün gözlemler sağlar. Bir pipet ucu ile membran geçme küçük bir delik, kuluçkalama ortamı içinde bileşiklerin uygulanmasını kolaylaştırmak için gereklidir. Bir ev yapımı kavisli uç pipet çözeltisi iletimini kolaylaştırmak için kullanılabilir.
Doku dilimleri canlı hücre göçü çalışmalardan biri sorunu dokusunun kendisi hareketleri hücre zor izleme yapabilirsiniz olmasıdır. Önceki yaklaşımlar hafifçe SLI stabilize etmek için önerdi OysaBir naylon ces mesh veya fare kuyruk kolajeni 7,17 ince bir tabaka, bu teknolojinin büyük bir avantaj hedefi altında CO2 inkübatör membran ekler serebellar dilim içeren bir 6-yuvalı kültür plakasının basit ve doğrudan transferi konfokal macroscope evi. Entegre sıcaklık ve CO 2 kontrolörleri de hücre migrasyonu 9 için gerekli uygun ve sabit çevre parametreleri sağlamak. Bu nedenle, kültür koşulları dilimleri de zar insert bağlı beri en aza indirilmiştir gözlemler ve doku hareketleri sırasında tutulur. Doku stabilizasyonu edinimi sırasında referanslar sabit olmalıdır dilim kenarları veya Purkinje hücrelerinin konumunu takip tarafından doğrulanmadı. Buna ek olarak, plaka 6 kuyucuklarına dağıtılmış ve serebellar dilimleri (12 ila 18), hızlı bir şekilde, bir motorlu kaide ile bir optik zoom ile ayrıntılı olarak görülmektedir. Nedeniyle kuru hedefi, epi büyük çalışma mesafesi (X2, 39 mm)Kültür ortamı daha kolay olarak * Gözlem bileşiklerinin daldırma ve uygulama imkanı mevcuttur. Bu nedenle, CO 2 kuvöz ve konfokal çevre parametreleri ve kültür destek benzerlikler biyolojik numune maksimum koruma yol makroskopi.
Protokol diğer bir avantajı, büyük görüş alanı ve aynı zamanda görülebilir hücre dolayısıyla büyük bir sayıdır. Örneğin, daha önce ML radyal göç floresan GC'ler yoğunluğu 1124 ± 138 hücre / mm 2 18 olduğunu tespit ettik. Konfokal Makroskopi (X2, NA 0,234 =) konfokal mikroskobu ile karşılaştırıldığında daha düşük bir yan çözünürlüğe sahip (40X NA = 1.25), ancak iki teknolojik 7,18 yaklaşır arasındaki hücre GClerin organları kolaylıkla takip edilebilir ve göç ortalama hızı karşılaştırılabilir .
Görüntü satın almalar, doku dilimleri ve th kalitesi için teknik gelişme yanındaetiketleme e kalitesi başarılı deneyler için kilit noktalarıdır. Her zaman diseksiyon süreçlerinde buz üzerinde medya ve dokuları korumak, vibratome bıçaklar yağ ortadan kaldırmak ve tutkal ile temas doku dilimleri kullanmak yok. Sagital ve enine kesitler sırasıyla radyal ve teğet göç adapte edilir. Serebellumun farklı kortikal katmanları uygun tespiti için inkübasyon farklı uzunluklara kullanın. (8 saat kadar) uzun inkübasyon süreleri, PCL ve Igl çok sayıda GClerin geçişini tespit etmek için gereklidir. GC göç özgü uzay-zamansal pencereleri sırasında fizyolojik süreç olduğundan, pozitif kontrol hücreleri düzgün göç etmek zorunda olmasıdır. Özellikle, ML çok sayıda aks GC sajital serebellar dilimleri için başlıca sağlık göstergesi biridir. Deney çalıştırmak için, ML GC hareketlerinin izlenmesi önerilmiştir. Gerçekten de, dikey olarak uzatılmış hücre gövdesi ile GC şekli, AC başlatmak için bir referans noktası olarak göz önüne alınmalıdırbirbirini takip eden kumanda (2 saat) ve tedavi (2 saat) kolayca ML yapılabilir dönemlerle edinirken.
Hücre Tracker aile ya da genetik yapıları aracılığıyla ifade floresan proteinleri gibi Floresan boyalar hücre göçü çalışmaları için izleyiciler olarak kullanılabilir. Nedeniyle GC göç (1 yığın her 30 dk) yavaş kinetiği için, renkli deneyler de sistemde 4 lazerler kiriş (405, 488, 532 ve 633 nm) beri sıralı modunda kullanılabilir olan yapılabilmektedir. Diğer internöronlar izleme, merkezcil ve merkezkaç radyal göç dikkate alındığında da 18 gerçekleştirilebilir. Özellikle, daha az sayıda hücre tipi daha kolay geniş bir görüş alanı ile lokalize edilebilir. Son olarak, bu protokol, serebellar gelişme için diğer aşamalarında değil, aynı zamanda diğer beyin bölgelerinde hücre göçü incelemek için kullanılabilir.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
- (PeReNE, Interreg 4A ERDF) Bu çalışma Biyotıp Araştırma ve Yenilik Enstitüsü (IRIB), Normandiya Hücre Görüntüleme Platformu (PRIMACEN), Inserm, IBiSA, Rouen Üniversitesi, Avrupa Bölgesel Kalkınma Fonu tarafından desteklenen LARC-Nörobilim Ağ ve Région Haute-Normandie.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified eagle medium (DMEM) nutrient mixture F-12 | Sigma-Aldrich | D8437 | |
| Hank's balanced salt solution 10x | Sigma-Aldrich | H1641 | |
| PACAP38 | INRS, Canada | Bourgault et al., 200919 | |
| PAI-1 | Calbiochem | 528208 | |
| N-2 supplement | Fisher Scientific / Gibco/ invitrogen | O973 | |
| Cyanoacrylate glue | Loctite | ||
| Cell Tracker Green CMFDA | Invitrogen | C2925 | |
| Polyester Transwell-Clear inserts | Corning | 3452 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| 6-well cell culture cluster | Corning | 3516 | |
| DMSO | Fisher Scientific | BP231-100 | |
| Tissue culture dish 35 mm diameter | BD Falcon | 353004 | |
| Tissue culture dish 100 mm diameter | Thermo SCIENTIFIC | 130182 | |
| Polypropylen tube (15 ml) | BD Falcon | 352096 | |
| Ethanol 70% | Fisher Chemical | E/0800DF/21 | |
| Biological safety cabinet fume hood | Thermo Scientific | MSC9 Class II A2 | |
| Adjustable-volume pipette (0.5-10 µL) | Eppendorf | 4910 000.018 | |
| Gyro-rocker, SSL3 | Stuart | ||
| CO2 incubator, Hera Cell 150 | Thermo Scientific | ||
| Vibrating blade microtome, VT1000S | Leica Microsystems | ||
| Confocal macroscope, TCS LSI | Leica Microsystems | ||
| Temperature controller | PeCon | ||
| CO2-controller | PeCon | ||
| Stereomicroscope, M205 C | Leica Microsystems | ||
| Operating scissors, curved, blunt/blunt | Medicon | 03.03.17 | |
| Hardened fine iris scissors, straight, sharp/sharp | FST | 149090-11 | |
| Dumont #3 and #5 forceps | FST | 11293-00 and 11252-20 | |
| Vibratome injector blades/single edge | Leica Microsystems | 39053250 | |
| Standard scalpel handle #3 solid | FST | 10003-12 | |
| Surgical blade #15 | Swann-Morton | 205 |
Referanslar
- Komuro, Y., Kumada, T., Ohno, N., Foote, K. D., Komuro, H. Migration in the Cerebellum. Cellular Migration and Formation of Neuronal Connections: Comprehensive Developmental Neuroscience. 2, 281-297 (2013).
- Altman, J., Bayer, S. A. . Development of the cerebellar system in relation to its evolution, structure, and functions. , (1997).
- Komuro, H., Rakic, P. Distinct modes of neuronal migration in different domains of developing cerebellar cortex. Journal of Neuroscience. 18 (4), 1478-1490 (1998).
- Komuro, H., Yacubova, E. Recent advances in cerebellar granule cell migration. Cellular and Molecular Life Sciences. 60 (6), 1084-1098 (2003).
- Fahrion, J. K., et al. Rescue of neuronal migration deficits in a mouse model of fetal Minamata disease by increasing neuronal Ca2+ spike frequency. Proceedings of National Academy of Sciences USA. 109 (13), 5057-5062 (2012).
- Raoult, E., et al. Pituitary adenylate cyclase-activating polypeptide (PACAP) stimulates the expression and the release of tissue plasminogen activator (tPA) in neuronal cells: involvement of tPA in the neuroprotective effect of PACAP. Journal of Neurochemistry. 119 (5), 10-1111 (2011).
- Cameron, D. B., et al. Cerebellar cortical-layer-specific control of neuronal migration by pituitary adenylate cyclase-activating polypeptide. Neuroscience. 146 (2), 697-712 (2007).
- Renaud, J., et al. Plexin-A2 and its ligand, Sema6A, control nucleus-centrosome coupling in migrating granule cells. Nature Neuroscience. 4, 440-449 (2008).
- Komuro, H., Rakic, P. Dynamics of granule cell migration: a confocal microscopic study in acute cerebellar slice preparations. Journal of Neuroscience. 15 (2), 1110-1120 (1995).
- Nielsen, H. S., Hannibal, J., Fahrenkrug, J. Expression of pituitary adenylate cyclase activating polypeptide (PACAP) in the postnatal and adult rat cerebellar cortex. Neuroreport. 9 (11), 2639-2642 (1998).
- Hannibal, J. Pituitary adenylate cyclase-activating peptide in the rat central nervous system: an immunohistochemical and in situ hybridization study. Journal of Comparative Neurology. 453 (4), 389-417 (2002).
- Garcia-Rocha, M., Avila, J., Armas-Portela, R. Tissue-type plasminogen activator (tPA) is the main plasminogen activator associated with isolated rat nerve growth cones. Neuroscience Letters. 180 (2), 123-126 (1994).
- Ware, J. H., DiBenedetto, A. J., Pittman, R. N. Localization of tissue plasminogen activator mRNA in the developing rat cerebellum and effects of inhibiting tissue plasminogen activator on granule cell migration. Journal of Neurobiology. 28 (1), 9-22 (1995).
- Friedman, G. C., Seeds, N. W. Tissue plasminogen activator mRNA expression in granule neurons coincides with their migration in the developing cerebellum. Journal of Comparative Neurology. 360 (4), 658-670 (1995).
- Seeds, N. W., Siconolfi, L. B., Haffke, S. P. Neuronal extracellular proteases facilitate cell migration, axonal growth, and pathfinding. Cell and Tissue Research. 290 (2), 367-370 (1997).
- Basham, M. E., Seeds, N. W. Plasminogen expression in the neonatal and adult mouse brain. Journal of Neurochemistry. 77 (1), 318-325 (2001).
- Bourgault, S., et al. Molecular and conformational determinants of pituitary adenylate cyclase-activating polypeptide (PACAP) for activation of the PAC1 receptor. Journal of Medical Chemistry. 52 (10), 3308-3316 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır