Method Article
공 초점 Macroscopy을 사용하여 출생 후의 소뇌 과립 세포 이동의 생체 이미징
요약
During postnatal cerebellum development, immature granule cells originating from the germinal zone exhibit distinct modalities of migration to reach their final destination and to establish neuronal networks. This protocol describes the preparation of cerebellar slices and the confocal macroscopic approach used to investigate the factors that regulate neuronal migration.
초록
출생 후 발달 동안, 미성숙 과립 세포 (흥분성의 interneurons)는 소뇌 피질의 내부 과립 층에 도달하는 분자 층과 조롱박 세포층에서 외부 과립 층 접선 이주하고 방사상 이동을 나타낸다. 이주 프로세스의 기본은 다양한 소뇌 기능에 적자로 이어지는, 세포 사멸 또는 뉴런의 오 배치를 유도한다. 구심력 과립 세포 이동은 최종 위치를 향해 안내하기 위해 세포의 화학 주성과 같은 세포 외 기질의 분해 등의 여러 메커니즘을 수반하지만, 각 층의 피질 세포의 이동을 조절하는 인자는 단지 부분적으로 알려져있다. 우리의 방법에있어서, 급성 소뇌 슬라이스는 P10 래트로부터 제조되며, 과립 세포를 형광 세포질 마커로 표지되고, 조직은 C 37 °에서 촛점 macroscopy하여 세포 이동의 실시간 모니터링을 시작하기 전에 4 내지 10 시간에 막 삽입에 배양 에서CO (2)의 존재. 소뇌의 다른 피질 층에서의 이송 중에, 과립 세포는 신경 세포의 이동의 조절에서의 가능한 역할을 조사하기 위해 신경 펩타이드 작용제 또는 길항제, 프로테아제 억제제, 세포 내 이펙터 또는 알코올이나 메틸 심지어 유해 물질의 차단제에 노출 될 수있다 .
서문
현상 소뇌 뉴런의 8 개의 서로 다른 유형의 배아 둘째 주 및 설치류 1 초 출생 후의 주 간의 순차적 일어난다. 처음에 차 종자 영역에서 발생, 미성숙 과립 세포 (GC)는 외부 과립 층 (EGL), 차 종자 영역 2에서 생산되는 마지막 뉴런이다. 처음 세 출생 후의 주 동안, 소뇌 피질 EGL, 분자 층 (ML)을 포함하여 4 개의 계층으로 구성 잎 모양 구조, 조롱박 전지 층 (PCL) 및 내부 과립 층 (IGL) (도 1). 구심 마이그레이션, 미성숙 GC를, 글루타메이트의 interneurons을 통해 약 2 일 이내에 IGL에 도달합니다. 세 번째 출생 후 주까지, EGL가 사라지고 IGL은 성인 소뇌의 과립 층 (GL) 소위 구성한다. GL에서 GC를 이끼 섬유와 유니 폴라 브러시 세포에서 흥분성 시냅스 입력을 받고,골지체 세포로부터 축삭 억제 시냅스 입력한다. ML에서 GC의 축삭은 조롱박 세포, 바구니 세포, 성상 세포, 그리고 골지 셀이 포함 GABA 성 신경 세포와 흥분성 시냅스를 확인합니다.
초기 출생 후의 설치류에서 얻은 급성 소뇌 조각의 세포 운동의 실시간 관찰 GC를이 소뇌 피질 3에서의 경로 동안 이동의 양상과 속도의 변화와 병용 자신의 모양을 수정하는 것이 보여줍니다. 생후 첫 두 주 동안, GC 전구체 적극적 EGL 상단의 증식. EGL의 중간 부분에서, GC를 postmitotic는 큰 프로세스의 접선 방향으로 이동한다. EGL-ML 국경에서 GC를 자신의 움직임을 느리게, 세포는 ML에 짧은 수직 하강 프로세스를 입력하기 시작합니다. ML에서 GC를는 수직으로 연장 된 전지 본체, 얇은 후행 처리 및 더 방대한 선두 처리를 가지며, Bergmann은 아교 섬유의 반경 방향을 따라 이동한다. 에서PCL은 GC를 자신의 움직임을 중지하지만 장기간 고정 단계 (2 시간) 후, 그들은 PCL-IGL의 국경을 넘어. IGL에서 GC를 폐해는 섬유 지지체의 부재 층의 바닥을 향해 이동한다. 주요 프로세스의 팁되면 IGL 흰색 물질 (WM) 테두리, GC를 천천히 접근하고 그들의 움직임을 중지합니다. 시상 슬라이스는 ML, PCL 및 IGL에서 마이그레이션을 방사상에 전념하는 동안 소뇌의 가로 부분은 EGL에서 접선 마이그레이션 연구에 바람직하다. (예를 들어, 소마토스타틴은, PACAP)는 지금까지 확인 된 피질 신경 펩티드 있지만 각 층에서 GC 마이그레이션 시공간 제어에 관여하는 메커니즘을 포함한 전체 GC 운동의 일부 규제 요인은 여전히 알려져 있지 1,4,5,6-이다.
GC 마이그레이션 ACU에 대한 격리 된 배양 세포 또는 형광 검출 중 투과광 조명을 사용하여 비디오 카메라와 공 초점 현미경을 통해 지난 20 년 동안 연구되어왔다테 소뇌 조각. 처음 친 유성 DII, 그리고 최근 "셀 트래커"염료 및 세포 발현 단백질은 공 초점 형광 또는 이광자 현미경 -7,8- 사용 하였다. 성공적인 실험 프로토콜은 간단하지만 쉽지 않다 있도록 구체적인 절차의 수에 따라 달라집니다. 특히, 급성 슬라이스 수제 나일론 메쉬 네트워크 (9)와 함께 일반적으로 관측 동안에 안정해야한다. 광 조도는 다중 공 초점 현미경의 주사 방식 제안한 광독성 및 광표백을 피하기 위해 가능한 한 낮아야한다. 또한, 온도 및 CO 2는 신경 세포의 이동에 영향을 미칠 수있는 불안정 이후 주요 환경 매개 변수입니다. 촉진 및 실험 절차를 구체화하기 위해, 우리는, 조각의 움직임을 제한하는 일정한 환경 매개 변수를 보장 광표백을 감소시키고, consequ (milimeters의 순서에) 시야를 증가시키는 공 초점 macroscopy 프로토콜을 개발 한이미지 분석을 통해 추적 될 수있는 셀 (수십)의 수를 고한다면. 따라서, 180 μm의 두께 슬라이스 막 삽입에 배양하고 6- 웰 플레이트에 직접 큰 배양 챔버, 온도 및 CO 2 컨트롤러 및 진동 제어 시스템을 갖추고 상용 촛점 macroscope의 2X 전동식 대물하에 전사된다. 시간이 경과하고, Z 스택은 여러 시간 동안 약물 학적 도구를 수행하거나, 생체 활성 분자는 추가 또는 배양 배지 내에 전달 될 수있다. 이 방법은 또한 상이한 발달 단계에서 소뇌 또는 대뇌의 신경 세포의 다른 유형의 이동을 연구하기 위해 적응 될 수있다.
프로토콜
동물 (남성 또는 여성의 Wistar 쥐) 관리 및 실험 동물의 사용을위한 프랑스의 가이드에 따라, 태어나 공인 동물 시설 (승인 B.76-451-04)에서 사육 하였다. 실험은 유럽 공동체위원회 지침 (9 월 22 일의 63분의 2,010 / 단말, 2010)과 농업의 프랑스 교육부에 따라 권한이 부여 된 연구자 (MB, DV 및 LG)의 감독하에 실시 하였다.
미디어 및 도구 1. 준비
- 생물 안전 캐비닛에서의 MgCl 2없이 염화칼슘 2 (1.85 g / ℓ) / 황산 (0.9767 G / L)를 포함 10 배 원액에서 멸균 수에 1X 행크의 BSS (HBSS)을 준비합니다. HBSS 용액을 1 배의 NaHCO3 (350 μg의 / ㎖)를 추가합니다.
- 생물 안전 캐비닛에서, N2의 (100 배 원액)에서 보충 및 페니실린 (100 단위 / ㎖) -streptomycin (0.1 ㎎ / ㎖) 둘 베코의 수정 이글 배지 (DMEM) 영양 믹스 솔루션을 추가스트럭처 F-12 (1 : 1).
- 무균 조건에서, DMSO의 세포질 형광 염료라는 세포 추적기 그린의 나누어지는 (25 μL, 2 mM)을 (1 mg을위한 1.075 ㎖) 준비합니다. 15 ML 원뿔 튜브에서 DMEM의 5ml에 하나 나누어지는을 희석.
- 4 ℃에서 미디어를 유지하기 위해 작성 얼음 양동이를 준비합니다.
- 70 % 에탄올로 실험실 벤치 탑 및 도구의 오염을 제거.
P10 쥐에서 소뇌의 해부 (2)
- 빠르게 척수의 시작을 얻기 위해 귀 뒤에 곡선 운영 가위로 쥐 새끼 (P10)를 목을 벨.
- 참수 머리 뒤쪽 측에서 잘 홍채 가위로 코 목 피부의 중간 선 절개를 미세 홍채 가위와 뒤몽 # 3 집게와 두개골에서 피부를 분리합니다.
- 섬세 두개골의 주동이의 영역으로베이스에서 두 개의 횡 절개를 만들기 위해 미세 홍채 가위를 사용합니다. 이 # 3 포셉으로 해부 두개골을 제거합니다. 브래지어를 분리같은 집게를 사용 두개골 모든 준수에서.
- 얼음처럼 차가운 HBSS 매체의 2ml를 포함하는 페트리 접시에 주걱 (Ø 35mm)의 숟가락 끝으로 뇌를 전송합니다.
- 실체 현미경의 무대에 얼음과 전송의 전체 큰 페트리 접시에 뇌를 포함하는 페트리 접시 (O 100mm)를 넣습니다.
- 실체 현미경에서 두 # 3 집게를 사용 dilaceration에 의해 뇌에서 소뇌을 격리 할 것. 마찬가지로, 잔류 척수 및 PIAL 멤브레인을 제거합니다.
- 주걱의 숟가락 끝으로 새 HBSS 채워진 페트리 접시에 소뇌 (O 35mm, 2 ml)에 전송하고 얼음에 보관하십시오.
급성 소뇌 조각 3. 준비
- 두 개의 헤드로 표시된 바와 같이 실체 현미경, vermis과 오른쪽 반구 사이 소뇌 잘라 표준 메스 핸들 # 3 고체 # 15 외과 블레이드도 2A의 화살표.
- 시안의 한 방울을 넣어oacrylate의 vibratome의 표본 디스크에 접착제 및 독성 용매 증기를 제거하기 위해 15 ~ 25 초를 기다립니다.
- 주걱의 숟가락 끝이 절단 된 소뇌를 수집하고 깨끗한 종이 타월로 여분의 HBSS를 제거합니다.
- 시편 디스크에 가까운 소뇌를 가져와. 시편 디스크에 절단 가장자리를 수정하고 10 초를 기다립니다.
- 매니퓰레이터와 버퍼 트레이에 표본 디스크를 삽입하고, 너무 소뇌의 가로 축이 칼 홀더에 수직 회전. 육각 렌치와 시편 디스크를 수정하고 소뇌가 덮여 때까지 부드럽게 HBSS 매체와 버퍼 트레이를 입력합니다.
- 로드 냉각 욕에 얼음을 분쇄.
- 기름을 제거하기 위해 70 % 에탄올로 블레이드 세 번 청소합니다.
- 칼 홀더에 블레이드를 삽입하고 나사를 체결하여 고정합니다.
- 시편 (사용자의 시각으로부터) 후방 에지 뒤에 면도날 에지 바로 놓고 출발점으로 정의한다. 앞으로 사용 T를 정의하는 명령그 시험편의 전방 에지 뒤에 종점.
- 2.5에서 속도를 절편 180 μm의에서 8. 트리밍 두께로 절편 주파수를 선택합니다. 조직 절편을 시작합니다.
- 얼음에 보관 페트리 접시 (Ø 35mm)를 HBSS이 함유에 파스퇴르 피펫 및 전송립니다 넓은 구멍 유리를 사용하여 각 섹션을 선택합니다.
- 블레이드 방해 할 때이 # 5 집게를 사용하여, 소뇌에서 신중하게 수막을 제거합니다. 소뇌 당 5 조각 (그림 2B, C)의 최대를 수집합니다.
- 조심스럽게 실체 현미경 아래 두 # 5 집게와 소뇌 조각에서 수막을 제거하고 더 나은 프로브 로딩 부드럽게 소엽를 구분합니다.
생활의 interneurons 4. 형광 염색
- 6 웰 플레이트 (물론 당 최대 3 조각 /)에 넓은 구멍 유리 절단 파스퇴르 피펫과 소뇌 조각을 전송합니다. HBSS 매체 기음.
- L 5ml에 조각 (3 max)를 품어형광 염료의 oading 용액 (10 μM).
- 빛으로부터 보호하기 위해 알루미늄 호일로 마이크로 커버. 셀 라벨링을 용이하게 RT에서 10 분 동안 35 rpm에서 자이로 이동 테이블에 넣어.
- 넓은 구멍 유리 절단 파스퇴르 피펫;없이 Transwell의 막에 전송 조각 (그림 2D 3.0 μm의 기공 크기)를 삽입합니다. 피펫 로딩 매체 기음.
- 삽입물을 제거하고 DMEM의 1.9 mL로 잘 채운다. 삽입물을 교체하고 조직을 커버하는 조각 위에 DMEM 100 μl를 추가합니다.
- 인큐베이터 실에서 문화 삽입 ML에서 GC를 관찰하기에 충분하다 2 시간 (37 ° C를, 5 % CO 2)가 포함 된 플레이트를 놓습니다. 삽입 막 (그림 2E)에 부착 할 수 있도록 평면 조직을 거짓말. 슬라이스가 건조되지 않도록해야합니다.
공 초점 Macroscopy을 통해 5 예 생체 내 이미징
- 없이 접시를 이동인큐베이터에 플라스틱 뚜껑은 공 초점 macroscope의 스탠드에 연결합니다. macroscope의 판 삽입에 유리 덮개를 놓습니다. 37.0 ° C로 챔버의 온도를 유지 0.5 ° C를 ±, 일정한 가스 유동 (95 % O 2, 5 % CO 2) 플레이트 인서트를 통해 pH를 일정하게 유지하기 위해 함께 슬라이스를 공급한다. 시간 경과 실험 전에 2 개의 추가 시간 동안 기다립니다.
- , 조직 슬라이스에서 GC 이주를 시각화 X2 건식 대물 갖춘 공 초점 레이저 주사 macroscope 통해 레이저 다이오드를 이용하여 488 nm 파장의 빛으로 제제를 조명 (작동 거리 : 39mm, 직경 : 58mm, NA = 0.234), 및 500 내지 530 nm의 형광 발광을 검출한다.
- GC를 미세하게 이동을 해결하려면 2.0 1.5 추가 광학 줌 배율 이미지를 획득. 하나의 초점 평면 또는 Z 축을 따라 10 개의 서로 다른 초점면 최대 12 시간 동안 매 30 분까지 GNS의 이미지를 수집합니다.
- 필요한 경우, 유리 덮개를 분리하고 GC 마이그레이션에 미치는 영향을 연구하기 위해 10 μL 피펫과 DMEM 생물학적 활성제 또는 억제제의 작은 볼륨 (1-10 μL)를 추가합니다.
6. 셀 추적
- 영화의 때마다, ImageJ에있는 ecart 형 모드를 통해 Z-스택 투영을 수행합니다. 명암을 조절하고 연속적으로 영상의 밝기 수준은 GC를 식별 및 분류의 추적을 용이하게하기 위해. 지도 (t에서 = 0) 기준 스냅 샷에 수동으로 각 위치.
- 분석한다 입자 메뉴에서 "수동 추적"플러그인을 사용하여 시간 경과시 각 셀의 몸의 중력 지점을 클릭하여 결정한다. 스프레드 시트에서 원시 추적 데이터를 내 보냅니다.
- 각 셀과 관련된 위치를 식별 (PHP 코드로 작성 http://primacen.fr) 스마트 집에서 만든 프로그램 ImageJ에에서 보낸 원시 추적 데이터를 재구성. 프로그램을 사용 calculat총 여행 거리와 각 셀에 대한 마이그레이션의 평균 속도를 전자. 분류와 같은 프로그램을 사용하여 적절한 필터에서 제어 및 처리 조건에서 세포 이동의 특성을 비교한다.
결과
서로 다른 대뇌 피질의 층 1 (그림 1) 교차으로 초기 출생 후 소뇌에서 GC를 자신의 모드와 이동 속도에 큰 변화를 나타낸다. 이 섹션은 그들의 자연 셀룰러 환경에서 GC 이동을 연구함으로써 얻을 수있는 결과의 예를 도시한다. 녹색 형광 염료로 표지 P10 쥐 소뇌 조직 조각 공 초점 macroscope (그림 3A)으로 관찰하고 우리는 GC를 18 μm의 / hr의 평균 속도 (그림 3B, C)와 ML에 방사상으로 마이그레이션을 보여준다. 지금까지의 상호 작용의 역할 / 조절 인자 및 각 층에서 피질 세포 이동의 제어에 관여하는 분자 메커니즘을 포함한 신경 교세포와 사이의 통신은 대부분 알려져 있지 않다. 따라서, 주요 문제는 이러한 피질 층 정시에 역할을 할 수 신경 펩티드, 신경 전달 물질, 및 뉴로 세포 외 기질 성분을 식별하는 것자신의 마이그레이션 과정에서 속도의 FIC 변경됩니다. 뇌하수체 아데 닐 레이트 시클 라제 - 활성화 폴리펩티드 (PACAP)은 또한 ML과 IGL 7,10,11 설치류에서의 처음 두 출생 후의 주 동안, PCL에서 주로 발견된다. 배지에 PACAP38 (10-6 M)의 적용은 ML에서 GC의 79 %의 속도 저하의 결과. 예를 들어, GC를 ML에서의 이동 속도는 PACAP38 (도 4a)의 투여 후 2.5 μm의 / 시간으로 제어 조건에서 11.9 ㎛ 인 / 시간에서 떨어졌다. 조직 - 형 플라스 미노 겐 활성제 (TPA)은 이러한 세포 유착 분자 또는 라미닌 12,13으로 세포 외 기질 (EM) 성분의 저하를 초래 단백질 분해 캐스케이드의 부재이다. tPA의 및 플라스 미노 겐, 만톤 기판은 출생 후 소뇌 14,15,16의 개발 과정에서 대뇌 피질의 층에서 검출된다. PAI-1 (10-7 M), 내인성 만톤 억제제의 투여는 78 % GC 감소ML에서 마이그레이션. 예를 들어, GC를이 PAI-1 (그림 4B)을 첨가 한 후 4.2 μm의 / 시간에 제어 조건에서 19.2 μm의 / 시간에서 ML에서 이동 속도를 감소시켰다. 이러한 결과는 PACAP가 GC의 움직임에와 세린 프로테아제 tPA의이 개발 쥐의 소뇌의 ML에서 GC를의 이동을 용이하게하는 직접 억제 효과를 발휘을 나타냅니다.
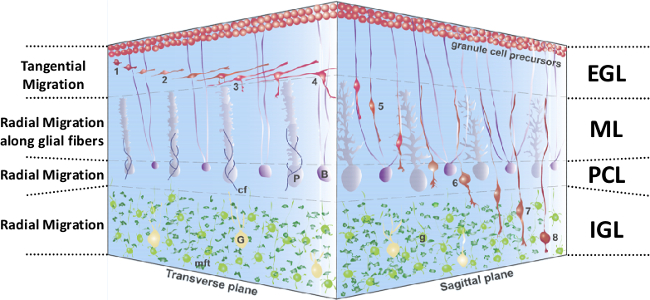
그림 1 : 출생 후 소뇌 피질에서 GC 마이그레이션의 3D 표현입니다. IGL에 1-4, EGL에 GC 프로세스와 접선 마이그레이션의 확장. 5, 버그만 아교 섬유를 따라 mL에 방사형 마이그레이션. 6, PCL에서 과도 정지상. 7, 폐해 독립적 인 방사형 마이그레이션. 8, 완료 . 빨간색 IGL GC에서 GC 마이그레이션, 과립 세포,의, EGL외부 과립 층, 어두운 보라색에서 B, 버그만의 아교 세포; G, 골지 세포, 노란색, CF, 등반 섬유, 파란색, G, postmigratory 과립 세포, 밝은 녹색의, IGL, 내부 세분화 된 계층, MFT, 이끼 섬유 터미널, 어두운 녹색, PCL, 조롱박 세포 층 밝은 자주색에서 P, 조롱박 세포, ML, 분자 층. 이 그림은 5에서 수정되었습니다.

그림 2 : P10의 소뇌 조각의 전 생체 내 문화 (A) P10 쥐 해부 소뇌.. 스케일 바 = 6mm. 실체 현미경을 통해 180 μm의 두께 소뇌 조각 생활의 (B)의 현미경 사진. 스케일 바 = 3mm. (C)에서높은 배율, 소뇌의 네 대뇌 피질의 층 (EGL, ML, PCL, IGL)는 이미 구별 할 수 있습니다. 스케일 바 = 1mm. 형광 표식 한 후 (D)는, 조직 슬라이스는 6 웰 플레이트에 배양 인서트 (24mm 직경) 상에 배치된다. (E) 조직 배양 처리 된 폴리 에스테르 막과 문화 삽입의 도식 표현. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
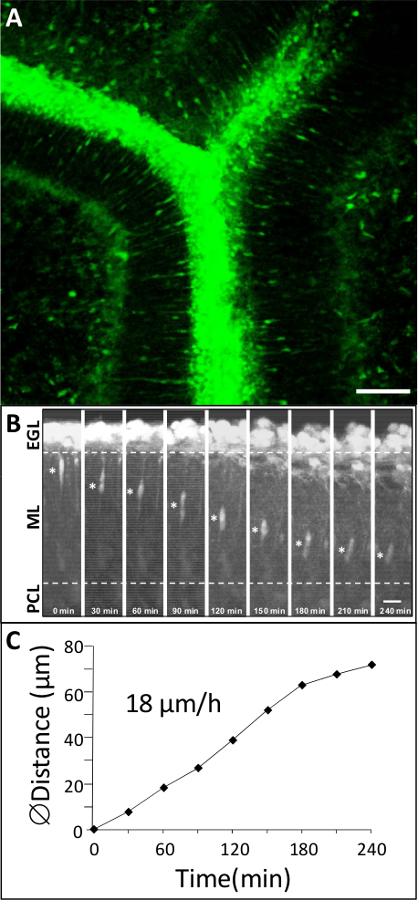
그림 3 : 쥐 P10 소뇌의 피질 층에서 GC를 동적 마이그레이션 GC를이 녹색 세포질 형광 염료로 표지 된 P10 쥐의 소뇌 슬라이스 (A) Macroconfocal보기 (XYZ, 2D 투사).. 스케일 바는 75 μm의 =. (B) GC를 보여주는 시간 경과 영상제어 조건에서 4 시간 동안 공 초점 macroscopy으로 ML에서 운동. 별표 (*) 표시는 GC의 소마를 표시합니다. 경과 시간 (분)에 각각의 현미경 사진의 맨 아래에 표시됩니다. 스케일 바는 10 μm의 =. (C) GC의 소마에 의해 이동 한 거리에서 순차적으로 변경됩니다.
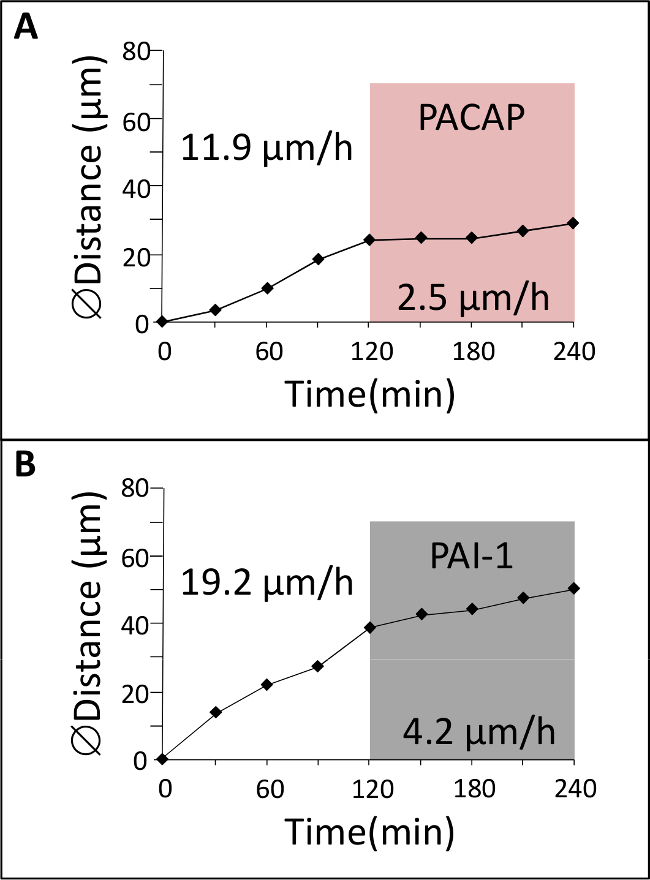
도 4 :. GC 이주의 신경 펩타이드 프로테아제 억제제의 효과 (A) GC 2 제어 조건에서 시간과 대해 촛점 macroscopy 의해 ML에서 추적 된 다음, 뇌하수체 아데 닐 레이트 시클 라제 - 활성화 폴리펩티드 (PACAP)의 존재하에 2 시간 동안. (B)는 GC 제어 조건에서 2 시간 동안 공 초점 macroscopy 의해 ML에서 추적 한 후, 플라스 미노 겐 활성화 제 억제제 -1 (PAI-1)의 존재하에 2 시간 동안.
토론
이 프로토콜은 트랜스 웰 시스템과 공 초점 macroscopy을 통해 출생 후 개발하는 동안 세포의 이동을 연구하는 녹색 형광 염료와 GC의 형광 표지 급성 P10 쥐 소뇌 조각의 문화를 설명합니다. 이 프로토콜은 12 시간 및 실험 기간 동안 작용제 또는 신경 펩타이드의 길항제, 효소 억제제, 세포 신호 변조기 또는 독성 물질을 포함한 이주 요인을 규제의 가능한 역할의 테스트까지의 기간에 대한 세포 이동을 관찰 할 수 있습니다. 피펫 팁과 막 삽입에 작은 구멍이 배양 배지에 화합물의 투여를 용이하게 할 필요가있다. 집에서 만든 곡선 피펫 팁은 용액의 전달을 용이하게하기 위해 사용될 수있다.
조직 조각을 생활에 세포 이동 연구의 한 가지 문제는 조직 자체의 운동 세포가 어려운 추적 할 수 있다는 것입니다. 이전의 접근법은 부드럽게 SLI 안정화 제안 반면나일론 CES 메쉬 또는 래트 꼬리 콜라겐 7,17의 얇은 층은이 기술의 주요 장점은 대물 하에서 CO 2 인큐베이터에서 막 삽입에 소뇌 슬라이스를 포함 6 웰 배양 플레이트의 단순하고 직접적인 전사이고 공 초점 macroscope의. 통합 온도와 CO 2 컨트롤러는 또한 세포 이동 (9)에 필수적인 적절하고 지속적인 환경 매개 변수를 제공합니다. 따라서, 배양 조건은 슬라이스 잘 멤브레인 삽입물에 부착되기 때문에 최소화된다 관찰 및 조직의 움직임 동안에 유지된다. 조직 안정화 취득 중에 참조를 고정해야 슬라이스 에지 또는 조롱박 세포의 위치에 따라 검증된다. 또한, 플레이트의 웰에 분포 6 소뇌 조각 (12 내지 18)는 신속 동력 스테이지 및 광학 줌을 상세히 관찰 할 수있다. 때문에 건조 목적, 에피의 큰 작동 거리 (X2, 39mm)에문화 매체가 훨씬 더 쉽습니다에서 - 전망대는 화합물의 침수 및 관리 무료입니다. 따라서, CO 2 배양기 및 공 초점의 환경 매개 변수 및 문화 지원 유사성은 생물학적 시료의 최대 보존으로 이어질 macroscopy.
프로토콜의 다른 장점은 큰 뷰의 필드를 동시에 관찰 할 수있다 셀 따라서 다수이다. 예를 들어, 우리는 이전에 ML에서 반경 이주 형광 GC를의 밀도가 1,124 ± 138 세포 / mm 2 18 것을 결정했다. 공 초점 macroscopy이 (X2는, NA는 0.234를 =) 공 초점 현미경에 비해 낮은 측면 해상도 (40X, NA = 1.25)하지만이 기술은 7,18 접근 사이에 세포 GC를의 몸은 쉽게 추적 할 수 및 마이그레이션의 평균 속도는 비슷 .
이미지 인수, 조직 슬라이스와 일의 질에 대한 기술 개선 게다가라벨의 전자 품질은 성공적인 실험을위한 키 포인트입니다. 항상 해부 과정에서 얼음에 미디어와 조직을 유지, vibratome 블레이드에 기름을 제거하고 접착제와 접촉 조직의 조각을 사용하지 않습니다. 시상 및 횡단면은 각각 방사형 및 접선 마이그레이션하도록되어있다. 소뇌의 다른 대뇌 피질의 층에 적절한 검출을위한 배양의 다른 길이를 사용합니다. (8 시간까지) 긴 배양 시간은 PCL과 IGL에 많은 GC를의 이동을 감지 할 필요합니다. GC 이주 특정 시공간 윈도우 동안 생리적 과정이기 때문에, 양성 대조군은 세포가 적절하게 이동해야한다는 것이다. 특히, ML 수많은 스핀들 GC는 시상 소뇌 슬라이스 주요 건강 지표 중 하나이다. 실험을 시작하기위한, ML에서 GC 운동의 관찰이 제안된다. 실제로, 수직으로 연장 된 전지 본체와 GC의 형상은 AC를 시작 기준점으로 간주되어야연속 제어 (2 시간)과 치료 (2 시간) ML 쉽게 수행 될 수있는 기간 quisition.
셀 추적기 가족이나 유전 적 구조를 통해 표현 형광 단백질과 같은 형광 염료는 세포 이동 연구에 추적자로 사용할 수 있습니다. 때문에 GC 마이그레이션 (1 스택 매 30 분)의 느린 반응 속도로, 여러 가지 빛깔의 실험은 또한 시스템에 4 레이저 빔 (405, 488, 532, 633 ㎚)부터 순차 모드에서 사용할 수있는 수행 할 수 있습니다. 기타의 interneurons의 추적, 구심력과 원심력 방사형 마이그레이션을 고려 또한 18 실현 될 수있다. 특히, 더 적은 다수의 세포 유형을보다 쉽게 넓은 시야와 로컬 라이즈 될 수있다. 마지막으로,이 프로토콜은 소뇌의 다른 개발 단계뿐만 아니라 다른 뇌 영역에서 세포 이동을 연구하는데 사용될 수있다.
공개
저자가 공개하는 게 없다.
감사의 말
- (PeReNE, Interreg 4A ERDF)이 작품은 생물 의학의 연구 및 혁신 연구소 (IRIB), 노르망디의 세포 이미징 플랫폼 (PRIMACEN), INSERM, IBiSA, 루앙 대학교, 유럽 지역 개발 기금에 의해 지원되었다 LARC - 신경 과학 네트워크 및 지역 오트 노르망디.
자료
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified eagle medium (DMEM) nutrient mixture F-12 | Sigma-Aldrich | D8437 | |
| Hank's balanced salt solution 10x | Sigma-Aldrich | H1641 | |
| PACAP38 | INRS, Canada | Bourgault et al., 200919 | |
| PAI-1 | Calbiochem | 528208 | |
| N-2 supplement | Fisher Scientific / Gibco/ invitrogen | O973 | |
| Cyanoacrylate glue | Loctite | ||
| Cell Tracker Green CMFDA | Invitrogen | C2925 | |
| Polyester Transwell-Clear inserts | Corning | 3452 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| 6-well cell culture cluster | Corning | 3516 | |
| DMSO | Fisher Scientific | BP231-100 | |
| Tissue culture dish 35 mm diameter | BD Falcon | 353004 | |
| Tissue culture dish 100 mm diameter | Thermo SCIENTIFIC | 130182 | |
| Polypropylen tube (15 ml) | BD Falcon | 352096 | |
| Ethanol 70% | Fisher Chemical | E/0800DF/21 | |
| Biological safety cabinet fume hood | Thermo Scientific | MSC9 Class II A2 | |
| Adjustable-volume pipette (0.5-10 µL) | Eppendorf | 4910 000.018 | |
| Gyro-rocker, SSL3 | Stuart | ||
| CO2 incubator, Hera Cell 150 | Thermo Scientific | ||
| Vibrating blade microtome, VT1000S | Leica Microsystems | ||
| Confocal macroscope, TCS LSI | Leica Microsystems | ||
| Temperature controller | PeCon | ||
| CO2-controller | PeCon | ||
| Stereomicroscope, M205 C | Leica Microsystems | ||
| Operating scissors, curved, blunt/blunt | Medicon | 03.03.17 | |
| Hardened fine iris scissors, straight, sharp/sharp | FST | 149090-11 | |
| Dumont #3 and #5 forceps | FST | 11293-00 and 11252-20 | |
| Vibratome injector blades/single edge | Leica Microsystems | 39053250 | |
| Standard scalpel handle #3 solid | FST | 10003-12 | |
| Surgical blade #15 | Swann-Morton | 205 |
참고문헌
- Komuro, Y., Kumada, T., Ohno, N., Foote, K. D., Komuro, H. Migration in the Cerebellum. Cellular Migration and Formation of Neuronal Connections: Comprehensive Developmental Neuroscience. 2, 281-297 (2013).
- Altman, J., Bayer, S. A. . Development of the cerebellar system in relation to its evolution, structure, and functions. , (1997).
- Komuro, H., Rakic, P. Distinct modes of neuronal migration in different domains of developing cerebellar cortex. Journal of Neuroscience. 18 (4), 1478-1490 (1998).
- Komuro, H., Yacubova, E. Recent advances in cerebellar granule cell migration. Cellular and Molecular Life Sciences. 60 (6), 1084-1098 (2003).
- Fahrion, J. K., et al. Rescue of neuronal migration deficits in a mouse model of fetal Minamata disease by increasing neuronal Ca2+ spike frequency. Proceedings of National Academy of Sciences USA. 109 (13), 5057-5062 (2012).
- Raoult, E., et al. Pituitary adenylate cyclase-activating polypeptide (PACAP) stimulates the expression and the release of tissue plasminogen activator (tPA) in neuronal cells: involvement of tPA in the neuroprotective effect of PACAP. Journal of Neurochemistry. 119 (5), 10-1111 (2011).
- Cameron, D. B., et al. Cerebellar cortical-layer-specific control of neuronal migration by pituitary adenylate cyclase-activating polypeptide. Neuroscience. 146 (2), 697-712 (2007).
- Renaud, J., et al. Plexin-A2 and its ligand, Sema6A, control nucleus-centrosome coupling in migrating granule cells. Nature Neuroscience. 4, 440-449 (2008).
- Komuro, H., Rakic, P. Dynamics of granule cell migration: a confocal microscopic study in acute cerebellar slice preparations. Journal of Neuroscience. 15 (2), 1110-1120 (1995).
- Nielsen, H. S., Hannibal, J., Fahrenkrug, J. Expression of pituitary adenylate cyclase activating polypeptide (PACAP) in the postnatal and adult rat cerebellar cortex. Neuroreport. 9 (11), 2639-2642 (1998).
- Hannibal, J. Pituitary adenylate cyclase-activating peptide in the rat central nervous system: an immunohistochemical and in situ hybridization study. Journal of Comparative Neurology. 453 (4), 389-417 (2002).
- Garcia-Rocha, M., Avila, J., Armas-Portela, R. Tissue-type plasminogen activator (tPA) is the main plasminogen activator associated with isolated rat nerve growth cones. Neuroscience Letters. 180 (2), 123-126 (1994).
- Ware, J. H., DiBenedetto, A. J., Pittman, R. N. Localization of tissue plasminogen activator mRNA in the developing rat cerebellum and effects of inhibiting tissue plasminogen activator on granule cell migration. Journal of Neurobiology. 28 (1), 9-22 (1995).
- Friedman, G. C., Seeds, N. W. Tissue plasminogen activator mRNA expression in granule neurons coincides with their migration in the developing cerebellum. Journal of Comparative Neurology. 360 (4), 658-670 (1995).
- Seeds, N. W., Siconolfi, L. B., Haffke, S. P. Neuronal extracellular proteases facilitate cell migration, axonal growth, and pathfinding. Cell and Tissue Research. 290 (2), 367-370 (1997).
- Basham, M. E., Seeds, N. W. Plasminogen expression in the neonatal and adult mouse brain. Journal of Neurochemistry. 77 (1), 318-325 (2001).
- Bourgault, S., et al. Molecular and conformational determinants of pituitary adenylate cyclase-activating polypeptide (PACAP) for activation of the PAC1 receptor. Journal of Medical Chemistry. 52 (10), 3308-3316 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유