Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek Molekül Düzeyde Halkalı Polimerlerin Sentezi ve eritin Devlet Onların Pasif Hareket Karakterizasyonu
Bu Makalede
Özet
sentez ve tek molekül düzeyinde halkalı polimerlerin uzadıya hareket karakterizasyonu için bir protokol sunulmuştur.
Özet
We demonstrate a method for the synthesis of cyclic polymers and a protocol for characterizing their diffusive motion in a melt state at the single molecule level. An electrostatic self-assembly and covalent fixation (ESA-CF) process is used for the synthesis of the cyclic poly(tetrahydrofuran) (poly(THF)). The diffusive motion of individual cyclic polymer chains in a melt state is visualized using single molecule fluorescence imaging by incorporating a fluorophore unit in the cyclic chains. The diffusive motion of the chains is quantitatively characterized by means of a combination of mean-squared displacement (MSD) analysis and a cumulative distribution function (CDF) analysis. The cyclic polymer exhibits multiple-mode diffusion which is distinct from its linear counterpart. The results demonstrate that the diffusional heterogeneity of polymers that is often hidden behind ensemble averaging can be revealed by the efficient synthesis of the cyclic polymers using the ESA-CF process and the quantitative analysis of the diffusive motion at the single molecule level using the MSD and CDF analyses.
Giriş
Cyclic polymers are unique in that they do not have chain ends. They often exhibit unusual behaviors which is distinct from their linear counterpart, including increased thermal stability of polymer micelles by a linear-to-cyclic conversion,1,2 and spatial organization of DNA in bacterial cells by a loop formation.3 Topological interactions between the cyclic chains are believed to be the critical factor for such unusual behaviors.4,5 Therefore, characterizing the motion and relaxation of cyclic polymers under entangled conditions has been an important research topic in polymer science for decades.6
Cyclic polymer dynamics has been investigated using both synthetic and naturally occurring molecules by means of ensemble averaged experimental methods such as nuclear magnetic resonance (NMR), light scattering, and viscosity measurements.7-9 However, these studies often suffer from impurity molecules in the samples.10 Furthermore, spatiotemporal heterogeneities of the motion of individual molecules caused by inherent structural heterogeneity of entangled polymers are often hidden behind the ensemble averaging in these studies. In order to characterize molecular level dynamics of cyclic polymers, a synthesis method that provides high purity cyclic polymers and an experimental and analysis methods that allow for quantitative characterization of molecular motion at the single molecule level have to be developed. Here, we will show a method to synthesize high-purity cyclic and dicyclic poly(THF)s that incorporate a fluorophore unit using an electrostatic self-assembly and covalent fixation (ESA-CF) process11-13 and a method to analyze the motion of the individual fluorophore-incorporated polymer chains using a combination of mean-squared displacement (MSD) and cumulative distribution function (CDF) analyses.
A proper data processing has been shown to be essential for the accurate characterization of the diffusive motion. With an adequate MSD and CDF analyses, a multiple-mode diffusion of the cyclic and dicyclic polymers in the melt and semi-dilute solution of the linear polymer chains has been revealed,14-16 suggesting the significant effects of the topological states of the polymers on the diffusive motion of the chains under entangled conditions.17 While the experimental and analytical approaches to characterize the motion of the cyclic polymers are described in this protocol, the same method can be used to quantitatively characterize the diffusive motion in many other heterogeneous systems. The approach would be especially suitable when multiple diffusion components existing in the samples are to be analyzed.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tek fonksiyonlu ve iki fonksiyonlu Poli 1. N- (THF)
- Tek fonksiyonlu poli (THF)
- Alev 2 boyunlu 100 ml'lik yuvarlak tabanlı bir şişeye kuru. Vakum ve nitrojen (3 kür) ile şişeyi doldurun.
- şişeye damıtılmış tetrahidrofuran (THF) (50 mi) eklenir. 20 ° C'de bir su banyosu içinde balon koyun ve sıcaklık dengelenmesi.
- Bir şırınga ile bir şişeye metil triflat (0.5 mmol) ekleyin. 20 ° C'de 5-10 dakika süreyle karıştırın.
- Bir şırınga ile bir şişeye N-fenil pirolidin (4-6 eşi.) Eklenir. 30-60 dakika boyunca karıştırın.
- Tamamen düşük basınçta (yaklaşık 100 Torr) altında çözücüyü çıkarın. aseton 3-5 ml artığı içinde çözündürülür. N-heksan 300-500 ml aseton solüsyonu ekleyin. çökelti filtre edin ve indirgenmiş basınç altında kurutulur.
- Çift işlevli poli (THF)
- Alev 2 boyunlu 100 ml'lik yuvarlak tabanlı bir şişeye kuru. Vacuum ve azot (3 kez) ile şişesi doldurun.
- şişeye damıtılmış THF (50 mi) eklenir. 20 ° C'de bir su banyosu içinde balon koyun ve sıcaklık dengelenmesi.
- Bir şırınga ile şişeye triflik anhidrit (0.3 mmol) ekleyin. 20 ° C'de 5-10 dakika süreyle karıştırın.
- Bir şırınga ile bir şişeye N-fenil pirolidin (4-6 eşi.) Eklenir. 30-60 dakika boyunca karıştırın.
- Tamamen düşük basınçta (yaklaşık 100 Torr) altında çözücüyü çıkarın. aseton 3-5 ml artığı içinde çözündürülür. N-heksan 300-500 ml aseton solüsyonu ekleyin. çökelti filtre edin ve indirgenmiş basınç altında kurutulur.
2. Perylene Sentezi etitkarbodiimit-dahil 4 kollu yıldız ve 8 şeklinde disiklik Poli (THF)
- Silahlı yıldız poli (THF)
- İyon değişimi
- Suda perilen diimid tetrakarboksilat, sodyum tuzu (10 mg / ml, 150 mi) içinde çözülür. eritmekAseton tek fonksiyonlu poli (THF) (160 mg / ml, 4 mi) eklenmiştir. kuvvetli bir şekilde karıştırıldı, sulu çözelti içine aseton çözeltisi damla damla ekleyin. süzme ile oluşan çökeltiyi toplamak.
- kazanılan çökelti (2.1.1.1) dört kez yukarıdaki işlemi tekrarlayın.
- kovalent tespit
- toluen içinde elde edilen çökelti (5 mg / ml) içinde çözülür. 4 saat çözelti, geri akış.
- Tamamen düşük basınçta (yaklaşık 100 Torr) altında çözücüyü çıkarın. N-heksan / aseton (2/1 hacim / hacim), bir silika jel tıpası içinden tortu filtre. Ürünü çöktürmek için buz gibi soğuk su (300-500 ml) içine çözeltisi ekleyin. Çökeltinin süzülerek toplanır.
- İyon değişimi
- Disiklik 8-şeklinde bir poli (THF)
- İyon değişimi
- Suda perilen diimid tetrakarboksilat, sodyum tuzu (6 mg / ml, 50 mi) içinde çözülür. (0.5 g çift fonksiyonlu poli (THF) içinde çözülür) Aseton 30-50 ml. 0 ° C'de kuvvetli bir şekilde karıştırıldı, sulu çözelti içine aseton çözeltisi damla damla ekleyin. süzme ile oluşan çökeltiyi toplamak.
- kazanılan çökelti (2.2.1.1) ile yukarıdaki işlemi tekrarlayın.
- kovalent tespit
- toluen içinde elde edilen çökelti (0,05 g / L) içinde çözülür. 4 saat çözelti, geri akış.
- Tamamen düşük basınçta (yaklaşık 100 Torr) altında çözücüyü çıkarın. Kısmen tortu çözünmesi için toluen ekleyin. Yeniden çökeltilmesi n-heksan 300-500 ml.
- N-heksan / aseton (2/1 hacim / hacim), bir silika jel tamponundan oluşan çökelti filtre. Yeniden çökeltilmesi su 300-500 ml.
- Bir polistiren jel kullanılarak kolon kromatografisiyle 18 ile oluşturulan çökelti saflaştınlır. Bundan başka REM CHCI3 bir eluent ile 19 preparatif jel geçirgenlik kromatografisi (GPC) ile ham ürünün arıtılmasırefraktif indeks (RI) ve UV dedektörler izleyerek ove yan.
- İyon değişimi
3. Tek-molekül Floresans Görüntüleme Deneyi
- örnek hazırlama
- Mikroskop kapak fişleri temizliği
- Yeri No 1.5 24 x 24 mm mikroskop kapağı boyama kavanoza kayıyor.
- 15 dakika boyunca kavanoz ve sonikasyon olarak 1 M potasyum hidrit çözeltisi (100 mi) eklenir. durultma yoluyla potasyum hidroksit çözeltisi dökün ve birkaç kez ultra saf su ile kapak slipi üzerinde çalkalayın. 15 dakika boyunca kavanoz ve sonikasyon içine spektroskopik dereceli etanol (100 mi) eklenir.
- durultma yoluyla etanol dökün ve birkaç kez ultra saf su ile kapak fişleri durulayın. durultma yoluyla ultra saf su kapalı döküldükten sonra, adımı 3.1.1.2 tekrarlayın.
- 15 dakika boyunca kavanoz ve sonikasyon ultra saf su ekleyin. birkaç kez ultra saf su ile kapak fişleri durulayın. Bir plastik cımbız ile kavanoz kapağı fişleri çıkarın ve kuru hava veya kuru nitrojen ya onları kurutun.
- Polimer eriyiği örnekleri 14,15 hazırlanması
- bir cam şişe içinde etiketli olmayan lineer poli (THF) 100 ul ilave edin ve bir saç kurutma makinesi kullanılarak erime noktasından (yaklaşık 25 ° C) üzerindeki bir sıcaklığa kadar ısıtılır.
- Florofor dahil polimer (lineer, 4 kollu bir yıldız, siklik ya da 8-şeklinde bir disiklik 2.1 ve 2.2 sentezlenir), kloroform (1 mi, 10 -6 M) içinde çözülür. etiketli olmayan lineer poli (THF) eriyiğin 100 ul çözelti 1 ul ekle.
- İyice bir pipet ucu ile karıştırılarak sonra, kurutucu kullanılarak örnek ısıtılmasıyla kloroform buharlaşır.
NOT: Bu florofor dahil polimerlerin 10 8 M ihtiva eden etiketli olmayan lineer poli (THF) içindeki bir eriyiği içerir. - örnek 10 ul mikro-pipet ve D'nin kullanımı almakbir temizlenmiş kapak kayma üzerinde ROP. numune üzerinde başka temizlenmiş kapak kayma koyun ve iki kapak fişleri arasında örnek sandviç.
- nazikçe plastik cımbız kullanarak örnek basınız.
- Mikroskop kapak fişleri temizliği
- Geniş alan floresan görüntüleme kurulumu 15
- Ters mikroskop arka portuna bir uyarım lazer (488 nm) tanıtımı
- ışın yoluna bir uyarım bant geçiren filtre ve polarize takın.
- Bir ışın genişletici tarafından çapı yaklaşık 1 cm ışını genişletin.
- ışın yoluna çeyrek dalga plakası yerleştirin. polarizörün olduğu ile ilgili olarak 45 derece dalga plakası optik eksenine ayarlayın. Alternatif olarak, bir Berek kompansatör eklemek için / 4 l optik gecikmeyi ayarlamak.
- kiriş boyutunu ayarlamak için uyarma ışın yolunda bir diyafram takın.
- ters optik mikroskobik arka portuna lazer ışını tanıtan öncePE, bir odaklama lensi yerleştirin (Plan dışbükey lens, odak uzaklığı ≈ 300 mm) objektif lens üzerinden bir lazer ışını kolime olan bir pozisyonda.
- Bir filtre küpü üzerine monte edilmiş bir dikroik ayna kullanılarak lazer ışını yansıtılarak ve sonra yüksek bir sayısal açıklık (NA) objektif lens numuneye lazer ışını tanıtmak (örneğin NA 1.3, 100X büyütme, yağ daldırma).
- objektife objektif bir ısıtıcı takın ve 30 ° C sıcaklığını ayarlamak.
- Ters mikroskop aşamasında numune montaj
- objektif lens üzerinde immersiyon bir damla damla ve mikroskop durumuna örnek monte edin.
- yaklaşık 10 um örnek kalınlığı numunenin alt ve üst yüzeyi eksenel pozisyonunu kontrol edilmesiyle elde olduğundan emin olun.
- numunenin alt yüzeyi üzerinde bir kaç mikrometre mikroskop odağı ayarlayın.
- Objektif mercek altında dairesel polarize uyarma ışık elde
- objektif lens dışarı paralelleştirilmiş lazer ışınına bir polarize yerleştirin.
- polarize sonra bir güç ölçer takarak polarize iletilen lazer yoğunluğunu kaydedin. polarize çevirerek farklı polarizasyon açılarında iletilen lazer gücünü kaydedin.
- iletilen lazer gücü tüm polarizasyon açılarında sabit değilse, biraz uyarma ışın yoluna yerleştirilen çeyrek dalga plakası veya Berek kompansatör döndürün.
- sabit iletilen lazer gücü kadar adımı yineleyin 3.2.5.2 ve 3.2.5.3 tüm polarizasyon açılarında elde edilir. dairesel polarize ışık numunesi elde emin olun.
- Kurulum EM (elektron çoğaltan) cihazı birleştiğinde -Ödeme (CCD) kamera
- mikroskop yan port EM-CCD kamera takın ve t bağlayıngörüntü elde etme yazılımı o.
- Gerekirse, cihazlara EM-CCD kamera tarafından oluşturulan transistör-transistör mantığı (TTL) sinyalleri göndererek bir mekanik obtüratör veya uyarma ışın yolu takılı acousto-optik ayarlanabilir filtre kamera poz senkronize. Alternatif olarak, lazer EM-CCD kamera tarafından oluşturulan TTL sinyaller göndererek lazer çıkışına kamera poz senkronize.
NOT:, çıkış gücü giriş transistörü-Transistör modüle edilebilir katı-hal lazer (TTL) sinyalleri deney için kullanılan yalnızca sonuncu seçenek, uygulanabilir. - Tek fluorofor yüksek kalitede floresan görüntü elde etmek için kamerayı kontrol yazılımı kullanarak CCD kamera bir EM kazanç (genellikle yaklaşık 300) uygulayın.
- Faiz (ROI) bir bölge kamerayı kontrol yazılımı kullanarak (görüş alanının merkezinde tipik 128 x 128 piksel) olarak ayarlayın.
NOT: Bu IMAGI sağlareriyik numunedeki fluorofor dahil polimer zincirleri hareketini görüntülenmesi için gerekli olan çerçeve aktarım modunda, 200 Hz - 100 kare hızında ng deneyler.
- Ters mikroskop arka portuna bir uyarım lazer (488 nm) tanıtımı
- deneme çalıştırırken
- Deneysel koşulları optimize
- uyarma ışın yolu takılı diyafram kullanarak çapı yaklaşık 20 um numunenin aydınlatma alanını ayarlayın.
- elle uyarma ışın yoluna yerleştirilen uygun bir nötr yoğunluk (ND) filtresi seçerek 8 mW - 4 numune uyarma lazer gücünü ayarlayın.
NOT: - 2 kW cm -2 örnek de bu 1 ortalama lazer gücü sağlar. - 200 Hz - 100 kare hızlarında örnek rekor floresan görüntüler. Bireysel florofor dahil polimerlerden elde edilen floresans yoğunluğu çok düşükse, yavaş yavaş TH ile uyarım gücünü artırmaknumune yaklaşık 100 mW ulaşana kadar e ND filtre.
- tek-molekül floresan görüntü kalitesi hala tatmin edici değilse, etiketli olmayan poli (THF) saf bir eriyik floresan görüntüleri kaydederek numunede floresan kirleri kontrol edin. Yüksek floresan arka plan görülmektedir durumda, farklı etiketli olmayan poli (THF) kullanın.
- eriyik içinde florofor dahil polimerlerden elde floresan nokta yoğunluğu uzamsal olması (bu pasif hareket analizinde hatalara neden) izole etmek için çok yüksek ise, örnek kadar içeri florofor dahil polimer konsantrasyonunu azaltmak mekansal izole noktalar görülmektedir.
- eriyik içinde florofor dahil polimerlerden elde floresan nokta yoğunluğu (bu görüntüleme deneyinde düşük verim neden olur) çok düşük ise, appropr kadar örnek florofor dahil polimer konsantrasyonunu arttırmakfloresan nokta iate yoğunluğu ulaşılır.
- eriyik içinde fluorofor dahil polimerlerden elde edilen floresan görüntüleri bulanık ise, görüntüleme edinimi çerçeve oranlarını artırmak.
NOT: Bu genellikle tipik olarak 64 x 64 piksel daha küçük bir yatırım getirisi gerektirir.
- Deneysel koşulları optimize
- Görüntü edinme
- Deney koşulları optimize sonra örnek denge şartları ulaşır, böylece bir saat mikroskop sahnede monte örnek bırakın.
- 200 Hz kare hızı - 100 eriyik halde fluorofor dahil polimerlerin 1000 floresan görüntü dizileri - 500 kaydediniz. varsayılan dosya biçimi TIFF değilse, TIFF formatında tüm resim dizilerini dönüştürmek.
Pasif Hareket 4. Analizi
- Ortalama kare deplasman (MSD) analizi
- bu şekilde floresan görüntü dizilerini kırpmaHer görüntü sırası gibi ImageJ gibi tek ve iyi odaklanmış difüzyon fluorofor-dahil polimer kullanılarak görüntü işleme yazılımı içerdiğini.
- kırpılan görüntü dizileri 10'dan fazla kare içerdiğinde, her dizi 10 kare oluşur, öyle ki birçok dizinin içine resim dizileri ayrıldı.
- doğru görüntü iki boyutlu Gauss geçme ile, her resim dizilerinin molekül konumlarını belirler.
- Denklem 20 Difüzyon katsayısı (D), ayrı ayrı moleküllerin difüzyon yörüngeleri (molekül, yani zamana bağlı pozisyonları) ortalama-kare yer değiştirme (MSD) analizi ile belirlemek
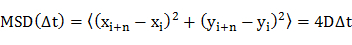
x i ve y ı resim çerçevesi i molekülün pozisyonları ve n çerçeve i dan time lapse ¨ t çerçeve numarasını ifade etmektedir. - difüzyon katsayıları arsabir frekans histogramı.
Not: Genellikle, histogram 100'den moleküllerden yapılmıştır.
- Kümülatif dağılım fonksiyonu (CDF) analizi
NOT: Bir CDF, P (r 2 i Δ t) i t ö belli bir zaman gecikmesi sonrası kökenli bir yarıçap r içinde difüzyon molekülleri bulmak kümülatif olasılık karşılık gelir.- Zaman 4.1.3'de elde edilen tüm difüzyon yörüngeleri için 1Δt, 2Δt, ····, iΔt arasında gecikme sırasında ortaya çıkan kareli-yer değiştirme hesaplayın.
NOT: Saat iΔt ve gecikme için bu hesaplamalar toplam i karesi-yer değiştirmeleri m verir. - Farklı r 2 değerlerinde r 2 daha küçük olan toplam m i veri kümesi içinde karesi-değiştirmeler (l i) sayıları hesaplamak (0 2 vs normalize l i araziler CDF, P (r 2, iΔt) karşılık gelmektedir.
- Zaman 4.1.3'de elde edilen tüm difüzyon yörüngeleri için 1Δt, 2Δt, ····, iΔt arasında gecikme sırasında ortaya çıkan kareli-yer değiştirme hesaplayın.
- Tat difüzyon modelleri ile TDF analizi
Not: Elde edilen CDFs farklı difüzyon modelleri ile donatılmıştır; Homojen difüzyon modeli, D dağılımı Gauss (tek Gauss modeli) tarafından tarif edildiği birden fazla difüzyon modları ve birden fazla difüzyon modları, D dağılımı çok Gauss (çoklu Gauss modeli) ile ifade edilir.- Homojen difüzyon modelde, bir denklem 21 kullanılarak CDF takarak ortalama D belirlemek
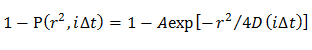
NOT: denklemin herhangi bir sapma molekülünün heterojen difüzyon göstermektedir. - Tek Gauss modelde, 15 kullanılarak CDF uydurma bir Gauss (f (D)) tarafından açıklanan D olasılık dağılımını belirlemek
On3 "src =" / files / ftp_upload / 54503 / 54503equation3.jpg "/>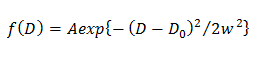
A, W ve D 0 Gauss genlik, genişlik ve merkez olduğu. - Çift Gauss modelde, 14 kullanılarak CDF uydurma bir Gauss (f (D)) tarafından açıklanan D bileşeni inci j olasılık dağılımını belirlemek
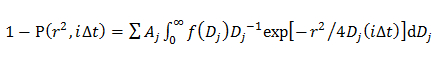

Bir j her bir difüzyon bileşen fraksiyonu ve α j, j B ve D 0 burada, j, Gauss bileşeni j nolu amplitüd, genişlik, ve merkez vardır.
- Homojen difüzyon modelde, bir denklem 21 kullanılarak CDF takarak ortalama D belirlemek
- Teorik olasılık göre dağılımın hesaplanmasıDifüzyon katsayısı Katkı
NOT: nedeniyle farklı difüzyon modelleri için hesaplanan istatistiksel hatalar (p (D) d D) oluşan D olasılık dağılımları; Homojen difüzyon modeli, D dağılımı Gauss (tek Gauss modeli) tarafından tarif edildiği birden fazla difüzyon modları ve birden fazla difüzyon modları, D dağılımı çok Gauss (çoklu Gauss modeli) ile ifade edilir.- Homojen difüzyon modelde, bir denklem 22 kullanılarak D istatistiksel olasılık dağılımını hesaplamak
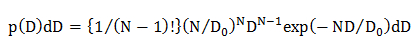
N difüzyon yörünge veri noktalarının sayısı (n = 10, 4.1.2) olduğu, D, 0 ortalama difüzyon katsayısı (CDF analizi ile tespit, 4.2.3.1 bakınız) ve D, deneysel olarak elde edilen bir bağımsız bir yörünge için difüzyon katsayısı. - içindeTek Gauss difüzyon modeli, bir denklem 15 kullanılarak D istatistiksel olasılık dağılımını hesaplamak

F (d) CDF analizi ile belirlenir D olasılık dağılımını (4.2.3.2 bakınız) temsil eder ve d, 0, ortalama difüzyon katsayısıdır (CDF analizi ile tespit, 4.2.3.2 bakınız). - Çift Gauss difüzyon modelinde, bir denklem 14 kullanılarak D istatistiksel olasılık dağılımını hesaplamak

F (d, J) CDF analizi ile belirlenmiştir D (d, J) bileşeni j nolu olasılık dağılımını ifade etmektedir (4.2.3.3 bakınız) ve D 0j CDF tarafından belirlenen bir bileşen TH J (ortalama difüzyon katsayısıdır analiz) 4.2.3.3 bkz.
- Homojen difüzyon modelde, bir denklem 22 kullanılarak D istatistiksel olasılık dağılımını hesaplamak
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Perilen 4 kollu yıldız ve diimid-dahil 8 şeklinde disiklik poli (THF) s elektrostatik kendini montaj ve kovalent tespit (ESA CF) işlemi (Şekil 1, Şekil 2) kullanılarak sentezlendi. Zaman atlamalı tek moleküllü Fluoresans görüntüleri 4-kollu (Şekil 3a) için ölçülmüş ve (Şekil 3b) polimerleri 8-şekillendirildi. Zaman atlamalı floresan görüntüleri (Şekil 3) mekansal nedeniyle zinc...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
4 kollu 8-şekilli polimerleri içerir. Sentez için önemli bir adımdır ESA CF protokolü (Şekil 1) yoluyla elde 12,24 tek fonksiyonlu ve iki fonksiyonlu lineer poli (THF) N S -phenylpiperidinium uç grupları olan edildi önceki edilen prosedüre göre sentezlendi. 11 iyon değişim karboksilat aşırı miktarını içeren bir sulu çözelti içine triflat karşı-bir polimer öncüsünün bir aseton çözeltisinin tekrar çökeltme işlemi ile gerçekleştirilmiştir...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was supported by a Grant-in-Aid for Scientific Research No. 22750122 (S.H.), No. 26288099 (T.Y.), and No. 23350050 (Y.T.) of the Japan Society for the Promotion of Science. S.H. is grateful for The Kurata Memorial Hitachi Science and Technology Foundation. The research reported in this publication was supported by the King Abdullah University of Science and Technology (S.H.).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Materials | |||
| THF | Godo | ||
| Wakosil C-300 | Wako Pure Chemical Industries | ||
| Acetone | Godo | ||
| Toluene | Godo | ||
| n-Hexane | Godo | ||
| CHCl3 | Kanto Chemical | ||
| Bio-Beads S-X1 | Bio-Rad | ||
| Methyl triflate | Nacalai Tesque | ||
| Triflic anhydride | Nacalai Tesque | ||
| Potassium Hydroxide | Wako Pure Chemical Industries | ||
| Ethanol | Wako Pure Chemical Industries | ||
| Poly(tetrahydrofuran) | Aldrich | ||
| Chloroform | Wako Pure Chemical Industries | ||
| Immersion oil | Cargille | Type 37 / Type A | |
| Equipment | |||
| 2-Neck 100-ml round-bottom flask | |||
| Flask | |||
| Beaker | |||
| Funnel | |||
| Filter paper | Whatman | ||
| Reflux condenser | |||
| Syringe | |||
| Water bath | |||
| Magnetic stirrer | |||
| Rotary evaporator | |||
| Microscope cover slips (24 x 24 mm, No. 1) | Matsunami Glass | CO22241 | |
| Staining jar | AS ONE Corporation | 1-7934-01 | |
| Ultrasonic cleaner | VWR International | 142-0047 | |
| Inverted microscope | Olympus | IX71 | |
| Ar-Kr ion laser | Coherent | Innova 70C | |
| Berek compensator | Newport | 5540 | |
| Excitation filter | Semrock | LL01-488-12.5 | |
| Dichloric mirror | Omega optical | 500DRLP | |
| Emission filter | Semrock | BLP01-488R-25 | |
| Lens and mirror | Thorlabs | ||
| EM-CCD camera | Andor Technology | iXon | |
| Objective lens (100X, N.A. = 1.3) | Olympus | UPLFLN 100XOP | |
| Objective heater | Bioptechs | ||
| Preparative GPC | Japan Analytical Industry | LC-908 |
Referanslar
- Honda, S., Yamamoto, T., Tezuka, Y. Topology-Directed Control on Thermal Stability: Micelles Formed from Linear and Cyclized Amphiphilic Block Copolymers. J. Am. Chem. Soc. 132 (30), 10251-10253 (2010).
- Honda, S., Yamamoto, T., Tezuka, Y. Tuneable enhancement of the salt and thermal stability of polymeric micelles by cyclized amphiphiles. Nat. Commun. 4, (2013).
- Jun, S., Mulder, B. Entropy-driven spatial organization of highly confined polymers: Lessons for the bacterial chromosome. Proc. Natl. Acad. Sci. U. S. A. 103 (33), 12388-12393 (2006).
- McLeish, T. Polymers without beginning or end. Science. 297 (5589), 2005-2006 (2002).
- McLeish, T. Polymer dynamics: Floored by the rings. Nat. Mater. 7 (12), 933-935 (2008).
- Roovers, J. Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. Tezuka, Y. , World Scientific Publishing Co. Pte. Ltd. 137-156 (2013).
- Klein, J. Evidence for reptation in an entangled polymer melt. Nature. 271 (5641), 143-145 (1978).
- Leger, L., Hervet, H., Rondelez, F. Reptation in entangled polymer-solutions by forced rayleigh light-scattering. Macromolecules. 14 (6), 1732-1738 (1981).
- von Meerwall, E. D., Amis, E. J., Ferry, J. D. Self-diffusion in solutions of polystyrene in tetrahydrofuran - comparison of concentration dependences of the diffusion-coefficients of polymers, and a ternary probe component. Macromolecules. 18 (2), 260-266 (1985).
- Kapnistos, M., et al. Unexpected power-law stress relaxation of entangled ring polymers. Nat. Mater. 7 (12), 997-1002 (2008).
- Adachi, K., Takasugi, H., Tezuka, Y. Telechelics having unstrained cyclic ammonium salt groups for electrostatic polymer self-assembly and ring-emitting covalent fixation. Macromolecules. 39 (17), 5585-5588 (2006).
- Oike, H., Imaizumi, H., Mouri, T., Yoshioka, Y., Uchibori, A., Tezuka, Y. Designing unusual polymer topologies by electrostatic self-assembly and covalent fixation. J. Am. Chem. Soc. 122 (40), 9592-9599 (2000).
- Yamamoto, T., Tezuka, Y. Topological polymer chemistry: a cyclic approach toward novel polymer properties and functions. Polym. Chem. 2 (9), 1930-1941 (2011).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Tezuka, Y. Single-molecule imaging reveals topological isomer-dependent diffusion by 4-armed star and dicyclic 8-shaped polymers. Polym. Chem. 6 (22), 4109-4115 (2015).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Vacha, M., Tezuka, Y. Single-Molecule Study on Polymer Diffusion in a Melt State: Effect of Chain Topology. Anal. Chem. 85 (15), 7369-7376 (2013).
- Habuchi, S., Satoh, N., Yamamoto, T., Tezuka, Y., Vacha, M. Multimode Diffusion of Ring Polymer Molecules Revealed by a Single-Molecule Study. Angew. Chem. Int. Ed. 49 (8), 1418-1421 (2010).
- Habuchi, S. Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. Tezuka, Y. , World Scientific. 265-290 (2013).
- Fernandez, P., Bayona, J. M. Use of off-line gel-remeation chromatography normal-phase liquid-chromatography fro the determination of polycyclic aromatic-compounds in environmental-samples and standard reference materials (air particulate matter and marine sediment). J. Chromatogr. 625 (2), 141-149 (1992).
- Biesenberger, J. A., Tan, M., Duvdevan, I., Maurer, T. Recycle gel permeation chromatography. 1. recycle principle and design. J. Polym. Sci. Pol. Lett. 9 (5), 353(1971).
- Kusumi, A., Sako, Y., Yamamoto, M. Confined lateral diffusion of membrane-receptors as studied by single-particle tracking (nanovid microscopy) - effects of calcium-induced differentiation in cultured epithelial-cells. Biophys. J. 65 (5), 2021-2040 (1993).
- Schutz, G. J., Schindler, H., Schmidt, T. Single-molecule microscopy on model membranes reveals anomalous diffusion. Biophys. J. 73 (2), 1073-1080 (1997).
- Vrljic, M., Nishimura, S. Y., Brasselet, S., Moerner, W. E., McConnell, H. M. Translational diffusion of individual class II MHC membrane proteins in cells. Biophys. J. 83 (5), 2681-2692 (2002).
- Margineanu, A., et al. Photophysics of a water-soluble rylene dye: Comparison with other fluorescent molecules for biological applications. J. Phys. Chem. B. 108 (32), 12242-12251 (2004).
- Tezuka, Y., Oike, H. Self-assembly and covalent fixation for topological polymer chemistry. Macromol. Rapid Commun. 22 (13), 1017-1029 (2001).
- Deres, A., et al. The Origin of Heterogeneity of Polymer Dynamics near the Glass Temperature As Probed by Defocused Imaging. Macromolecules. 44 (24), 9703-9709 (2011).
- Flier, B. M. I., et al. Heterogeneous Diffusion in Thin Polymer Films As Observed by High-Temperature Single-Molecule Fluorescence Microscopy. J. Am. Chem. Soc. 134 (1), 480-488 (2012).
- Habuchi, S., Oba, T., Vacha, M. Multi-beam single-molecule defocused fluorescence imaging reveals local anisotropic nature of polymer thin films. Phys. Chem. Chem. Phys. 13 (15), 6970-6976 (2011).
- Zettl, U., et al. Self-Diffusion and Cooperative Diffusion in Semidilute Polymer Solutions As Measured by Fluorescence Correlation Spectroscopy. Macromolecules. 42 (24), 9537-9547 (2009).
- Kirstein, J., Platschek, B., Jung, C., Brown, R., Bein, T., Brauchle, C. Exploration of nanostructured channel systems with single-molecule probes. Nat. Mater. 6 (4), 303-310 (2007).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır