É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Síntese de polímeros cíclicos e Caracterização do seu movimento difusivo no estado fundido na molécula de nível único
Neste Artigo
Resumo
Um protocolo para a síntese e caracterização de movimento difusivo de polímeros cíclicos no único nível molécula é apresentado.
Resumo
We demonstrate a method for the synthesis of cyclic polymers and a protocol for characterizing their diffusive motion in a melt state at the single molecule level. An electrostatic self-assembly and covalent fixation (ESA-CF) process is used for the synthesis of the cyclic poly(tetrahydrofuran) (poly(THF)). The diffusive motion of individual cyclic polymer chains in a melt state is visualized using single molecule fluorescence imaging by incorporating a fluorophore unit in the cyclic chains. The diffusive motion of the chains is quantitatively characterized by means of a combination of mean-squared displacement (MSD) analysis and a cumulative distribution function (CDF) analysis. The cyclic polymer exhibits multiple-mode diffusion which is distinct from its linear counterpart. The results demonstrate that the diffusional heterogeneity of polymers that is often hidden behind ensemble averaging can be revealed by the efficient synthesis of the cyclic polymers using the ESA-CF process and the quantitative analysis of the diffusive motion at the single molecule level using the MSD and CDF analyses.
Introdução
Cyclic polymers are unique in that they do not have chain ends. They often exhibit unusual behaviors which is distinct from their linear counterpart, including increased thermal stability of polymer micelles by a linear-to-cyclic conversion,1,2 and spatial organization of DNA in bacterial cells by a loop formation.3 Topological interactions between the cyclic chains are believed to be the critical factor for such unusual behaviors.4,5 Therefore, characterizing the motion and relaxation of cyclic polymers under entangled conditions has been an important research topic in polymer science for decades.6
Cyclic polymer dynamics has been investigated using both synthetic and naturally occurring molecules by means of ensemble averaged experimental methods such as nuclear magnetic resonance (NMR), light scattering, and viscosity measurements.7-9 However, these studies often suffer from impurity molecules in the samples.10 Furthermore, spatiotemporal heterogeneities of the motion of individual molecules caused by inherent structural heterogeneity of entangled polymers are often hidden behind the ensemble averaging in these studies. In order to characterize molecular level dynamics of cyclic polymers, a synthesis method that provides high purity cyclic polymers and an experimental and analysis methods that allow for quantitative characterization of molecular motion at the single molecule level have to be developed. Here, we will show a method to synthesize high-purity cyclic and dicyclic poly(THF)s that incorporate a fluorophore unit using an electrostatic self-assembly and covalent fixation (ESA-CF) process11-13 and a method to analyze the motion of the individual fluorophore-incorporated polymer chains using a combination of mean-squared displacement (MSD) and cumulative distribution function (CDF) analyses.
A proper data processing has been shown to be essential for the accurate characterization of the diffusive motion. With an adequate MSD and CDF analyses, a multiple-mode diffusion of the cyclic and dicyclic polymers in the melt and semi-dilute solution of the linear polymer chains has been revealed,14-16 suggesting the significant effects of the topological states of the polymers on the diffusive motion of the chains under entangled conditions.17 While the experimental and analytical approaches to characterize the motion of the cyclic polymers are described in this protocol, the same method can be used to quantitatively characterize the diffusive motion in many other heterogeneous systems. The approach would be especially suitable when multiple diffusion components existing in the samples are to be analyzed.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Síntese de monofuncional e poli Bifuncional (THF)
- Poli monofuncional (THF)
- Chama seco num balão de fundo redondo de 2 tubuladuras de 100 ml. Vácuo e encher o balão com azoto (3 ciclos).
- Adicionar tetra-hidrofurano destilado (THF) (50 ml) ao balão. Colocar o balão num banho de água a 20 ° C e a temperatura equilibrar.
- Adicionar triflato de metilo (0,5 mmol) ao frasco por uma seringa. Agita-se a mistura durante 5-10 min a 20 ° C.
- Adiciona-se N -fenil pirrolidina (4-6 equiv.) Ao frasco por uma seringa. Agita-se a mistura durante 30-60 minutos.
- Remover completamente o solvente sob pressão reduzida (cerca de 100 Torr). Dissolve-se o resíduo em 3-5 ml de acetona. Adicionar a solução de acetona em 300-500 ml de n-hexano. Filtra-se o precipitado e secá-lo sob pressão reduzida.
- Poli bifuncional (THF)
- Chama seco num balão de fundo redondo de 2 tubuladuras de 100 ml. Vaente e encher o balão com azoto (3 ciclos).
- Adicionar THF destilado (50 ml) ao balão. Colocar o balão num banho de água a 20 ° C e a temperatura equilibrar.
- Adicionar anidrido triflico (0,3 mmol) ao frasco por uma seringa. Agita-se a mistura durante 5-10 min a 20 ° C.
- Adiciona-se N -fenil pirrolidina (4-6 equiv.) Ao frasco por uma seringa. Agita-se a mistura durante 30-60 minutos.
- Remover completamente o solvente sob pressão reduzida (cerca de 100 Torr). Dissolve-se o resíduo em 3-5 ml de acetona. Adicionar a solução de acetona a 300-500 ml de n-hexano. Filtra-se o precipitado e secá-lo sob pressão reduzida.
em forma de 8 2. Síntese de Perileno diimida-incorporada por estrelas 4-armada e dicíclico Poly (THF)
- Armado poli estrela (THF)
- troca iônica
- Dissolve-se o sal de di-imida perileno tetracarboxilato de sódio em água (10 mg / ml, 150 ml). Dissolverpoli monofuncional (THF) em acetona (160 mg / ml, 4 ml). Adicionar gota a gota, a solução de acetona na solução aquosa vigorosamente agitada. Recolhe-se o precipitado formado por filtração.
- Repetir o procedimento acima com o precipitado recuperado (2.1.1.1) quatro vezes.
- fixação covalente
- Dissolve-se o precipitado obtido em tolueno (5 mg / ml). Refluxo a solução durante 4 horas.
- Remover completamente o solvente sob pressão reduzida (cerca de 100 Torr). Filtra-se o resíduo através de um tampão de gel de sílica com n-hexano / acetona (2/1 vol / vol). Adicionar a solução em água arrefecida com gelo (300-500 ml) para precipitar o produto. Recolher o precipitado por filtração.
- troca iônica
- Poli em forma de oito dicíclico (THF)
- troca iônica
- Dissolve-se o sal de di-imida perileno tetracarboxilato de sódio em água (6 mg / ml, 50 ml). Dissolve-se poli bifuncional (THF) (0,5 g) Em 30-50 ml de acetona. Adicionar gota a gota, a solução de acetona na solução aquosa vigorosamente agitada a 0 ° C. Recolhe-se o precipitado formado por filtração.
- Repetir o procedimento acima com o precipitado recuperado (2.2.1.1).
- fixação covalente
- Dissolve-se o precipitado obtido em tolueno (0,05 g / L). Refluxo a solução durante 4 horas.
- Remover completamente o solvente sob pressão reduzida (cerca de 100 Torr). Adicionar tolueno para dissolver parcialmente o resíduo. Re-precipitar em 300-500 ml de n-hexano.
- Filtra-se o precipitado formado por meio de um tampão de gel de sílica com n-hexano / acetona (2/1 vol / vol). Re-precipitar em 300-500 ml de água.
- Purifica-se o precipitado que se formou por cromatografia em coluna utilizando 18 um gel de poliestireno. Purificar o produto bruto por cromatografia de permeação em gel preparativa (GPC) 19 com um eluente de CHCl3 a REMsubprodutos ove, monitorando índice de refração (RI) e detectores de UV.
- troca iônica
3. única molécula de fluorescência de imagem Experiment
- Preparação de amostra
- Limpeza de lamelas de microscópio
- Coloque a tampa mm microscópio No. 1.5 24 x 24 desliza em uma tina de coloração.
- Adicionar solução de hidreto de potássio 1 M (100 ml) no frasco e sonicado durante 15 minutos. Decantar a solução de hidróxido de potássio por decantação e lavar as lamelas com água ultra-pura por várias vezes. Adicionar etanol de qualidade espectroscópica (100 ml) no frasco e sonicado durante 15 minutos.
- Deitar fora o etanol por decantação e lavar as lamelas com água ultra-pura por várias vezes. Após o vazamento para fora da água ultra-pura por decantação, repita o passo 3.1.1.2.
- Adicione a água ultra-pura para o frasco e sonicate para 15 min. Lavar as lamelas com água ultra-pura por diversas vezes. Retire as lamelas do frasco por uma pinça de plástico e secá-las por qualquer ar seco ou azoto seco.
- Preparação de amostras de massa fundida de polímero 14,15
- Adicionar 100 ul de poli linear não marcado (THF) num frasco de vidro e aquecê-la a uma temperatura acima do ponto de fusão (cerca de 25 ° C) usando um secador de cabelo.
- Dissolve-se o polímero incorporado-fluoróforo (linear, em estrela de 4 ramos, cíclico, ou dicíclico em forma de oito sintetizado em 2,1 e 2,2) em clorofórmio (1 ml, 10 -6 M). Adicionar 1 ml de solução aos 100 ul da massa fundida do poli linear não marcado (THF).
- Depois de se misturar cuidadosamente a amostra com uma ponta de pipeta, evapora-se o clorofórmio por aquecimento da amostra, utilizando um secador.
NOTA: Este fornece uma massa fundida do poli linear não marcado (THF) contendo 10 -8 M de os polímeros fluoróforos incorporados. - Tomar 10 ul da amostra, utilizando uma micro-pipeta e dROP-lo em uma lamela limpa. Dito de outra lamela limpo na amostra e sanduíche da amostra entre as duas lamelas.
- Pressione suavemente a amostra usando uma pinça de plástico.
- Limpeza de lamelas de microscópio
- Wide-campo de configuração imagens de fluorescência 15
- Introdução de um laser de excitação (488 nm) para a porta de trás do microscópio invertido
- Insira um filtro de excitação de banda e polarizador para o caminho do feixe.
- Expandir o feixe de cerca de 1 cm de diâmetro por um expansor de feixe.
- Insira uma placa de quarto de onda para o caminho do feixe. Definir o eixo óptico da placa de onda a 45 graus em relação ao do polarizador. Alternativamente, insira um compensador de Berek e definir o atraso óptico para? / 4.
- Inserir um diafragma no caminho do feixe de excitação para ajustar o tamanho do feixe.
- Antes de introduzir o feixe de laser na porta traseira do microsco óptico invertidoPE, inserir uma lente de focagem (lentes plano-convexo, o comprimento focal ≈ 300 mm) a uma posição em que o feixe de laser para fora da lente objectiva é colimada.
- Depois de reflectir o feixe de laser utilizando um espelho dicróico montado sobre um cubo de filtro, introduzir o feixe de laser para a amostra através de uma lente objectiva de alta abertura numérica (NA) (por exemplo, NA 1.3, uma ampliação de 100X, de imersão em óleo).
- Anexar um aquecedor objectivo para a lente objectiva e ajustar a temperatura a 30 ° C.
- Montagem da amostra sobre a fase de microscópio invertido
- Deixe cair uma gota de óleo de imersão na lente objetiva e montar a amostra sobre o estado microscópio.
- Assegure-se que a espessura da amostra de cerca de 10 um é obtido através da verificação da posição axial da superfície de fundo e de topo da amostra.
- Ajustar a focagem do microscópio, para alguns micrómetros acima da superfície inferior da amostra.
- Obter luz de excitação polarizada circularmente sob a lente objetiva
- Insira um polarizador para o raio laser colimado para fora da lente objetiva.
- Grave a intensidade do laser transmitida através do polarizador através da inserção de um medidor de energia após o polarizador. Grave a potência do laser transmitida em diferentes ângulos de polarização através da rotação do polarizador.
- Se a potência do laser transmitida não é constante em todos os ângulos de polarização, gire ligeiramente a placa de quarto de onda ou Berek compensador inserido no caminho do feixe de excitação.
- Repita o passo 3.2.5.2 e 3.2.5.3 até que a constante potência do laser transmitido é obtido em todos os ângulos de polarização. Certifique-se de que a luz polarizada circularmente é obtido na amostra.
- Configuração do EM (multiplicador de elétrons) -Charge coupled device (CCD)
- Fixe a câmara EM-CCD à porta lateral do microscópio e conectá-lo para tele software de aquisição de imagem.
- Se necessário, sincronizar a exposição da câmara para um obturador mecânico ou filtro sintonizável acústico-óptico inserido no caminho do feixe de excitação através do envio do Transistor-Transistor Logic (TTL) sinais gerada pela câmara EM-CCD para os dispositivos. Alternativamente, sincronizar a exposição da câmara para a saída do laser, enviando os sinais TTL gerados pela câmara CCD EM-ao laser.
NOTA: A última opção é aplicável somente quando um laser de estado sólido, cuja potência de saída pode ser modulada pela entrada lógica transístor-transístor (TTL), sinais é utilizado para a experiência. - Aplicar um ganho EM (tipicamente, aproximadamente, 300) para a câmara CCD usando software que controla a câmara, a fim de obter uma imagem de fluorescência de alta qualidade do único fluoróforo.
- Definir uma região de interesse (ROI) (tipicamente 128 x 128 pixels no centro do campo de vista), usando software que controla a câmara.
NOTA: Isto permite a imagiexperimentos ng em taxas de quadro de 100-200 Hz no modo de transferência de quadro, o que é necessário para visualizar o movimento das cadeias de polímero incorporado-fluoróforo na amostra de fusão.
- Introdução de um laser de excitação (488 nm) para a porta de trás do microscópio invertido
- A execução do experimento
- Otimizar as condições experimentais
- Ajustar a área de iluminação da amostra a cerca de 20 um de diâmetro usando o diafragma inserido no caminho do feixe de excitação.
- Definir a potência do laser de excitação na amostra a 4-8 mW manualmente selecionando um filtro apropriado de densidade neutra (ND) inserido no caminho do feixe de excitação.
NOTA: Este fornece a potência do laser médio de 1 - 2 cm -2 kW na amostra. - Gravação de imagens de fluorescência da amostra nas taxas de quadro de 100-200 Hz. Se a intensidade de fluorescência obtidos a partir dos polímeros individuais incorporadas-fluoróforo é demasiado baixa, aumentar gradualmente a potência de excitação utilizando the ND filtro até atingir cerca de 100 mW na amostra.
- Se a qualidade da imagem de fluorescência única molécula ainda não é satisfatória, verificar as impurezas de fluorescência na amostra através da gravação de imagens de fluorescência de uma massa fundida pura do poli não marcado (THF). No caso de um fundo de fluorescência elevada é observada, usar poli diferente não marcado (THF).
- Se a densidade do local de fluorescência obtidos a partir dos polímeros incorporada fluororo na massa fundida é demasiado elevado para isolá-los (o que provoca erros na análise do movimento difusivo) espacialmente, diminuir a concentração dos polímeros incorporada fluororo na amostra até espacialmente são observados pontos isolados.
- Se a densidade do local de fluorescência obtidos a partir dos polímeros incorporada fluororo no estado fundido é muito baixa (isto causa um baixo rendimento do experimento de imagem), aumentar a concentração dos polímeros incorporada fluororo na amostra até uma aproprdensidade iate do local de fluorescência é atingido.
- Se as imagens de fluorescência obtidos a partir dos polímeros incorporou-fluoróforo no estado fundido são borradas, aumentar as taxas de quadro de aquisição de imagem.
NOTA: Isso muitas vezes requer um ROI menor, normalmente 64 x 64 pixels.
- Otimizar as condições experimentais
- Aquisição de imagem
- Uma vez que as condições experimentais são optimizadas, deixar a amostra montada na platina do microscópio para uma hora de modo a que a amostra atinge condições de equilíbrio.
- Grave 500 - 1000 sequências de imagens de fluorescência dos polímeros incorporada fluororo no estado de fusão a 100 - 200 Hz taxa de quadros. Se o formato de arquivo padrão não é TIFF, converter todas as sequências de imagens para o formato TIFF.
4. Análise do movimento difusivo
- Deslocamento quadrático médio de análise (MSD)
- Cortar as sequências de imagens de fluorescência de tal formaque cada sequência de imagens contém um polímero usando difusão de imagem software de processamento incorporadas-fluoróforo única e bem focada, como ImageJ.
- Quando as sequências de imagens recortadas conter mais de 10 quadros, dividir as sequências de imagens em várias sequências de tal forma que cada sequência é composta por 10 quadros.
- Determinar as posições das moléculas em cada sequências de imagem com precisão por encaixe Gaussiana bidimensional das imagens.
- Determinar o coeficiente de difusão (D) das moléculas individuais através da análise quadrático médio deslocamento (MSD) das trajectórias de difusão (isto é, posições dependentes do tempo da molécula) utilizando uma equação 20
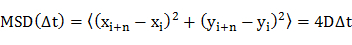
onde x i e y i são as posições da molécula no quadro de imagem i, e n indica o número de quadro com o lapso de tempo At do quadro I. - Traçar os coeficientes de difusão emum histograma de frequência.
NOTA: Tipicamente, o histograma é construído a partir de mais do que 100 moléculas.
- Função de distribuição cumulativa de análise (CDF)
NOTA: Um CDF, P (R 2, i Δ t) corresponde à probabilidade cumulativa de encontrar as moléculas de difusão dentro de um raio R a partir da origem, após um certo lapso de tempo i ô t.- Calcule o deslocamento quadrado que ocorre durante defasagens de 1Δt, 2Δt, ····, iΔt para todas as trajetórias de difusão obtidos em 4.1.3.
NOTA: Estes cálculos dar m total de i-quadrado deslocamentos para atrasos no momento da iΔt. - Calcule números dos deslocamentos-quadrado (l i) no prazo total de conjunto de dados m i que são menores que r 2 em diferentes valores de r 2 (0 i vs r 2 parcelas correspondem a CDF, P (R 2, iΔt).
- Calcule o deslocamento quadrado que ocorre durante defasagens de 1Δt, 2Δt, ····, iΔt para todas as trajetórias de difusão obtidos em 4.1.3.
- Análise de CDFs com modelos de difusão distintas
Nota: Os CDFs obtidos são ajustados por modelos de difusão distintas; modelo homogéneo difusão, vários modos de difusão na qual a distribuição D é descrita por uma distribuição Gaussiana (modelo gaussiano único), e vários modos de difusão na qual a distribuição D é descrita por múltiplos Gaussiana (múltiplos modelo gaussiano).- No modelo de difusão homogénea, determinam uma média de D, ajustando a CDF usando uma equação 21
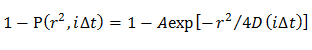
NOTA: Qualquer desvio a partir da equação sugere a difusão heterogênea da molécula. - No modelo gaussiano único, determinar a distribuição de probabilidade de D descrito por uma Gaussiana (f (D)), através da montagem do CDF utilizando 15
on3 "src =" / files / ftp_upload / 54503 / 54503equation3.jpg "/>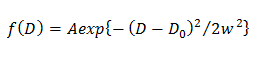
em que A, W, e D são 0 a amplitude, a largura, e o centro de Gauss. - No modelo gaussiano dupla, determinar a distribuição de probabilidade de ordem j de componente D descrito por uma Gaussiana (f (D)), através da montagem do CDF usando 14
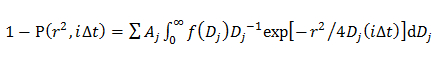

Um onde j é a fracção de cada componente de difusão, e α J, W J, D e J são 0 a amplitude, a largura, e o centro de ordem j componente da Gaussiana.
- No modelo de difusão homogénea, determinam uma média de D, ajustando a CDF usando uma equação 21
- Cálculo do distri probabilidade teóricabuição de coeficiente de difusão
NOTA: As distribuições de probabilidade de D que ocorrem devido a erros estatísticos (p (D) d D) são calculados para os diferentes modelos de difusão; modelo homogéneo difusão, vários modos de difusão na qual a distribuição D é descrita por uma distribuição Gaussiana (modelo gaussiano único), e vários modos de difusão na qual a distribuição D é descrita por múltiplos Gaussiana (múltiplos modelo gaussiano).- No modelo de difusão homogénea, calcular a distribuição de probabilidade estatística de D utilizando uma equação 22
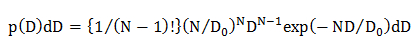
onde N é o número dos pontos de dados em uma trajectória de difusão (N = 10, ver 4.1.2), D 0 é o coeficiente de difusão médio (determinado por análise do CDF, ver 4.2.3.1), e D é a obtida experimentalmente coeficiente de difusão para uma trajetória individual. - Noúnico modelo de difusão Gaussian, calcular a distribuição de probabilidade estatística de D usando uma equação 15

onde f (D) indica a distribuição de probabilidade de D determinado por análise CDF (ver 4.2.3.2), e D 0 é o coeficiente de difusão médio (determinado por análise do CDF, ver 4.2.3.2). - No modelo de difusão Gaussian casal, calcular a distribuição de probabilidade estatística de D usando uma equação 14

onde f (D J) indica a distribuição de probabilidade de o componente de ordem j D (D J) determinada pela análise de CDF (ver 4.2.3.3), e D 0j é o coeficiente de difusão médio de j th componente (determinado pelo CDF análise, ver 4.2.3.3).
- No modelo de difusão homogénea, calcular a distribuição de probabilidade estatística de D utilizando uma equação 22
Access restricted. Please log in or start a trial to view this content.
Resultados
O perylene diimida-incorporada estrelas 4 armado e em forma de 8 poli dicíclico (THF) s foram sintetizados utilizando a auto-montagem eletrostática e fixação covalente (ESA-CF) processo (Figura 1, Figura 2). Imagens de fluorescência de molécula única de lapso de tempo foram medidos para o 4-armada (Figura 3a) e 8 em forma de polímeros (Figura 3B). As imagens de lapso de tempo de fluorescência (Figura 3)<...
Access restricted. Please log in or start a trial to view this content.
Discussão
Os polímeros de 4-armados e moldaram-8 foram preparados por meio do protocolo SEC-CF (figura 1), que é um passo crítico para a síntese. 12,24 monofuncional e poli bifuncional linear (THF) com N s grupos terminais foram -phenylpiperidinium sintetizado de acordo com o procedimento anterior. 11 a permuta iónica foi realizada por reprecipitação de uma solução de acetona de um precursor de polímero com contra-aniões triflato, para uma solução aquosa contendo uma qu...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by a Grant-in-Aid for Scientific Research No. 22750122 (S.H.), No. 26288099 (T.Y.), and No. 23350050 (Y.T.) of the Japan Society for the Promotion of Science. S.H. is grateful for The Kurata Memorial Hitachi Science and Technology Foundation. The research reported in this publication was supported by the King Abdullah University of Science and Technology (S.H.).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Materials | |||
| THF | Godo | ||
| Wakosil C-300 | Wako Pure Chemical Industries | ||
| Acetone | Godo | ||
| Toluene | Godo | ||
| n-Hexane | Godo | ||
| CHCl3 | Kanto Chemical | ||
| Bio-Beads S-X1 | Bio-Rad | ||
| Methyl triflate | Nacalai Tesque | ||
| Triflic anhydride | Nacalai Tesque | ||
| Potassium Hydroxide | Wako Pure Chemical Industries | ||
| Ethanol | Wako Pure Chemical Industries | ||
| Poly(tetrahydrofuran) | Aldrich | ||
| Chloroform | Wako Pure Chemical Industries | ||
| Immersion oil | Cargille | Type 37 / Type A | |
| Equipment | |||
| 2-Neck 100-ml round-bottom flask | |||
| Flask | |||
| Beaker | |||
| Funnel | |||
| Filter paper | Whatman | ||
| Reflux condenser | |||
| Syringe | |||
| Water bath | |||
| Magnetic stirrer | |||
| Rotary evaporator | |||
| Microscope cover slips (24 x 24 mm, No. 1) | Matsunami Glass | CO22241 | |
| Staining jar | AS ONE Corporation | 1-7934-01 | |
| Ultrasonic cleaner | VWR International | 142-0047 | |
| Inverted microscope | Olympus | IX71 | |
| Ar-Kr ion laser | Coherent | Innova 70C | |
| Berek compensator | Newport | 5540 | |
| Excitation filter | Semrock | LL01-488-12.5 | |
| Dichloric mirror | Omega optical | 500DRLP | |
| Emission filter | Semrock | BLP01-488R-25 | |
| Lens and mirror | Thorlabs | ||
| EM-CCD camera | Andor Technology | iXon | |
| Objective lens (100X, N.A. = 1.3) | Olympus | UPLFLN 100XOP | |
| Objective heater | Bioptechs | ||
| Preparative GPC | Japan Analytical Industry | LC-908 |
Referências
- Honda, S., Yamamoto, T., Tezuka, Y. Topology-Directed Control on Thermal Stability: Micelles Formed from Linear and Cyclized Amphiphilic Block Copolymers. J. Am. Chem. Soc. 132 (30), 10251-10253 (2010).
- Honda, S., Yamamoto, T., Tezuka, Y. Tuneable enhancement of the salt and thermal stability of polymeric micelles by cyclized amphiphiles. Nat. Commun. 4, (2013).
- Jun, S., Mulder, B. Entropy-driven spatial organization of highly confined polymers: Lessons for the bacterial chromosome. Proc. Natl. Acad. Sci. U. S. A. 103 (33), 12388-12393 (2006).
- McLeish, T. Polymers without beginning or end. Science. 297 (5589), 2005-2006 (2002).
- McLeish, T. Polymer dynamics: Floored by the rings. Nat. Mater. 7 (12), 933-935 (2008).
- Roovers, J. Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. Tezuka, Y. , World Scientific Publishing Co. Pte. Ltd. 137-156 (2013).
- Klein, J. Evidence for reptation in an entangled polymer melt. Nature. 271 (5641), 143-145 (1978).
- Leger, L., Hervet, H., Rondelez, F. Reptation in entangled polymer-solutions by forced rayleigh light-scattering. Macromolecules. 14 (6), 1732-1738 (1981).
- von Meerwall, E. D., Amis, E. J., Ferry, J. D. Self-diffusion in solutions of polystyrene in tetrahydrofuran - comparison of concentration dependences of the diffusion-coefficients of polymers, and a ternary probe component. Macromolecules. 18 (2), 260-266 (1985).
- Kapnistos, M., et al. Unexpected power-law stress relaxation of entangled ring polymers. Nat. Mater. 7 (12), 997-1002 (2008).
- Adachi, K., Takasugi, H., Tezuka, Y. Telechelics having unstrained cyclic ammonium salt groups for electrostatic polymer self-assembly and ring-emitting covalent fixation. Macromolecules. 39 (17), 5585-5588 (2006).
- Oike, H., Imaizumi, H., Mouri, T., Yoshioka, Y., Uchibori, A., Tezuka, Y. Designing unusual polymer topologies by electrostatic self-assembly and covalent fixation. J. Am. Chem. Soc. 122 (40), 9592-9599 (2000).
- Yamamoto, T., Tezuka, Y. Topological polymer chemistry: a cyclic approach toward novel polymer properties and functions. Polym. Chem. 2 (9), 1930-1941 (2011).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Tezuka, Y. Single-molecule imaging reveals topological isomer-dependent diffusion by 4-armed star and dicyclic 8-shaped polymers. Polym. Chem. 6 (22), 4109-4115 (2015).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Vacha, M., Tezuka, Y. Single-Molecule Study on Polymer Diffusion in a Melt State: Effect of Chain Topology. Anal. Chem. 85 (15), 7369-7376 (2013).
- Habuchi, S., Satoh, N., Yamamoto, T., Tezuka, Y., Vacha, M. Multimode Diffusion of Ring Polymer Molecules Revealed by a Single-Molecule Study. Angew. Chem. Int. Ed. 49 (8), 1418-1421 (2010).
- Habuchi, S. Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. Tezuka, Y. , World Scientific. 265-290 (2013).
- Fernandez, P., Bayona, J. M. Use of off-line gel-remeation chromatography normal-phase liquid-chromatography fro the determination of polycyclic aromatic-compounds in environmental-samples and standard reference materials (air particulate matter and marine sediment). J. Chromatogr. 625 (2), 141-149 (1992).
- Biesenberger, J. A., Tan, M., Duvdevan, I., Maurer, T. Recycle gel permeation chromatography. 1. recycle principle and design. J. Polym. Sci. Pol. Lett. 9 (5), 353(1971).
- Kusumi, A., Sako, Y., Yamamoto, M. Confined lateral diffusion of membrane-receptors as studied by single-particle tracking (nanovid microscopy) - effects of calcium-induced differentiation in cultured epithelial-cells. Biophys. J. 65 (5), 2021-2040 (1993).
- Schutz, G. J., Schindler, H., Schmidt, T. Single-molecule microscopy on model membranes reveals anomalous diffusion. Biophys. J. 73 (2), 1073-1080 (1997).
- Vrljic, M., Nishimura, S. Y., Brasselet, S., Moerner, W. E., McConnell, H. M. Translational diffusion of individual class II MHC membrane proteins in cells. Biophys. J. 83 (5), 2681-2692 (2002).
- Margineanu, A., et al. Photophysics of a water-soluble rylene dye: Comparison with other fluorescent molecules for biological applications. J. Phys. Chem. B. 108 (32), 12242-12251 (2004).
- Tezuka, Y., Oike, H. Self-assembly and covalent fixation for topological polymer chemistry. Macromol. Rapid Commun. 22 (13), 1017-1029 (2001).
- Deres, A., et al. The Origin of Heterogeneity of Polymer Dynamics near the Glass Temperature As Probed by Defocused Imaging. Macromolecules. 44 (24), 9703-9709 (2011).
- Flier, B. M. I., et al. Heterogeneous Diffusion in Thin Polymer Films As Observed by High-Temperature Single-Molecule Fluorescence Microscopy. J. Am. Chem. Soc. 134 (1), 480-488 (2012).
- Habuchi, S., Oba, T., Vacha, M. Multi-beam single-molecule defocused fluorescence imaging reveals local anisotropic nature of polymer thin films. Phys. Chem. Chem. Phys. 13 (15), 6970-6976 (2011).
- Zettl, U., et al. Self-Diffusion and Cooperative Diffusion in Semidilute Polymer Solutions As Measured by Fluorescence Correlation Spectroscopy. Macromolecules. 42 (24), 9537-9547 (2009).
- Kirstein, J., Platschek, B., Jung, C., Brown, R., Bein, T., Brauchle, C. Exploration of nanostructured channel systems with single-molecule probes. Nat. Mater. 6 (4), 303-310 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados