Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Synthese cyclischer Polymere und Charakterisierung ihrer Diffusionsbewegung im geschmolzenen Zustand auf der Einzelmolekülebene
In diesem Artikel
Zusammenfassung
Ein Protokoll für die Synthese und Charakterisierung von Diffusionsbewegung von zyklischen Polymeren auf der Einzelmolekülebene vorgestellt.
Zusammenfassung
We demonstrate a method for the synthesis of cyclic polymers and a protocol for characterizing their diffusive motion in a melt state at the single molecule level. An electrostatic self-assembly and covalent fixation (ESA-CF) process is used for the synthesis of the cyclic poly(tetrahydrofuran) (poly(THF)). The diffusive motion of individual cyclic polymer chains in a melt state is visualized using single molecule fluorescence imaging by incorporating a fluorophore unit in the cyclic chains. The diffusive motion of the chains is quantitatively characterized by means of a combination of mean-squared displacement (MSD) analysis and a cumulative distribution function (CDF) analysis. The cyclic polymer exhibits multiple-mode diffusion which is distinct from its linear counterpart. The results demonstrate that the diffusional heterogeneity of polymers that is often hidden behind ensemble averaging can be revealed by the efficient synthesis of the cyclic polymers using the ESA-CF process and the quantitative analysis of the diffusive motion at the single molecule level using the MSD and CDF analyses.
Einleitung
Cyclic polymers are unique in that they do not have chain ends. They often exhibit unusual behaviors which is distinct from their linear counterpart, including increased thermal stability of polymer micelles by a linear-to-cyclic conversion,1,2 and spatial organization of DNA in bacterial cells by a loop formation.3 Topological interactions between the cyclic chains are believed to be the critical factor for such unusual behaviors.4,5 Therefore, characterizing the motion and relaxation of cyclic polymers under entangled conditions has been an important research topic in polymer science for decades.6
Cyclic polymer dynamics has been investigated using both synthetic and naturally occurring molecules by means of ensemble averaged experimental methods such as nuclear magnetic resonance (NMR), light scattering, and viscosity measurements.7-9 However, these studies often suffer from impurity molecules in the samples.10 Furthermore, spatiotemporal heterogeneities of the motion of individual molecules caused by inherent structural heterogeneity of entangled polymers are often hidden behind the ensemble averaging in these studies. In order to characterize molecular level dynamics of cyclic polymers, a synthesis method that provides high purity cyclic polymers and an experimental and analysis methods that allow for quantitative characterization of molecular motion at the single molecule level have to be developed. Here, we will show a method to synthesize high-purity cyclic and dicyclic poly(THF)s that incorporate a fluorophore unit using an electrostatic self-assembly and covalent fixation (ESA-CF) process11-13 and a method to analyze the motion of the individual fluorophore-incorporated polymer chains using a combination of mean-squared displacement (MSD) and cumulative distribution function (CDF) analyses.
A proper data processing has been shown to be essential for the accurate characterization of the diffusive motion. With an adequate MSD and CDF analyses, a multiple-mode diffusion of the cyclic and dicyclic polymers in the melt and semi-dilute solution of the linear polymer chains has been revealed,14-16 suggesting the significant effects of the topological states of the polymers on the diffusive motion of the chains under entangled conditions.17 While the experimental and analytical approaches to characterize the motion of the cyclic polymers are described in this protocol, the same method can be used to quantitatively characterize the diffusive motion in many other heterogeneous systems. The approach would be especially suitable when multiple diffusion components existing in the samples are to be analyzed.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Synthese von mono- und bifunktionelle Poly (THF)
- Monofunktionellen Poly (THF)
- Flamme trocknen ein 2-Hals 100-ml-Rundkolben. Vakuum und füllt den Kolben mit Stickstoff (3 Zyklen).
- Hinzufügen destilliertem Tetrahydrofuran (THF) (50 ml) in den Kolben. Setzen Sie den Kolben in einem Wasserbad bei 20 ° C und die Temperatur ins Gleichgewicht.
- Hinzufügen Methyltriflat (0,5 mmol) in den Kolben mit einer Spritze. Rühren Sie die Mischung 5-10 min bei 20 ° C.
- Hinzufügen N -phenyl pyrrolidin (4-6 equiv.) In den Kolben mit einer Spritze. Rühren Sie die Mischung für 30-60 min.
- Entfernen Sie vollständig das Lösungsmittel unter vermindertem Druck (ca. 100 Torr). Löse den Rückstand in 3-5 ml Aceton. Fügen Sie die Acetonlösung in 300-500 ml n - Hexan. Filtern Sie den Niederschlag und trocknet ihn unter vermindertem Druck.
- Bifunktionelle poly (THF)
- Flamme trocknen ein 2-Hals 100-ml-Rundkolben. Vaumpumpe und füllen Sie den Kolben mit Stickstoff (3 Zyklen).
- Destilliertes THF (50 ml) in den Kolben. Setzen Sie den Kolben in einem Wasserbad bei 20 ° C und die Temperatur ins Gleichgewicht.
- Hinzufügen Trifluormethansulfonsäureanhydrid (0,3 mmol) in den Kolben mit einer Spritze. Rühren Sie die Mischung 5-10 min bei 20 ° C.
- Hinzufügen N -phenyl pyrrolidin (4-6 equiv.) In den Kolben mit einer Spritze. Rühren Sie die Mischung für 30-60 min.
- Entfernen Sie vollständig das Lösungsmittel unter vermindertem Druck (ca. 100 Torr). Löse den Rückstand in 3-5 ml Aceton. Fügen Sie die Acetonlösung auf 300-500 ml n - Hexan. Filtern Sie den Niederschlag und trocknet ihn unter vermindertem Druck.
2. Synthese von Perylendiimid-4 enthalten einarmigen Star und 8-förmigen dicyclic Poly (THF)
- Bewaffnete Stern Poly (THF)
- Ionenaustausch
- Auflösen Perylendiimid tetracarboxylat Natriumsalz in Wasser (10 mg / ml, 150 ml). Sich auflösenmonofunktionelle Poly (THF) in Aceton (160 mg / ml, 4 ml). Fügen Sie die Acetonlösung tropfenweise in die kräftig gerührt wässriger Lösung. Sammeln des gebildeten Niederschlag durch Filtration.
- Das obige Verfahren mit der gewonnene Niederschlag (2.1.1.1) viermal.
- Kovalente Fixierung
- Man löst den erhaltenen Niederschlag in Toluol (5 mg / ml). Ösophagealem Lösung für 4 Stunden.
- Entfernen Sie vollständig das Lösungsmittel unter vermindertem Druck (ca. 100 Torr). Filter mit dem Rückstand durch einen Pfropfen aus Kieselgel mit n - Hexan / Aceton (2/1 vol / vol). Fügen Sie die Lösung in eisgekühltes Wasser (300-500 ml), um das Produkt auszufällen. Sammle den Niederschlag durch Filtration.
- Ionenaustausch
- Dicyclische 8-förmigen Poly (THF)
- Ionenaustausch
- Auflösen Perylendiimid tetracarboxylat Natriumsalz in Wasser (6 mg / ml, 50 ml). Auflösen bifunktionellen poly (THF) (0,5 g) In 30 bis 50 ml Aceton. Fügen Sie die Acetonlösung tropfenweise in die kräftig gerührte wässrige Lösung bei 0 ° C. Sammeln des gebildeten Niederschlag durch Filtration.
- Das obige Verfahren mit der gewonnene Niederschlag (2.2.1.1).
- Kovalente Fixierung
- Man löst den erhaltenen Niederschlag in Toluol (0,05 g / L). Ösophagealem Lösung für 4 Stunden.
- Entfernen Sie vollständig das Lösungsmittel unter vermindertem Druck (ca. 100 Torr). In Toluol, um teilweise den Rückstand aufzulösen. Re-ausfällen in 300-500 ml n - Hexan.
- Filtern der gebildete Niederschlag durch einen Pfropfen aus Kieselgel mit n - Hexan / Aceton (2/1 vol / vol). Re-ausfällen in 300-500 ml Wasser.
- Reinige den gebildeten Niederschlag durch Säulenchromatographie unter Verwendung eines 18 Polystyrolgelsäulen. Weiteren Reinigung des Rohprodukts durch präparative Gelpermeationschromatographie (GPC) 19 mit einem Eluenten von CHCl 3 zu remOve Nebenprodukte durch den Brechungsindex (RI) und UV-Detektoren überwacht wird.
- Ionenaustausch
3. Einzelmolekül-Fluoreszenz-Imaging Experiment
- Probenvorbereitung
- Reinigung von Mikroskopdeckgläser
- Platz Nr 1.5 24 x 24 mm Mikroskop Abdeckung gleitet in einem Färbeküvette.
- 1 M Kaliumhydrid-Lösung (100 ml) in den Topf und beschallen für 15 min. Gießen Sie die Kalilauge durch Abgießen ab und spülen Sie die Deckgläser mit ultrareinem Wasser für mehrere Male. In spektroskopischer Qualität Ethanol (100 ml) in den Topf und beschallen für 15 min.
- Gießen Sie das Ethanol durch Abgießen und spülen Sie die Deckgläser mit ultrareinem Wasser für die mehrmals ab. Nach dem Gießen der ultrareinem Wasser durch Abgießen, wiederholen Sie den Schritt 3.1.1.2 ab.
- In ultrareinem Wasser in das Gefäß und beschallen für 15 min. Spülen Sie die Deckgläser mit ultrareinem Wasser für mehrere Male. Nehmen Sie die Deckgläser aus dem Glas heraus durch eine Kunststoff-Pinzette und trocknen Sie sie entweder durch trockene Luft oder trockenem Stickstoff.
- Herstellung von Polymerschmelze Proben 14,15
- Füge 100 & mgr; l nicht markiertes linearen Poly (THF) in einer Glasflasche und erhitzen Sie es auf eine Temperatur oberhalb des Schmelzpunktes (ca. 25 ° C) mit einem Fön.
- Man löst das Fluorophor eingebaut Polymer (linear, 4-armed Stern, zyklisch, oder 8-förmigen dicyclic synthetisiert in 2.1 und 2.2) in Chloroform (1 ml, 10 -6 M). 1 & mgr; l der Lösung zu den 100 ul der Schmelze der nicht-markierten linearen Poly (THF).
- Nach gründlichem der Probe mit einer Pipettenspitze Mischen verdunsten Chloroform, indem die Probe unter Verwendung eines Trockners erhitzt.
ANMERKUNG: Dies stellt eine Schmelze des nicht-markierten linearen Poly (THF) , das 10 -8 M der Fluorophor eingebaut Polymere. - Nehmen 10 ul der Probe unter Verwendung einer Mikropipette und dRop es auf einem gereinigten Deckglas. Setzen Sie eine andere gereinigte Deckglas auf die Probe und Sandwich die Probe zwischen den beiden Deckgläsern.
- Drücken Sie die Probe vorsichtig mit einem Kunststoff-Pinzette.
- Reinigung von Mikroskopdeckgläser
- Weitfeld - Fluoreszenz - Imaging - Setup 15
- Einführung eines Anregungslasers (488 nm) in den hinteren Anschluss des inversen Mikroskops
- Legen Sie eine Anregung Bandfilter und Polarisator in den Strahlengang.
- Erweitern des Strahls auf etwa 1 cm im Durchmesser von einem Strahlaufweiter.
- Legen Sie eine Viertelwellenplatte in den Strahlengang. Stellen Sie die optische Achse der Wellenplatte bei 45 Grad gegenüber derjenigen des Polarisators. Alternativ legen Sie eine Berek-Kompensator und stellen die optische Verzögerung / 4 & lgr;.
- Legen Sie eine Membran im Anregungsstrahlengang der Strahlgröße einzustellen.
- Vor der Einführung des Laserstrahls in den hinteren Anschluss des invertierten optischen microscope, legen Sie eine Fokussierlinse (plan-konvexe Linse, Brennweite ≈ 300 mm) an einer Stelle, wo der Laserstrahl aus der Objektivlinse kollimiert wird.
- Nach Reflektieren des Laserstrahls einen dichroitischen Spiegel auf einem Filterwürfel angebracht verwenden, führen den Laserstrahl auf die Probe durch eine hohe numerische Apertur (NA) Objektivlinse (zB NA 1,3, 100 - facher Vergrößerung, Eintauchen in Öl).
- Bringen Sie eine objektive Heizung auf die Objektivlinse und die Temperatur auf 30 ° C.
- Montieren der Probe auf der Stufe des invertierten Mikroskops
- Lassen Sie einen Tropfen Immersionsöl auf die Objektivlinse und montieren Sie die Probe auf dem Mikroskop Zustand.
- Sicherzustellen, daß die Probendicke von etwa 10 um durch Überprüfen der axialen Position der unteren und oberen Oberfläche der Probe erhalten wird.
- Stellen Sie den Fokus des Mikroskops auf wenige Mikrometer über der Bodenfläche der Probe.
- Erhalten zirkular polarisierte Anregungslicht unter der Objektivlinse
- Setzen Sie einen Polarisator in den gebündelten Laserstrahl aus der Objektivlinse.
- Aufzeichnen der Intensität des Lasers durch den Polarisator übertragen wird, indem ein Leistungsmesser nach dem Polarisator eingefügt. Notieren Sie sich die übertragene Laserleistung bei unterschiedlichen Polarisationswinkeln durch den Polarisator drehen.
- Wenn die übertragene Laserleistung bei allen Polarisationswinkel nicht konstant ist, drehen Sie leicht die Viertelwellenplatte oder Berek-Kompensator im Anregungsstrahlengang eingebracht.
- Wiederholen Sie Schritt 3.2.5.2 und 3.2.5.3 bis zum konstanten übertragen Laserleistung auf allen Polarisationswinkeln erhalten. Sicherzustellen, dass das zirkular polarisierte Licht an der Probe erhalten.
- Richten Sie die EM (Elektronenvervielfachungs) -charge Coupled Device (CCD) Kamera
- Bringen Sie den EM-CCD-Kamera an den Seitenanschluss des Mikroskops und verbinden Sie es mit ter Bildaufnahme-Software.
- Falls erforderlich, synchronisieren Sie die Kamera Belichtung mit einem mechanischen Verschluss oder akustooptischen im Anregungsstrahlengang eingefügt abstimmbaren Filter durch den Transistor-Transistor-Logik sendet (TTL) von der EM-CCD-Kamera erzeugten Signale an die Geräte. Alternativ synchronisieren die Kamerabelichtung durch Senden der TTL-Signale, die durch die EM-CCD-Kamera an den Laser an dem Laserausgang.
HINWEIS: Die letztere Möglichkeit ist nur dann anwendbar, wenn ein Festkörper-Laserleistung, dessen Ausgang durch die Eingangs Transistor-Transistor-Logik moduliert werden kann (TTL) Signale für das Experiment verwendet. - Tragen Sie eine EM-Verstärkung (typischerweise etwa 300) an der CCD-Kamera mit einer Software die Steuerung der Kamera, um eine hohe Qualität Fluoreszenzbild des einzelnen Fluorophore zu erhalten.
- Legen Sie eine Region of Interest (ROI) (in der Regel 128 x 128 Pixel in der Mitte des Sichtfeldes) unter Verwendung von Software, um die Kamera zu steuern.
ANMERKUNG: Dies ermöglicht die imaging Experimente an den Bildraten von 100 bis 200 Hz in dem Rahmenübertragungsmodus, der zur Sichtbarmachung der Bewegung der Fluorophor inkorporiert Polymerketten in der Schmelzprobe erforderlich ist.
- Einführung eines Anregungslasers (488 nm) in den hinteren Anschluss des inversen Mikroskops
- Das Ausführen des Experiments
- Optimierung der Versuchsbedingungen
- Stellen Sie den Beleuchtungsbereich der Probe auf etwa 20 um Durchmesser der Membran im Anregungsstrahlengang eingebracht werden.
- Stellen Sie die Anregungslaserleistung an der Probe auf 4 - 8 mW durch manuell im Anregungsstrahlengang eine geeignete Neutraldichtefilter (ND) eingefügt auswählen.
ANMERKUNG: Dies stellt die mittlere Laserleistung von 1 bis 2 kW cm -2 an der Probe. - Nehmen Fluoreszenzbilder der Probe an den Bildraten von 100 bis 200 Hz. Wenn die Fluoreszenzintensität der einzelnen Fluorophor eingebaut Polymere erhalten zu niedrig ist, schrittweise Erhöhung der Anregungsleistung th mite ND-Filter bis etwa 100 mW bei der Probe zu erreichen.
- Wenn die Qualität des Fluoreszenzbildes Einzelmolekül noch nicht zufrieden stellend ist, überprüfen Sie die Fluoreszenz Verunreinigungen in der Probe durch Fluoreszenz-Aufnahme von Bildern von einer reinen Schmelze des nicht-markierten Poly (THF). Im Falle einer hohen Fluoreszenzhintergrund beobachtet wird, verwenden verschiedene nicht-markierten Poly (THF).
- Wenn die Dichte des Fluoreszenzfleck von dem Fluorophor-inkorporiert Polymere in der Schmelze erhalten ist zu hoch, um sie räumlich zu isolieren (dies führt zu Fehlern in der Analyse der diffusiven Bewegung), verringern die Konzentration der Fluorophor inkorporiert Polymeren in der Probe, bis räumlich werden isolierte Flecken beobachtet.
- Wenn die Dichte des Fluoreszenzfleck von dem Fluorophor-Polymere eingearbeitet in die erhaltene Schmelze zu niedrig ist (dies führt zu einem geringen Durchsatz des Abbildungsexperiment), erhöhen die Konzentration der Fluorophor-Polymere eingearbeitet in die Probe bis zu einer appropriate Dichte des Fluoreszenz Stelle erreicht ist.
- Wenn die Fluoreszenzbilder von den Fluorophor eingebaut Polymere in der Schmelze erhalten verwischt werden, erhöhen Sie die Bildraten der Bilderfassung.
HINWEIS: Diese oft eine kleinere ROI erfordert, in der Regel 64 x 64 Pixel.
- Optimierung der Versuchsbedingungen
- Bildaufnahme
- Sobald die Versuchsbedingungen optimiert sind, lassen eine Stunde lang auf dem Mikroskoptisch montiert, die Probe so, dass die Probe Gleichgewichtsbedingungen erreicht.
- Nehmen Sie 500 - 1000 Fluoreszenzbildsequenzen der Fluorophor eingebaut Polymere im Schmelzzustand bei einer 100 - 200 Hz Bildrate. Wenn die Standard-Dateiformat TIFF nicht ist, konvertieren alle Bildsequenzen in das TIFF-Format.
4. Analyse der Diffusionsbewegung
- Mittlere quadratische Verschiebung (MSD) Analyse
- Zuschneiden der Fluoreszenzbildsequenzen in der Weisedass jede Bildsequenz eine einzelne und gut fokussierte Diffundieren Fluorophor eingebaut Polymer unter Verwendung von Bildverarbeitungssoftware, wie ImageJ enthält.
- Wenn die beschnittenen Bildsequenzen mehr als 10 Frames enthalten, teilen Sie die Bildsequenzen in mehrere Sequenzen, so dass jede Folge von 10 Bildern besteht.
- Bestimmen die Positionen der Moleküle in jeder Bildsequenzen genau durch zweidimensionale Gaußsche Anpassung der Bilder.
- Bestimmung der Diffusionskoeffizient (D) der einzelnen Moleküle durch mean-squared Verschiebung (MSD) Analyse der Diffusions Trajektorien (dh zeitabhängigen Positionen des Moleküls) unter Verwendung einer Gleichung 20
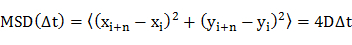
wobei x i und y i die Positionen des Moleküls in dem Bildrahmen i, und n mit dem Zeitablauf von & Delta; t - Rahmen die Rahmennummer i. - Zeichnen Sie die Diffusionskoeffizienten inein Frequenz Histogramm.
HINWEIS: In der Regel wird das Histogramm von mehr als 100 Molekülen aufgebaut.
- Kumulative Verteilungsfunktion (CDF) Analyse
HINWEIS: Eine CDF, P (r 2, i Δ t) entspricht der kumulative Wahrscheinlichkeit der Streumoleküle innerhalb eines Radius r vom Ursprung nach einer gewissen Zeitverzögerung zu finden i t & delta.- Berechnen Sie die eckigen Verschiebung, die während der Zeit der 1Δt nacheilt, 2Δt, ····, iΔt für alle Diffusions Trajektorien in 4.1.3 erhalten.
HINWEIS: Diese Berechnungen insgesamt m geben i eckigen Verschiebungen für die Zeit der iΔt nacheilt. - Berechnen Zahlen der eckigen Verschiebungen (l i) innerhalb von insgesamt m i Datensatzes, die kleiner als r 2 an verschiedenen r 2 -Werte (0 i vs r 2 Plots entsprechen der CDF, P (r 2, iΔt).
- Berechnen Sie die eckigen Verschiebung, die während der Zeit der 1Δt nacheilt, 2Δt, ····, iΔt für alle Diffusions Trajektorien in 4.1.3 erhalten.
- Analyse von CDF mit unterschiedlichen Diffusionsmodelle
Hinweis: Die erhaltenen CDF durch unterschiedliche Diffusionsmodelle montiert; homogene Diffusionsmodell wird mehrere Diffusionsmodus , in dem die D Verteilung durch eine Gauß'sche (single Gaußschen Modell) beschrieben ist, und mehrere Diffusionsmodus , in dem die Verteilung D durch mehrere Gaussian (multiple Gaußschen Modell) beschrieben.- Im homogenen Diffusionsmodell, bestimmen einen mittleren D durch die CDF Einpassen einer Gleichung 21 unter Verwendung von
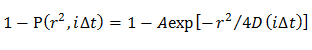
HINWEIS: Jede Abweichung von der Gleichung legt nahe, die heterogene Diffusion des Moleküls. - Im einzelnen Gaußschen Modell bestimmen , die Wahrscheinlichkeitsverteilung von D beschrieben durch eine Gauß (f (D)) durch die CDF Beschlag 15 unter Verwendung
on3 "src =" / files / ftp_upload / 54503 / 54503equation3.jpg "/>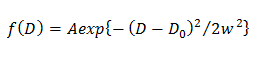
wobei A, W und D 0 die Amplitude, Breite und Mitte der Gaußschen. - In dem Doppel Gauß - Modell, bestimmen die Wahrscheinlichkeitsverteilung der j - ten Komponente des D beschrieben durch eine Gauß (f (D)) durch die CDF Beschlag 14 unter Verwendung von
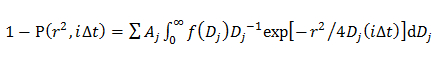

wobei A j der Anteil jedes Diffusionskomponente und α j, w j und D j 0 sind die Amplitude, Breite und Mitte der j - ten Komponente des Gaußschen.
- Im homogenen Diffusionsmodell, bestimmen einen mittleren D durch die CDF Einpassen einer Gleichung 21 unter Verwendung von
- Die Berechnung der theoretischen Wahrscheinlichkeit distriteilung der Diffusionskoeffizient
HINWEIS: Die Wahrscheinlichkeitsverteilungen von D auftritt aufgrund der statistischen Fehler (p (D) d D) für die unterschiedlichen Diffusionsmodellen berechnet; homogene Diffusionsmodell wird mehrere Diffusionsmodus , in dem die D Verteilung durch eine Gauß'sche (single Gaußschen Modell) beschrieben ist, und mehrere Diffusionsmodus , in dem die Verteilung D durch mehrere Gaussian (multiple Gaußschen Modell) beschrieben.- Im homogenen Diffusionsmodell, die Berechnung der statistischen Wahrscheinlichkeitsverteilung von D eine Gleichung 22 unter Verwendung
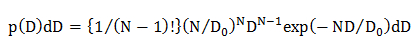
wobei N die Anzahl der Datenpunkte in einer Diffusions Trajektorie (N = 10, siehe 4.1.2) ist, 0 D ist die mittlere Diffusionskoeffizienten (von der CDF - Analyse bestimmt, siehe 4.2.3.1) und D ist die experimentell erhaltene Diffusionskoeffizient für eine einzelne Bahn. - In demeinzelne Gauß - Diffusionsmodell, die Berechnung der statistischen Wahrscheinlichkeitsverteilung von D unter Verwendung einer Gleichung 15

wobei f (D) von dem CDF - Analyse (siehe 4.2.3.2) bestimmt Wahrscheinlichkeitsverteilung von D darstellt, und D 0 die mittlere Diffusionskoeffizienten (von der CDF - Analyse bestimmt, siehe 4.2.3.2). - In der Doppel Gaussian Diffusionsmodell, die Berechnung der statistischen Wahrscheinlichkeitsverteilung von D unter Verwendung einer Gleichung 14

wobei f (D j) von dem CDF - Analyse Wahrscheinlichkeitsverteilung der j - ten Komponente des D (D j) bestimmt bezeichnet (siehe 4.2.3.3) und D 0j ist die mittlere Diffusionskoeffizient des j - ten Komponente (der CDF bestimmt Analyse siehe 4.2.3.3).
- Im homogenen Diffusionsmodell, die Berechnung der statistischen Wahrscheinlichkeitsverteilung von D eine Gleichung 22 unter Verwendung
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die Perylendiimid-4 enthalten einarmigen Stern und 8-förmigen dicyclic Poly (THF) s wurden unter Verwendung der elektrostatische Selbstorganisation und kovalente Fixierung synthetisiert (ESA-CF) Prozess (Abbildung 1, Abbildung 2). Zeitraffer-Einzelmolekül - Fluoreszenzbilder wurden für die 4-armed (Abbildung 3a) gemessen und 8-förmigen (Abbildung 3b) Polymere. Die Zeitraffer-Fluoreszenzbilder (Abbildung 3)
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die 4-armed und 8 förmige Polymere wurden über die ESA-CF - Protokoll (1) hergestellt, die ein kritischer Schritt für die Synthese ist. 12,24 mono- und bifunktionelle lineare Poly (THF) s mit N -phenylpiperidinium Endgruppen waren nach dem vorstehenden Verfahren synthetisiert. 11 der Ionenaustausch wurde durch Umfällung aus einer Aceton - Lösung eines Polymervorläufers mit Triflat Gegenanionen in eine wässrige Lösung , die eine überschüssige Menge an carboxylat d...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by a Grant-in-Aid for Scientific Research No. 22750122 (S.H.), No. 26288099 (T.Y.), and No. 23350050 (Y.T.) of the Japan Society for the Promotion of Science. S.H. is grateful for The Kurata Memorial Hitachi Science and Technology Foundation. The research reported in this publication was supported by the King Abdullah University of Science and Technology (S.H.).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Materials | |||
| THF | Godo | ||
| Wakosil C-300 | Wako Pure Chemical Industries | ||
| Acetone | Godo | ||
| Toluene | Godo | ||
| n-Hexane | Godo | ||
| CHCl3 | Kanto Chemical | ||
| Bio-Beads S-X1 | Bio-Rad | ||
| Methyl triflate | Nacalai Tesque | ||
| Triflic anhydride | Nacalai Tesque | ||
| Potassium Hydroxide | Wako Pure Chemical Industries | ||
| Ethanol | Wako Pure Chemical Industries | ||
| Poly(tetrahydrofuran) | Aldrich | ||
| Chloroform | Wako Pure Chemical Industries | ||
| Immersion oil | Cargille | Type 37 / Type A | |
| Equipment | |||
| 2-Neck 100-ml round-bottom flask | |||
| Flask | |||
| Beaker | |||
| Funnel | |||
| Filter paper | Whatman | ||
| Reflux condenser | |||
| Syringe | |||
| Water bath | |||
| Magnetic stirrer | |||
| Rotary evaporator | |||
| Microscope cover slips (24 x 24 mm, No. 1) | Matsunami Glass | CO22241 | |
| Staining jar | AS ONE Corporation | 1-7934-01 | |
| Ultrasonic cleaner | VWR International | 142-0047 | |
| Inverted microscope | Olympus | IX71 | |
| Ar-Kr ion laser | Coherent | Innova 70C | |
| Berek compensator | Newport | 5540 | |
| Excitation filter | Semrock | LL01-488-12.5 | |
| Dichloric mirror | Omega optical | 500DRLP | |
| Emission filter | Semrock | BLP01-488R-25 | |
| Lens and mirror | Thorlabs | ||
| EM-CCD camera | Andor Technology | iXon | |
| Objective lens (100X, N.A. = 1.3) | Olympus | UPLFLN 100XOP | |
| Objective heater | Bioptechs | ||
| Preparative GPC | Japan Analytical Industry | LC-908 |
Referenzen
- Honda, S., Yamamoto, T., Tezuka, Y. Topology-Directed Control on Thermal Stability: Micelles Formed from Linear and Cyclized Amphiphilic Block Copolymers. J. Am. Chem. Soc. 132 (30), 10251-10253 (2010).
- Honda, S., Yamamoto, T., Tezuka, Y. Tuneable enhancement of the salt and thermal stability of polymeric micelles by cyclized amphiphiles. Nat. Commun. 4, (2013).
- Jun, S., Mulder, B. Entropy-driven spatial organization of highly confined polymers: Lessons for the bacterial chromosome. Proc. Natl. Acad. Sci. U. S. A. 103 (33), 12388-12393 (2006).
- McLeish, T. Polymers without beginning or end. Science. 297 (5589), 2005-2006 (2002).
- McLeish, T. Polymer dynamics: Floored by the rings. Nat. Mater. 7 (12), 933-935 (2008).
- Roovers, J. Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. Tezuka, Y. , World Scientific Publishing Co. Pte. Ltd. 137-156 (2013).
- Klein, J. Evidence for reptation in an entangled polymer melt. Nature. 271 (5641), 143-145 (1978).
- Leger, L., Hervet, H., Rondelez, F. Reptation in entangled polymer-solutions by forced rayleigh light-scattering. Macromolecules. 14 (6), 1732-1738 (1981).
- von Meerwall, E. D., Amis, E. J., Ferry, J. D. Self-diffusion in solutions of polystyrene in tetrahydrofuran - comparison of concentration dependences of the diffusion-coefficients of polymers, and a ternary probe component. Macromolecules. 18 (2), 260-266 (1985).
- Kapnistos, M., et al. Unexpected power-law stress relaxation of entangled ring polymers. Nat. Mater. 7 (12), 997-1002 (2008).
- Adachi, K., Takasugi, H., Tezuka, Y. Telechelics having unstrained cyclic ammonium salt groups for electrostatic polymer self-assembly and ring-emitting covalent fixation. Macromolecules. 39 (17), 5585-5588 (2006).
- Oike, H., Imaizumi, H., Mouri, T., Yoshioka, Y., Uchibori, A., Tezuka, Y. Designing unusual polymer topologies by electrostatic self-assembly and covalent fixation. J. Am. Chem. Soc. 122 (40), 9592-9599 (2000).
- Yamamoto, T., Tezuka, Y. Topological polymer chemistry: a cyclic approach toward novel polymer properties and functions. Polym. Chem. 2 (9), 1930-1941 (2011).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Tezuka, Y. Single-molecule imaging reveals topological isomer-dependent diffusion by 4-armed star and dicyclic 8-shaped polymers. Polym. Chem. 6 (22), 4109-4115 (2015).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Vacha, M., Tezuka, Y. Single-Molecule Study on Polymer Diffusion in a Melt State: Effect of Chain Topology. Anal. Chem. 85 (15), 7369-7376 (2013).
- Habuchi, S., Satoh, N., Yamamoto, T., Tezuka, Y., Vacha, M. Multimode Diffusion of Ring Polymer Molecules Revealed by a Single-Molecule Study. Angew. Chem. Int. Ed. 49 (8), 1418-1421 (2010).
- Habuchi, S. Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. Tezuka, Y. , World Scientific. 265-290 (2013).
- Fernandez, P., Bayona, J. M. Use of off-line gel-remeation chromatography normal-phase liquid-chromatography fro the determination of polycyclic aromatic-compounds in environmental-samples and standard reference materials (air particulate matter and marine sediment). J. Chromatogr. 625 (2), 141-149 (1992).
- Biesenberger, J. A., Tan, M., Duvdevan, I., Maurer, T. Recycle gel permeation chromatography. 1. recycle principle and design. J. Polym. Sci. Pol. Lett. 9 (5), 353(1971).
- Kusumi, A., Sako, Y., Yamamoto, M. Confined lateral diffusion of membrane-receptors as studied by single-particle tracking (nanovid microscopy) - effects of calcium-induced differentiation in cultured epithelial-cells. Biophys. J. 65 (5), 2021-2040 (1993).
- Schutz, G. J., Schindler, H., Schmidt, T. Single-molecule microscopy on model membranes reveals anomalous diffusion. Biophys. J. 73 (2), 1073-1080 (1997).
- Vrljic, M., Nishimura, S. Y., Brasselet, S., Moerner, W. E., McConnell, H. M. Translational diffusion of individual class II MHC membrane proteins in cells. Biophys. J. 83 (5), 2681-2692 (2002).
- Margineanu, A., et al. Photophysics of a water-soluble rylene dye: Comparison with other fluorescent molecules for biological applications. J. Phys. Chem. B. 108 (32), 12242-12251 (2004).
- Tezuka, Y., Oike, H. Self-assembly and covalent fixation for topological polymer chemistry. Macromol. Rapid Commun. 22 (13), 1017-1029 (2001).
- Deres, A., et al. The Origin of Heterogeneity of Polymer Dynamics near the Glass Temperature As Probed by Defocused Imaging. Macromolecules. 44 (24), 9703-9709 (2011).
- Flier, B. M. I., et al. Heterogeneous Diffusion in Thin Polymer Films As Observed by High-Temperature Single-Molecule Fluorescence Microscopy. J. Am. Chem. Soc. 134 (1), 480-488 (2012).
- Habuchi, S., Oba, T., Vacha, M. Multi-beam single-molecule defocused fluorescence imaging reveals local anisotropic nature of polymer thin films. Phys. Chem. Chem. Phys. 13 (15), 6970-6976 (2011).
- Zettl, U., et al. Self-Diffusion and Cooperative Diffusion in Semidilute Polymer Solutions As Measured by Fluorescence Correlation Spectroscopy. Macromolecules. 42 (24), 9537-9547 (2009).
- Kirstein, J., Platschek, B., Jung, C., Brown, R., Bein, T., Brauchle, C. Exploration of nanostructured channel systems with single-molecule probes. Nat. Mater. 6 (4), 303-310 (2007).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten