È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sintesi di ciclici polimeri e caratterizzazione di loro moto diffusivo allo stato fuso alla molecola Piano unico
In questo articolo
Riepilogo
Un protocollo per la sintesi e la caratterizzazione di moto diffusivo di polimeri ciclici a livello di singola molecola è presentato.
Abstract
We demonstrate a method for the synthesis of cyclic polymers and a protocol for characterizing their diffusive motion in a melt state at the single molecule level. An electrostatic self-assembly and covalent fixation (ESA-CF) process is used for the synthesis of the cyclic poly(tetrahydrofuran) (poly(THF)). The diffusive motion of individual cyclic polymer chains in a melt state is visualized using single molecule fluorescence imaging by incorporating a fluorophore unit in the cyclic chains. The diffusive motion of the chains is quantitatively characterized by means of a combination of mean-squared displacement (MSD) analysis and a cumulative distribution function (CDF) analysis. The cyclic polymer exhibits multiple-mode diffusion which is distinct from its linear counterpart. The results demonstrate that the diffusional heterogeneity of polymers that is often hidden behind ensemble averaging can be revealed by the efficient synthesis of the cyclic polymers using the ESA-CF process and the quantitative analysis of the diffusive motion at the single molecule level using the MSD and CDF analyses.
Introduzione
Cyclic polymers are unique in that they do not have chain ends. They often exhibit unusual behaviors which is distinct from their linear counterpart, including increased thermal stability of polymer micelles by a linear-to-cyclic conversion,1,2 and spatial organization of DNA in bacterial cells by a loop formation.3 Topological interactions between the cyclic chains are believed to be the critical factor for such unusual behaviors.4,5 Therefore, characterizing the motion and relaxation of cyclic polymers under entangled conditions has been an important research topic in polymer science for decades.6
Cyclic polymer dynamics has been investigated using both synthetic and naturally occurring molecules by means of ensemble averaged experimental methods such as nuclear magnetic resonance (NMR), light scattering, and viscosity measurements.7-9 However, these studies often suffer from impurity molecules in the samples.10 Furthermore, spatiotemporal heterogeneities of the motion of individual molecules caused by inherent structural heterogeneity of entangled polymers are often hidden behind the ensemble averaging in these studies. In order to characterize molecular level dynamics of cyclic polymers, a synthesis method that provides high purity cyclic polymers and an experimental and analysis methods that allow for quantitative characterization of molecular motion at the single molecule level have to be developed. Here, we will show a method to synthesize high-purity cyclic and dicyclic poly(THF)s that incorporate a fluorophore unit using an electrostatic self-assembly and covalent fixation (ESA-CF) process11-13 and a method to analyze the motion of the individual fluorophore-incorporated polymer chains using a combination of mean-squared displacement (MSD) and cumulative distribution function (CDF) analyses.
A proper data processing has been shown to be essential for the accurate characterization of the diffusive motion. With an adequate MSD and CDF analyses, a multiple-mode diffusion of the cyclic and dicyclic polymers in the melt and semi-dilute solution of the linear polymer chains has been revealed,14-16 suggesting the significant effects of the topological states of the polymers on the diffusive motion of the chains under entangled conditions.17 While the experimental and analytical approaches to characterize the motion of the cyclic polymers are described in this protocol, the same method can be used to quantitatively characterize the diffusive motion in many other heterogeneous systems. The approach would be especially suitable when multiple diffusion components existing in the samples are to be analyzed.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Sintesi di monofunzionale e bifunzionale Poly (THF)
- Poly monofunzionali (THF)
- Fiamma asciugare un pallone a 2-collo da 100 ml. Aspirare e riempire il pallone con azoto (3 cicli).
- Aggiungere tetraidrofurano distillato (THF) (50 ml) al pallone. Mettere il pallone in un bagno di acqua a 20 ° C ed equilibrare la temperatura.
- Aggiungere triflato metile (0,5 mmol) al pallone da una siringa. Mescolare la miscela per 5-10 minuti a 20 ° C.
- Aggiungere N fenil pirrolidina (4-6 equiv.) Al pallone da una siringa. Lavorare l'impasto per 30-60 min.
- Rimuovere completamente il solvente a pressione ridotta (circa 100 Torr). Sciogliere il residuo in 3-5 ml di acetone. Aggiungere la soluzione di acetone in 300-500 ml di n esano. Filtrare il precipitato e asciugare sotto pressione ridotta.
- Poli bifunzionale (THF)
- Fiamma asciugare un pallone a 2-collo da 100 ml. Vacuum e riempire il pallone con azoto (3 cicli).
- Aggiungere THF distillata (50 ml) al pallone. Mettere il pallone in un bagno di acqua a 20 ° C ed equilibrare la temperatura.
- Aggiungere anidride triflica (0,3 mmol) al pallone da una siringa. Mescolare la miscela per 5-10 minuti a 20 ° C.
- Aggiungere N fenil pirrolidina (4-6 equiv.) Al pallone da una siringa. Lavorare l'impasto per 30-60 min.
- Rimuovere completamente il solvente a pressione ridotta (circa 100 Torr). Sciogliere il residuo in 3-5 ml di acetone. Aggiungere la soluzione di acetone a 300-500 ml di n esano. Filtrare il precipitato e asciugare sotto pressione ridotta.
a forma di 8 2. Sintesi di Perilene diimide-incorporato 4 armata Star e Dicyclic Poli (THF)
- Armato poli stella (THF)
- Scambio ionico
- Sciogliere perilene diimide tetracarbossilato sale di sodio in acqua (10 mg / ml, 150 ml). Scioglierepoly monofunzionale (THF) in acetone (160 mg / ml, 4 ml). Aggiungere goccia a goccia una soluzione di acetone nella soluzione acquosa agitata vigorosamente. Raccogliere il precipitato formatosi mediante filtrazione.
- Ripetere la procedura di cui sopra con il precipitato recuperato (2.1.1.1) quattro volte.
- fissazione covalente
- Sciogliere il precipitato ottenuto in toluene (5 mg / ml). Riflusso soluzione per 4 ore.
- Rimuovere completamente il solvente a pressione ridotta (circa 100 Torr). Filtrare il residuo attraverso un tampone di gel di silice con n esano / acetone (2/1 vol / vol). Aggiungere la soluzione in acqua raffreddata con ghiaccio (300-500 ml) per precipitare il prodotto. Raccogliere il precipitato per filtrazione.
- Scambio ionico
- Poly forma di 8 Dicyclic (THF)
- Scambio ionico
- Sciogliere perilene diimide tetracarbossilato sale di sodio in acqua (6 mg / ml, 50 ml). Sciogliere poli bifunzionale (THF) (0,5 g) In 30-50 ml di acetone. Aggiungere goccia a goccia una soluzione di acetone nella soluzione acquosa vigorosamente agitata a 0 ° C. Raccogliere il precipitato formatosi mediante filtrazione.
- Ripetere la procedura di cui sopra con il precipitato recuperato (2.2.1.1).
- fissazione covalente
- Sciogliere il precipitato ottenuto in toluene (0,05 g / L). Riflusso soluzione per 4 ore.
- Rimuovere completamente il solvente a pressione ridotta (circa 100 Torr). Aggiungere toluene per sciogliere parzialmente il residuo. Re-precipitare in 300-500 ml di n esano.
- Filtrare il precipitato formato attraverso un tappo di gel di silice con n esano / acetone (2/1 vol / vol). Re-precipitare in 300-500 ml di acqua.
- Purificare il precipitato formato mediante cromatografia in colonna 18 utilizzando un gel di polistirene. Ulteriori purificare il prodotto grezzo da preparativa cromatografia a permeazione (GPC) 19 con un eluente di CHCl 3 a remsottoprodotti ove monitorando indice di rifrazione (RI) e rivelatori di raggi UV.
- Scambio ionico
3. singola molecola di imaging di fluorescenza Experiment
- preparazione del campione
- Pulizia del microscopio copertura scivola
- Posizionare la copertura mm microscopio No. 1.5 24 x 24 scivola in una vaschetta di colorazione.
- Aggiungere la soluzione idruro 1 M di potassio (100 ml) nel vaso e ultrasuoni per 15 min. Eliminare la soluzione di idrossido di potassio per decantazione e risciacquare le scivola coprire con acqua ultra-pura per diverse volte. Aggiungere spettroscopica etanolo (100 ml) nel vaso e ultrasuoni per 15 min.
- Eliminare l'etanolo per decantazione e risciacquare le scivola coprire con acqua ultra-pura per diverse volte. Dopo aver versato l'acqua ultra-pura per decantazione, ripetere il passo 3.1.1.2.
- Aggiungere l'acqua ultra-pura al barattolo e ultrasuoni per 15 minuti. Sciacquare i vetrini con acqua ultra-pura per diverse volte. Estrarre i vetrini dal vaso da una pinzetta di plastica e asciugarle con o aria secca o azoto secco.
- Preparazione dei campioni polimero fuso 14,15
- Aggiungere 100 ml di poli lineari non marcato (THF) in una bottiglia di vetro e riscaldarlo ad una temperatura superiore al punto di fusione (circa 25 ° C) usando un asciugacapelli.
- Sciogliere il polimero fluoroforo-incorporato (lineare, stella 4 bracci, ciclico, o dicyclic a forma di 8 sintetizzato in 2.1 e 2.2) in cloroformio (1 ml, 10 -6 M). Aggiungere 1 ml di soluzione per 100 ml di fusione del poli lineari non-marcato (THF).
- Dopo aver accuratamente la miscelazione del campione con un puntale, evapora il cloroformio riscaldando il campione utilizzando un essiccatore.
NOTA: Questo fornisce una colata del poli non marcato lineare (THF) contenente 10 -8 M dei polimeri fluoroforo incorporato. - Prendere 10 microlitri del campione usando un micro-pipetta e dRop su un vetrino pulito. Mettere un altro vetrino pulito sul campione e panino il campione tra le due coprioggetto.
- Premere il campione delicatamente con una pinzetta di plastica.
- Pulizia del microscopio copertura scivola
- Wide-field configurazione imaging di fluorescenza 15
- Introduzione di un laser di eccitazione (488 nm) nella porta posteriore del microscopio invertito
- Inserire un filtro passa-banda di eccitazione e polarizzatore nel percorso ottico.
- Espandere il fascio di circa 1 cm di diametro con un espansore del fascio.
- Inserire una lastra quarto d'onda nel percorso ottico. Impostare l'asse ottico del piatto dell'onda a 45 gradi rispetto a quello del polarizzatore. In alternativa, inserire un compensatore Berek e impostare il ritardo ottica di lambda / 4.
- Inserire un diaframma nel percorso del fascio di eccitazione per regolare la dimensione del fascio.
- Prima di introdurre il raggio laser nella porta posteriore del microsco ottica invertitape, inserire una lente di focalizzazione (lente piano-convessa, lunghezza focale ≈ 300 mm) in una posizione in cui viene collimato il raggio laser dalla lente obiettivo.
- Dopo che riflette il fascio laser utilizzando uno specchio dicroico montato su un cubo filtro, introdurre il raggio laser il campione attraverso un'alta apertura numerica (NA) lente obiettivo (per esempio, NA 1.3, ingrandimento 100X, immersione in olio).
- Attaccare un riscaldatore obiettivo di lente obiettivo e impostare la temperatura a 30 ° C.
- Montaggio del campione sul palco del microscopio invertito
- Goccia una goccia di olio per immersione sulla lente dell'obiettivo e montare il campione sullo stato microscopio.
- Assicurarsi che lo spessore del campione di circa 10 micron è ottenuta controllando la posizione assiale della superficie inferiore e superiore del campione.
- Regolare il fuoco del microscopio per pochi micrometri sopra la superficie inferiore del campione.
- Ottenere luce di eccitazione polarizzata circolarmente sotto la lente dell'obiettivo
- Inserire un polarizzatore il raggio laser collimato dalla lente dell'obiettivo.
- Registrare l'intensità del laser trasmesso attraverso il polarizzatore inserendo un misuratore di potenza dopo il polarizzatore. Registrare la potenza del laser trasmessa a diversi angoli di polarizzazione ruotando il polarizzatore.
- Se la potenza del laser trasmesso non è costante per tutti gli angoli di polarizzazione, ruotare leggermente la piastra a quarto d'onda o Berek compensatore inserito nel percorso del fascio di eccitazione.
- Ripetere il passaggio 3.2.5.2 e 3.2.5.3 fino a quando la potenza del laser trasmessa costante è ottenuto a tutti gli angoli di polarizzazione. Assicurarsi che la luce polarizzata circolarmente si ottiene il campione.
- Imposta la EM (moltiplicazione degli elettroni) -Charge Coupled Device (CCD) fotocamera
- Fissare la telecamera EM-CCD alla porta laterale del microscopio e collegarlo a tegli software di acquisizione immagini.
- Se necessario, sincronizzare l'esposizione fotocamera a un otturatore meccanico o un filtro acusto-ottico sintonizzabile inserito nel percorso del fascio di eccitazione inviando logica transistor-transistor (TTL) segnali generati dalla telecamera EM-CCD ai dispositivi. In alternativa, sincronizzare l'esposizione fotocamera all'uscita laser inviando i segnali TTL generati dalla telecamera EM-CCD al laser.
NOTA: L'ultima opzione è applicabile solo quando un laser a stato solido la cui potenza di uscita può essere modulata dalla logica transistore-transistore di ingresso (TTL) segnali viene utilizzata per l'esperimento. - Applicare un guadagno EM (tipicamente di circa 300) alla camera CCD utilizzando software di controllo della telecamera in modo da ottenere un'immagine di fluorescenza di alta qualità del singolo fluoroforo.
- Impostare una regione di interesse (ROI) (tipicamente 128 x 128 pixel al centro del campo visivo) utilizzando software di controllo della telecamera.
NOTA: Questo permette la Imagiesperimenti ng ai frame rate da 100 - 200 Hz in modalità di trasferimento telaio, che è richiesto per visualizzare il movimento delle catene polimeriche fluoroforo incorporato nel campione melt.
- Introduzione di un laser di eccitazione (488 nm) nella porta posteriore del microscopio invertito
- Esecuzione dell'esperimento
- Ottimizzando le condizioni sperimentali
- Regolare la zona di illuminazione del campione a circa 20 micron di diametro utilizzando il diaframma inserito nel percorso ottico di eccitazione.
- Impostare la potenza del laser di eccitazione al campione 4 - 8 mW selezionando manualmente un filtro appropriato densità neutra (ND) inserito nel percorso del fascio di eccitazione.
NOTA: Questo fornisce la potenza del laser medio di 1 - 2 kW cm -2 al campione. - Per registrare immagini di fluorescenza del campione ai frame rate di 100-200 Hz. Se l'intensità di fluorescenza ottenute dai singoli polimeri fluoroforo incorporata è troppo bassa, aumentare gradualmente la potenza di eccitazione utilizzando the ND filtro fino a raggiungere circa 100 mW a campione.
- Se la qualità dell'immagine di fluorescenza singola molecola non è ancora soddisfacente, controllare le impurità fluorescenza del campione registrando immagini di fluorescenza di una fusione pura del poli non marcato (THF). Nel caso in cui si osserva uno sfondo di fluorescenza, utilizzare diversi poli non etichettati (THF).
- Se la densità dello spot di fluorescenza ottenute dai polimeri fluoroforo incorporato nella massa fusa è troppo alta per loro (ciò causa errori nell'analisi del moto diffusivo) isolare spazialmente, diminuire la concentrazione dei polimeri fluoroforo incorporato nel campione finché spazialmente sono osservate macchie isolate.
- Se la densità dello spot di fluorescenza ottenute dai polimeri fluoroforo incorporato nella massa fusa è troppo bassa (ciò provoca una bassa produttività dell'esperimento di imaging), aumentare la concentrazione dei polimeri fluoroforo incorporato nel campione finché un approprsi raggiunge la densità iate dello spot di fluorescenza.
- Se le immagini di fluorescenza ottenuti dai polimeri fluoroforo incorporato nella massa fusa sono sfocate, aumentare il frame rate di acquisizione delle immagini.
NOTA: Questo richiede spesso un ROI più piccolo, di solito 64 x 64 pixel.
- Ottimizzando le condizioni sperimentali
- Acquisizione dell'immagine
- Una volta che le condizioni sperimentali sono ottimizzate, lasciare il campione montato sul palco microscopio per un'ora in modo che il campione raggiunge condizioni di equilibrio.
- Registrate 500 - 1.000 sequenze di immagini di fluorescenza dei polimeri fluoroforo incorporato allo stato fuso in un 100-200 Hz cornice rate. Se il formato file predefinito non è TIFF, convertire tutte le sequenze di immagini in formato TIFF.
4. Analisi del movimento diffusivo
- Spostamento quadratico medio (MSD) Analisi
- Raccolto le sequenze di immagini di fluorescenza in modoche ogni sequenza di immagini contiene un polimero diffonde utilizzando il software di elaborazione singola e ben focalizzato fluoroforo-incorporato immagine, come ad esempio ImageJ.
- Quando le sequenze di immagini ritagliate contengono più di 10 fotogrammi, dividere le sequenze di immagini in più sequenze in modo tale che ogni sequenza è composta da 10 fotogrammi.
- Determinare le posizioni delle molecole in ogni sequenze di immagini accuratamente da bidimensionale montaggio gaussiana delle immagini.
- Determinare il coefficiente di diffusione (D) di singole molecole mediante spostamento (MSD) analisi quadratico medio delle traiettorie di diffusione (cioè posizioni dipendenti dal tempo della molecola) utilizzando un'equazione 20
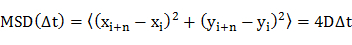
dove x i ey i sono le posizioni della molecola nella trama dell'immagine i, e n denota il numero di frame con il lasso di tempo Dt dal telaio i. - Tracciare i coefficienti di diffusione inun istogramma di frequenza.
NOTA: Tipicamente, l'istogramma è costruito da più di 100 molecole.
- Funzione di distribuzione cumulativa (CDF) Analisi
NOTA: A CDF, P (r 2, i Δ t) corrisponde alla probabilità cumulativa di trovare le molecole che diffondono entro un raggio r dall'origine dopo un certo lasso di tempo i Δ t.- Calcolare il quadrato-spostamento che si verificano durante il tempo di ritardo di 1Δt, 2Δt, ····, iΔt per tutte le traiettorie di diffusione ottenuti in 4.1.3.
NOTA: Questi calcoli danno m totale i squadrata spostamenti per il tempo in ritardo di iΔt. - Calcolare il numero dei-spostamenti quadrati (L i) all'interno di set di dati m i totali che sono più piccoli r 2 a differenti valori di R 2 (0 i vs R 2 trame corrispondono alla CDF, P (R 2, iΔt).
- Calcolare il quadrato-spostamento che si verificano durante il tempo di ritardo di 1Δt, 2Δt, ····, iΔt per tutte le traiettorie di diffusione ottenuti in 4.1.3.
- L'analisi di CDF con modelli di diffusione distinti
Nota: I CDF ottenuti sono montati dai modelli di diffusione distinti; modello omogeneo diffusione, molteplici modalità di diffusione nel quale la distribuzione D è descritta da un (unico modello gaussiano) gaussiana, e molteplici modalità di diffusione in cui la distribuzione D è descritta da più gaussiana (multipla modello gaussiana).- Nel modello di diffusione omogenea, determinare una media D inserendo la CDF utilizzando un'equazione 21
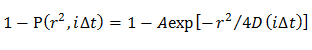
NOTA: Qualsiasi deviazione dalla equazione suggerisce la diffusione eterogenea della molecola. - Nel modello Gaussiano singolo, determinare la distribuzione di probabilità di D descritta da una gaussiana (f (D)) inserendo la CDF utilizzando 15
on3 "src =" / files / ftp_upload / 54503 / 54503equation3.jpg "/>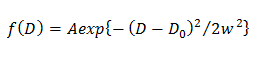
dove A, w, e D 0 sono l'ampiezza, la larghezza e il centro della gaussiana. - Nel modello doppia gaussiana, determinare la distribuzione di probabilità di j esima componente D descritta da una gaussiana (f (D)) inserendo la CDF utilizzando 14
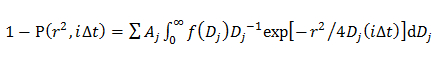

dove A j è la frazione di ciascun componente di diffusione, e α j, w j, e D 0 j sono l'ampiezza, la larghezza e il centro della j esima componente della gaussiana.
- Nel modello di diffusione omogenea, determinare una media D inserendo la CDF utilizzando un'equazione 21
- Calcolo del distri probabilità teoricabuto di coefficiente di diffusione
NOTA: Le distribuzioni di probabilità di D che si verificano a causa degli errori statistici (p (D) d D) sono calcolati per i diversi modelli di diffusione; modello omogeneo diffusione, molteplici modalità di diffusione nel quale la distribuzione D è descritta da un (unico modello gaussiano) gaussiana, e molteplici modalità di diffusione in cui la distribuzione D è descritta da più gaussiana (multipla modello gaussiana).- Nel modello di diffusione omogenea, calcolare la distribuzione di probabilità statistica di D utilizzando un'equazione 22
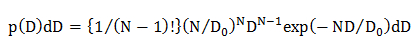
dove N è il numero di punti di dati in una traiettoria di diffusione (N = 10, vedere 4.1.2), D 0 è il coefficiente medio di diffusione (determinato mediante analisi CDF, vedere 4.2.3.1), e D è il sperimentalmente ottenuto coefficiente di diffusione per una traiettoria individuale. - Nelsingolo modello di diffusione gaussiana, calcolare la distribuzione di probabilità statistica di D utilizzando un'equazione 15

dove f (D) indica distribuzione di probabilità di D determinata dall'analisi CDF (vedi 4.2.3.2), e D 0 è il coefficiente medio di diffusione (determinato mediante analisi CDF, vedere 4.2.3.2). - Nel modello di diffusione gaussiana doppio, calcolare la distribuzione di probabilità statistica di D utilizzando un'equazione 14

dove f (D j) indica distribuzione di probabilità del j esima componente D (D j) determinato dall'analisi CDF (vedi 4.2.3.3), e D 0j è il coefficiente medio di diffusione del j esima componente (determinata dal CDF analisi, vedi 4.2.3.3).
- Nel modello di diffusione omogenea, calcolare la distribuzione di probabilità statistica di D utilizzando un'equazione 22
Access restricted. Please log in or start a trial to view this content.
Risultati
Il perylene diimide-incorporato stella 4 armata e forma-8 poli dicyclic (THF) s sono stati sintetizzati utilizzando il elettrostatica auto-assemblaggio e covalente fissaggio (ESA-CF) di processo (Figura 1, Figura 2). Immagini di fluorescenza singola molecola time-lapse sono stati misurati per il 4-armata (Figura 3a) e 8 a forma di polimeri (figura 3b). Le immagini time-lapse di fluorescenza (Figura 3) mo...
Access restricted. Please log in or start a trial to view this content.
Discussione
I polimeri 4-armati e sagomati-8 sono state preparate tramite il protocollo ESA-CF (figura 1), che è un passaggio fondamentale per la sintesi. 12,24 monofunzionale e bifunzionale poli lineare (THF) s con N terminali -phenylpiperidinium erano sintetizzato secondo la procedura precedente. 11 lo scambio ionico è stata effettuata da riprecipitazione di una soluzione in acetone di un precursore polimero con counteranions triflato in una soluzione acquosa contenente un eccesso...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by a Grant-in-Aid for Scientific Research No. 22750122 (S.H.), No. 26288099 (T.Y.), and No. 23350050 (Y.T.) of the Japan Society for the Promotion of Science. S.H. is grateful for The Kurata Memorial Hitachi Science and Technology Foundation. The research reported in this publication was supported by the King Abdullah University of Science and Technology (S.H.).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Materials | |||
| THF | Godo | ||
| Wakosil C-300 | Wako Pure Chemical Industries | ||
| Acetone | Godo | ||
| Toluene | Godo | ||
| n-Hexane | Godo | ||
| CHCl3 | Kanto Chemical | ||
| Bio-Beads S-X1 | Bio-Rad | ||
| Methyl triflate | Nacalai Tesque | ||
| Triflic anhydride | Nacalai Tesque | ||
| Potassium Hydroxide | Wako Pure Chemical Industries | ||
| Ethanol | Wako Pure Chemical Industries | ||
| Poly(tetrahydrofuran) | Aldrich | ||
| Chloroform | Wako Pure Chemical Industries | ||
| Immersion oil | Cargille | Type 37 / Type A | |
| Equipment | |||
| 2-Neck 100-ml round-bottom flask | |||
| Flask | |||
| Beaker | |||
| Funnel | |||
| Filter paper | Whatman | ||
| Reflux condenser | |||
| Syringe | |||
| Water bath | |||
| Magnetic stirrer | |||
| Rotary evaporator | |||
| Microscope cover slips (24 x 24 mm, No. 1) | Matsunami Glass | CO22241 | |
| Staining jar | AS ONE Corporation | 1-7934-01 | |
| Ultrasonic cleaner | VWR International | 142-0047 | |
| Inverted microscope | Olympus | IX71 | |
| Ar-Kr ion laser | Coherent | Innova 70C | |
| Berek compensator | Newport | 5540 | |
| Excitation filter | Semrock | LL01-488-12.5 | |
| Dichloric mirror | Omega optical | 500DRLP | |
| Emission filter | Semrock | BLP01-488R-25 | |
| Lens and mirror | Thorlabs | ||
| EM-CCD camera | Andor Technology | iXon | |
| Objective lens (100X, N.A. = 1.3) | Olympus | UPLFLN 100XOP | |
| Objective heater | Bioptechs | ||
| Preparative GPC | Japan Analytical Industry | LC-908 |
Riferimenti
- Honda, S., Yamamoto, T., Tezuka, Y. Topology-Directed Control on Thermal Stability: Micelles Formed from Linear and Cyclized Amphiphilic Block Copolymers. J. Am. Chem. Soc. 132 (30), 10251-10253 (2010).
- Honda, S., Yamamoto, T., Tezuka, Y. Tuneable enhancement of the salt and thermal stability of polymeric micelles by cyclized amphiphiles. Nat. Commun. 4, (2013).
- Jun, S., Mulder, B. Entropy-driven spatial organization of highly confined polymers: Lessons for the bacterial chromosome. Proc. Natl. Acad. Sci. U. S. A. 103 (33), 12388-12393 (2006).
- McLeish, T. Polymers without beginning or end. Science. 297 (5589), 2005-2006 (2002).
- McLeish, T. Polymer dynamics: Floored by the rings. Nat. Mater. 7 (12), 933-935 (2008).
- Roovers, J. Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. Tezuka, Y. , World Scientific Publishing Co. Pte. Ltd. 137-156 (2013).
- Klein, J. Evidence for reptation in an entangled polymer melt. Nature. 271 (5641), 143-145 (1978).
- Leger, L., Hervet, H., Rondelez, F. Reptation in entangled polymer-solutions by forced rayleigh light-scattering. Macromolecules. 14 (6), 1732-1738 (1981).
- von Meerwall, E. D., Amis, E. J., Ferry, J. D. Self-diffusion in solutions of polystyrene in tetrahydrofuran - comparison of concentration dependences of the diffusion-coefficients of polymers, and a ternary probe component. Macromolecules. 18 (2), 260-266 (1985).
- Kapnistos, M., et al. Unexpected power-law stress relaxation of entangled ring polymers. Nat. Mater. 7 (12), 997-1002 (2008).
- Adachi, K., Takasugi, H., Tezuka, Y. Telechelics having unstrained cyclic ammonium salt groups for electrostatic polymer self-assembly and ring-emitting covalent fixation. Macromolecules. 39 (17), 5585-5588 (2006).
- Oike, H., Imaizumi, H., Mouri, T., Yoshioka, Y., Uchibori, A., Tezuka, Y. Designing unusual polymer topologies by electrostatic self-assembly and covalent fixation. J. Am. Chem. Soc. 122 (40), 9592-9599 (2000).
- Yamamoto, T., Tezuka, Y. Topological polymer chemistry: a cyclic approach toward novel polymer properties and functions. Polym. Chem. 2 (9), 1930-1941 (2011).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Tezuka, Y. Single-molecule imaging reveals topological isomer-dependent diffusion by 4-armed star and dicyclic 8-shaped polymers. Polym. Chem. 6 (22), 4109-4115 (2015).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Vacha, M., Tezuka, Y. Single-Molecule Study on Polymer Diffusion in a Melt State: Effect of Chain Topology. Anal. Chem. 85 (15), 7369-7376 (2013).
- Habuchi, S., Satoh, N., Yamamoto, T., Tezuka, Y., Vacha, M. Multimode Diffusion of Ring Polymer Molecules Revealed by a Single-Molecule Study. Angew. Chem. Int. Ed. 49 (8), 1418-1421 (2010).
- Habuchi, S. Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. Tezuka, Y. , World Scientific. 265-290 (2013).
- Fernandez, P., Bayona, J. M. Use of off-line gel-remeation chromatography normal-phase liquid-chromatography fro the determination of polycyclic aromatic-compounds in environmental-samples and standard reference materials (air particulate matter and marine sediment). J. Chromatogr. 625 (2), 141-149 (1992).
- Biesenberger, J. A., Tan, M., Duvdevan, I., Maurer, T. Recycle gel permeation chromatography. 1. recycle principle and design. J. Polym. Sci. Pol. Lett. 9 (5), 353(1971).
- Kusumi, A., Sako, Y., Yamamoto, M. Confined lateral diffusion of membrane-receptors as studied by single-particle tracking (nanovid microscopy) - effects of calcium-induced differentiation in cultured epithelial-cells. Biophys. J. 65 (5), 2021-2040 (1993).
- Schutz, G. J., Schindler, H., Schmidt, T. Single-molecule microscopy on model membranes reveals anomalous diffusion. Biophys. J. 73 (2), 1073-1080 (1997).
- Vrljic, M., Nishimura, S. Y., Brasselet, S., Moerner, W. E., McConnell, H. M. Translational diffusion of individual class II MHC membrane proteins in cells. Biophys. J. 83 (5), 2681-2692 (2002).
- Margineanu, A., et al. Photophysics of a water-soluble rylene dye: Comparison with other fluorescent molecules for biological applications. J. Phys. Chem. B. 108 (32), 12242-12251 (2004).
- Tezuka, Y., Oike, H. Self-assembly and covalent fixation for topological polymer chemistry. Macromol. Rapid Commun. 22 (13), 1017-1029 (2001).
- Deres, A., et al. The Origin of Heterogeneity of Polymer Dynamics near the Glass Temperature As Probed by Defocused Imaging. Macromolecules. 44 (24), 9703-9709 (2011).
- Flier, B. M. I., et al. Heterogeneous Diffusion in Thin Polymer Films As Observed by High-Temperature Single-Molecule Fluorescence Microscopy. J. Am. Chem. Soc. 134 (1), 480-488 (2012).
- Habuchi, S., Oba, T., Vacha, M. Multi-beam single-molecule defocused fluorescence imaging reveals local anisotropic nature of polymer thin films. Phys. Chem. Chem. Phys. 13 (15), 6970-6976 (2011).
- Zettl, U., et al. Self-Diffusion and Cooperative Diffusion in Semidilute Polymer Solutions As Measured by Fluorescence Correlation Spectroscopy. Macromolecules. 42 (24), 9537-9547 (2009).
- Kirstein, J., Platschek, B., Jung, C., Brown, R., Bein, T., Brauchle, C. Exploration of nanostructured channel systems with single-molecule probes. Nat. Mater. 6 (4), 303-310 (2007).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon