Method Article
Antikor parçalarının bir kütüphanenin taranması için bakteriyel iç zar görüntü
Bu Makalede
Özet
We provide a method to simultaneously screen a library of antibody fragments for binding affinity and cytoplasmic solubility by using the Escherichia coli twin-arginine translocation pathway, which has an inherent quality control mechanism for intracellular protein folding, to display the antibody fragments on the inner membrane.
Özet
Antibodies engineered for intracellular function must not only have affinity for their target antigen, but must also be soluble and correctly folded in the cytoplasm. Commonly used methods for the display and screening of recombinant antibody libraries do not incorporate intracellular protein folding quality control, and, thus, the antigen-binding capability and cytoplasmic folding and solubility of antibodies engineered using these methods often must be engineered separately. Here, we describe a protocol to screen a recombinant library of single-chain variable fragment (scFv) antibodies for antigen-binding and proper cytoplasmic folding simultaneously. The method harnesses the intrinsic intracellular folding quality control mechanism of the Escherichia coli twin-arginine translocation (Tat) pathway to display an scFv library on the E. coli inner membrane. The Tat pathway ensures that only soluble, well-folded proteins are transported out of the cytoplasm and displayed on the inner membrane, thereby eliminating poorly folded scFvs prior to interrogation for antigen-binding. Following removal of the outer membrane, the scFvs displayed on the inner membrane are panned against a target antigen immobilized on magnetic beads to isolate scFvs that bind to the target antigen. An enzyme-linked immunosorbent assay (ELISA)-based secondary screen is used to identify the most promising scFvs for additional characterization. Antigen-binding and cytoplasmic solubility can be improved with subsequent rounds of mutagenesis and screening to engineer antibodies with high affinity and high cytoplasmic solubility for intracellular applications.
Giriş
katlanması ve hücre içi ortamı fonksiyon görme yeteneğine sahip antikorlar, araştırma ve terapötik uygulamaları için umut vaat eden araçlar. Bunlar protein-protein etkileşimlerini önlemek protein, nükleik asit etkileşimleri bozmak ya da enzimler 1-5'e alt-tabaka erişimi engellemek için hücre içinde bir hedef proteine bağlanarak protein aktivitesini modüle etme kabiliyetine sahiptir.
antikorlar, hücre içi uygulamalar için büyük bir potansiyele sahip olmalarına rağmen, bir hedef antijene bağlanma yeteneğine korurken, hücre içi çevrede düzgün katlanmasını ve çözünürlüğünü bunları mühendislik zordur. Indirgeme sitoplazmik ortamı, normal olarak, tam-uzunlukta antikorlar ve tek zincirli değişken fragmanı (scFv) 6,7 antikorlar dahil olmak üzere antikor fragmanları, sabit katlama için gerekli disülfit bağlarının oluşumunu engeller. yönlendirilmiş evrim bir kısım yaklaşımlar, h antikor mühendislikten geçirilmesi için kullanılmıştırhedef IGH afiniteleri 8-10 antijenleri. Bu yaklaşımlar genellikle antikor 11-13 büyük kütüphanelerinin taranması için faj gösterimi, maya yüzey görüntüsünü veya bakteriyel yüzey görüntüsünü kullanın. Bu yöntemler, hedeflere bağlanan antikorların belirlenmesi için güçlü ve etkili, henüz 14-16 görüntülenir proteinlerin taşınması için salgı yoluna bağlıdır. salgı yolu maya veya bakteri içinde periplazmaya endoplazmik retikulum lümenine azaltarak sitoplazmadan katlanmamış proteinleri translocates. Daha sonra proteinler oksitleyici şartlar altında kat ve hücre yüzeyinde gösterilen ya da afinite 17,18 bağlanma taranması için faj parçacıkları halinde paketlenir. Bunun bir sonucu olarak, bu teknikler kullanılarak izole antikorlar zorunlu olarak sitoplazmada de katı olmayacak ve antikorlar, hücre içi uygulamalarda kullanılacaksa, hücre içi içindeki çözünürlüğü çoğu zaman ayrı ayrı işlenmiş olması gerekir.
Geliştirmekde sitoplazmada katlanmaktadır mühendisliği antikorların etkinliği, daha önce MAD-TRAP (ilişkilendirilmesi proteinleri Tat bazlı tanınması için, zara-sabitlenmiş ekran) başarısını Escherichia coli inner- kullanarak bir scFv antikoru kütüphanesinin taranması için bir yöntem rapor membran ekran 19. Bakteriyel bir iç zar görüntüleme salgılama yoluna kullanan diğer yaygın görüntü yöntemlerin aksine olarak, görüntülenen antikorların taşınması için çift arginin translokasyon (TAT) yolu kullanır. Tat yolu, sadece çözünür, doğru biçimde katlanmış proteinler, E. taşınacak sağlayan bir kalite kontrol mekanizması içerir iç zarından ve periplasmasında 20,21 içine coli sitoplazma. De sitoplazmada katlanmaktadır (bir TAT sinyal peptidi ssTorA bir N-terminal füzyon Tat yoluna hedeflenmiş yani., Proteinler) aşırı eksprese Tat substratlar bir N terminaline sahip bir ara madde, uzun ömürlü bir translokasyon Form Isitoplazma ve periplasmasında 19 C-terminali n. Bu E. periplazmik yüzünde, antikor fragmanları da dahil olmak üzere doğru katlanmış Tat yüzeyler, görüntülenmesini sağlar E. coli iç zarı. Spheroplastlar oluşturmak için enzimatik sindirme ile dış membran ayrılmasından sonra, antikorlar, hücre dışı alan (Şekil 1) maruz kalmaktadır. Bu, iç zar üzerinde görüntülenen Tat substratlar belirli bir hedefe bağlanması açısından taranabilir sağlar. Önemli olarak, hücre-yüzeyi ekran Tat yolu sokmak de sitoplazmada katlanmaktadır Kütüphanede yalnızca antikorlar afinite ve hücre içi katlanmayı bağlama eşzamanlı mühendisliği sağlayan bağlanma için sorguya garanti eder. Bu protokol, biz E. üzerinde bir scFv kitaplığı nasıl görüntüleneceğini açıklar coli iç zarı, bir hedef antijene karşı kütüphane pan ve kütüphaneden en umut verici bileşenleri tanımlamak için ikincil bir ekran gerçekleştirin. biz odak iken scFvs'ye üzerinde protokol, yöntem başvurusu bağlayıcı ve hücre içi katlanmayı gerektiren herhangi bir proteini mühendislik tatbik edilebilir.
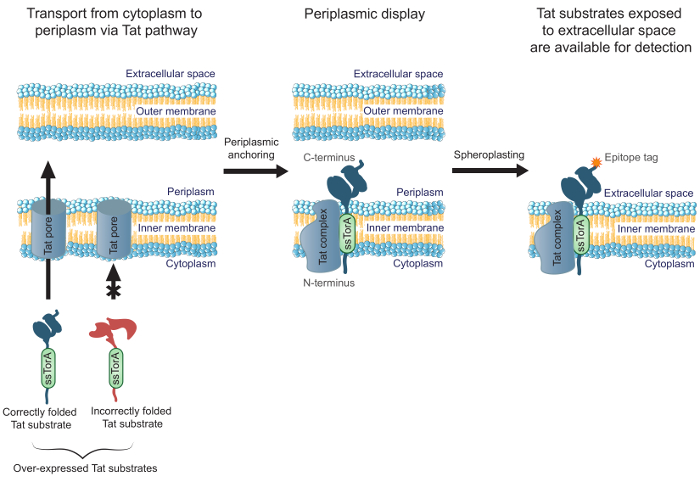
Şekil 1. Tat iç zar ekran. E. ise E. coli, ssTorA sinyal sekansına bir füzyon olarak ifade edilir ve doğru şekilde sitoplazmada katlanır scFv antikor iç zarı boyunca taşınmaktadır. scFv sitoplazma içinde N-terminalinde ve periplazmada C-terminali ile bir iç zar içinde tutturulmuş Translokasyon ara form. E. coli dış zar enzimatik ve böylece hücre-dışı alana bağımlı antikorların açığa görüntülenen antikorun C-terminalli füzyonu yapılmış epitop takısına bağlanan bir antikor kullanılarak tespit edilmesi için kullanılabilir hale, spheroplastlar oluşturmak için sindirilmiştir.yük / 54583 / 54583fig1large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Protokol
1. ssTorA sinyal sekansının bir füzyon olarak scFv kitaplığı hazırlamak
- Bir scFv geni varyantlarını ihtiva eden bir deoksiribonükleik asit (DNA) kütüphane elde edin.
Not: kütüphanesi de tüm scFv geni veya hedeflenen etki fazla çeşitlilik oluşturmak için uygun olan herhangi bir modu kullanılarak yapılabilir 22 (örneğin, belirleyici bölgeler üçüncü tamamlayıcılık, CDR3s.). - Standart moleküler klonlama yöntemleri 23 kullanılarak PIMD plazmid (Şekil 2) DNA kütüphanesinin yerleştirin.
Not: Bu plazmid, (scFv N-terminali) ssTorA sinyal sekansına genetik füzyon ve FLAG epitop (scFv C-terminal) ve scFv'leri ifade eder. İç membran görüntü için plazmidin tasarım, daha önce 19 tarif edilmiştir. PIMD plazmid yazarların edinilebilir.
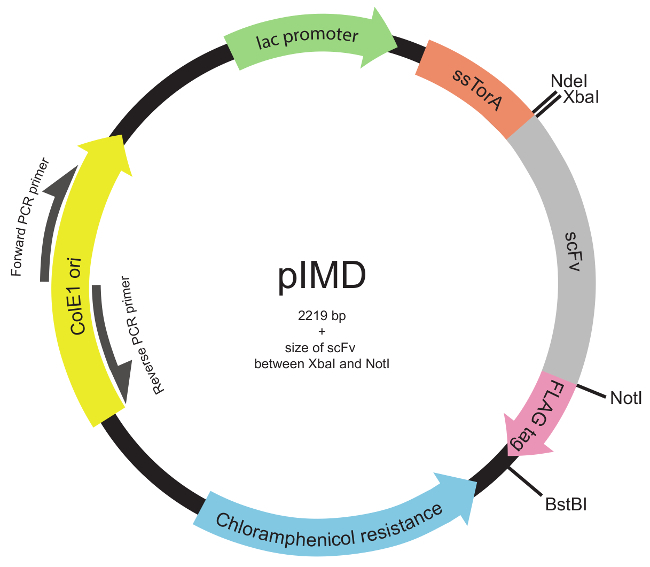
Şekil 2. İç zar görüntüleme plazmid (PIMD) harita (Basamak 1.3 ile 1.2). Bu plazmid, lak promoter, ColE1 replikasyon orijini ve bir kloramfenikol direnç geni de içerir. eklenen scFv geni, aynı okuma çerçevesi içinde tüm üç ile Tat yolu ve bir FLAG epitop etiketine scFv hedef ssTorA sinyal sekansına kaynaştırılır. Kısıtlama enzimi yerleri gösterilmiştir. Xbal ve Notl kısıtlama enzimi siteleri arasına yerleştirilir bir kütüphane, plazmid büyüklüğü 2219 bp artı scFv boyutudur. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- MC4100 E. kütüphaneleri ihtiva eden plazma DNA Dönüşümü coli hücreleri 23. Kurtar ve kütüphanenin bu bakteri formunu büyür. Oda sıcaklığında 15 dakika boyunca 4000 x g'de santrifüje hücreleri toplamak için. Süpernatantı ve toplanan hücreleri tekrar süspansiyonLuria-Bertani (LB) medya% 25 gliserol içinde. -80 ° C'de saklayın alikotları gerekli ya da 2. Adıma geçin kadar.
NOT: protokol, diğer E. rağmen, MC4100 hücreleri ile doğrulanmıştır E. coli suşları, aynı zamanda protokole uygun olması beklenmektedir. Elektroporasyon, yüksek transformasyon verimi nedeniyle dönüştürme için tercih edilen bir yöntemdir. Kitaplık tipik olarak en az 10, scFv, bu aşamada varyantları 9 arasında olmalıdır, ve her bir sıvı bölüntü bir kütüphane 100 kat örtülecek kadar yeterli hücre içermelidir.
2. spheroplastlar Kütüphane Hızlı ve hazırlayın
- RT'de (Kademe 1.3) bakteriyel kütüphanesinin bir kısım Çözülme ve 20 ug / ml kloramfenikol (cm) 100 ml LB ortamı ihtiva eden bir şişeye kısım ekleyin. 37 ° C'de 3 saat ve kuluçkaya çalkalayıcı 225 rpm için büyür.
- 3 saat sonra, 37 ° C enkübe çalkalayıcı balonun çıkarın. için scFv kitaplığı ekspresyonunu VerenBir inkübe çalkalayıcıda 15 rpm, 20 ° C de saat 22 ve 225 için O / N devam edin.
NOT: Hiçbir indükleyici gerekli organizatörü sızdıran olduğu gibi PIMD plazmid kullanırken. MC4100 hücreleri Lac bastırıcı aşın yok (ve Laci plazmid üzerinde bulunmayan) unutmayın.

Şekil 3. E.coli hücreleri ve sferoplastlar. (A) E. coli hücreleri silindir şeklindedir. (B) EDTA ve lizozim, E. dış membran kullanılarak spheroplasting sonra E. coli, hücreler yırtılmakta ve elde edilen sferoplastlar şekli küreseldir. Diferansiyel girişim kontrast (DIC) mikroskopi görüntüleri. Ters bir mikroskop bir 100X objektif kullanılarak elde edilmiştir Lütfen cBu rakamın büyük halini görmek için buraya yalamak.
- kütüphane spheroplastlar hazırlayın.
NOT: spheroplastlar E. dış zarını oluşturulmaktadır E. coli (Şekil 3), şekil bakımından küreseldir.- Gerekli tamponlar hazırlayın.
Not: Tüm tamponlar steril olmalıdır.- Damıtılmış H 1000 ml'lik bir son hacme kadar 2 O 2 PO 4 HPO 4 8 g NaCl, 0.2 g KCI, 1.44 g 2 Na çözülmesiyle (pH 7.4 PBS) ve 0.24 g KH 1 x fosfat tamponlu tuzlu su hazırlayın. buz üzerinde tutun.
- % 0.1 PBS Hazırlama 200 mi 1 x PBS içinde 0.2 g BSA çözülmesiyle sığır albümin serumu (BSA) (ağ / hac). buz üzerinde tutun.
- Steril filtre edildi, 1 M sukroz, 1 M Tris tamponu (pH 8.0) ve 1.5 ml 1 ml damıtık H2O 7.5 ml karıştırılarak fraksiyonasyon tamponu (FB) hazırlanması buz üzerinde tutun.
- 30 ul o eklenerek 1 mM etilendiamintetraasetik asit (EDTA) hazırlanmasıH2O damıtılmış f 0.5 M EDTA ile 14.97 mi
- 100 ml 4.76 g MgCI2 çözülmesiyle, 0.5 M MgCl2 Hazırlama H2O damıtılmış buz üzerinde tutun.
- çalkalayıcı balonun çıkarın ve hücre yoğunluğu belirlemek için bir spektrofotometre kullanılarak 600 nm'de optik yoğunluk (OD) ölçün. Kaynaklı kültür hacmi spheroplasting her numune, 1 x 10 10 hücreleri olduğu, gerektiğinde hesaplayın.
Not: E. 10 9 hücre / ml'lik bir konsantrasyon gösteren bir OD 1 600 yaklaştırılması E. coli 24 kullanılabilir. - Santrifüj 5 dakika boyunca oda sıcaklığında 12,000 x g'de 1.5 ml mikrosantrifüj tüpü içinde indüklenen kültür hesaplanan hacmi. Sorun numune hazırlama ortaya çıkan halinde, en az iki numune hazırlayın.
- santrifüjlenmiş kültürlerden Süpernatantı ve buz soğukluğunda FB 100 ul her bir hücre pelletini. 12.000 × santrifüj1 dakika için oda sıcaklığında G ve daha sonra pipet ile süpernatantı. / Ml lizozim, 10 mg 3.5 ul desteklenmiş buz soğukluğunda FB 350 ul her bir pelletini.
- , Damla damla ilave 1 mM EDTA, 700 ul yavaşça her tüp vorteks ve yavaş yavaş örnekleri karıştırmak için bir boru rotator dönerken, daha sonra 20 dakika boyunca oda sıcaklığında inkübe edin. , Rotator tüpleri çıkarın her tüpe buz soğukluğunda 0.5 M MgCl2, 50 ul ve 10 dakika süreyle buz üzerinde inkübe. Santrifüj 10 dakika boyunca 4 ° C'de 11,000 x g'de borular.
- sferoplast pelet izole edin.
- yavaş yavaş pelet kısmını çekmek için 1 ml ucu ile bir mikropipet kullanın. doğrudan yeni bir 1.5 ml'lik tübe Yukarıdaki açıklığı olan bir açıyla boru tutarken, yavaşça yüzer üzerinden pipet kaldırın ve yeni bir tüp içine pelet kaydırın.
- süpernatan önemli bir hacim yeni bir tüpe aktarılır ise, pipetleme çıkarın. pelet firması eno değilseöf yine 2 dakika ve girişimi pelet izolasyonu için 11.000 x g'de yeniden santrifüj, transfer.
- buz soğukluğunda 1 x 1 ml PBS, her bir tüp içinde sferoplast pelletini. pipetle ve topak tamamen yeniden süspansiyona kadar yavaşça girdap tutucuya girdap arasında gidip. Bir seferde en fazla 2 dakika süreyle buz kapalı örnekleri tutmak ve tekrar buz çıkarmadan önce en az 5 dakika boyunca buz iade etmeyin. Aşama 4'te kaydırma için kullanılana kadar (en fazla 2 gün), 4 ° C'de spheroplastlar tutun.
- Gerekli tamponlar hazırlayın.
3. Manyetik boncuklar üzerine hedef antijen hareketsiz
- E. Rekombinant üretim sırasında, in vivo olarak, hedef antijen Biotinylate coli hücreleri. Alternatif olarak, kimyasal konjugasyon 25 ya da zaten biyotinile edilmiş satın alma hedef antijeni kullanın ve 3.2 adıma geçin.
- 10 x bisin tampon yapmak için 50 mi su 816 gr bisin ekleyin. buf seyreltin50 ° C'ye kadar damıtılmış H2O ve ısı fer 1 x. 10 mM bisin tamponunda 5 mM biyotin bir biyotin çözelti yapmak için ısıtıldı 1 x bisin tampon 12 ml 14.7 mg biyotin ekleyin. kadar gerekli -20 ° C'de saklayın.
- Hızlı ve biyotin karboksil taşıyıcı protein (BCCP) bir füzyon olarak hedef antijenin üretimine olanak sağlar pAK400cb-BCCP plazmid 26 kullanılarak hedef protein biotinylate.
NOT: E. coli hücreleri doğal olarak biotinylate BCCP, arındırmak ve kimyasal olarak önceden streptavidin kaplı boncuklar immobilizasyon hedef protein biotinylate ihtiyacını ortadan kaldırır. Yerli E. E. coli biyotin ligaz BirA füzyon proteinini biyotinile için yeterlidir.- E. büyütün E. coli O (BCCP N-terminaline füzyon olarak yerleştirilmiş hedef antijen ile birlikte) biyotinilasyon plasmid ihtiva eden / N çalkalanırken 37 ° C'de mi Cm 20 ug / ile takviye edilmiş LB ortamı 15 saat 18 5 mi 225 rpm.
- 20 ug / ml Cm denklemi kullanılarak 0.05 25 mi taze LB ortamı, bir başlangıç OD alt kültür kültür gerekli (V eklenti) hacminin bir spektrofotometre kullanılarak 600 nm'de OD ölçme ve hesaplama: H ekleme = (0.05 × 25 ml) / (OD 600 - OD 600 O / N kültür ve V eklenti optik yoğunluk 0.05), taze LB eklemek için O / N kültürünün hacmi Alt kültür ve 37 ° C ve 225 rpm'de inkübe çalkalayıcıda 0.8, 0.5 OD'ye büyür.
- izopropil p-D-1-tiogalaktopiranosid 5 uM bir nihai konsantrasyona kadar bir son 100 uM konsantrasyona ve biotin ekleyin. 20 ° C ve 225 rpm'de 15 saat 22 için bir çalkalayıcı içinde inkübe ifadesini teşvik eder.
- 10 dakika boyunca 4 ° C'de 4000 x g santrifüjleme ile hasat bakteri. süpernatantı. Kullanım için hazır olana kadar -20 ° C 'de pelet saklayın.
- EklemekHücre peleti, 0.2 g başına bir hücre parçalama deterjan 1 mi. pipetle yeniden süspanse edin ve yavaşça hücreleri lize etmek için 20 dakika boyunca döner. liziz sonra 16,000 x g'de santrifüj ile 20 dakika boyunca 4 ° C. yeni bir 1.5 ml'lik tüp içine Çözünür lizat (süpernatant) Pipet.
- Bağlanmamış biyotin çıkarmak için 3 kDa'lık bir moleküler ağırlık cutoff sütunu kullanın. üreticinin talimatlarına uygun olarak 20 ° C'de sütun içine lizat ve santrifüj Pipet. lizat biotin 100 kat seyreltildikten ve yıkandı lizat hacmi lizatının orijinal hacmine eşit olana kadar 1 x PBS ile yıkayın. Yeni bir tüp lizat aktarın.
- Streptavidin kaplı manyetik boncuklar üzerine biyotinile edilmiş hedef antijeni hareketsiz.
- Aşama 2.3.1 tarif edildiği gibi 1 x PBS ve BSA (w / v)% 0.1 1 x PBS hazırlayın.
- manyetik boncuk hazırlayın.
Not: Bu, bir manyetik ayırma raf kullanılmasını gerektirir.- süspanse streptavorijinal şişede manyetik boncuklar pipehdin kaplı. ya da en azından 30 saniye için ya vorteks 5 dakika boyunca döner.
- 1.5 ml tüp 7-10 × 10 9 boncuk aktarın.
NOT: İstenilen ses üreticisi tarafından sağlanan boncuk konsantrasyonuna bağlı olacaktır. - tüp tarafında boncuk toplamak için 2 dakika süreyle manyetik raf boncuklar içeren tüp yerleştirin. mıknatıs hala tüp dikkatlice boncuk bozmadan pipetleme süpernatant kaldırmak.
- yıkamak, mıknatıstan tüp kaldırmak ve kabarcıklar oluşturmadan pipetleme 1 × 1 ml PBS boncuklar tekrar süspansiyon. boncuk toplamak için 2 dakika süreyle mıknatıs tüp dönün ve dikkatli pipetleme süpernatant kaldırmak. üç yıkamadan toplam işlem iki kez daha tekrarlayın. Hiçbir sıvı nihai yıkamadan sonra tüp kalan olduğundan emin olun.
- Manyetik BEA biyotinile antijeni içeren lizat eklemeds.
- Mıknatıs tüp çıkarın ve (Kademe 3.1.5 arasında) lizat, 1 ml içinde yeniden süspanse boncuklar. hafifçe dönerken, 30 dakika boyunca oda sıcaklığında inkübe edin.
- 3 dakika antijen kaplı boncuk toplamak için mıknatıs tüp yerleştirin. Adımlar 3.2.2.4 için 3.2.2.3 tarif edildiği gibi aynı şekilde,% 0.1 BSA ile 1 x PBS ile kaplı boncuklar beş kez yıkayın. Son yıkamadan sonra, Aşama 3.2.2.2 kullanılan aynı hacme% 0.1 BSA ile 1 x PBS içinde yeniden süspanse boncuklar.
- Hareketsizleşmiş hedef antijen 4 ° C 'de stabil ise kaydırma için gerekli olana kadar, 4 ° C de, kaplanmış boncuklar saklayın. Aksi takdirde, 4. Adıma geçin.
4. Ekran Hedef Antigen karşı gezdirme ile scFv Kütüphanesi (Şekil 4)
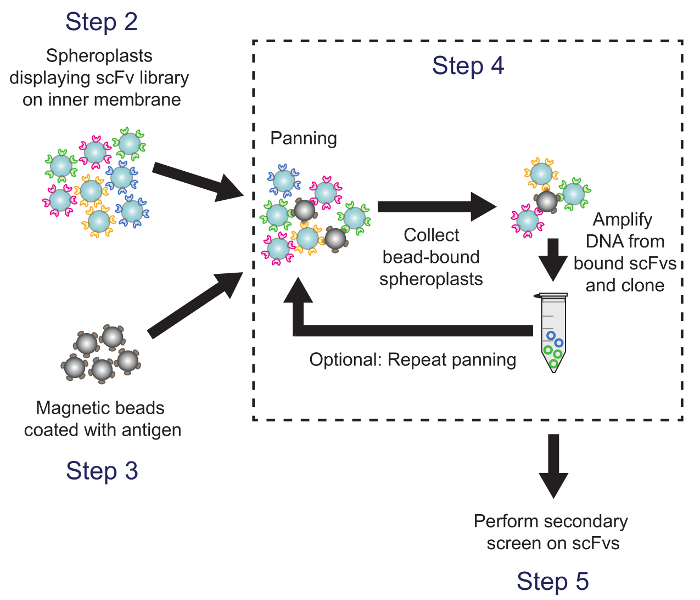
Şekil 4. Kaydırma (Aşama 4). Antijen-kaplı manyetik boncuklar arE antikor kitaplığı varyantlarını eksprese spheroplastlar inkübe edildi. Boncuk bağlı spheroplastlar plazmid DNA geri kazanılmış ve ELISA bazlı bir ekran kullanılarak taranır bir alt kütüphanesi oluşturmak için kullanılır. Protokol adımlar belirtilmiştir tekabül etmektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- spheroplastlar ile kaplanmış boncuklar inkübe edin.
- Yaklaşık 5 oranını boncuk için bir sferoplast kullanın: 1. Steril bir 15 ml tüp 4 x 10 9 spheroplastlar 8 x 10 8 boncuk ekleyin.
NOT: konsantrasyonu hala 1 × 10 10 sferoplastlar / ml hiçbir hücreler, spheroplasting işlemi sırasında kaybolan olduğunu varsayalım. - 4 ml toplam hacmi getirmek için% 0.1 BSA ile 1 x PBS ekleyin. 1 ml'lik dört 1.5 ml tüpler içine kısım. hafifçe dönerken 5 saat boyunca 4 ° C 'de reaksiyonlar inkübe edin.
- Yaklaşık 5 oranını boncuk için bir sferoplast kullanın: 1. Steril bir 15 ml tüp 4 x 10 9 spheroplastlar 8 x 10 8 boncuk ekleyin.
- PrPolimeraz zincir reaksiyonu (PCR) için, boncuk bağlı spheroplastlar epare.
- 3 dakika boyunca mıknatıs üzerinde kaydırma reaksiyon tüpleri yerleştirin. pipetleme süpernatantı ve 3.2.2.4 Adımları 3.2.2.3 tarif edildiği gibi aynı şekilde,% 0.1 BSA ile soğuk 1 x PBS, buzla Boncuk bağlı spheroplastlar dört kez yıkayın. Damıtılmış H2O 25 ul, her bir tüp içinde, boncuk bağlı spheroplastlar yeniden süspanse -20 ° C'de boncuk saklayın veya 4.3 Adım geçin.
- boncuk bağlı scFvs'ye için genleri içeren plazmidler yükseltmek için boncuk bağlı spheroplastlar üzerinde tam plazmid PCR gerçekleştirin.
- Aşağıdaki dizileri ile primerler elde: 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(ileri primer) ve 5'TAGCTCTTGATCCGGCAAACAAA3' (ters primer).
NOT: Bu son uca PIMD plazmid karşıt şeritler üzerindeki (Şekil 2) bağlanır ve PIMD ortak bir özelliği tavlanacak şekilde tasarlanmış, bu amplifikasyon bağımsız olarak ortaya çıkarscFv varyantı. - primerler fosforile.
NOT: fosforilasyon olmadan, yeniden ligasyon meydana gelmeyecektir. Astarlar de oldukça bu protokol bu fosforilasyon yöntemi kullanmak yerine, 5'-fosforilasyon ile sipariş edilebilir.- 0.5 ml'lik bir tüp içinde, Tablo 1 'de tarif edildiği gibi ileri PCR primeri için fosforilasyon reaksiyonu başlatacak. Ters primer için bu işlemi tekrar edin.
- 1 saat süre ile 37 ° C 'de reaksiyonlar inkübe edin. 20 dakika T4 polinükleotid kinaz (PNK) devre dışı bırakmak için daha sonra, 65 ° C'de inkübe. -20 ° C'de fosforlu primerler saklayın.
- PCR gerçekleştirin.
- Tablo 2'de tarif edildiği gibi bir PCR tüpü içinde, PCR reaksiyonunu hazırlanması.
NOT: Çoklu reaksiyonlar yüksek verim için hazırlanmış olabilir. Kullanılmayan kordon bağlı sferoplastlar -20 ° C'de saklanabilir. - Tam lizis sağlamak için, bir termal döngü içinde 15 dakika boyunca 98 ° C 'de, PCR reaksiyonunun ısı spheroplastlar evi. termal döngü tüpleri çıkarın ve her bir yüksek sadakat polimeraz 0.5 ul ekleyin. Termal döngü tüpleri dönün ve Tablo 3'te ayrıntılı programını kullanarak çalıştırın.
- uygun şekilde PCR ürünleri havuzu. -20 ° C'de saklayın veya 4.4 Adım geçin.
- Tablo 2'de tarif edildiği gibi bir PCR tüpü içinde, PCR reaksiyonunu hazırlanması.
- Aşağıdaki dizileri ile primerler elde: 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(ileri primer) ve 5'TAGCTCTTGATCCGGCAAACAAA3' (ters primer).
Tablo 1. PNK fosforilasyon reaksiyonu (Aşama 4.3.2.1).
| reaktif | Hacim (ul) |
| Damıtılmış H2O | 15 |
| 10x T4 DNA ligaz reaksiyon tamponu | 2 |
| 100 uM astar | 2 |
| T4 polinükleotid kinaz (PNK) | 1 |
| reaktif | Hacim (ul) |
| Damıtılmış H2O | 28.5 |
| 5x Yüksek sadakat polimeraz tampon | 10 |
| 10 uM Fosforile ileri primer | 2.5 |
| 10 uM Fosforile edilmiş ters primer | 2.5 |
| 40 mM dNTP karışımı (10 mM, her dNTP) | 1 |
| Boncuk bağlı sferoplastlar | 5 |
Tablo 3. PCR programı (Aşama 4.3.3.2).
| Adım | Sıcaklık (° C) | Süre (dk: sn) | Döngü sayısı |
| ilk doğasını | 98 | 00:30 | 1 |
| doğasını değiştirmek | 98 | 00:10 | 35 |
| tavlama | 69 | 00:30 | |
| uzatma | 72 | KB başına 0:30 | |
| son uzatma | 72 | 06:00 | 1 |
| Ambar | 12 | Sonsuz | 1 |
- Bütün plazmid PCR ürünleri yeniden sirküler ve MC4100 E. dönüştürmek için lige ürün kullanmak coli hücreleri.
- , Bir agaroz jeli 23 üzerinde PCR reaksiyonu, jel 23 DNA boyama ve kullanılarak PCR ürünü saflaştırmakJel temizleme kiti üretici tarafından sağlanan talimatları izleyerek doğrusallaştırılmış plazmid arındırmak için. 260 nm'de bir spektrofotometre kullanılarak konsantrasyonu ölçümü. gerekli olana kadar -20 ° C'de saflaştırılmış fragman saklayın ya 4.4.2 Adım devam etmektedir.
- PCR ürünü plazmid yeniden sirküler.
- Düşük konsantrasyonda 1 ng / PCR ürününün ul 27 bağlanma reaksiyonunun gerçekleştirilmesi, PCR ürünü moleküller ligasyonu önlemek için. Bu konsantrasyonda 800 ul ligasyon reaksiyonu hazırlamak için gerekli hacmi hesaplayın.
- Buz üzerinde Ligasyon reaksiyonu hazırlayınız. Bir tüp içinde, 800 ul kadar PCR ürününün Aşama 4.4.2.1 hesaplanan hacim 10 x DNA ligaz tamponu 80 ul, damıtılmış H2O ekleyin. T4 DNA ligaz 4 ul ekleyin ve hemen bir su banyosu ya da termal döngüleyici içinde 16 ° C 'de tüpleri. 14 ila 18 saat boyunca 16 ° de CO / N inkübe edin. -20 ° C'de tamamlanan ligasyon reaksiyonları Mağazaihtiyaç kadar, ya da 4.4.3 Adım geçin.
- DNA ligazı ısı ile inaktive etmek için 15 dakika boyunca 65 ° C'de sıcaklıkta bir blok üzerinde Ligasyon reaksiyonu yerleştirin. Sonra bağlanan DNA-tuz de bir mikrodiyaliz zarı veya DNA temizleme kiti kullanın. 20 ° C'de saklayın veya 4.4.4 Adım geçin.
- MC4100 E. dönüştürmek için tüm ısı ile inaktive, de-tuzlu ligasyon ürünü kullanın coli hücreleri 23. -80 ° C 'de elde edilen büyütülebilir alt kütüphanesi içeren hücrelere ve mağaza alikotları, Aşama 1.3 de tarif edildiği gibi, gliserol stokları hazırlayın.
- alt kütüphanesi ikinci kaydırma yapmak için Aşama 4.4.4 elde edilen bir alikot ile bütünüyle tekrar 4. Adım.
NOT: İkinci bir kaydırma hedef antijene 19 iyi bağlanan kütüphane bileşenleri için zenginleştirmek yardımcı olur.
5. daha fazla karakterizasyon için ümit vaat eden klonları tanımlamak için (Şekil 5), bir enzime bağlı immünosorbent analiz yöntemi kullanılarak ikinci bir ekran gerçekleştirme
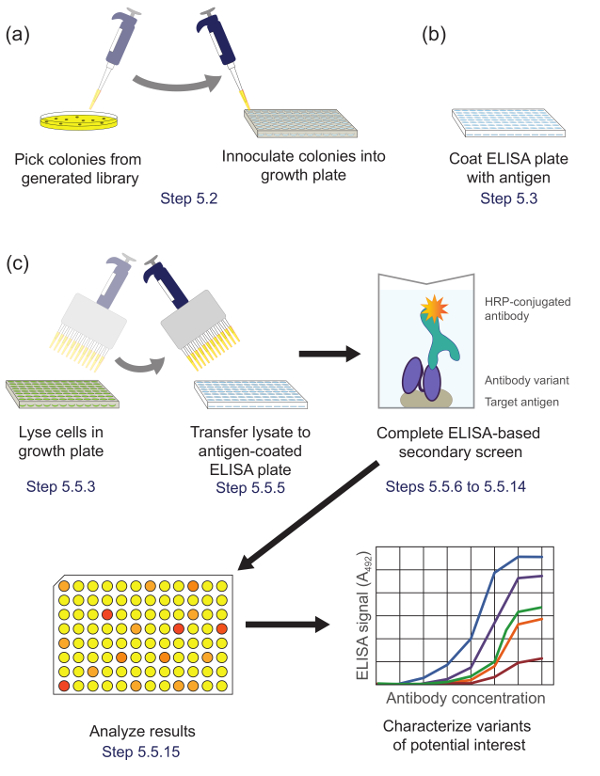
Şekil 5. ELISA bazlı bir eleme (Aşama 5). Kaydırma esnasında zenginleştirilmiş alt kütüphanesi (A) Kütüphane varyantları büyüme ve ifade için bir kültür plakasının her bir gözeneğinden aşılanmıştır. (B) bir ELISA plakası, hedef antijen ile kaplanmıştır. (Cı) kütüphane varyantları protokolde tarif edilen ELISA bazlı bir ekran kullanılarak taranır. İkinci ekrana elde edilen verilerin Analiz yapıldığında, ilgi konusu varyantları seçilir ve daha da karakterize edilmiştir. Protokol adımlar belirtilmiştir tekabül etmektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- LB agar plakaları üzerine ve levha (Kademe 4.4.4 arasında) büyütülebilir alt kütüphanesi bir tüp çözülme. Levha bir kaç sulandırma,(- 10 6 kat dilüsyonları örneğin, 10 2) bireysel koloniler sağlamak için yeterli düşük konsantrasyonlarda. 37 ° C'de 15 saat 18 için inkübe edin. 4 ° C'de plakaları saklayın ya da 5.2 Adım geçin.
- panned alt kütüphanesi gelen Kültür ve teşvik koloniler. steril şartlar altında tüm adımları uygulayın. 96 gözlü levhalar içine alan aşamalar için çok kanallı bir pipet kullanın.
- Bir yuvarlak tabanlı 96 oyuklu bir kültür plakasının her bir oyuğuna 20 ug / ml Cm LB 200 ul ekle.
- Bir pipet ucu ile agar plakasından bağımsız bir koloni seçin 96 oyuklu plakanın ilk kuyudaki ucu ve yavaşça aşılamak için karıştırın. her bir kuyu için yeni bir uç kullanın. her bir kuyunun içine bir koloni aşılamak. Bir kontrol olarak, en az bir sterilite kontrolü de inoküle Resim koloni bulunmaktadır.
- Tekrar Adım 5.2.1 ve 5.2.2 çok 96 oyuklu plakaların aşılanması için.
- 310 rpm'de bir mikro-plaka karıştırıcısı üzerinde 96 gözlü levhalar yerleştirin. 37 ° C'de inkübe edin6; 20 saat 24 C scFv'leri ifade etmek.
- Aşama 5.2'de hazırlanan her bir kültür plakasına, kaplama, hedef antijen ile bir 96-çukurlu ELISA plaka için.
- Kaplama çözeltisinin yapılması için 1 x PBS içinde uygun bir konsantrasyonda (4 ug / ml, örneğin, 1 ug / ml), saflaştırılmış hedef antijeni seyreltilir. Her bir 96-delikli plaka için kaplama çözeltisinin 5 ml olun.
NOT: uygun konsantrasyon kullanılan spesifik antijen bağlıdır ve ayarlanması gerekebilir. - 96 oyuklu yüksek bağlama açık bir polistiren ELISA plakasının her oyuğuna kaplama solüsyonu 50 ul ekle. Beher kuyudan yavaşça tüm yüzeyi kaplanmış olduğundan emin olmak için tezgah üstü yüzeyi üzerinde plaka hafifçe vurun. Her plaka için tekrarlayın. 4 ° CO / N plakaları inkübe edin.
- Kaplama çözeltisinin yapılması için 1 x PBS içinde uygun bir konsantrasyonda (4 ug / ml, örneğin, 1 ug / ml), saflaştırılmış hedef antijeni seyreltilir. Her bir 96-delikli plaka için kaplama çözeltisinin 5 ml olun.
- agar plakları üzerine 96-yuvalı kültür plakaları koloniler çoğaltır.
- Sıvı sabun, az miktarda toplamak için bir kültür plakasının yuvaları içine steril polistiren çoğaltıcısının yerleştirinİD. Dikkatle çoğaltıcısının yükseltmek ve tüm ipuçları plaka dokunmadan böyle bir 15 cm LB agar plaka transfer. Sıvı transfer edildikten sonra, doğruca yukarı çoğaltıcısı kaldırın. Her kültür plaka için tekrarlayın.
- Daha fazla karakterizasyon isteniyorsa 96 oyuklu plaka içerisinde ikinci bir ekran sonuçları, plakasında doğru çoğaltılmış kolonisi ile uyumlu şekilde, doğru bir yönlendirme ile agar plaka etiketleyin. 15 saat 18 süreyle 37 ° C'de büyütülmüştür ve gerekli olana kadar, 4 ° C'de depolayın.
- ELISA ikincil ekran gerçekleştirin.
- 1 x PBS içinde kuru süt (ağırlık / hacim)% 2 yaparak bloke çözeltisi hazırlayın. ELISA plakaları kaplama çözümü boşaltın. Her bir oyuğa bloklama çözeltisi 100 ul ekle. 4 ° C'de en az 2 saat ya da blok olarak O / N, oda sıcaklığında inkübe edilir.
- 1 x PBS içinde% 0,05 nihai konsantrasyona polisorbat 20 ilave edilerek yıkama tamponu hazırlayın. ELISA plakasına 250 ml yapmak.
- Bir 20 ul ekleKonsantre hücre lisis yuvarlak tabanlı kültür plakasının her bir oyuğuna, deterjan ve 15 ila 20 dakika boyunca oda sıcaklığında bir mikro-plaka çalkalayıcıda kültürü plakası kuluçkalayın. parçalama ve yıkama adım 5.5.4 aynı anda gerçekleştirilir, böylece ELISA plakaları bloke tamamlandığında, aynı zamanda lizis başlayın.
- ELISA plakaları engelleme çözümü boşaltın. yıkama başına oyuk başına yıkama tamponu 200 ul bloke ELISA plakaları dört kez yıkayın. Kuyulardan yıkama tamponu boşaltın.
- her bir için yeni bir uç ile, ELISA plakasının karşılık gelen transfer hücre parçalama bir levhanın her çukuruna 50 ul. 1 ila 2 saat boyunca oda sıcaklığında ELISA plaka inkübe edin.
- bağlı scFv'leri algılamak için antikor çözeltisi hazırlayın.
- bir yaban turbu peroksidaz (HRP) kitaplığı scFv'den kaynaşmış FLAG epitop takısına bağlanan primer antikor ile konjüge edilmiş kullanın.
- (ELISA kullanmak tedarikçi & # görmek için uygun seyreltme antikor sulandırmak39;% 2 tavsiyeleri) (1 x PBS içinde% 0,05 polisorbat 20 / hac) kuru süt ağ. Her bir plaka için 5 ml hazırlayın.
- Aşama 5.5.4 de tarif edildiği gibi ELISA plakalar, yıkama tamponu ile dört kere yıkanır.
- ELISA plakasının her oyuğuna antikor çözeltisi 50 ul ekle. Oda sıcaklığında 1 ila 2 saat süreyle inkübe edin.
- Işık kaçınarak üreticinin protokolü damıtılmış H2O O -fenilendiamin dihidroklorid (OPD) tabletlerinin çözülmesiyle HRP substratı hazırlayın. ELISA plaka başına 20 ml hazırlayın.
- Gerektiği gibi distile H2O ile konsantre H 2 SO 4 seyrelterek 3 MH 2 SO 4 hazırlayın. ELISA plaka başına 5 ml hazırlayın.
Dikkat: H 2 SO 4 güçlü bir asittir. Uygun kişisel koruyucu ekipman giymek emin olun. - Aşama 5.5.4 de tarif edildiği gibi, yıkama tamponu ile ELISA plakaları dört kez yıkayın.
- HRP substra ELISA inkübe edinte.
- Her bir oyuğa HRP alt-tabaka 200 ul ekle. , Işığa maruz kalma minimize seferinde bir ELISA plakasına substrat ekleyin ve sonraki plaka geçmeden önce, alüminyum folyo ile sarılır. karanlıkta, oda sıcaklığında 30 ila 60 dakika boyunca inkübe edin.
- İlk 30 dakika sonra, alt-tabakanın kararması plakaları kontrol ve renk geliştirme görselleştirmek için gerekirse daha inkübe edilir.
- Reaksiyonun sönmesi için her bir oyuğa 3 MH 2 SO 4 50 ul ekle. Her bir kuyu için farklı bir ucu kullanarak köpürme olmadan yavaşça yukarı pipetleme ve aşağı kuyularda çözüm karıştırın. Tutarlılık ve doygunluk önlemek için, her plaka için çözüm karıştırmadan önce ELISA plakaları tüm SO 4 hızlı ve dikkatli H 2 ekleyin.
- Bir plaka okuyucusu kullanılarak 492 nm de her bir levhanın gözleri içine çözeltinin absorbansı ölçülür.
- scFv bu exhib varyantları tanımlamak için absorbans verileri analizo bağlayıcı sinyalleri umut verici ve bu umut verici scFv'leri karakterize. Her plaka üzerinde ortalama sinyal daha arka plan sinyalinden daha yüksek ve daha yüksek absorbans sinyalleri sergileyen scFv'leri seçin.
Not: emme düzeyi tarama izole edildi scFv varyantlarının gücü ile birlikte kullanılır antijen ve anti-FLAG antikor özelliklerine bağlı olacaktır.
Sonuçlar
E. Tat yolunun, hücre içi protein katlanması kalite kontrol mekanizması E. coli de indirgeyici sitoplazmik ortamda katlanır proteinlere iç hücre zarından karşıya aktarımı sınırlar. SsTorA sinyal sekansı (doğal Tat yolunun 20 ile taşınır Tora proteini, sinyal sekansı) bir scFv füzyon aşırı ifade ile, translokasyon iç zarı 19 scFv'lerin ekranda sonuçlanan durdu. Dış zar enzimatik bölündükten sonra gösterildi antikorlar antijen bağlanma aktivitesi için tarama için uygun yapılır. ScFv ekran Tat yolunun yararlanmak olanağı Karlsson ve arkadaşları tarafından gösterilmiştir. 19 (Şekil 6). scFv antikor scFv13 ve scFv13.R4 tarafından tanınan arginin-arginin Tortu çifti yoksun nativ ssTorA dizisi ya da modifiye edilmiş bir ssTorA da kaynaştırılmıştırTat yolu. scFv13.R4 yönlendirilmiş evrim dört tur boyunca scFv13 arasında. Martineau ve arkadaşları tarafından işlenmiş ve sitoplazma 9 iyi katlama bilinmektedir. Bu scFv iç zarı görüntülenen, fakat yerli ssTorA sinyal sekansına bir füzyon olarak ifade edilmiştir, sadece (Şekil 6). Bunun aksine, scFv13 de sitoplazmik 9 katlanmamış olduğundan, bu nedenle bağımsız olarak sinyal dizisinin bu da erimiş olduğu, iç zar üzerinde de görüntülenir. Buna ek olarak, eğer scFv'ler görüntülü dahili zar görüntü ve Tat yolu arasında önemli bir bağ gösteren gözlenmemiştir, TatC protein, Tat Makine 20,28 önemli bir bileşeni yoksun hücreler olarak ifade edildi. Bu sonuçlar, hücre içi fol için bir ekran olarak işlev Tat yolu ile taşıma sağlayan bir TAT sinyal peptidi içerir ve sadece bir protein doğru olarak iç zar üzerinde gösterildi sitoplazmada katlanır göstermektedirding.
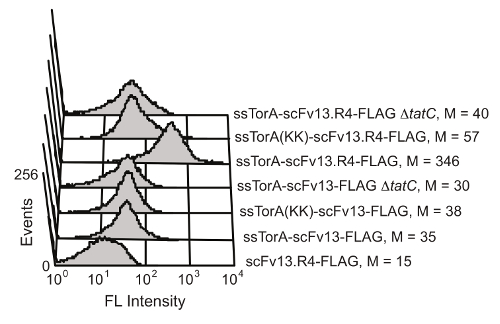
Şekil iç zarı görüntülenen scFv'lerin 6. bulunması. Sitometri analizi akışı iç zar üzerinde zayıf katlanmış scFv13 ve de katlanmış scFv13.R4 görüntüsünü tespit etmek için yapılmıştır. scFv ssTorA sırayla Arg-Arg çifti Lys-Lys değiştirildiği doğal ssTorA ya ssTorA (KK), kaynaştırılmıştır. scFv'nin C-terminal FLAG epitop takıları, floresanlı bir izotiyosiyanat (FITC) ile tespit edilmiştir anti-FLAG antikoru ile konjüge edilmiş. FLAG etiketi olmadan TatC protein (ΔtatC) ve ssTorA-scFv13 olmayan hücreler kontrol olarak test edildi. M medyan floresan değerini gösterir. Izni ile referans 19 den yeniden basılmıştır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
İç-zar ekran başarıyla hedef protein için afinite yüksek düzeyde ve sitoplazmik çözünürlüğü yüksek olan scFv antikorları izole edebilir. Buna ek olarak, iç-zar ekranı kullanarak yönlendirilmiş evrim sonraki mermi antikor özelliklerini 19 artırmak. Bunu göstermek için, β-galaktosidaz için bağlanma afinitesi düşük bir seviyede yer alır scFv13 dayanan bir hata eğilimli PCR kütüphanesi, protokolde tarif edilen yöntemi ekran kullanılarak ve panning hedef antigen β-galaktosidaz karşı pişirilmiştir. scFv 1-4 mutajenez ve kaydırma bir turdan sonra izole edilir ve scFv13 (Şekil 7A) az ve sitoplazmik çözünürlüğünün daha yüksek bir seviyede (Şekil 7B)-galaktosidaz olan B için yüksek bir bağlanma afinitesine sergilendi.
scFv 1-4 dayalı yeni bir kütüphane, hata eğilimli PCR kullanılarak yapılan ve karşı bu ikinci nesil kütüphane kaydırma olduβ-galaktosidaz tarif edilen protokolün bir modifikasyonu kullanılarak yapıldı. evrim ikinci turu için β-galaktosidaz karşı kaydırma scFv 1-4 daha yüksek afinite ile klonların izole edilmesi olasılığını arttırmak için bir rakip olarak saflaştınlmış, çözülebilir scFv 14 varlığında yapıldı. mutagenez ve kaydırma bu ikinci turundan sonra, scFv 2-1 ve scFv 2-3 ELISA tabanlı ikincil tarama kullanılarak izole edilmiştir. Bu scFv'ler sadece scFv13 daha β-galaktosidaz için daha yüksek bağlanma afinitesi sergiledi, fakat aynı zamanda ilk turda klonu scFv 1-4 daha iyi bağlama sergiledi değil. scFv 2-1 scFv13.R4 (Şekil 7A) ile karşılaştırılabilir bağlanma β-galaktosidaz sergiledi. scFv 2-3, aynı zamanda çözünebilirlik ve antijen bağlayıcı eşzamanlı mühendisliği vurgulama, scFv 14 göre sitoplazmik çözünürlük daha fazla bir artış görülmektedir. scFv'lerin afinite ve çözünür sentezleme aynı zamanda açısından taranır için, seçilmiş bir scFv mod olması mümkündürerate çözünürlük ancak yüksek bağlanma ya da tam tersi. Örneğin, scFv 2-1 scFv 2-3 daha düşük eriyebilir bir ifade vardır, ancak P-galaktosidaz için daha yüksek bir bağlanma eğilimi gösterir.

Şekil 7. Hedef bağlayıcı ve scFv sitoplazmik ifade iç zarı ekran kullanılarak izole varyantları. (A) scFv'ler E. sitoplazmasında ifade edildi coli Heksahistidin (6 × His) etiketi ile (ssTorA sinyal dizisi olmaksızın örneğin.,) hücreleri ve nikel-nitrilotriasetik asit spin-sütunları kullanılarak saflaştırılmış. -Galaktosidaz olan B için saflaştınlmış scFv'lerin bağlayıcı bir ELISA ile ölçüldü. Saflaştırılmış scFv'ler β-galaktosidaz ile kaplanmış ELISA plakaları üzerine yüklendi, ve bağlanmış scFv'ler bir anti-6 x -His antikor ile tespit edilmiştir. Veri altı tekrarların ortalamasıdır, ve buradaki hata çubuğu, ortalamanın standart hatasını gösterir.(B) sitoplazmik bir anti-6 x -His antikoru ile problanmış bir Batı lekesi ile analiz edilmiştir scFv'leri eksprese eden hücrelerden elde edilen hücre lizatları çözünen ve çözünmeyen fraksiyonlar. Toplam protein konsantrasyonu numune yükleme normalize etmek için kullanıldı. (A) yayımlanmaktadır ve izni ile referans 19 (B) uyarladı. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Sitoplazmik aktivite için antikorların mühendislik nedeniyle disülfid bağlarını 6,7 stabilize oluşumunu engellemektedir sitoplazmasında, azaltılması ortamda bir zor bir iştir. Bu, bağlanma afinitesi için tasarlanmış olan ek olarak, sitoplazma içinde kararlılıklannın ve çözülebilirliklerinin için tasarlanmıştır sürece sitoplazmik inaktif olarak en antikorları neden olur. Faj gösterimi, bakteriyel yüzey ekranında ve maya yüzey görüntüleme yöntemleri, mevcut yöntemler, tüm antikorların görüntülenmesi için salgılama yoluna 14-16 kullanır, ancak bu yöntemler, hücre içi katlama mühendislik için bir araç vardır. Tat yolunun katlama kalite kontrolü kötü katlanmış ve sitoplazmada kararsız olan antikorların translokasyonu önler, çünkü iç zarı ekranı kullanarak işlenmiş antikorlar sitoplazmik istikrar ve gelişmiş çözünürlüğe sahip. Bu yöntem afinite a mühendislik içi antikorların tekrarlı sürecini kolaylaştırırnd çözünürlük, iki özellik tek adımda mühendislik gibidir. bu yöntem indirgeyici hücre içi çevrede çözünürlüğe sahip antikorların mühendislik için tasarlanmış olsa da, aynı zamanda, proteinler, bu yöntem, periplazma oksitleyici ortamda katlama muhafaza kullanılarak tasarlanır, çünkü, indirgeyici olmayan koşullar işlev mühendislik antikorlara uygulanabilir.
Bu teknik, yüksek afinite ve yüksek sitoplazmik çözünürlüğe sahip antikorlar mühendislik sürecini kolaylaştırır rağmen, çeşitli sınırlamalar bu protokolü kullanarak göz önünde bulundurulacak önemlidir. İkincil ekran ELISA sinyallerini analiz ederken scFv varyantları umut tanımlamak için yeterli antijen bağlama sergilemek olmayabilir potansiyel olarak ilginç varyantları ve bu arasındaki seçici eşiği birkaç klon daha karakterize edilmiştir sonrasına kadar belirgin olması muhtemel değildir. Ana antikor üzerinde bağlayıcı geliştirilmiş bakmak için önemlidir; ancak,anormal yüksek sinyal avidite 29 veya toplama etkileri 30, iç-zar ekran tarama yaklaşımı özgü olmayan bir meydan okuma işaret olabilir. Bu protokolü kullanarak kaydırma sonra spheroplastlar kurtarmak için yetersizlik olduğunda onlar cansız (yayınlanmamış veri) olarak önemli bir sınırlaması, hatırlamak. Bu antikor kodlayan plazmidler kurtarmak için DNA amplifikasyonu ve dönüşüm adımlarını gerektirir.
protokolün birkaç kritik adımlar katlama ve antikorların bağlanma eşzamanlı mühendislik sağlar. Tarama başarılı olması için, taranan scFv kitaplığı ssTorA sinyal peptidine bir füzyon olarak ifade edilmelidir. Bu sekans olmadan, antikorlar, Tat yoluna yönlendirilecektir garanti eder ve periplasmasında 19 transloke edilmez. Buna ek olarak, bir C-terminal epitop etiketi kutusu görüntülenen antikorların saptanmasına olanak tanınması için antikorlara kaynaşık şarttırDing tahlilleri. Açıktır ki, E. coli suşu da gerekli Tat yolu makine olması gerekir scFv'leri ifade etmek için kullanılan, ancak bu yaygın olarak kullanılan E. doğrudur coli suşları.
Bu protokole değişiklikler arzu edilen özelliklere sahip antikorların izole edilmesi için potansiyelini geliştirmek mümkündür. Bir çıkarımsal kaydırma adım önce olmayan, istenen bileşenlerin scFv kütüphanesini tüketmek için hedef antijene karşı kaydırma tamamlanmış olabilir. Kütüphane sferoplastlar olmayan bir istenen proteini, tek başına veya kaplanmış BCCP kaplanmış manyetik boncuklarla inkübe edilebilir ve bu boncuklara bağlanan sferoplastlar istenen hedefe bağlanma için geri kalan bağlanmamış spheroplastlar taramadan önceki atılabilir. Örnek Sonuçlar de belirtildiği gibi, bir yöntem olup, izole edilmiş bir scFv afinite spheroplastlar görüntülenen scFv'den ile rekabet kaydırma reaksiyonunda çözünebilir rakip eklemektir geliştirmek. çözünür comp Çünküetitor hiç DNA spheroplastlar görüntülenen scFv'lerin yani sadece sekanslar PCR reaksiyonunda geri kazanılan olacak, amplifiye edilir, saflaştırılmış bir proteindir. Buna ek olarak, bu yöntem, antikor ya da olmayan bir antikor bağlama proteinlerinin diğer türleri mühendisliğine genişletilebilir.
E.coli iç zarı ekran yüksek afinite ve hücre içi çözünürlüğü yüksek olan mühendislik antikorları için güçlü bir platformdur. Bu yöntem, hücre içi çevrede meydana gelecek şekilde tasarlanmıştır antikorların etkin ürünler için özellikle uygundur. Bu hücre içi antikorlar, nörodejeneratif hastalıklar, kanser ve viral enfeksiyonların 31 gibi alanlarda bir dizi potansiyel terapötikler olarak araştırılmaktadır. Bu teknik, araştırma ve tıp bu alanlarda ve in situ bir protein hedefi istenen incelenmesi her bir diğer alan için bir araç olarak hücre içi antikorlar daha yaygın kullanımı sağlayacak.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
We thank Tomer Zohar for work on scFv screening and characterization assays. A portion of this work was supported by award number F32CA150622 from the National Cancer Institute (to AJK). The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Cancer Institute or the National Institutes of Health.
Malzemeler
| Name | Company | Catalog Number | Comments |
| scFv library | Varies | A suitable scFv library should be obtained from a commercial or academic source. | |
| MC4100 E. coli cells | Coli Genetic Stock Center | 6152 | Cells need to be chemically competent or electrocompetent, depending on the selected transformation method. |
| Glycerol | Fisher Scientific | BP229-4 | |
| Difco dehydrated culture media LB Broth, Miller (Luria-Bertani) | BD | 244610 | |
| Chloramphenicol (Cm) | Fisher Scientific | BP904-100 | |
| Sodium chloride (NaCl) | Fisher Scientific | BP358-1 | |
| Potassium chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, dibasic (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Potassium phosphate, monobasic (KH2PO4) | Fisher Scientific | BP362-500 | |
| Bovine serum albumin (BSA) | Fisher Scientific | BP9706-100 | |
| Sucrose | Fisher Scientific | BP220-1 | |
| Tris base | Fisher Scientific | BP1521 | |
| Ethylenediaminetetraacetic acid (EDTA), 0.5 M | Fisher Scientific | BP2482-500 | |
| Magnesium chloride (MgCl2) | Fisher Scientific | BP214-500 | |
| Lysozyme | Sigma Aldrich | L3790-10X1ML | |
| Vortex mixer | VWR | 97043-564 | |
| Bicine | Fisher Scientific | BP2646100 | |
| D-Biotin | Fisher Scientific | BP232-1 | |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher Scientific | BP1755-1 | |
| BugBuster Master Mix (cell lysis detergent) | EMD Millipore | 71456 | |
| Vivaspin 2 MWCO, 3,000 daltons | GE Healthcare Sciences | 28932240 | |
| Target antigen | Varies | N/A | Purified target antigen may be purchased or produced/purified. |
| Dynabeads MyOne Streptavidin T1 | Invitrogen | 65601 | |
| Dynamag-2 magnet | Invitrogen | 12321D | |
| Tube rotator | VWR | 13916-822 | |
| PCR primers | IDT | N/A | Primer sequences are as described in the protocol. |
| 10x T4 DNA ligase reaction buffer | New England BioLabs | B0202S | |
| T4 Polynucelotide kinase (PNK) | New England BioLabs | M0201S | Make sure the T4 ligase buffer used in the primer phosphorylation reaction contains 1 mM ATP. |
| 5x Phusion HF buffer pack | New England BioLabs | B0518S | |
| Deoxynucleotide (dNTP) solution mix, 10 mM each dNTP | New England BioLabs | N0447L | |
| Phusion DNA polymerase | New England BioLabs | M0530S | Other high-fidelity polymerases may be used as an alternative, but the annealing temperature in Table 3 must be adjusted. |
| C1000 Touch thermal cycler with dual 48/48 fast reaction module | Bio-Rad | 185-1148 | |
| Agarose | Promega | V3121 | |
| SYBR Safe DNA gel stain | Invitrogen | S33102 | |
| Wizard SV gel and PCR clean-up system | Promega | A9281 | |
| T4 DNA ligase | New England BioLabs | M0202S | |
| Microdialysis membrane filter | EMD Millipore | VSWP04700 | |
| Agar | BD | 214030 | |
| 96-well polystyrene round-bottom cell culture plates | VWR | 10062-902 | |
| Costar general polystyrene assay plate lids | Corning | 3931 | |
| Microtitre plate shaker | VWR | 12620-926 | |
| Costar 96 well EIA/RIA Easy Wash clear flat bottom polystyrene high bind microplate | Corning | 3369 | |
| Bel-blotter polycarbonate 96-well replicating tool | Bel-Art Products | 378760002 | |
| Instant nonfat dry milk | Quality Biological | A614-1000 | |
| Tween 20 (polysorbate 20) | Fisher Scientific | BP337-500 | |
| PopCulture reagent (concentrated cell lysis detergent) | EMD Millipore | 71092-3 | |
| Monoclonal ANTI-FLAG M2-Peroxidase(HRP) antibody produced in mouse | Sigma Aldrich | A8592 | |
| SigmaFast OPD | Sigma Aldrich | P9187-50SET | |
| Sulfuric acid (H2SO4), 10 N solution | Fisher Scientific | SA200-1 | |
| Reynolds Wrap aluminum foil | VWR | 89079-075 | |
| BioTek Epoch microplate spectrophotometer | Fisher Scientific | 11120570 |
Referanslar
- Biocca, S., Pierandrei-Amaldi, P., Campioni, N., Cattaneo, A. Intracellular immunization with cytosolic recombinant antibodies. Biotechnology (NY). 12 (4), 396-399 (1994).
- Chen, S. Y., Bagley, J., Marasco, W. A. Intracellular antibodies as a new class of therapeutic molecules for gene-therapy. Hum. Gene Ther. 5 (5), 595-601 (2008).
- Gargano, N., Biocca, S., Bradbury, A., Cattaneo, A. Human recombinant antibody fragments neutralizing human immunodeficiency virus type 1 reverse transcriptase provide an experimental basis for the structural classification of the DNA polymerase family. J Virol. 70 (11), 7706-7712 (1996).
- Mhashilkar, A. M., et al. Inhibition of HIV-1 Tat-mediated LTR transactivation and HIV-1 infection by anti-Tat single chain intrabodies. Embo J. 14 (7), 1542-1551 (1995).
- Strube, R. W., Chen, S. Y. Characterization of anti-cyclin E single-chain Fv antibodies and intrabodies in breast cancer cells: enhanced intracellular stability of novel sFv-F-c intrabodies. J. Immunol. Meth. 263 (1-2), 149-197 (2002).
- Mössner, E., Koch, H., Plückthun, A. Fast selection of antibodies without antigen purification: adaptation of the protein fragment complementation assay to select antigen-antibody pairs. J. Mol. Biol. 308 (2), 115-122 (2001).
- Wörn, A., et al. Correlation between in vitro stability and in vivo performance of anti-GCN4 intrabodies as cytoplasmic inhibitors. J Biol Chem. 275 (4), 2795-2803 (2000).
- Knappik, A., Plückthun, A. Engineered turns of a recombinant antibody improve its in vivo folding. Protein Eng. 8 (1), 81-89 (1995).
- Martineau, P., Jones, P., Winter, G. Expression of an antibody fragment at high levels in the bacterial cytoplasm. J Mol Biol. 280 (1), 117-127 (1998).
- Steipe, B., Schiller, B., Plückthun, A., Steinbacher, S. Sequence statistics reliably predict stabilizing mutations in a protein domain. J. Mol. Biol. 240 (3), 188-192 (1994).
- Daugherty, P. S. Protein engineering with bacterial display. Curr Opin Struct Biol. 17 (4), 474-480 (2007).
- Lener, M., et al. Diverting a protein from its cellular location by intracellular antibodies. Eur. J. Biochem. 267 (4), 1196-1205 (2000).
- Lynch, S. M., Zhou, C., Messer, A. An scFv intrabody against the nonamyloid component of α-synuclein reduces intracellular aggregation and toxicity. J. Mol. Biol. 377 (1), 136-147 (2008).
- Gai, S. A., Wittrup, K. D. Yeast surface display for protein engineering and characterization. Curr. Opin. Struc. Biol. 17 (4), 467-473 (2007).
- Kieke, M. C., et al. Selection of functional T cell receptor mutants from a yeast surface-display library. Proc. Natl. Acad. Sci. USA. 96 (10), 5651-5656 (1999).
- Steiner, D., Forrer, P., Stumpp, M. T., Pluckthun, A. Signal sequences directing cotranslational translocation expand the range of proteins amenable to phage display. Nat. Biotechnol. 24, 823-831 (2006).
- Pugsley, A. P. The complete general secretory pathway in gram-negative bacteria. Microbiol. Rev. 57 (1), 50-108 (1993).
- Rapoza, M. P., Webster, R. E. The filamentous bacteriophage assembly proteins require the bacterial SecA protein for correct localization to the membrane. J. Bacteriol. 175 (6), 1856-1859 (1993).
- Karlsson, A. J., et al. Engineering antibody fitness and function using membrane-anchored display of correctly folded proteins. J. Molec. Biol. 416 (1), 94-107 (2012).
- DeLisa, M. P., Tullman, D., Georgiou, G. Folding quality control in the export of proteins by the bacterial twin-arginine translocation pathway. Proc Natl Acad Sci U S A. 100 (10), 6115-6120 (2003).
- Fisher, A. C., Kim, W., DeLisa, M. P. Genetic selection for protein solubility enabled by the folding quality control feature of the twin-arginine translocation pathway. Protein Sci. 15 (3), 449-458 (2006).
- Maynard, J., Georgiou, G. Antibody engineering. Annu Rev Biomed Eng. 2, 339-376 (2000).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. 1, (2012).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--the database of key numbers in molecular and cell biology. Nucleic Acids Res. 38, D750-D753 (2010).
- Hermanson, G. T. . Bioconjugate Techniques. , (2013).
- Tayapiwatana, C., Chotpadiwetkul, R., Kasinrerk, W. A novel approach using streptavidin magnetic bead-sorted in vivo biotinylated survivin for monoclonal antibody production. J Immunol Methods. 317 (1-2), 1-11 (2006).
- Zhu, G., Song, L., Lippard, S. J. Visualizing inhibition of nucleosome mobility and transcription by cisplatin-DNA interstrand crosslinks in live mammalian cells. Cancer Res. 73 (14), 4451-4460 (2013).
- Bogsch, E. G., et al. An essential component of a novel bacterial protein export system with homologues in plastids and mitochondria. J. Biol. Chem. 273, 18003-18006 (1998).
- Julian, M. C., et al. Co-evolution of affinity and stability of grafted amyloid-motif domain antibodies. Protein Eng. Des. Sel. 28 (10), 339-350 (2015).
- Garber, K. Bispecific antibodies rise again. Nat. Rev. Drug. Discov. 13 (11), 799-801 (2014).
- Marschall, A. L., Dübel, S., Böldicke, T. Specific in vivo knockdown of protein function by intrabodies. MAbs. 7 (6), 1010-1035 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır