Method Article
Bakterielle Inner-Membran-Display für das Screening einer Bibliothek von Antikörperfragmenten
In diesem Artikel
Zusammenfassung
We provide a method to simultaneously screen a library of antibody fragments for binding affinity and cytoplasmic solubility by using the Escherichia coli twin-arginine translocation pathway, which has an inherent quality control mechanism for intracellular protein folding, to display the antibody fragments on the inner membrane.
Zusammenfassung
Antibodies engineered for intracellular function must not only have affinity for their target antigen, but must also be soluble and correctly folded in the cytoplasm. Commonly used methods for the display and screening of recombinant antibody libraries do not incorporate intracellular protein folding quality control, and, thus, the antigen-binding capability and cytoplasmic folding and solubility of antibodies engineered using these methods often must be engineered separately. Here, we describe a protocol to screen a recombinant library of single-chain variable fragment (scFv) antibodies for antigen-binding and proper cytoplasmic folding simultaneously. The method harnesses the intrinsic intracellular folding quality control mechanism of the Escherichia coli twin-arginine translocation (Tat) pathway to display an scFv library on the E. coli inner membrane. The Tat pathway ensures that only soluble, well-folded proteins are transported out of the cytoplasm and displayed on the inner membrane, thereby eliminating poorly folded scFvs prior to interrogation for antigen-binding. Following removal of the outer membrane, the scFvs displayed on the inner membrane are panned against a target antigen immobilized on magnetic beads to isolate scFvs that bind to the target antigen. An enzyme-linked immunosorbent assay (ELISA)-based secondary screen is used to identify the most promising scFvs for additional characterization. Antigen-binding and cytoplasmic solubility can be improved with subsequent rounds of mutagenesis and screening to engineer antibodies with high affinity and high cytoplasmic solubility for intracellular applications.
Einleitung
Antikörper, die Falten und in der intrazellulären Umgebung funktionieren sind vielversprechend Werkzeuge für die Forschung und therapeutische Anwendungen. Sie haben die Fähigkeit , die Proteinaktivität zu modulieren , indem sie innerhalb der Zellen an ein Zielprotein bindende Protein-Protein - Wechselwirkungen zu verhindern, Protein-Nukleinsäure-Wechselwirkungen stören, oder ein Substrat Zugang zu Enzyme 1-5 verhindern.
Obwohl Antikörper für die intrazelluläre Anwendungen viel Potential haben, sie Engineering für die richtige Faltung und Löslichkeit in der intrazellulären Umgebung, während die Fähigkeit beibehalten an ein Zielantigen zu binden, ist eine Herausforderung. Das Reduktions zytoplasmatische Umgebung verhindert die Bildung der Disulfidbindungen normalerweise erforderlich für die stabile Faltung von Volllängen - Antikörpern und Antikörperfragmente, einschließlich Einzelketten - Variable - Fragment (scFv) -Antikörper 6,7. Eine Reihe der gerichteten Evolution Ansätze verwendet wurden Antikörper mit h Ingenieurigh Affinitäten für Target - Antigene 8-10. Diese Ansätze häufig Phagen - Display, Hefe Oberfläche Anzeige oder Bakterienoberfläche Anzeige zu screenen große Bibliotheken von Antikörpern 11-13 verwenden. Diese Methoden sind leistungsfähig und wirksam für Antikörper zu identifizieren , die an Ziele binden, aber sie hängen von den sekretorischen Weg Proteine zu transportieren , die 14 bis 16 angezeigt. Der Sekretionsweg transloziert ungefaltete Proteine aus dem Reduktions Cytoplasma in das endoplasmatische Retikulum Lumen in Hefe oder in das Periplasma in Bakterien. Die Proteine falten dann unter oxidierenden Bedingungen und werden auf der Zelloberfläche oder in Phagenpartikel verpackt für die Bindungsaffinität 17,18 auf dem Bildschirm angezeigt. Als Ergebnis isolierten Antikörper mit diesen Techniken wird im Zytoplasma nicht notwendigerweise gut falten und intrazelluläre Löslichkeit oft müssen separat konstruiert werden, wenn die Antikörper in intrazellulären Anwendungen verwendet werden.
Verbesserndie Effizienz der Engineering - Antikörper , die in das Zytoplasma und gefaltet werden, wir zuvor berichtet , den Erfolg von MAD-TRAP (membranverankerten Anzeige für Tat-basierte Erkennung Assoziieren Proteine), ein Verfahren zum Screenen eines scFv - Antikörperbibliothek unter Verwendung von Escherichia coli inner- Membran - Display 19. Bakterielle Innenmembran Anzeige beruht auf der twin-arginine-Translokation (Tat) -Weg für den angezeigten Antikörpern Transport im Gegensatz zu anderen üblichen Anzeigemethoden, die den sekretorischen Weg verwenden. Der Tat - Weg enthält einen Mechanismus zur Qualitätssicherung , die erlaubt nur lösliche, korrekt gefaltete Proteine aus dem E. transportiert werden coli Zytoplasma über die innere Membran und in das Periplasma 20,21. Überexprimierten Tat Substrate (dh., Zielproteine an den Tat - Weg mit einer N-terminalen Fusion mit dem Tat - Signalpeptid ssTorA) , die in dem Zytoplasma und gefaltet sind eine langlebige Translokation bilden Zwischen mit dem N-Terminus in das Zytoplasma und der C-Terminus in das Periplasma 19. Dies ermöglicht die Anzeige von korrekt gefalteten Tat Substraten, einschließlich Antikörperfragmente auf der periplasmatischen Seite des E. coli innere Membran. Nachdem die äußere Membran durch enzymatischen Verdau entfernt Sphäroplasten zu erzeugen, werden Antikörper zu den extrazellulären Raum (Figur 1) ausgesetzt wird . Dies ermöglicht Tat Substrate auf der inneren Membran angezeigt für die Bindung an ein spezifisches Ziel gescreent werden. Wichtig ist, sorgt für die Tat-Weg nutzbar zu machen für Zelloberflächen-Display, dass nur die Antikörper in der Bibliothek, die im Zytoplasma gut gefaltet werden, werden für die Bindung abgefragt werden, so dass Simultaneous Engineering Affinität und intrazelluläre Faltung von Bindung. In diesem Protokoll beschreiben wir , wie auf der E. eine scFv - Bibliothek anzuzeigen coli innere Membran, die Bibliothek gegen ein Zielantigen schwenken, und führen Sie einen sekundären Bildschirm , um die vielversprechendsten Bestandteile der Bibliothek zu identifizieren. Während wir uns konzentrieren das Protokoll über scFvs könnte das Verfahren zum Engineering jedes Protein, deren Anwendung verbindlich und intrazelluläre Faltung erfordert angewendet werden.
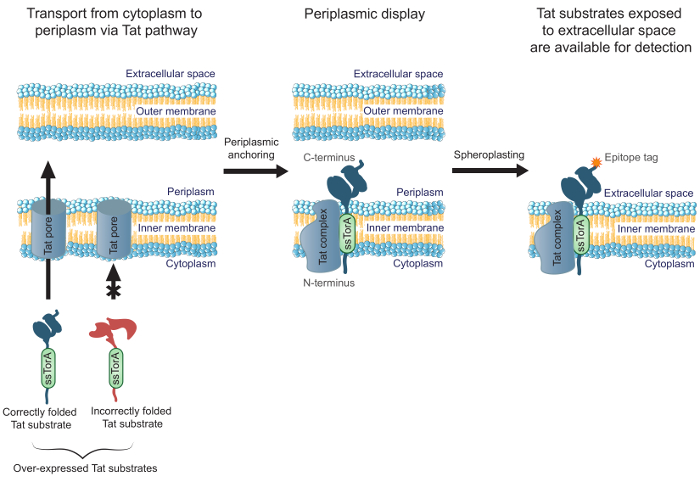
Abbildung 1. Tat Innenmembran - Display. In E. coli, scFv - Antikörper , die als Fusion mit dem ssTorA Signalsequenz und korrekt gefalteten im Cytoplasma exprimiert werden , werden über die innere Membran transportiert. Eine Translokation Zwischenformen, wobei die scFvs in der inneren Membran mit dem N-Terminus in dem Zytoplasma und dem C-Terminus in das Periplasma verankert sind. Die E. coli äußeren Membran enzymatisch verdaute Sphäroplasten zu bilden, wodurch die verankerten Antikörper gegen den extrazellulären Raum freigelegt und zur Verfügung zum Nachweis Herstellung durch Verwendung eines Antikörpers, der auf dem angezeigten Antikörper an das C-terminal verschmolzenen Epitop - Tag bindet.Last / 54583 / 54583fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Protokoll
1. Bereiten Sie die scFv Bibliothek als Fusion mit dem ssTorA Signalsequenz
- Besorgen Sie sich eine Desoxyribonukleinsäure (DNA) Bibliothek Varianten eines scFv-Gen enthält.
HINWEIS: Die Bibliothek auch konstruiert werden , kann jede geeignete Modus Diversität über die gesamte scFv - Gen oder gezielte Domänen zu erzeugen , 22 (beispielsweise der dritten komplementaritätsbestimmenden Regionen, CDR3s.). - Legen Sie die DNA - Bibliothek in das PIMD Plasmid (Abbildung 2) unter Verwendung von Standard molekularen Klonierungsverfahren 23.
Hinweis: Dieses Plasmid exprimiert scFvs als genetische Fusion an die ssTorA Signalsequenz (N-terminal zu scFv) und dem FLAG-Epitop-Tag (C-terminal an das scFv). Die Konstruktion des Plasmids für die innere Membran Anzeige wurde zuvor 19 beschrieben. Das PIMD Plasmid ist von den Autoren zur Verfügung.
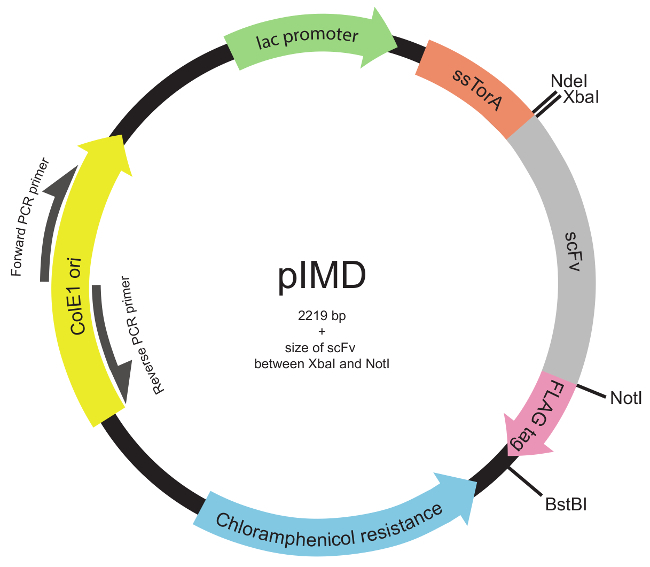
Abbildung 2. Inner-Membran Anzeige Plasmid (PIMD) Karte (Schritte 1.2 bis 1.3). Dieses Plasmid enthält ein lac - Promotor, ColE1 - Replikationsursprung und ein Chloramphenicol - Resistenzgen. Der eingegebene scFv-Gen wird in die ssTorA Signalsequenz fusioniert ist, die scFv an den Tat-Weg zum Ziel und mit einem FLAG-Epitop-Tag, wobei alle drei im gleichen Leserahmen. Restriktionsenzymstellen sind angegeben. Für eine Bibliothek zwischen den XbaI und NotI - Restriktionsenzym - Stellen eingefügt, die Größe des Plasmid ist 2219 bp plus der Größe des scFv. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Wandeln Sie die Plasmid - DNA , die die Bibliothek in MC4100 E. enthält coli - Zellen 23. Erholen und wachsen diese bakterielle Form der Bibliothek. Zentrifuge bei 4000 × g für 15 min bei RT die Zellen zu sammeln. Entfernen des Überstandes und Resuspendieren der gesammelten Zellenin 25% Glycerol in Luria-Bertani (LB) Medium. Shop Aliquots bei -80 ° C, bis sie benötigt, oder gehen Sie zu Schritt 2.
HINWEIS: Das Protokoll wurde mit MC4100 - Zellen überprüft worden, obwohl andere E. coli - Stämme sind auch mit dem Protokoll kompatibel sein erwartet. Elektroporation ist das bevorzugte Verfahren für die Transformation, aufgrund seiner hohen Transformationseffizienz. Die Bibliothek sollte typischerweise aus mindestens 10 9 scFv in diesem Stadium Varianten und jedes Aliquot sollte genug Zellen enthalten , so dass die Bibliothek 100fachen bedeckt.
2. Drücken Sie die Bibliothek und vorbereiten Sphäroplasten
- ein Aliquot der bakteriellen Bibliothek (aus Schritt 1.3) bei RT auftauen, und fügen Sie den aliquoten in einen Kolben mit 100 ml LB-Medium mit 20 ug / ml Chloramphenicol (Cm). Wachsen 3 h bei 37 ° C und 225 rpm in einem Schüttler inkubiert.
- Nach 3 Stunden, die Kolben aus dem 37 ° C inkubiert Schüttler entfernen. Lassen Sie die Expression der scFv-BibliothekO / N für 15 bis 22 Stunden bei 20 ° C und 225 rpm in einem Schüttler inkubiert fortzufahren.
HINWEIS: Kein Induktor benötigt wird, wenn das PIMD Plasmid verwenden, da der Promotor undicht ist. Beachten Sie, dass MC4100 Zellen überexprimiert nicht den Lac-Repressor (und LacI nicht auf dem Plasmid gefunden).

Abbildung 3. E. coli - Zellen und Sphäroplasten. (A) E. coli - Zellen sind von zylindrischer Form. (B) Nach Spheroplasting EDTA und Lysozym unter Verwendung der äußeren Membran des E. coli Zellen wird aufgebrochen, und die erhaltenen Sphäroplasten sind kugelförmig. Differentialinterferenzkontrast (DIC) Mikroskopie - Aufnahmen wurden mit einem 100x Objektiv auf einem inversen Mikroskop erhalten. Bitte clecken hier eine größere Version dieser Figur zu sehen.
- Bereiten Sie die Bibliothek Sphäroplasten.
HINWEIS: Die Sphäroplasten werden durch Zerreißen der äußeren Membran von E. gebildet coli und sind kugelförmig (Figur 3).- Bereiten Sie die erforderlichen Puffer.
HINWEIS: Alle Puffer sollten steril sein.- Vorbereitung 1 × Phosphat-gepufferter Salzlösung (PBS; pH 7,4) durch Auflösen von 8 g NaCl, 0,2 g KCl, 1,44 g Na 2 HPO 4 und 0,24 g KH 2 PO 4 in destilliertem H 2 O auf ein Endvolumen von 1000 ml. Halten Sie sich auf dem Eis.
- Bereiten PBS mit 0,1% (w / v) Rinderserumalbumin (BSA) durch Auflösen von 0,2 g BSA in 200 ml 1 × PBS. Halten Sie sich auf dem Eis.
- Bereiten Sie die Fraktionierung Puffer (FB) um 7,5 ml sterilfiltrierter 1 M Saccharose, 1 ml 1 M Tris - Puffer (pH 8,0) vermischt und 1,5 ml destilliertem H 2 O. Halten Sie sich auf dem Eis.
- Vorbereitung 1 mM Ethylendiamintetraessigsäure (EDTA) durch Zugabe von 30 & mgr; l of 0,5 M EDTA zu 14,97 ml destilliertem H 2 O.
- Bereiten 0,5 M MgCl 2 von 4,76 g MgCl 2 in 100 ml Lösen von H 2 O destilliert Halten Sie sich auf dem Eis.
- Entfernen Sie den Kolben aus dem Schüttler, und messen die optische Dichte (OD) bei 600 nm mit einem Spektralphotometer der Zelldichte zu bestimmen. Berechne das Volumen der induzierten Kultur benötigt , so dass jede Probe für Spheroplasting 1 × 10 10 Zellen hat.
HINWEIS: Die Annäherung einer OD 600 von 1 mit einer Konzentration von 10 9 Zellen / ml für E. anzeigt , coli 24 können verwendet werden. - Zentrifuge das berechnete Volumen der induzierten Kultur in ein 1,5 ml Mikrozentrifugenröhrchen bei 12000 × g bei RT für 5 min. Bereiten Sie mindestens zwei Proben in dem Fall, dass ein Problem bei der Probenvorbereitung entsteht.
- Entfernen Sie den Überstand von den zentrifugiert Kulturen und resuspendieren jedes Zellpellet in 100 ul eiskaltem FB. Zentrifuge bei 12.000 ×g bei RT für 1 min, und anschließend den Überstand mit einer Pipette entfernt werden. Resuspendieren jedes Pellet in 350 ul eiskaltem FB ergänzt mit 3,5 ul 10 mg / ml Lysozym.
- Langsam jedes Röhrchen verwirbeln, während die Zugabe tropfenweise 700 ul 1 mM EDTA, und dann für 20 min die Röhrchen bei RT inkubieren, während langsam auf einem Rohr rotierenden Rotator um die Proben zu mischen. Entfernen Sie die Schläuche aus dem Rotator, fügen Sie 50 ul eiskaltem 0,5 M MgCl 2 in jedes Röhrchen und brüten sie auf Eis für 10 min. Zentrifuge die Röhrchen bei 11.000 × g bei 4 ° C für 10 min.
- Isolieren Sie die Sphäroplast Pellet.
- Verwenden Sie einen Mikro mit einer 1 ml-Spitze zu langsam Teil des Pellet nach oben ziehen. in einem Winkel mit der Öffnung direkt über ein neues 1,5-ml-Röhrchen, heben Sie langsam die Pipettenspitze aus dem Überstand, während das Rohr halten und das Pellet in das neue Rohr schieben.
- Wenn ein signifikantes Volumen an Überstand auf das neue Rohr übertragen wird, entfernen Sie sie durch Pipettieren. Wenn das Pellet nicht fest ist enoigitt zu übertragen, Wieder Zentrifuge bei 11.000 × g für 2 min und Versuch Pellet Isolation wieder.
- Resuspendieren Sphäroplast Pellet in jedem Röhrchen in 1 ml eiskaltem 1 × PBS. Wechseln Sie zwischen Pipettieren und langsam verwirbelt auf einem Vortex-Halter, bis das Pellet vollständig suspendiert ist. Bewahren Sie keine Proben für mehr als 2 min zu einer Zeit des Eises ab und kehren zum Eis für mindestens 5 min, bevor er wieder aus dem Eis zu entfernen. Halten Sie die Sphäroplasten bei 4 ° C (für bis zu 2 Tage) bis zum Schwenken in Schritt 4 verwendet.
- Bereiten Sie die erforderlichen Puffer.
3. Unbeweglichkeitseffekt das Ziel-Antigen auf Magnetic Beads
- Biotinylierung das Zielantigen in vivo während der rekombinanten Produktion in E. coli - Zellen. Alternativ chemische Konjugation 25 oder Kauf Zielantigen verwenden , die bereits biotinyliert wurde, und fahren 3.2 zu Schritt.
- In 816 g Bicin bis 50 ml Wasser auf 10 × Bicin Puffer zu machen. Verdünnen Sie die buffer bis 1 × in destilliertem H 2 O und Wärme auf 50 ° C. In 14,7 mg Biotin bis 12 ml des erwärmten 1 × Bicin Puffer eine Biotin-Lösung zu machen, die 5 mM Biotin in 10 mM Bicin Puffer ist. Lagerung bei -20 ° C bis benötigt.
- Auszudrücken und Biotinylierung des Zielproteins mit Hilfe des pAK400cb-BCCP Plasmid 26, die die Produktion des Zielantigens als eine Fusion an das Biotin - Carboxyl - Carrier - Protein (BCCP) ermöglicht.
HINWEIS: E. coli - Zellen nativ biotinylieren BCCP, entfällt die Notwendigkeit zu reinigen und chemisch das Zielprotein vor der Immobilisierung auf mit Streptavidin beschichteten Kügelchen biotinylieren. Die native E. coli Biotin - Ligase BirA ist ausreichend zur Biotinylierung des Fusionsproteins.- Wachsen E. coli , enthaltend das Biotinylierung Plasmid (mit der als eine Fusion an den N-Terminus von BCCP eingefügt Zielantigen) O / N für 15 bis 18 Stunden in 5 ml LB - Medium mit 20 ug / ml Cm bei 37 ° C ergänzt unter Schütteln bei 225 Upm.
- Messen Sie die OD bei 600 nm mit einem Spektralphotometer und berechnen das Volumen der Kultur benötigt (V) In den Subkultur zu einem Ausgangs - OD von 0,05 in 25 ml frischem LB - Medium mit 20 ug / ml Cm unter Verwendung der Gleichung: V add = (0,05 × 25 ml) / (OD 600 bis 0,05), wobei OD 600 ist die optische Dichte des O / N - Kultur und V hinzuzufügen , ist das Volumen des O / N - Kultur auf die frische LB. hinzuzufügen Subkultur und auf eine OD von 0,5 bis 0,8 in einem Schüttler inkubiert bei 37 ° C und 225 UpM wachsen.
- Hinzufügen Isopropyl β-D-1-thiogalactopyranosid bis zu einer Endkonzentration von 100 uM und Biotin bis zu einer Endkonzentration von 5 uM. Induzieren die Expression in einer Schüttelvorrichtung inkubiert 15 bis 22 Stunden bei 20 ° C und 225 Umdrehungen pro Minute.
- Ernte Bakterien durch Zentrifugation bei 4.000 × g bei 4 ° C für 10 min. Entfernen Sie den Überstand. Lagern Sie das Pellet bei -20 ° C bis zur Verwendung.
- Hinzufügen1 ml einer Zelllyse Waschmittels pro 0,2 g Zellpellet. Resuspendieren durch Pipettieren und drehen sanft für 20 Minuten um die Zellen zu lysieren. Nach der Lyse Zentrifuge bei 16.000 × g und 4 ° C für 20 min. Pipette das lösliche Lysat (Überstand) in ein neues 1,5-ml-Röhrchen.
- Verwenden Sie ein 3 kDa Molekulargewichtsgrenze Säule des ungebundenen Biotin zu entfernen. Pipettieren des Lysats in die Säule und zentrifugieren bei 20 ° C gemäß den Anweisungen des Herstellers. Waschen mit 1 × PBS, bis das Biotin in dem Lysat wurde 100-fach und das Volumen des gewaschenen Lysat wird auf das ursprüngliche Volumen des Lysats gleich verdünnt worden. Transfer des Lysats in ein neues Röhrchen.
- Immobilisieren das biotinylierte Zielantigen auf Streptavidin-beschichteten magnetischen Kügelchen.
- Vorbereitung 1 × PBS und 1 × PBS mit 0,1% (w / v) BSA, wie in Schritt 2.3.1 beschrieben.
- Bereiten Sie die magnetischen Kügelchen.
ANMERKUNG: Dies erfordert die Verwendung einer magnetischen Trennständer.- resuspendieren streptavidin-beschichteten magnetischen Kügelchen in ihrer Originalflasche. Entweder Wirbel für mindestens 30 Sekunden oder drehen 5 min.
- Übertragen 7-10 × 10 9 Kügelchen in ein 1,5 - ml - Röhrchen.
HINWEIS: Das erforderliche Volumen wird auf der Perlenkonzentration vom Hersteller geliefert, abhängig sein. - Das Röhrchen wird die Perlen auf dem Magnetträger für 2 min mit den Perlen auf der Seite des Röhrchens zu sammeln. Mit dem Rohr noch auf dem Magneten, entfernen Sie den Überstand vorsichtig durch Pipettieren ohne die Perlen zu stören.
- Zum Waschen entfernen Sie den Schlauch aus dem Magneten und resuspendieren die Perlen in 1 ml 1 × PBS durch Pipettieren ohne Blasen zu erzeugen. Bringen Sie das Rohr zum Magneten für 2 min die Perlen zu sammeln, und den Überstand vorsichtig entfernen durch Pipettieren. Den Vorgang wiederholen zwei weitere Male für insgesamt drei Waschungen. Stellen Sie sicher, dass keine Flüssigkeit in dem Rohr nach dem letzten Waschschritt bleibt.
- Fügen Sie das Lysat des biotinylierten Antigens an den magnetischen bea enthältds.
- Entfernen des Rohres aus dem Magneten und Resuspendieren der Kügelchen in 1 ml des Lysats (aus Schritt 3.1.5). für 30 Minuten bei RT inkubieren, während sanft drehen.
- Das Röhrchen wird auf dem Magneten 3 min die Antigen-beschichteten Perlen zu sammeln. Waschen der beschichteten Kügelchen fünfmal mit 1 × PBS mit 0,1% BSA auf die gleiche Weise wie in den Schritten 3.2.2.3 bis 3.2.2.4 beschrieben. Nach dem letzten Waschen, Resuspendieren der Kügelchen in 1 × PBS mit 0,1% BSA up Volumen derselben in Schritt 3.2.2.2 verwendet.
- Wenn das immobilisierte Ziel-Antigen bei 4 ° C stabil ist, lagern die beschichteten Kügelchen bei 4 ° C bis zum Schwenken erforderlich ist. Andernfalls gehen Sie zu Schritt 4.
4. Bildschirm die scFv-Bibliothek durch Panning gegen das Zielantigen (Abbildung 4)
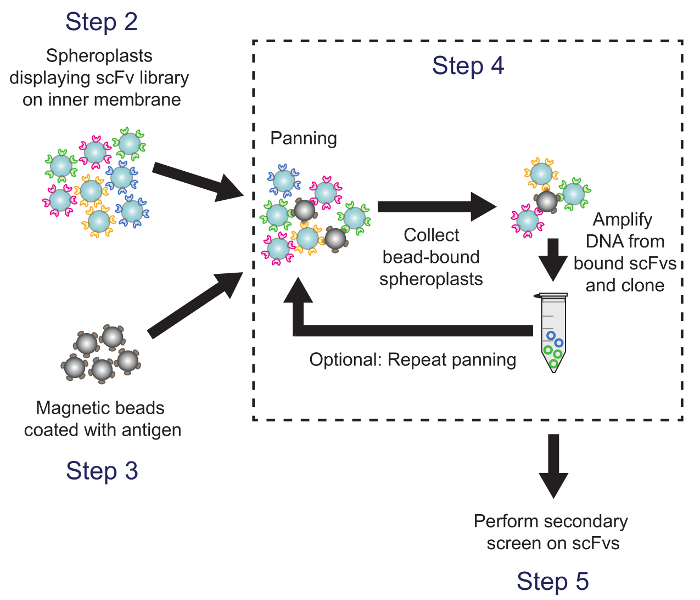
Abbildung 4. Schwenken (Schritt 4). Antigen-beschichteten magnetischen Kügelchen are mit Sphäroplasten exprimieren Antikörper-Bibliothek Varianten inkubiert. Plasmid DNA aus Kügelchen gebundenen Sphäroplasten wird zurückgewonnen und verwendet, um eine Subbibliothek zu erzeugen, die die ELISA-basierten sekundäre Sieb gesiebt verwendet. Entsprechende Protokollschritte werden zur Kenntnis genommen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Inkubieren der beschichteten Kügelchen mit Sphäroplasten.
- Verwenden Sie ein Sphäroplast zum Auffädeln Verhältnis von etwa 5: 1. In 4 × 10 9 Sphäroplasten und 8 × 10 8 Kügelchen in ein steriles 15 ml Röhrchen.
HINWEIS: Es sei angenommen , daß keine Zellen während des Spheroplasting verloren wurden, so dass die Konzentration noch 1 × 10 10 Sphäroplasten / ml ist. - 1 × PBS mit 0,1% BSA das Gesamtvolumen auf 4 ml zu bringen. Aliquot in vier 1,5-ml-Röhrchen mit 1 ml. Inkubieren der Reaktion bei 4 ° C für 5 Stunden unter leichtem Drehen.
- Verwenden Sie ein Sphäroplast zum Auffädeln Verhältnis von etwa 5: 1. In 4 × 10 9 Sphäroplasten und 8 × 10 8 Kügelchen in ein steriles 15 ml Röhrchen.
- Prepare die Kügelchen gebundenen Sphäroplasten für die Polymerase-Kettenreaktion (PCR).
- Legen Sie die Panning Reaktionsrohre auf dem Magneten 3 min. Entfernen Sie den Überstand durch Pipettieren und wäscht die Sicke gebundenen Sphäroplasten viermal mit eiskaltem 1 × PBS mit 0,1% BSA auf die gleiche Weise wie in den Schritten 3.2.2.3 bis 3.2.2.4 beschrieben. Resuspendieren der Kügelchen gebundenen Sphäroplasten in jedem Röhrchen in 25 ul destilliertem H 2 O. Lagern Sie die Perlen bei -20 ° C oder gehen 4.3 zu Schritt.
- Führen Ganz Plasmid PCR an Kügelchen gebundenen Sphäroplasten die Plasmide zu amplifizieren, die die Gene für die Kügelchen gebundenen scFvs enthält.
- Erhalten Primer mit den folgenden Sequenzen: 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(Forward-Primer) und 5'TAGCTCTTGATCCGGCAAACAAA3' (Reverse-Primer).
ANMERKUNG: Diese werden Ende-zu-Ende binden an entgegengesetzten Strängen des Plasmids PIMD (Figur 2) und sind mit einem gemeinsamen Merkmal PIMD zu tempern ausgelegt, so wird Amplifikation auftreten , unabhängig von derscFv Variantensequenz. - Phosphorylieren der Primer.
Anmerkung: Ohne Phosphorylierung, Religation wird nicht auftreten. Primer können auch mit 5'-Phosphorylierung bestellt werden, anstatt diese Phosphorylierung Verfahren in diesem Protokoll.- In einer 0,5 - ml - Röhrchen, eine Phosphorylierungsreaktion für die Vorwärts - PCR - Primer aufgebaut , wie in Tabelle 1 beschrieben. Wiederholen Sie diesen Vorgang für die Reverse - Primer.
- Inkubiere die Reaktionen bei 37 ° C für 1 Stunde. Dann inkubieren bei 65 ° C für 20 min, um die T4-Polynukleotidkinase (PNK) zu deaktivieren. Lagern Sie die phosphorylierte Primer bei -20 ° C.
- Führen Sie die PCR.
- In einem PCR - Röhrchen, bereiten die PCR - Reaktion wie in Tabelle 2 beschrieben.
HINWEIS: Mehrere Reaktionen können für eine höhere Ausbeute hergestellt werden. Die nicht verwendeten Kügelchen gebundenen Sphäroplasten kann bei -20 ° C gelagert werden. - Erhitzen Sie die PCR-Reaktionen bei 98 ° C für 15 min in einem Thermocycler vollständige Lyse sicherzustellen der Sphäroplasten. Entferne die Röhrchen aus dem Thermocycler und mit 0,5 ul einer High-Fidelity-Polymerase zu jedem. Rücklaufrohre zu den Thermocycler und starten Sie das Programm mit detaillierten in Tabelle 3.
- Pool der PCR-Produkte als angemessen. Lagerung bei -20 ° C oder gehen 4.4 zu Schritt.
- In einem PCR - Röhrchen, bereiten die PCR - Reaktion wie in Tabelle 2 beschrieben.
- Erhalten Primer mit den folgenden Sequenzen: 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(Forward-Primer) und 5'TAGCTCTTGATCCGGCAAACAAA3' (Reverse-Primer).
Tabelle 1 PNK Phosphorylierungsreaktion (Schritt 4.3.2.1).
| Reagens | Volumen (ul) |
| Destilliertes H 2 O | 15 |
| 10x T4-DNA-Ligase-Reaktionspuffer | 2 |
| 100 & mgr; M Primer | 2 |
| T4-Polynukleotidkinase (PNK) | 1 |
| Reagens | Volumen (ul) |
| Destilliertes H 2 O | 28.5 |
| 5x High-fidelity-Polymerase-Puffer | 10 |
| 10 & mgr; M Phosphorylated Vorwärtsprimer | 2.5 |
| 10 & mgr; M Phosphorylated Reverse-Primer | 2.5 |
| 40 mM dNTP-Mix (10 mM jedes dNTP) | 1 |
| Bead-gebundene Sphäroplasten | 5 |
Tabelle 3. PCR - Programm (Schritt 4.3.3.2).
| Schritt | Temperatur (° C) | Zeit (min: sek) | Anzahl der Zyklen |
| Initial denaturieren | 98 | 0.30 | 1 |
| Denaturieren | 98 | 00.10 | 35 |
| Glühen | 69 | 0.30 | |
| Erweiterung | 72 | 0.30 pro kb | |
| Endgültige Verlängerung | 72 | 06.00 | 1 |
| Halten | 12 | Unendlich | 1 |
- Re-circularize die ganze-Plasmid PCR - Produkte, und verwenden Sie das ligierte Produkt MC4100 E. zu transformieren coli - Zellen.
- Man reinige das PCR - Produkt von der PCR - Reaktion läuft auf einem Agarosegel 23, Anfärben der DNA in dem Gel 23 und unter Verwendung einerGel Cleanup Kit das linearisierte Plasmid gemäß den Anweisungen des Herstellers zu reinigen. Messen Sie die Konzentration eines Spektrophotometers bei 260 nm verwendet wird. Lagern Sie das gereinigte Fragment bei -20 ° C bis sie benötigt werden, oder weiter 4.4.2 Schritt.
- Re-circularize Plasmid aus dem PCR-Produkt.
- Um zu verhindern , intermolekulare Ligation des PCR - Produkts, Durchführung der Ligationsreaktion mit einer niedrigen Konzentration von 27 1 ng / & mgr; l des PCR - Produktes. Berechnen Sie das Volumen benötigt zur Herstellung eines 800 & mgr; l Ligationsreaktion bei dieser Konzentration.
- Bereiten Sie die Ligatur Reaktion auf Eis. In einem Rohr, fügen Sie die in Schritt 4.4.2.1 des PCR - Produkts berechnet Volumen, 80 & mgr; l von 10 × DNA - Ligase - Puffer und destilliertem H 2 O bis zu 800 & mgr; l. Hinzufügen, 4 ul T4 DNA Ligase und sofort Die Röhrchen bei 16 ° C in einem Wasserbad oder Thermocycler. Inkubieren bei 16 ° CO / N für 14 bis 18 Stunden. Speichern Sie die fertigen Ligasierungsreaktionen bei -20 ° Cbis sie benötigt werden, oder gehen Sie 4.4.3 Schritt.
- Platzieren Sie die Ligationsreaktion auf einem Heizblock bei 65 ° C für 15 Minuten, um die DNA-Ligase wärme inaktivieren. Dann verwenden Sie eine Mikrodialyse- Membran oder DNA-Cleanup-Kit, um de-Salz mit der ligierten DNA. Lagern bei 20 ° C oder gehen 4.4.4 zu Schritt.
- Verwenden Sie die gesamte hitzeinaktiviertem, de-gesalzen Ligierungsproduktes MC4100 E. zu transformieren coli - Zellen 23. Bereiten Glycerinstamm, wie in Schritt 1.3, der Zellen enthält, die sich ergebende ausgewaschen Subbibliothek beschrieben und speichern Aliquots bei -80 ° C.
- Wiederholen Sie Schritt 4 in seiner Gesamtheit eine aliquote Menge von Schritt 4.4.4 unter Verwendung eines zweiten Panning auf der Unterbibliothek zu tun.
HINWEIS: Eine zweite Panning hilft für Bibliothek Bestandteile bereichern , die gut an das Ziel - Antigen 19 binden.
5. Führen Sie einen zweiten Bildschirm unter Verwendung eines Enzym-Immunoassay-Methode viel versprechende Klone zu identifizieren, für die weitere Charakterisierung (Abbildung 5)
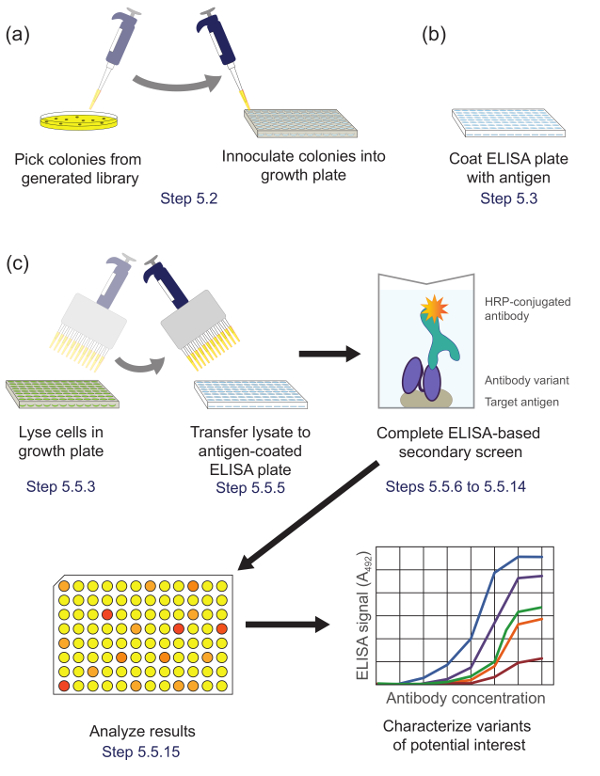
Abbildung 5 : ELISA-basierten Sekundärscreening (Schritt 5). (A) Bibliothek Varianten aus der Unterbibliothek während Panning angereichert werden in einzelnen Vertiefungen einer Kulturplatte für das Wachstum und die Expression inokuliert. (B) Eine ELISA - Platte wird mit dem Zielantigen beschichtet. (C) Die Bibliothek Varianten werden unter Verwendung des ELISA-basierten sekundären Bildschirm im Protokoll beschrieben gescreent. Bei der Analyse der Daten aus dem sekundären Bildschirm erhalten, Varianten von Interesse ausgewählt und weiter gekennzeichnet. Entsprechende Protokollschritte werden zur Kenntnis genommen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Tauen ein Rohr der verrissen Subbibliothek (aus Schritt 4.4.4) und Platte auf LB-Agar-Platten. Platte mehrere Verdünnungenbei Konzentrationen niedrig genug einzelne Kolonien zu gewährleisten (beispielsweise 10 2 - bis 10 6 -fachen Verdünnungen). Inkubieren der Platten für 15 bis 18 Stunden bei 37 ° C. Lagern Sie die Platten bei 4 ° C oder gehen 5.2 zu Schritt.
- Kultur und induzieren Kolonien von der verrissen Subbibliothek. Führen Sie alle Schritte unter sterilen Bedingungen. Verwenden Sie eine Mehrkanalpipette für die Schritte 96-Well-Platten beteiligt sind.
- In 200 ul LB mit 20 ug / ml Cm in jede Vertiefung einer Rundboden-96-Well-Kulturplatte.
- Wählen Sie eine einzelne Kolonie von der Agarplatte mit einer Pipettenspitze, legen Sie die Spitze in der ersten Vertiefung der 96-Well-Platte, und sanft rühren zu impfen. Verwenden Sie für jede Vertiefung eine neue Spitze. eine Kolonie in jede Vertiefung impfen. Als Kontrolle mindestens ein Sterilitätskontrolle gut keine Kolonie inokuliert.
- Wiederholen Sie die Schritte 5.2.1 und 5.2.2 bis zu mehreren 96-Well-Platten impfen.
- Legen Sie die 96-Well-Platten auf einem Schüttler bei 310 Umdrehungen pro Minute. Inkubieren bei 376; C für 20 bis 24 Stunden die scFvs auszudrücken.
- Für jede Kulturplatte in Stufe 5.2, Mantel einer 96-Well-ELISA-Platte mit dem Zielantigen.
- Verdünnter gereinigter Zielantigen zu einer geeigneten Konzentration (beispielsweise 1 & mgr; g / ml bis 4 & mgr; g / ml) in 1 × PBS um die Beschichtungslösung herzustellen. Machen Sie 5 ml Beschichtungslösung für jede 96-Well-Platte.
Hinweis: Die entsprechende Konzentration auf das spezifische Antigen hängt verwendet und muss unter Umständen angepasst werden. - In 50 ul der Beschichtungslösung zu jeder Vertiefung einer 96-Well-Hoch Bindung klarem Polystyrol-ELISA-Platte. Klopfen Sie leicht die Platte an der Benchtop-Oberfläche, dass die gesamte Oberfläche jedes gut gewährleistet ist, beschichtet. Wiederholen Sie für jede Platte. Inkubiere die Platten bei 4 ° CO / N.
- Verdünnter gereinigter Zielantigen zu einer geeigneten Konzentration (beispielsweise 1 & mgr; g / ml bis 4 & mgr; g / ml) in 1 × PBS um die Beschichtungslösung herzustellen. Machen Sie 5 ml Beschichtungslösung für jede 96-Well-Platte.
- Replizieren Sie die Kolonien, die aus den 96-Well-Kulturplatten auf Agarplatten.
- Legen Sie eine sterile Polystyrol-Replikator in die Vertiefungen einer Kulturplatte eine kleine Menge von Liqu zu sammelnIch würde. Sorgfältig den Replikator erhöhen und so zu einer 15 cm LB-Agar-Platte übertragen, dass alle Tipps, um die Platte berühren. Sobald die Flüssigkeit übertragen hat, heben Sie gerade nach oben den Replikator. Wiederholen Sie für jede Kulturplatte.
- Beschriften Sie die Agar-Platte mit der richtigen Ausrichtung, so dass die Ergebnisse aus dem sekundären Bildschirm im 96-Well-Platte kann mit der richtigen replizierten Kolonie auf der Platte angepasst werden, wenn die weitere Charakterisierung erwünscht ist. Wachsen bei 37 ° C für 15 bis 18 Stunden, und dann bei 4 ° C lagern, bis sie gebraucht.
- Führen Sie den ELISA sekundären Bildschirm.
- Bereiten Sie die Blockierungslösung von 2% zu machen (w / v) Trockenmilch in 1 × PBS. Entleeren der Beschichtungslösung aus den ELISA-Platten. Füge 100 ul der Blockierungslösung in jede Vertiefung. mindestens 2 Stunden bei RT inkubieren oder Block O / N bei 4 ° C.
- Vorbereitung der Waschpuffer durch Polysorbat 20 bis zu einer Endkonzentration von 0,05% in 1 × PBS hinzugefügt wird. Stellen Sie 250 ml pro ELISA-Platte.
- In 20 ul einerkonzentrierte Waschmittel Zelllyse zu jeder Vertiefung der Rundboden-Kulturplatte, und die auf einem Mikrotiterplatten-Schüttler Kulturplatte für 15 bis 20 min bei RT inkubiert. Beginnen die Lyse zur gleichen Zeit, dass die Blockierung der ELISA Platten abgeschlossen ist, so dass die Lyse und Waschschritt 5.5.4 gleichzeitig durchgeführt werden können.
- Leeren Sie den Blockierungslösung aus den ELISA-Platten. Waschen Sie die blockierten ELISA-Platten viermal mit 200 ul Waschpuffer pro Vertiefung pro Wäsche. Leeren Sie den Waschpuffer aus den Vertiefungen.
- Dann werden 50 & mgr; l aus jeder Vertiefung der Platte Zelllyse die Vertiefung der ELISA-Platte entspricht, eine neue Spitze für jede Vertiefung verwenden. Inkubiere die ELISA-Platte bei RT für 1 bis 2 h.
- Bereiten Sie die Antikörperlösung zu gebundenen scFvs erkennen.
- Verwenden, um eine Meerrettich-Peroxidase (HRP) -konjugiertem primären Antikörper, der in die Bibliothek scFvs fusioniert an die FLAG-Epitop-Tag bindet.
- Verdünnen Sie die Antikörper an die entsprechende Verdünnung in einem ELISA zu verwenden (siehe Zulieferer & #39; s Empfehlungen) in 2% (w / v) Trockenmilch in 0,05% Polysorbat 20 in 1 × PBS. Bereiten Sie 5 ml für jede Platte.
- Waschen Sie die ELISA-Platten viermal mit Waschpuffer wie in Schritt 5.5.4 beschrieben.
- Je 50 ul der Antikörperlösung zu jeder Vertiefung der ELISA-Platte. Inkubieren für 1 bis 2 h bei RT.
- Bereiten Sie das HRP - Substrat durch Auflösen von o - Phenylendiamin (OPD) -Tabletten in destilliertem H 2 O pro Protokoll des Herstellers während Licht zu vermeiden. Es werden 20 ml pro ELISA-Platte.
- Vorbereitung 3 MH 2 SO 4 durch konzentrierte H 2 SO 4 mit destilliertem H 2 O wie erforderlich verdünnt. Bereiten Sie 5 ml pro ELISA-Platte.
Achtung: H 2 SO 4 ist eine starke Säure. Achten Sie darauf, geeignete persönliche Schutzausrüstung zu tragen. - Waschen Sie die ELISA-Platten viermal mit Waschpuffer, wie in Schritt 5.5.4 beschrieben.
- Inkubieren ELISA-Platten mit dem HRP Substrate.
- In 200 ul des HRP-Substrat in jede Vertiefung. Zur Minimierung der Belichtung, fügen Sie das Substrat auf eine ELISA-Platte zu einem Zeitpunkt, und wickeln mit Aluminiumfolie, bevor zum nächsten Platte fortfahren. Inkubieren der Platten für 30 bis 60 min bei RT im Dunkeln.
- Nach der ersten 30 Minuten, überprüfen Sie die Platten für die des Substrats Verdunkelung und brüten mehr Farbe sichtbar zu machen, wenn nötig zu entwickeln.
- Je 50 ul 3 MH 2 SO 4 in jede Vertiefung die Reaktion zu quenchen. Mit einer anderen Tipp für jede Vertiefung, mischen Sie die Lösung in den Vertiefungen durch vorsichtiges Pipettieren nach oben und unten ohne Aufschäumen. Aus Gründen der Einheitlichkeit und der Sättigung zu verhindern, fügen die H 2 SO 4 schnell und sorgfältig auf alle der ELISA - Platten vor , die Lösung für jede Platte zu mischen.
- Messen der Extinktion der Lösung in den Vertiefungen jeder Platte bei 492 nm einen Plattenleser.
- Analysieren Sie die Absorptionsdaten zu identifizieren scFv-Varianten, die exhibes vielversprechende Bindungssignale und diese vielversprechenden scFvs charakterisieren. Wählen scFvs, die Absorptionssignale höher als das Hintergrundsignal und höher als die durchschnittliche Signal auf jeder Platte aufweisen.
HINWEIS: Die Absorptionsstufe wird auf die Eigenschaften des Antigens und anti-FLAG-Antikörper verwendet, zusammen mit der Stärke der scFv Varianten abhängig sein, die in dem Screening isoliert.
Ergebnisse
Die intrazelluläre Proteinfaltung Qualitätskontrollmechanismus des Tat - Weg in E. coli begrenzt Transport über die innere Zellmembran zu Proteinen , die in der reduzierenden zytoplasmatische Umgebung gut gefaltet werden. Durch Überexpression eines Fusions eines scFv mit dem ssTorA Signalsequenz (die Signalsequenz aus dem TorA - Protein, das natürlicherweise durch den Tat - Weg 20 transportiert wird), wird die Translokation ins Stocken geraten, was zu einer Anzeige von scFvs an der inneren Membran 19. Nach enzymatischer Zerstörung der äußeren Membran, werden die angezeigten Antikörper zum Screenen für Antigen-Bindungsaktivität zur Verfügung gestellt. Die Möglichkeit , die Vorteile des Tat - Weg für scFv - Anzeige aufzunehmen wurde von Karlsson et al. 19 gezeigt ist (Abbildung 6). Die scFv-Antikörper scFv13 und scFv13.R4 wurden entweder die native ssTorA Sequenz oder eine modifizierte ssTorA fusioniert, die das Arginin-Argininrest Paar erkannt fehlt durchdie Tat-Weg. scFv13.R4 wurde von Martineau et al entwickelt. von scFv13 durch vier Runden der gerichteten Evolution und bekannt ist gut 9 in das Zytoplasma zu falten. Dieser scFv wurde auf der inneren Membran angezeigt, aber nur , wenn sie als Fusion mit dem nativen ssTorA Signalsequenz (Abbildung 6) ausgedrückt. Konträr ist scFv13 nicht gut gefaltet cytoplasmatisch 9, so ist es nicht gut an der inneren Membran angezeigt, unabhängig von der Signalsequenz , an die es fusioniert ist. Außerdem, wenn die scFvs wurden in Zellen exprimiert, die das TatC Protein fehlte, eine wichtige Komponente der Tat Maschinen 20,28, Anzeige nicht beobachtet wurde, die wichtige Verbindung zwischen Innenmembran - Display und die Tat - Weg zeigt. Diese Ergebnisse zeigen, dass nur Proteine, die die Tat-Signalpeptid enthalten und dass die richtigen Einstellungen im Zytoplasma gefaltet sind an der inneren Membran angezeigt, in dem Transport durch den Tat-Weg als Bildschirm zu funktionieren für die intrazelluläre folding.
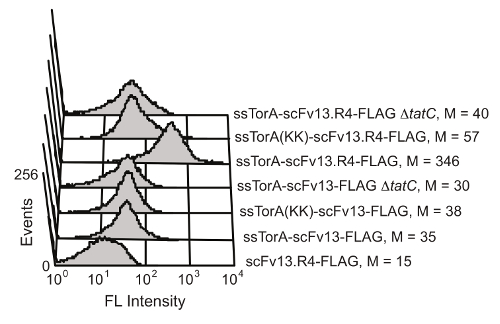
Abbildung 6. Der Nachweis der angezeigten scFvs auf der inneren Membran. Zytometrie Analyse Fluss wurde durchgeführt , um die Anzeige von schlecht gefalteten scFv13 und gut gefaltet scFv13.R4 auf der inneren Membran zu erkennen. scFvs wurden mit nativem ssTorA oder ssTorA (KK) fusioniert, wobei das Arg-Arg-Paar in der ssTorA Sequenz Lys-Lys modifiziert wurde. Die C-terminale FLAG-Epitop-Tags auf den scFvs wurden mit einem Fluorescein-Isothiocyanat (FITC) detektiert -konjugiertem anti-FLAG-Antikörper. Zellen ohne TatC Protein (ΔtatC) und ssTorA-scFv13 ohne das FLAG - Tag wurden als Kontrollen getestet. M zeigt die mittlere Fluoreszenzwert. Wiedergabe aus Lit. 19 mit Genehmigung. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Inner-Membran-Display kann erfolgreich scFv-Antikörper mit hoher Affinität für ein Zielprotein und ein hohes Maß an Cytoplasma-Löslichkeit zu isolieren. Zusätzlich Anzeige nachfolgenden Runden der gerichteten Evolution unter Verwendung von inneren Membran Antikörper Merkmale 19 zu verbessern. Um dies zu demonstrieren, eine fehleranfällige Bibliothek PCR auf Basis von scFv13, die von Bindungsaffinität für β-Galactosidase ein niedriges Niveau hat, wurde gegen die β-Galactosidase Zielantigen verrissen über das Display und Panning-Methode in dem Protokoll beschrieben. scFv 1-4 wurde nach einer Runde der Mutagenese und Panning isoliert und zeigten höhere Bindungsaffinität zu & beta; -Galactosidase als scFv13 (7A) und ein höheres Niveau der zytoplasmatischen Löslichkeit (7B).
Eine neue Bibliothek, basierend auf scFv 1-4, wurde unter Verwendung von fehleranfälligen PCR gemacht, und Schwenken dieser zweiten Generation Bibliothek gegenβ-Galactosidase wurde durchgeführt, das eine Modifikation des beschriebenen Protokolls. Das Panning gegen β-Galaktosidase für die zweite Runde der Evolution wurde in Gegenwart von gereinigtem, löslichem scFv 14 als Konkurrent getan, um die Wahrscheinlichkeit zu verbessern, von Klonen mit höherer Affinität als scFv 1-4 isolieren. Nach dieser zweiten Runde der Mutagenese und Panning, scFv 2-1 und 2-3 scFv wurden isoliert, um die ELISA-basierten sekundären Screening verwendet wird. Diese scFvs nicht nur eine höhere Bindungsaffinität für β-Galactosidase als scFv13 ausgestellt, sondern auch eine bessere Bindung als die erste Runde Klon scFv 1-4 gezeigt. scFv 2-1 zeigten β-Galaktosidase - Bindungs vergleichbar mit der von scFv13.R4 (7A). scFv 2-3 zeigt auch eine weitere Erhöhung der zytoplasmatischen Löslichkeit im Vergleich zu scFv 14, Hervorhebung der simultanen Engineering von Löslichkeit und antigenbindende. Da Affinität und löslicher Expression der scFvs für gleichzeitig gescreent werden, ist es möglich, daß ein ausgewählter scFv moderate Löslichkeit aber hohe Bindung oder umgekehrt. Zum Beispiel hat scFv 2-1 unteren löslichen Expression als scFv 2-3, aber es zeigt eine höhere Bindungsaffinität an & beta; -Galactosidase.

Abbildung 7. Ziel Bindung und Cytoplasmaexpression von scFv - Varianten Innenmembran - Display isoliert werden. (A) scFvs wurden im Zytoplasma von E. ausgedrückt coli - Zellen (z. B. ohne die ssTorA Signalsequenz) mit einem Hexahistidin (6 × His) Markierung und gereinigt Nickel-Nitrilotriessigsäure Spin-Säulen verwendet wird . Die Bindung der gereinigten scFvs an & beta; -Galactosidase wurde mit einem ELISA gemessen. Gereinigtes scFvs wurden auf β-Galactosidase-beschichteten ELISA-Platten geladen werden, und die gebundenen scFvs wurden mit einem anti-6 × His-Antikörper nachgewiesen. Die Daten sind ein Durchschnitt von sechs Wiederholungen, und die Fehlerbalken zeigt Standardfehler des Mittelwerts.(B) Die löslichen und unlöslichen Fraktionen der Zellysate von Zellen, die scFvs cytoplasmatisch durch einen Western - Blot sondiert mit anti-6 × His - Antikörpers analysiert. Gesamtproteinkonzentration das Laden der Proben zu normalisieren, wurde verwendet. Abgedruckt (A) und angepasst (B) von der Referenz 19 mit freundlicher Genehmigung. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Antikörper für zytoplasmatische Aktivität ist eine schwierige Aufgabe aufgrund der reduzierenden Milieu des Cytoplasmas Technik, die die Bildung von Bindungen Stabilisierungs Disulfid 6,7 behindert. Dies bewirkt, dass die meisten Antikörper sein cytoplasmatisch inaktiv, wenn sie nicht für die Stabilität und Löslichkeit im Zytoplasma konstruiert sind, zusätzlich zu den für die Bindungsaffinität konstruiert werden. Die vorhandenen Methoden der Phagen - Display, Bakterien-Oberflächen - Display sowie Anzeigeverfahren Hefe Oberfläche verwenden alle die sekretorischen Weg 14-16 zur Darstellung von genetisch manipulierten Antikörper, aber diese Verfahren haben keine Mittel intrazellulär Faltung zu konstruieren. Antikörper entwickelt, mit Innenmembran-Display haben zytoplasmatische Stabilität verbessert und die Löslichkeit, da die Faltung Qualitätskontrolle des Tat-Weg Translokation von Antikörpern verhindert, die schlecht gefaltet und instabil im Zytoplasma. Dieses Verfahren vereinfacht den iterativen Prozess Engineering intrazellulären Antikörper für Affinität and Löslichkeit, da die beiden Eigenschaften in einem Schritt entwickelt werden. Obwohl dieses Verfahren für das Engineering Antikörper mit Löslichkeit in der reduzierenden intrazellulären Umgebung entworfen wurde, könnte sie auch auf Engineering Antikörper angewendet werden, in nicht-reduzierenden Bedingungen zu funktionieren, da die Proteine dieses Verfahren beibehalten konstruiert unter Verwendung ihrer Faltung in der oxidierenden Umgebung des Periplasmas.
Obwohl diese Technik den Prozess von Engineering-Antikörpern mit hoher Affinität und hoher Zytoplasma-Löslichkeit vereinfacht, mehrere Einschränkungen wichtig, zu berücksichtigen, wenn dieses Protokoll verwenden. Wenn die sekundären Bildschirm ELISA-Signale analysieren zu identifizieren viel versprechende scFv-Varianten ist die Schwelle für anspruchsvolle zwischen potenziell interessante Varianten und diejenigen, die nicht zeigen können ausreichende antigenbindende nicht wahrscheinlich, bis offensichtlich zu sein, nachdem mehrere Klone weiter charakterisiert. Es ist wichtig, für eine verbesserte Bindung über den Eltern-Antikörpers zu schauen; aber,eine ungewöhnlich hohe Signal 29 oder Aggregation - Effekte durch Avidität 30 sein könnte, eine Herausforderung , die nicht nur in der Innenmembran - Display - Screening - Ansatz ist. Eine wesentliche Einschränkung zu erinnern, wenn dieses Protokoll verwenden die Unfähigkeit ist Sphäroplasten nach Panning zu erholen, da sie nicht lebensfähig (nicht veröffentlichte Daten) sind. Dies erfordert die DNA-Amplifikation und Transformationsschritte, die Antikörper-kodierenden Plasmide zu erholen.
Mehrere kritische Schritte des Protokolls ermöglichen die gleichzeitige Engineering von Falten und Binden von Antikörpern. Für das Screening erfolgreich zu sein, wobei das scFv-Bibliothek gescreent muss als Fusion mit dem ssTorA Signalpeptid exprimiert werden. Ohne diese Sequenz, Antikörper werden nicht an den Tat - Weg geleitet werden und somit nicht in das Periplasma transloziert 19 wird. Zusätzlich ist es zwingend notwendig, dass ein C-terminales Epitop-Markierung an die Antikörper fusioniert ist Nachweis der angezeigten Antikörper in dem Behälter zu ermöglichen,ding-Assays. Offensichtlich ist die E. coli - Stamm verwendet , um die scFvs auszudrücken muß auch die notwendige Tat - Weg Maschinen haben, aber dies gilt auch für die häufig verwendeten E. coli - Stämmen.
Modifikationen an diesem Protokoll sind möglich sein Potenzial zur Verbesserung der Antikörper mit den gewünschten Eigenschaften zu isolieren. Ein subtraktives Panning-Schritt kann vor dem Panning gegen das Zielantigen abgeschlossen werden, um die scFv Bibliothek von nicht erwünschten Bestandteile abzureichern. Die Bibliotheks Sphäroplasten können mit magnetischen Kügelchen mit BCCP allein oder beschichtet mit einer nicht-gewünschte Protein und die Sphäroplasten beschichtet inkubiert werden, die den Kügelchen binden können um die Bindung an das gewünschte Ziel vor Screenen der verbleibenden ungebundenen Sphäroplasten verworfen werden. Wie in den Repräsentative Ergebnisse erwähnt, ein Verfahren ist die Affinität eines isolierten scFv zu verbessern, ist ein lösliches Konkurrent in der Panning Reaktion aufzunehmen mit den scFvs auf den Sphäroplasten angezeigt zu konkurrieren. Da der löslichen competitor ist ein gereinigtes Protein, keine DNA aus ihm amplifiziert, so dass nur Sequenzen der scFvs auf den Sphäroplasten angezeigt wird in der PCR-Reaktion gewonnen werden. Zusätzlich könnte diese Methode zur Entwicklung Andere Typen von Antikörpern oder nicht-Antikörper-bindende Proteine ausgedehnt werden.
E. coli Innenmembran - Display ist eine leistungsstarke Plattform für den Engineering - Antikörper mit hoher Affinität und ein hohes Maß an intrazellulären Löslichkeit. Dieses Verfahren ist besonders geeignet für die effiziente Herstellung von Antikörpern in der intrazellulären Umgebung zu funktionieren gestaltet. Diese intrazellulären Antikörper werden bereits als potenzielle Therapeutika in einer Reihe von Bereichen untersucht, darunter neurodegenerative Erkrankungen, Krebs und Virusinfektionen 31. Diese Technik wird mehr weit verbreiteten Einsatz von intrazellulären Antikörper als Werkzeuge für die Forschung und Medizin in diesen Bereichen und jedem anderen Bereich ermöglichen , wo ein Zielprotein in situ studying erwünscht ist .
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
We thank Tomer Zohar for work on scFv screening and characterization assays. A portion of this work was supported by award number F32CA150622 from the National Cancer Institute (to AJK). The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Cancer Institute or the National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| scFv library | Varies | A suitable scFv library should be obtained from a commercial or academic source. | |
| MC4100 E. coli cells | Coli Genetic Stock Center | 6152 | Cells need to be chemically competent or electrocompetent, depending on the selected transformation method. |
| Glycerol | Fisher Scientific | BP229-4 | |
| Difco dehydrated culture media LB Broth, Miller (Luria-Bertani) | BD | 244610 | |
| Chloramphenicol (Cm) | Fisher Scientific | BP904-100 | |
| Sodium chloride (NaCl) | Fisher Scientific | BP358-1 | |
| Potassium chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, dibasic (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Potassium phosphate, monobasic (KH2PO4) | Fisher Scientific | BP362-500 | |
| Bovine serum albumin (BSA) | Fisher Scientific | BP9706-100 | |
| Sucrose | Fisher Scientific | BP220-1 | |
| Tris base | Fisher Scientific | BP1521 | |
| Ethylenediaminetetraacetic acid (EDTA), 0.5 M | Fisher Scientific | BP2482-500 | |
| Magnesium chloride (MgCl2) | Fisher Scientific | BP214-500 | |
| Lysozyme | Sigma Aldrich | L3790-10X1ML | |
| Vortex mixer | VWR | 97043-564 | |
| Bicine | Fisher Scientific | BP2646100 | |
| D-Biotin | Fisher Scientific | BP232-1 | |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher Scientific | BP1755-1 | |
| BugBuster Master Mix (cell lysis detergent) | EMD Millipore | 71456 | |
| Vivaspin 2 MWCO, 3,000 daltons | GE Healthcare Sciences | 28932240 | |
| Target antigen | Varies | N/A | Purified target antigen may be purchased or produced/purified. |
| Dynabeads MyOne Streptavidin T1 | Invitrogen | 65601 | |
| Dynamag-2 magnet | Invitrogen | 12321D | |
| Tube rotator | VWR | 13916-822 | |
| PCR primers | IDT | N/A | Primer sequences are as described in the protocol. |
| 10x T4 DNA ligase reaction buffer | New England BioLabs | B0202S | |
| T4 Polynucelotide kinase (PNK) | New England BioLabs | M0201S | Make sure the T4 ligase buffer used in the primer phosphorylation reaction contains 1 mM ATP. |
| 5x Phusion HF buffer pack | New England BioLabs | B0518S | |
| Deoxynucleotide (dNTP) solution mix, 10 mM each dNTP | New England BioLabs | N0447L | |
| Phusion DNA polymerase | New England BioLabs | M0530S | Other high-fidelity polymerases may be used as an alternative, but the annealing temperature in Table 3 must be adjusted. |
| C1000 Touch thermal cycler with dual 48/48 fast reaction module | Bio-Rad | 185-1148 | |
| Agarose | Promega | V3121 | |
| SYBR Safe DNA gel stain | Invitrogen | S33102 | |
| Wizard SV gel and PCR clean-up system | Promega | A9281 | |
| T4 DNA ligase | New England BioLabs | M0202S | |
| Microdialysis membrane filter | EMD Millipore | VSWP04700 | |
| Agar | BD | 214030 | |
| 96-well polystyrene round-bottom cell culture plates | VWR | 10062-902 | |
| Costar general polystyrene assay plate lids | Corning | 3931 | |
| Microtitre plate shaker | VWR | 12620-926 | |
| Costar 96 well EIA/RIA Easy Wash clear flat bottom polystyrene high bind microplate | Corning | 3369 | |
| Bel-blotter polycarbonate 96-well replicating tool | Bel-Art Products | 378760002 | |
| Instant nonfat dry milk | Quality Biological | A614-1000 | |
| Tween 20 (polysorbate 20) | Fisher Scientific | BP337-500 | |
| PopCulture reagent (concentrated cell lysis detergent) | EMD Millipore | 71092-3 | |
| Monoclonal ANTI-FLAG M2-Peroxidase(HRP) antibody produced in mouse | Sigma Aldrich | A8592 | |
| SigmaFast OPD | Sigma Aldrich | P9187-50SET | |
| Sulfuric acid (H2SO4), 10 N solution | Fisher Scientific | SA200-1 | |
| Reynolds Wrap aluminum foil | VWR | 89079-075 | |
| BioTek Epoch microplate spectrophotometer | Fisher Scientific | 11120570 |
Referenzen
- Biocca, S., Pierandrei-Amaldi, P., Campioni, N., Cattaneo, A. Intracellular immunization with cytosolic recombinant antibodies. Biotechnology (NY). 12 (4), 396-399 (1994).
- Chen, S. Y., Bagley, J., Marasco, W. A. Intracellular antibodies as a new class of therapeutic molecules for gene-therapy. Hum. Gene Ther. 5 (5), 595-601 (2008).
- Gargano, N., Biocca, S., Bradbury, A., Cattaneo, A. Human recombinant antibody fragments neutralizing human immunodeficiency virus type 1 reverse transcriptase provide an experimental basis for the structural classification of the DNA polymerase family. J Virol. 70 (11), 7706-7712 (1996).
- Mhashilkar, A. M., et al. Inhibition of HIV-1 Tat-mediated LTR transactivation and HIV-1 infection by anti-Tat single chain intrabodies. Embo J. 14 (7), 1542-1551 (1995).
- Strube, R. W., Chen, S. Y. Characterization of anti-cyclin E single-chain Fv antibodies and intrabodies in breast cancer cells: enhanced intracellular stability of novel sFv-F-c intrabodies. J. Immunol. Meth. 263 (1-2), 149-197 (2002).
- Mössner, E., Koch, H., Plückthun, A. Fast selection of antibodies without antigen purification: adaptation of the protein fragment complementation assay to select antigen-antibody pairs. J. Mol. Biol. 308 (2), 115-122 (2001).
- Wörn, A., et al. Correlation between in vitro stability and in vivo performance of anti-GCN4 intrabodies as cytoplasmic inhibitors. J Biol Chem. 275 (4), 2795-2803 (2000).
- Knappik, A., Plückthun, A. Engineered turns of a recombinant antibody improve its in vivo folding. Protein Eng. 8 (1), 81-89 (1995).
- Martineau, P., Jones, P., Winter, G. Expression of an antibody fragment at high levels in the bacterial cytoplasm. J Mol Biol. 280 (1), 117-127 (1998).
- Steipe, B., Schiller, B., Plückthun, A., Steinbacher, S. Sequence statistics reliably predict stabilizing mutations in a protein domain. J. Mol. Biol. 240 (3), 188-192 (1994).
- Daugherty, P. S. Protein engineering with bacterial display. Curr Opin Struct Biol. 17 (4), 474-480 (2007).
- Lener, M., et al. Diverting a protein from its cellular location by intracellular antibodies. Eur. J. Biochem. 267 (4), 1196-1205 (2000).
- Lynch, S. M., Zhou, C., Messer, A. An scFv intrabody against the nonamyloid component of α-synuclein reduces intracellular aggregation and toxicity. J. Mol. Biol. 377 (1), 136-147 (2008).
- Gai, S. A., Wittrup, K. D. Yeast surface display for protein engineering and characterization. Curr. Opin. Struc. Biol. 17 (4), 467-473 (2007).
- Kieke, M. C., et al. Selection of functional T cell receptor mutants from a yeast surface-display library. Proc. Natl. Acad. Sci. USA. 96 (10), 5651-5656 (1999).
- Steiner, D., Forrer, P., Stumpp, M. T., Pluckthun, A. Signal sequences directing cotranslational translocation expand the range of proteins amenable to phage display. Nat. Biotechnol. 24, 823-831 (2006).
- Pugsley, A. P. The complete general secretory pathway in gram-negative bacteria. Microbiol. Rev. 57 (1), 50-108 (1993).
- Rapoza, M. P., Webster, R. E. The filamentous bacteriophage assembly proteins require the bacterial SecA protein for correct localization to the membrane. J. Bacteriol. 175 (6), 1856-1859 (1993).
- Karlsson, A. J., et al. Engineering antibody fitness and function using membrane-anchored display of correctly folded proteins. J. Molec. Biol. 416 (1), 94-107 (2012).
- DeLisa, M. P., Tullman, D., Georgiou, G. Folding quality control in the export of proteins by the bacterial twin-arginine translocation pathway. Proc Natl Acad Sci U S A. 100 (10), 6115-6120 (2003).
- Fisher, A. C., Kim, W., DeLisa, M. P. Genetic selection for protein solubility enabled by the folding quality control feature of the twin-arginine translocation pathway. Protein Sci. 15 (3), 449-458 (2006).
- Maynard, J., Georgiou, G. Antibody engineering. Annu Rev Biomed Eng. 2, 339-376 (2000).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. 1, (2012).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--the database of key numbers in molecular and cell biology. Nucleic Acids Res. 38, D750-D753 (2010).
- Hermanson, G. T. . Bioconjugate Techniques. , (2013).
- Tayapiwatana, C., Chotpadiwetkul, R., Kasinrerk, W. A novel approach using streptavidin magnetic bead-sorted in vivo biotinylated survivin for monoclonal antibody production. J Immunol Methods. 317 (1-2), 1-11 (2006).
- Zhu, G., Song, L., Lippard, S. J. Visualizing inhibition of nucleosome mobility and transcription by cisplatin-DNA interstrand crosslinks in live mammalian cells. Cancer Res. 73 (14), 4451-4460 (2013).
- Bogsch, E. G., et al. An essential component of a novel bacterial protein export system with homologues in plastids and mitochondria. J. Biol. Chem. 273, 18003-18006 (1998).
- Julian, M. C., et al. Co-evolution of affinity and stability of grafted amyloid-motif domain antibodies. Protein Eng. Des. Sel. 28 (10), 339-350 (2015).
- Garber, K. Bispecific antibodies rise again. Nat. Rev. Drug. Discov. 13 (11), 799-801 (2014).
- Marschall, A. L., Dübel, S., Böldicke, T. Specific in vivo knockdown of protein function by intrabodies. MAbs. 7 (6), 1010-1035 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten