Method Article
Бактериальный Внутренняя мембрана-дисплей для скрининга библиотеки фрагментов антител
В этой статье
Резюме
We provide a method to simultaneously screen a library of antibody fragments for binding affinity and cytoplasmic solubility by using the Escherichia coli twin-arginine translocation pathway, which has an inherent quality control mechanism for intracellular protein folding, to display the antibody fragments on the inner membrane.
Аннотация
Antibodies engineered for intracellular function must not only have affinity for their target antigen, but must also be soluble and correctly folded in the cytoplasm. Commonly used methods for the display and screening of recombinant antibody libraries do not incorporate intracellular protein folding quality control, and, thus, the antigen-binding capability and cytoplasmic folding and solubility of antibodies engineered using these methods often must be engineered separately. Here, we describe a protocol to screen a recombinant library of single-chain variable fragment (scFv) antibodies for antigen-binding and proper cytoplasmic folding simultaneously. The method harnesses the intrinsic intracellular folding quality control mechanism of the Escherichia coli twin-arginine translocation (Tat) pathway to display an scFv library on the E. coli inner membrane. The Tat pathway ensures that only soluble, well-folded proteins are transported out of the cytoplasm and displayed on the inner membrane, thereby eliminating poorly folded scFvs prior to interrogation for antigen-binding. Following removal of the outer membrane, the scFvs displayed on the inner membrane are panned against a target antigen immobilized on magnetic beads to isolate scFvs that bind to the target antigen. An enzyme-linked immunosorbent assay (ELISA)-based secondary screen is used to identify the most promising scFvs for additional characterization. Antigen-binding and cytoplasmic solubility can be improved with subsequent rounds of mutagenesis and screening to engineer antibodies with high affinity and high cytoplasmic solubility for intracellular applications.
Введение
Антитела, способные складывание и функционировать во внутриклеточной среде являются перспективными инструментами для обоих исследований и терапевтических применений. Они обладают способностью модулировать активность белка путем связывания с белком - мишенью внутри клетки , чтобы предотвратить белок-белковых взаимодействий, нарушают взаимодействие белок-нуклеиновых кислот, или предотвратить доступ субстрата к ферментам 1-5.
Хотя антитела имеют большой потенциал для внутриклеточных приложений, инженерных их правильной складчатости и растворимости в внутриклеточной среде, сохраняя при этом способность связываться с антигеном-мишенью является сложной задачей. Восстановительный цитоплазматический среда предотвращает образование дисульфидных связей , как правило , необходимых для стабильного складывания полнометражных антител и фрагментов антител, в том числе одноцепочечного вариабельного фрагмента (ScFv) антител 6,7. Ряд направленных подходов эволюции были использованы для конструирования антител с чIgh сродства для антигенов - мишеней 8-10. Эти подходы обычно используют фаговый дисплей, дисплей поверхности дрожжей или бактерий поверхности дисплея для скрининга больших библиотек антител 11-13. Эти методы являются мощным и эффективным для выявления антител , которые связываются с целями, но они зависят от секреторного пути для транспортировки белков , которые будут отображаться 14-16. Секреторный путь транслоцируется развернутые белки из восстановительной цитоплазмы в эндоплазматический ретикулум просвет в дрожжах или в периплазму бактерий. Белки затем складываются в окислительных условиях и отображаются на поверхности клетки , или упакованы в фаговые частицы на экран для аффинности связывания 17,18. В результате, антитела, выделенные с помощью этих методов не обязательно складываются наилучшим образом в цитоплазме, и внутриклеточный растворимость должны часто быть сконструированы отдельно, если антитела будут использованы в внутриклеточных приложениях.
Улучшитьэффективность инженерных антител, которые хорошо сложены в цитоплазме, мы уже сообщали успех MAD-Trap (мембранно-якорь дисплей для Tat на основе распознавания ассоциирующих белков), метод скрининга библиотеки антител с использованием ScFv кишечной палочки внутри- дисплей мембраны 19. Бактериальный внутренней мембраны дисплей опирается на твин-аргинином транслокации (TAT) пути для транспортировки представленных антител, в отличие от других методов общего отображения, которые используют секреторный путь. Путь Tat содержит механизм контроля качества , который позволяет только растворимые, правильно свернутых белков , которые будут транспортироваться из E. цитоплазма палочка, через внутреннюю мембрану, и в периплазмы 20,21. Суперэкспрессированный Tat субстратов (например., Белки , ориентированные на пути Tat с N-концевого слияния с сигнальным пептидом Tat ssTorA), которые хорошо сложенным в цитоплазме образуют долговечное транслокацию промежуточное с N-концом Iп цитоплазма и С-конец в периплазмы 19. Это позволяет отображать правильно свернутых подложках Tat, включая фрагменты антител, на периплазматическому лице Е. палочка внутренняя мембрана. После удаления наружной мембраны путем ферментативного расщепления генерировать сферопластов, антитела подвергаются межклеточное пространство (рисунок 1). Это позволяет Tat субстраты, отображаемые на внутренней мембране, чтобы быть подвергнуты скринингу для связывания с конкретной цели. Важно отметить, что обуздывать путь Tat для клеточной поверхности дисплея гарантирует, что только антитела, используемые в библиотеке, которые хорошо сложенные в цитоплазме допросишься для связывания, что позволяет одновременно инженерию аффинность связывания и внутриклеточного складывание. В этом протоколе мы опишем , как отобразить библиотеку ScFv на Е. палочка внутренняя мембрана, панорамирование библиотеку против антигена - мишени, а также выполнять дополнительный экран для определения наиболее перспективных составляющих библиотеку. В то время как мы ориентируемся протокол о scFvs, метод может быть применен к технологии любой белок, применение требует связывания и внутриклеточного складывания.
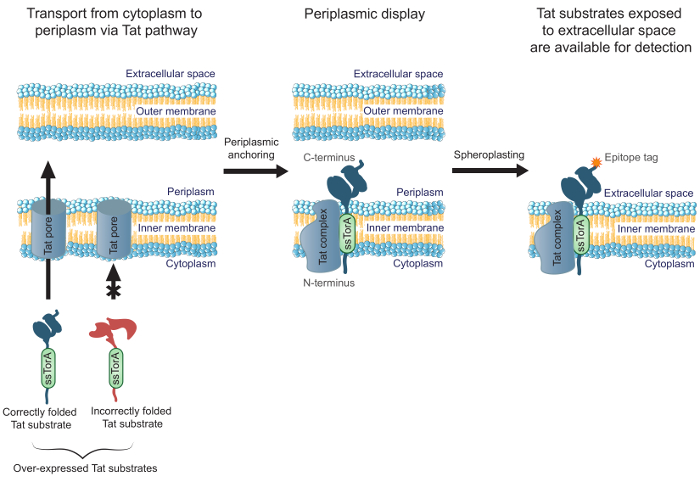
Рисунок 1. Tat дисплей внутренней мембраны. В Е. палочка, ScFv антитела , которые выражены в виде слитой с сигнальной последовательностью ssTorA и правильно уложенного в цитоплазму переносятся через внутреннюю мембрану. Транслокации промежуточные формы, где scFvs закреплены на внутренней мембране с N-конца в цитоплазме и с С-концом в периплазме. E. палочка наружной мембраны ферментативно расщепляют с образованием сферопластов, тем самым подвергая прижатого антитела к межклеточное пространство и делает их доступными для обнаружения с использованием антитела , которое связывается с С-терминально плавленого эпитоп метки на отображаемом антитела.нагрузка / 54583 / 54583fig1large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
протокол
1. Подготовьте ScFv библиотеку как Fusion к ssTorA сигнальной последовательности
- Получить библиотеку дезоксирибонуклеиновой кислоты (ДНК), содержащую варианты гена ScFv.
Примечание: Кроме того, библиотека может быть построена с использованием любого подходящего режима для создания разнообразия в течение всего гена ScFv или целевых областей 22 (например, третий гипервариабельные области, CDR3s.). - Вставьте библиотеку ДНК в плазмиду pIMD (рисунок 2) с использованием стандартных методов молекулярного клонирования 23.
Примечание: Эта плазмида выражает scFvs в качестве генетического слияния с сигнальной последовательностью ssTorA (N-терминала к ScFv) и ФЛАГ эпитоп тегом (C-концевой к ScFv). Конструкция плазмиды для внутреннего дисплея мембраны было описано ранее 19. Плазмиду pIMD можно получить у авторов.
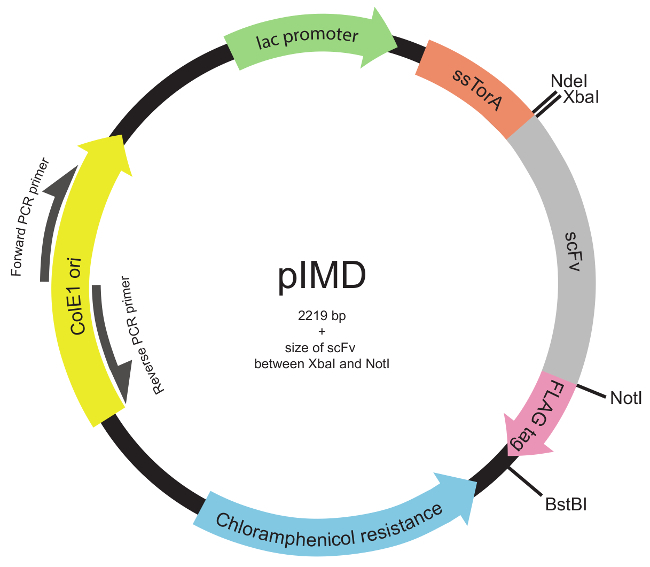
Рисунок 2. Внутренняя мембрана-дисплей плазмида (pIMD) карту (шаги 1.2 через 1.3). Эта плазмида содержит LAC промотор, ColE1 начало репликации и ген устойчивости к хлорамфениколу. Встроенный ген ScFv сливают с сигнальной последовательностью ssTorA для целевой ScFv на пути Tat и к флагу эпитопной меткой, со всеми тремя в одной рамке считывания. Ограничение фермента сайты указаны. Для библиотеки вставленным между сайтами рестрикции XbaI фермента и NotI, размер плазмиды составляет 2219 пар оснований плюс размер ScFv. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Transform плазмидная ДНК , содержащая библиотеку в MC4100 E. клетки палочки 23. Восстановление и вырастить эту бактериальную форму библиотеки. Центрифуга при 4000 х г в течение 15 мин при комнатной температуре, чтобы собрать клетки. Удалить супернатант и ресуспендируют собранные клеткив 25% глицерина в Лурия-Бертани (LB) средств массовой информации. Магазин аликвоты при -80 ° С до тех пор, пока это необходимо, или перейдите к шагу 2.
Примечание: Протокол был проверен с MC4100 клетками, хотя другой Е. штаммы палочки также , как ожидается, будут совместимы с протоколом. Электропорация является предпочтительным методом трансформации, из-за его высокой эффективности трансформации. Библиотека должна состоять , как правило , по меньшей мере , 10 9 ScFv вариантов на данном этапе, и каждая аликвота должна содержать достаточное количество клеток , таких , что библиотека покрыта в 100 раз.
2. Экспресс-библиотеку и подготовить сферопласты
- Растаяйте одну аликвоту бактериальной библиотеки (со стадии 1.3) при комнатной температуре, и добавьте аликвоты в колбу, содержащую 100 мл LB среды с 20 мкг / мл хлорамфеникола (Cm). Grow в течение 3 ч при температуре 37 ° С и 225 оборотах в минуту в качестве инкубированных шейкере.
- Через 3 часа снимите колбу с инкубированных шейкере 37 ° C. Дают возможность экспрессии библиотеки ScFv кпродолжить O / N от 15 до 22 ч при температуре 20 ° C и 225 оборотов в минуту в инкубированных шейкере.
Примечание: не требуется индуктор при использовании плазмиды pIMD, как промотор является утечкой. Обратите внимание, что MC4100 клетки не гиперэкспрессией репрессор Lac (и LacI не найден на плазмиде).

Рисунок 3. E.coli клетки и сферопласты. (A) E. Клетки палочки имеют цилиндрическую форму. (В) После того, как сферопластов с использованием ЭДТА и лизоцим, внешнюю мембрану Е. палочка клетки разрушается, и полученные сферопласты имеют сферическую форму. Дифференциального интерференционного контраста (DIC) микроскопии изображения были получены с использованием объектива 100X на инвертированный микроскоп. Пожалуйста , Cлизать здесь, чтобы посмотреть большую версию этой фигуры.
- Подготовьте библиотеку сферопластов.
Примечание: сферопластах образованы разрывания внешнюю мембрану Е. палочки и имеют сферическую форму (рисунок 3).- Подготовьте необходимые буферы.
ПРИМЕЧАНИЕ: Все буферы должны быть стерильными.- Готовят 1 × фосфатно-солевой буфер (PBS, рН 7,4), растворяя 8 г NaCl, 0,2 г KCl, 1,44 г Na 2 HPO 4, и 0,24 г KH 2 PO 4 в дистиллированной H 2 O до конечного объема 1000 мл. Держите на льду.
- Готовят PBS с 0,1% (вес / об) сыворотки бычьего альбумина (BSA) путем растворения 0,2 г БСА в 200 мл 1 х PBS. Держите на льду.
- Подготовьте фракционирования буфер (FB) путем смешивания 7,5 мл стерилизованного фильтрацией 1 М сахарозы, 1 мл 1 М Трис - буфера (рН 8,0) и 1,5 мл дистиллированной H 2 O. Держите на льду.
- Готовят 1 мМ этилендиаминтетрауксусной кислоты (ЭДТА) путем добавления 30 мкл Oе 0,5 М ЭДТА до 14.97 мл дистиллированной H 2 O.
- Приготовьте 0,5 М MgCl 2 путем растворения 4,76 г MgCl 2 в 100 мл дистиллированной H 2 O. Держите на льду.
- Выньте колбу из шейкера, и измеряют оптическую плотность (OD) при 600 нм с использованием спектрофотометра для определения плотности клеток. Рассчитать объем индуцированных культуры необходим таким образом, что каждый образец для сферопластов имеет 1 × 10 10 клеток.
Примечание: аппроксимация OD 600 , равной 1 указывает концентрации 10 9 клеток / мл для E. палочка может быть использована 24. - Центрифуга расчетный объем индуцированной культуры в 1,5 мл трубки микроцентрифужных при 12000 х г при комнатной температуре в течение 5 мин. Подготовьте по крайней мере, два образца, в случае, если возникает проблема в процессе подготовки образца.
- Удалить супернатант из центрифугированных культур и ресуспендируют каждый осадок клеток в 100 мкл охлажденного на льду FB. Центрифуга при 12000 ×г при комнатной температуре в течение 1 мин, а затем удалить супернатант с помощью пипетки. Ресуспендируют каждую гранулу в 350 мкл охлажденного на льду FB, дополненной 3,5 мкл 10 мг / мл лизоцима.
- Медленно вихрь каждую пробирку, добавляя по каплям в 700 мкл 1 мМ ЭДТА, а затем инкубируют в пробирки при комнатной температуре в течение 20 мин при медленном вращении на ротатор трубки для смешивания пробы. Удалить труб из поворотного устройства, добавить 50 мкл охлажденной льдом 0,5 М MgCl 2 в каждую пробирку и инкубировать их на льду в течение 10 мин. Центрифуга пробирки при 11000 х г при 4 ° С в течение 10 мин.
- Изолировать сферопластовых осадок.
- Используйте микропипетки с наконечником 1 мл медленно подтяните часть гранул. Удерживая трубку под углом с отверстием непосредственно над новой 1,5 мл трубки, медленно поднимите кончик пипетки из надосадочной жидкости и слайд гранул в новую пробирку.
- Если значительный объем надосадочной жидкости переносят в новую пробирку, удалить его с помощью пипетки. Если осадок не фирма ENOУф передачи, повторно центрифугировать при 11000 & bull; g в течение 2 мин и попытка выделения гранул снова.
- Ресуспендируют осадок сферопластовых в каждой пробирке в 1 мл охлажденного на льду 1 × PBS. Переключение между пипеткой и медленно встряхиванием на держателе вихря, пока осадок не будет полностью ресуспендировали. Не хранить образцы от льда в течение более 2 мин, в то время, и вернуться на лед в течение не менее 5 мин, прежде чем снова удалением от льда. Держите сферопластов при 4 ° C (в течение до 2-х дней), пока не используется для панорамирование на шаге 4.
- Подготовьте необходимые буферы.
3. Зафиксировать антигену-мишени на магнитные шарики
- Biotinylate антиген - мишень в естественных условиях в процессе производства рекомбинантного в E. палочки клетки. В качестве альтернативы, использовать химическое конъюгирование 25 или приобрести антиген - мишень , который уже был биотинилированного, и перейдите к шагу 3.2.
- Добавить 816 г Бицина 50 мл воды, чтобы сделать 10 × бицин буфер. Развести БУФфер до 1 × в дистиллированной H 2 O и нагревают до 50 ° С. Добавить 14,7 мг биотина в 12 мл нагретого 1 × Бицина буфера, чтобы сделать биотин решение, 5 мМ биотина в 10 мМ бицин буфера. Хранить при -20 ° C до тех пор, пока это необходимо.
- Экспресс и biotinylate белок - мишень с использованием плазмиды pAK400cb-BCCP 26, что позволяет выпускать антигена - мишени в виде гибрида с белком - носителем биотин карбоксильной (BCCP).
Примечание: E. Клетки палочки изначально biotinylate ВССР, устраняя необходимость очистить и химически biotinylate целевого белка до иммобилизации на покрытых стрептавидином бусин. Уроженец Е. биотин палочка лигазная Бира достаточна для биотинилирования слитого белка.- Grow E. палочки , содержащие биотинилирования плазмиду (с антигеном - мишенью , вставленной в качестве слитой с N-концом BCCP) O / N в течение от 15 до 18 ч в 5 мл LB - среде с 20 мкг / мл Cm при 37 ° C при встряхивании при 225 оборотов в минуту.
- Измерьте оптическую плотность при 600 нм с использованием спектрофотометра и рассчитать объем культуры , необходимого (V добавочная) к субкультуры при начальной OD 0,05 в 25 мл свежей LB - среды с 20 мкг / мл Cm , используя уравнение: V добавить = (0,05 × 25 мл) / (OD 600 - 0,05), где OD 600 является оптическая плотность оных O / N культуры и V представляет собой объем O / N культуры , чтобы добавить к свежей LB. Субкультура и вырасти до OD от 0,5 до 0,8, в инкубированных шейкере при 37 ° С и 225 оборотах в минуту.
- Добавить изопропил -D-1-тиогалактопиранозид до конечной концентрации 100 мкМ и биотин до конечной концентрации 5 мкМ. Индуцируют экспрессию в инкубированных шейкере в течение от 15 до 22 ч при температуре 20 ° С и 225 оборотах в минуту.
- Урожай бактерий центрифугированием при 4000 х г при 4 ° С в течение 10 мин. Удалить супернатант. Храните осадок при -20 ° С до готовности к использованию.
- Добавить1 мл клеточного лизиса детергента на 0,2 г клеточного осадка. Ресуспендируют пипетированием и осторожно повернуть в течение 20 минут, чтобы лизировать клетки. После лизиса, центрифуге при 16000 х г и 4 ° С в течение 20 мин. Пипетировать растворимый лизат (всплывающую) в новую 1,5 мл трубки.
- С помощью колонки молекулярная масса отсечки 3 кДа для удаления несвязанного биотина. Пипетировать лизата в колонку, и центрифуге при 20 ° C в соответствии с инструкциями изготовителя. Промывают 1 × PBS до тех пор, биотин в лизате не было разбавлено в 100 раз, а объем промытого лизат равен исходному объему лизата. Передача лизата в новую пробирку.
- Зафиксировать биотинилированный антиген-мишень, на покрытые стрептавидином магнитные гранулы.
- Готовят 1 × PBS и 1 х PBS с 0,1% (вес / объем) БСА, как описано в шаге 2.3.1.
- Подготовка магнитных шариков.
Примечание: Для этого требуется использование магнитной сепарации стойки.- Ресуспендируют streptavIdin покрытием магнитных шариков в собственном флаконе. Либо вихревое течение, по крайней мере 30 секунд или вращаться в течение 5 мин.
- Передача 7-10 × 10 9 бусин 1,5 мл трубки.
Примечание: объем, необходимый будет зависеть от концентрации бисерной поставляемой изготовителем. - Поместите пробирку, содержащую шарики на магните стойке в течение 2 мин, чтобы собрать бусинки на стороне трубки. С трубкой еще на магните, осторожно удалите супернатант с помощью пипетки, не нарушая бусинки.
- Для того, чтобы помыть, вынуть трубку от магнита, и ресуспендируют бусины в 1 мл 1 × PBS с помощью пипетки без образования пузырьков. Возвращение трубки к магниту в течение 2 мин, чтобы собрать шарики и осторожно удалить супернатант с помощью пипетки. Повторите этот процесс еще два раза в общей сложности трех стирок. Убедитесь, что жидкость не остается в трубке после окончательной промывки.
- Добавляют лизат, содержащий биотинилированный антиген к магнитному BEADS.
- Вынуть трубку из магнита и ресуспендирования бусин в 1 мл лизата (со стадии 3.1.5). Инкубируют при комнатной температуре в течение 30 мин при осторожном вращении.
- Поместите пробирку на магнит в течение 3 мин, чтобы собрать покрытых антигеном бусинки. Промыть шарики с покрытием в пять раз с 1 × PBS с 0,1% BSA таким же образом, как описано в шагах 3.2.2.3 до 3.2.2.4. После последней промывки, ресуспендируют бусины в 1 × PBS с 0,1% БСА до такого же объема, используемого на стадии 3.2.2.2.
- Если иммобилизованный антиген-мишень стабилен при 4 ° С, хранить покрытые гранулы при температуре 4 ° С до тех пор, пока требуется для панорамирование. В противном случае перейдите к шагу 4.
4. Экран ScFv библиотеки панорамирование против антигена-мишени (рис 4)
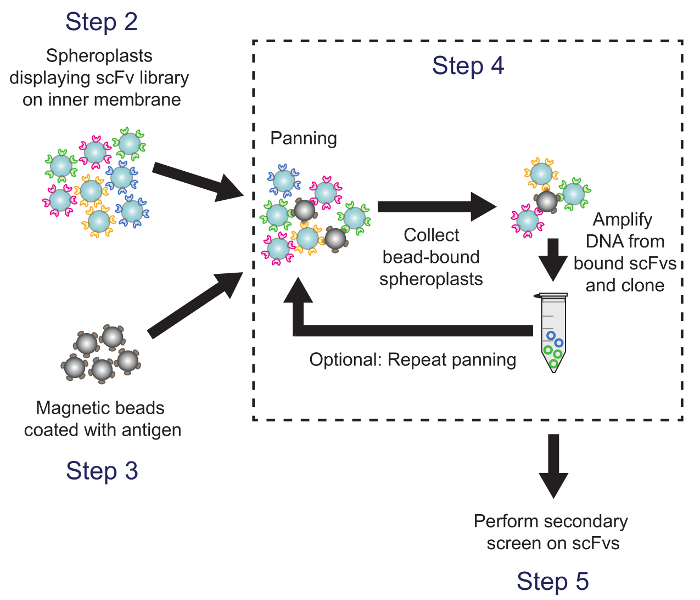
Рисунок 4. панорамирование (Шаг 4). Антиген покрытием магнитных шариков аре инкубировали с сферопластов, выражающих антител варианты библиотек. Плазмидную ДНК из бусин переплете сферопластах восстанавливается и используется для генерации подбиблиотеки, который скринингу с использованием вторичного скрининга ИФА на основе. Соответствующие шаги протокола отмечены. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Инкубацию гранулы, покрытые сферопластов.
- Используйте сферопластовых отбортовка соотношении приблизительно 5: 1. Добавить 4 × 10 9 сферопластов и 8 × 10 8 бусин в стерильный 15 мл трубки.
Примечание: Предположим , что клетки не были потеряны во время процесса сферопластов, так что концентрация еще 1 × 10 10 сферопластах / мл. - Добавляют 1 × PBS с 0,1% BSA, чтобы довести общий объем до 4 мл. Алиготе в четыре 1,5 мл пробирки с 1 мл каждого. Инкубируйте реакции при 4 ° С в течение 5 ч при осторожном вращении.
- Используйте сферопластовых отбортовка соотношении приблизительно 5: 1. Добавить 4 × 10 9 сферопластов и 8 × 10 8 бусин в стерильный 15 мл трубки.
- Prepare бортовых переплете сферопластов для полимеразной цепной реакции (ПЦР).
- Поместите панорамирование трубки реакции на магнит в течение 3 мин. Удалить супернатант с помощью пипетки, и мыть бусинка переплете сферопластах четыре раза охлажденным на льду 1 × PBS с 0,1% BSA таким же образом, как описано в шагах 3.2.2.3 до 3.2.2.4. Ресуспендируют шарик переплете сферопластов в каждой пробирке в 25 мкл дистиллированной H 2 O. Храните шарики при -20 ° C или перейдите к шагу 4.3.
- Выполните цельной плазмиды ПЦР на бусинки переплете сферопластах для амплификации плазмиды, содержащие гены бусинку переплете scFvs.
- Получение праймеров со следующими последовательностями: 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(прямой праймер) и 5'TAGCTCTTGATCCGGCAAACAAA3' (обратный праймер).
Примечание: Они будут связывать впритык на противоположных нитей плазмиды pIMD (рисунок 2) и предназначены для отжечь к общей особенностью pIMD, поэтому усиление будет происходить независимо от того ,ScFv вариант последовательности. - Фосфорилируют праймеров.
Примечание: Без дополнительного фосфорилирования, повторное лигирование не произойдет. Грунтовки также может быть заказан с 5'-фосфорилирования, а не с помощью этого метода фосфорилирования в этом протоколе.- В 0,5 мл пробирку, создать реакции фосфорилирования для праймера вперед ПЦР , как описано в таблице 1. Повторите этот процесс для обратного праймера.
- Инкубируйте реакции при 37 ° С в течение 1 часа. Затем инкубировать их при 65 ° С в течение 20 мин, чтобы дезактивировать Т4 полинуклеотидкиназу (ПНК). Хранить Фосфорилированную праймеры при -20 ° С.
- Выполните ПЦР.
- В ПЦР - пробирку, готовят ПЦР - реакции , как описано в таблице 2.
Примечание: Множественные реакции могут быть подготовлены к более высоким выходом. Неиспользованные шарик переплете сферопласты можно хранить при -20 ° С. - Тепло реакции ПЦР при температуре 98 ° С в течение 15 мин в термоциклеру для обеспечения полного лизиса из сферопластов. Удалить труб из термоциклеру, и добавьте 0,5 мкл полимеразы с высокой точностью для каждого из них. Возврат трубки к термоциклеру и запустить с помощью программы подробно излагаются в таблице 3.
- Бассейн ПЦР-продуктов в зависимости от обстоятельств. Хранить при -20 ° C или перейти к шагу 4.4.
- В ПЦР - пробирку, готовят ПЦР - реакции , как описано в таблице 2.
- Получение праймеров со следующими последовательностями: 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(прямой праймер) и 5'TAGCTCTTGATCCGGCAAACAAA3' (обратный праймер).
Таблица 1. PNK реакция фосфорилирования (этап 4.3.2.1).
| реактив | Объем (мкл) |
| Дистиллированная Н 2 О | 15 |
| 10x T4 ДНК-лигазы буфера реакция | 2 |
| 100 мкМ праймера | 2 |
| Т4 полинуклеотидкиназой (ПНК) | 1 |
| реактив | Объем (мкл) |
| Дистиллированная Н 2 О | 28,5 |
| 5x Высококачественный буфер полимеразы | 10 |
| 10 мкМ фосфорилированный прямой праймер | 2.5 |
| 10 мкМ фосфорилированные обратного праймера | 2.5 |
| 40 мМ дНТФ смеси (10 мМ каждого дНТФ) | 1 |
| Bead переплете сферопласты | 5 |
Таблица 3. Программа ПЦР (этап 4.3.3.2).
| шаг | Температура (° C) | Время (мин: сек) | Количество циклов |
| Первоначальная денатурация | 98 | 0:30 | 1 |
| денатурировать | 98 | 0:10 | 35 |
| отжиг | 69 | 0:30 | |
| расширение | 72 | 0:30 в кб | |
| Окончательное расширение | 72 | 6:00 | 1 |
| Держать | 12 | бесконечность | 1 |
- Повторно рассылать циркуляры целые-плазмид продуктов ПЦР, а также использовать лигирован продукт для преобразования MC4100 E. палочки клетки.
- Очищают продукт ПЦР путем запуска реакции ПЦР на агарозном геле 23, окрашиванием ДНК в геле 23, и с использованиемгель комплект очистки для очистки линеаризованной плазмиды, следуя инструкциям, прилагаемым изготовителем. Измерение концентрации с использованием спектрофотометра при длине волны 260 нм. Храните очищенный фрагмент при температуре от -20 ° C до необходимости, или переходите к шагу 4.4.2.
- Повторно плазмиды из рассылать проспекты ПЦР-продукта.
- Для предотвращения межмолекулярного лигирования ПЦР - продукта, осуществляют реакции лигирования с низкой концентрацией 27 1 нг / мкл ПЦР - продукта. Рассчитать объем, необходимый для подготовки реакции лигирования 800 мкл при этой концентрации.
- Готовят реакции лигирования на льду. В трубке, добавить объем , вычисленный в пункте 4.4.2.1 продукта ПЦР, 80 мкл 10 × буфера ДНК лигазы и дистиллированную H 2 O до 800 мкл. Добавить 4 мкл ДНК-лигазы Т4, и сразу поместить пробирки при 16 ° С в водяной бане или термоциклеру. Инкубировать при 16 ° CO / N в течение от 14 до 18 ч. Храните заполненные реакции лигирования при -20 ° Cдо тех пор, пока это необходимо, или перейдите к шагу 4.4.3.
- Поместите реакции лигирования на тепловом блоке при 65 ° С в течение 15 мин для нагревания-инактивировать ДНК-лигазы. Затем с помощью набора микродиализ мембраны или очистки ДНК-де-соль сшита ДНК. Хранить при температуре 20 ° C или перейти к этапу 4.4.4.
- Используйте весь инактивированной нагреванием, де-соленый продукт лигирования превратить MC4100 E. клетки палочки 23. Приготовьте запасы глицерина, как описано на стадии 1.3, из клеток, содержащих полученную приготовлена подбиблиотеки и хранить аликвоты при -80 ° С.
- Повторите шаг 4 в полном объеме с использованием аликвоты со стадии 4.4.4, чтобы сделать второй панорамирование на подбиблиотеки.
Примечание: Второй панорамирование способствует обогащению библиотечных компонентов , которые хорошо связываются с антигеном - мишенью 19.
5. Выполнение дополнительного экрана С помощью иммуноферментного Метод анализа для определения перспективных клонов для дальнейшей характеристики (рисунок 5)
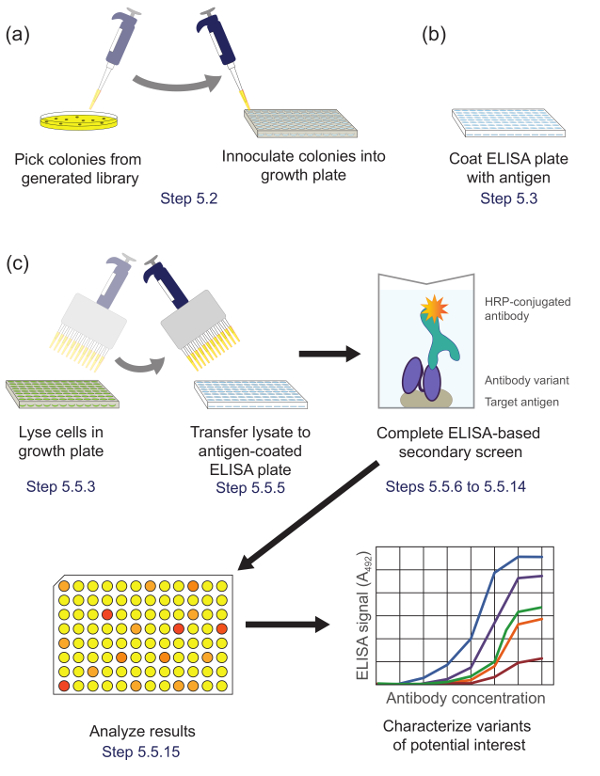
Рисунок 5. ELISA на основе вторичного скрининга (Шаг 5). Варианты (А) библиотеки из подбиблиотеки обогащенной во время панорамирование высевают в отдельные лунки планшета для культуры для роста и экспрессии. (Б) ELISA - планшет , покрытый антигеном - мишенью. (C) варианты библиотек скринингу с использованием ELISA на основе вторичного экрана , описанного в протоколе. При анализе данных, полученных из вторичного экрана, варианты интереса выбраны и охарактеризованы далее. Соответствующие шаги протокола отмечены. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Оттепель одну трубку из приготовлена подбиблиотеки (со стадии 4.4.4) и пластину на чашки с агаром LB. Пластинчатые несколько разведенийпри концентрациях , достаточно низких , чтобы обеспечить отдельные колонии (например, 10 2 - до 10 6 -кратных разведений). Инкубируйте пластин в течение от 15 до 18 ч при температуре 37 ° С. Хранить пластины при температуре 4 ° C или перейти к шагу 5.2.
- Культура и индуцируют колонии от приготовлена подбиблиотеки. Выполните все шаги в стерильных условиях. С помощью многоканальной пипетки для этапов с участием 96-луночных планшетах.
- Добавить 200 мкл LB с 20 мкг / мл Cm в каждую лунку планшета для культуры с круглым дном 96-луночного.
- Выберите отдельную колонию с чашки с агаром с наконечником пипетки, поместите кончик в первую лунку 96-луночного планшета, и осторожно перемешать до инокуляции. Используйте новый наконечник для каждой лунки. Привить одной колонии в каждую лунку. В качестве контроля, включают в себя по меньшей мере один контроль стерильности хорошо с не привит колонии.
- Повторите шаги 5.2.1 и 5.2.2 для инокуляции нескольких 96-луночных планшетов.
- Поместите 96-луночные планшеты на микропланшет-шейкере при 310 оборотах в минуту. Инкубировать при температуре 376; С в течение 20 до 24 часов, чтобы выразить scFvs.
- Для каждой культуры пластины, полученного в стадии 5.2, пальто один 96-луночного ELISA пластины с антигеном-мишенью.
- Развести очищенный антиген - мишень , до соответствующей концентрации (например, 1 мкг / мл до 4 мкг / мл) в 1 × PBS , чтобы сделать раствор для нанесения покрытия. Приготовьте 5 мл раствора для покрытия для каждого 96-луночного планшета.
Примечание: Соответствующая концентрация зависит от конкретного антигена, используемой и может потребоваться корректировка. - Добавьте 50 мкл раствора для нанесения покрытия на каждую лунку 96-луночного высокого связывания прозрачного полистирола ELISA пластины. Аккуратно нажмите на пластину на поверхности стендовых для того, чтобы вся поверхность каждой лунки с покрытием. Повторите эти действия для каждой пластины. Инкубируйте пластин при 4 ° CO / N.
- Развести очищенный антиген - мишень , до соответствующей концентрации (например, 1 мкг / мл до 4 мкг / мл) в 1 × PBS , чтобы сделать раствор для нанесения покрытия. Приготовьте 5 мл раствора для покрытия для каждого 96-луночного планшета.
- Репликация колоний от культуральных планшетов 96-луночных на чашках с агаром.
- Поместите стерильный полистирольный репликатор в лунки планшета для культуры, чтобы собрать небольшое количество жидкого мылаЯ бы. Осторожно поднимите репликатор и передать LB агаром 15 см таким образом, что все советы касаются пластины. После того, как жидкость переносили, поднимите репликатор прямо вверх. Повторите эти действия для каждой культуры пластины.
- Этикетка чашки с агаром с правильной ориентацией, так что результаты вторичного экрана в 96-луночный планшет, могут быть сопоставлены с правильным реплицируется колонии на пластине, если дальнейшая характеристика желательна. Grow при температуре 37 ° С в течение от 15 до 18 ч, а затем хранят при температуре 4 ° С до тех пор, пока это необходимо.
- Выполните вторичный экран ELISA.
- Готовят блокирующий раствор, сделав 2% (вес / объем) сухого молока в 1 × PBS. Очищать раствора для нанесения покрытия из планшетов ELISA. Добавьте 100 мкл блокирующего раствора в каждую лунку. Инкубируют при комнатной температуре в течение по крайней мере 2 ч, или блок-O / N при 4 ° С.
- Приготовьте промывочный буфер путем добавления полисорбат 20 до конечной концентрации 0,05% в 1 × PBS. Сделать 250 мл на ELISA пластины.
- Добавьте 20 мклКонцентрированный лизис клеток моющего средства в каждую лунку пластины с круглым дном культуры, и инкубировать культуральный планшет на микропланшет-шейкере при комнатной температуре в течение от 15 до 20 мин. Начало лизиса в то же самое время, что блокирование планшетов ELISA является полным, так что лизис и промывную Шаг 5.5.4 могут быть выполнены одновременно.
- Очищать блокирующий раствор из пластин ELISA. Промыть блокировали ELISA пластины четыре раза 200 мкл промывочного буфера на каждую лунку на каждую промывку. Слейте промывочный буфер из лунок.
- Передача 50 мкл из каждой лунки для лизиса клеток пластины к соответствующим лунку планшета ELISA, используя новый наконечник для каждой лунки. Инкубируйте планшет ELISA при КТ в течение 1 до 2 часов.
- Приготовьте раствор антител для выявления связанных scFvs.
- С помощью пероксидазой хрена (HRP) первичное антитело, которое связывается с ФЛАГ эпитоп слит с тэгом библиотеки scFvs.
- Развести антитела к соответствующему разбавлении для использования в ELISA (см поставщиком & #39; s рекомендации) в 2% (вес / объем) сухого молока в 0,05% полисорбата 20 в 1 × PBS. Подготовка 5 мл на каждую пластину.
- Промыть пластины ELISA четыре раза промывочным буфером, как описано в шаге 5.5.4.
- Добавьте 50 мкл раствора антител в каждую лунку планшета ELISA. Выдержите в течение от 1 до 2 ч при комнатной температуре.
- Приготовьте субстрат HRP путем растворения -phenylenediamine уплотнительных дигидрохлорид (OPD) таблетки в дистиллированной H 2 O в соответствии с протоколом производителя, избегая при этом свет. Приготовьте 20 мл на ELISA пластины.
- Приготовьте 3 М H 2 SO 4 путем разбавления концентрированной H 2 SO 4 с дистиллированной H 2 O в случае необходимости. Подготовка 5 мл на ELISA пластины.
Внимание: H 2 SO 4 является сильной кислотой. Обязательно носить соответствующие средства индивидуальной защиты. - Промыть пластины ELISA четыре раза промывочным буфером, как описано в шаге 5.5.4.
- Выдержите ELISA пластины с substra HRPт.е.
- Добавьте 200 мкл субстрата HRP в каждую лунку. Для того, чтобы свести к минимуму воздействия света, добавьте субстрат одной пластине, ELISA, в то время, и обертывают алюминиевой фольгой, прежде чем перейти к следующей пластине. Инкубируйте пластин в течение от 30 до 60 мин при комнатной температуре в темноте.
- После того, как первые 30 мин, проверьте пластины на потемнение подложки, и инкубировать дольше, если это необходимо, чтобы визуализировать разработке цвета.
- Добавляют 50 мкл 3 М H 2 SO 4 в каждую лунку , чтобы погасить реакцию. Использование другой наконечник для каждой лунки, перемешать раствор в лунки, осторожно пипеткой вверх и вниз без вспенивания. Для получения консистенции и для предотвращения насыщения, добавьте H 2 SO 4 быстро и тщательно , чтобы все из пластин ELISA перед смешиванием раствора для каждой пластины.
- Измерьте оптическую плотность раствора в лунках каждой пластины при 492 нм с использованием планшет-ридера.
- Анализ данных оптической плотности для идентификации ScFv вариантов, которые Exhibон обещает обязательные сигналы и характеризуют эти перспективные scFvs. Выберите scFvs, которые обладают оптической плотности сигналов выше, чем фоновый сигнал, и выше, чем средний сигнал на каждой пластине.
Примечание: Уровень оптическую плотность будет зависеть от свойств антигена и анти-FLAG антитела, используемые, наряду с силой вариантов ScFv, которые были изолированы в скрининге.
Результаты
Внутриклеточный белок складной механизм контроля качества пути Tat в E. палочка ограничивает транспорт через мембрану клетки внутренней к белкам, которые хорошо сложенными в восстановительной среде цитоплазмы. По гиперэкспрессией слияние с ScFv к сигнальной последовательности ssTorA (сигнальной последовательности из белка TORA, который естественным образом переносимого Tat пути 20), транслокации затормаживается, в результате чего отображение scFvs на внутренней мембране 19. После ферментативного разрушения внешней мембраны, отображенные антитела были доступны для скрининга на антиген-связывающей активности. Возможность воспользоваться преимуществами пути Tat для отображения ScFv было показано Карлссон и др. 19 (Рисунок 6). Эти антитела ScFv scFv13 и scFv13.R4 были слиты либо с нативной последовательностью ssTorA или модифицированного ssTorA, который испытывает недостаток вычет пару аргинин-аргинин, распознаваемыйТат путь. scFv13.R4 был спровоцирован Мартино и др. от scFv13 через четыре раунда направленной эволюции и , как известно, хорошо складываются в цитоплазме 9. Этот ScFv отображалась на внутренней мембране, но только тогда , когда выражается в виде гибрида с нативной сигнальной последовательностью ssTorA (рисунок 6). Противоположно, scFv13 не очень хорошо сложенный цитоплазматической 9, так что он не будет отображаться хорошо на внутренней мембране, независимо от сигнальной последовательности , к которой он слит. Кроме того, если были выражены scFvs в клетках , которые испытывали недостаток белка TaTc, жизненно важным компонентом механизма Tat 20,28, дисплей не наблюдалось, показывающий важную связь между внутренней мембраной дисплея и пути Tat. Эти результаты показывают, что только белки, которые содержат сигнальный пептид Tat и которые правильно свернутый в цитоплазме отображаются на внутренней мембране, что позволяет транспортировку через путь Tat, чтобы функционировать в качестве экрана для внутриклеточного ВОЛПдинь.
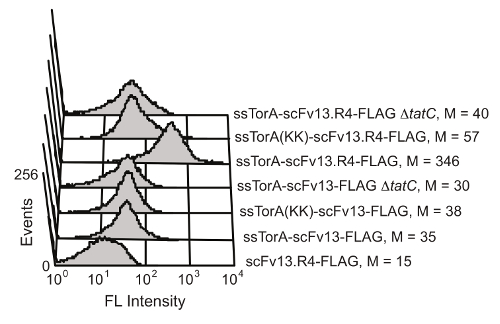
Рисунок 6. Обнаружение отображаемых scFvs на внутренней мембране. Проточная цитометрия анализ проводили для определения отображения плохо сложенного scFv13 и хорошо сложенной scFv13.R4 на внутренней мембране. scFvs были слиты с нативным ssTorA или ssTorA (KK), где пара Arg-Arg в последовательности ssTorA был модифицирован Lys-Lys. С-концевой эпитоп ФЛАГ тегов на оцFv детектируют с флуоресцеинизотиоцианатом (FITC) -conjugated анти-FLAG антитела. Клетки без белка TaTc (ΔtatC) и ssTorA-scFv13 без FLAG тега были испытаны в качестве контроля. M обозначает среднее значение флуоресценции. Перепечатано из ссылки 19 с разрешения. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Внутренняя мембрана-дисплей может успешно изолировать ScFv антитела с высоким уровнем сродства к белку-мишени и высокие уровни цитоплазматического растворимости. Кроме того, последующие раунды направленной эволюции с использованием дисплея внутренней мембраны улучшить характеристики антител 19. Чтобы продемонстрировать это, ошибка подверженным ПЦР библиотека основана на scFv13, который имеет низкий уровень связывания сродством к бета-галактозидазы, была приготовлена против антигена-мишени бета-галактозидазы с использованием дисплея и панорамирование метод, описанный в протоколе. ScFv 1-4 был выделен после одного раунда мутагенеза и панорамирование, и обладал более высокой аффинностью связывания с -галактозидазы , чем scFv13 (7А) и более высокий уровень цитоплазматической растворимости (рис 7б).
Новая библиотека, основанная на ScFv 1-4, было сделано с использованием подверженной ошибкам ПЦР, и панорамирование этой библиотеки второго поколения противβ-галактозидазы проводили с использованием модификации описанного протокола. Панорамирование против бета-галактозидазы для второго раунда эволюции было сделано в присутствии очищенного растворимого ScFv 14 в качестве конкурента, чтобы повысить вероятность выделения клонов с более высоким сродством, чем ScFv 1-4. После второго раунда мутагенеза и панорамирование, ScFv 2-1 и ScFv 2-3 выделяли с использованием ELISA на основе вторичного скрининга. Эти scFvs не только обладал более высокой аффинностью связывания бета-галактозидазы, чем scFv13, но также показали более связывание, чем в первом раунде клона ScFv 1-4. ScFv 2-1 выставлены -галактозидазу связывания сравнима с scFv13.R4 (7А). ScFv 2-3 также показывает дальнейшее увеличение цитоплазматического растворимости по сравнению с ScFv 14, подчеркивая одновременное проектирование растворимости и связывание антигена. Так как аффинность и растворимым экспрессия scFvs подвергают скринингу одновременно, то возможно, что выбранный ScFv имеет модрастворимость кции, но высокая связывающая или наоборот. Например, ScFv 2-1 имеет более низкую, чем экспрессии растворимого ScFv 2-3, но он обладает более высокой аффинностью связывания с бета-галактозидазы.

Рисунок 7. Целевая-связывающим и цитоплазматический экспрессия ScFv вариантов изолированы с помощью внутренней мембраны дисплея. Выражались (A) scFvs в цитоплазме E. клетки палочки (например., без сигнальной последовательности ssTorA) с гексагистидиновую (6 × -Его) тег и очищен с использованием никель-нитрилтриуксусная кислоты спин-колонки. Связывание очищенного scFvs к -галактозидазы измеряли с помощью ELISA. Очищенные scFvs погрузили на β-галактозидазы покрытием ELISA пластин, а связанные оцFv детектируют с помощью анти-6-антитело × -His. Данные представляют собой среднее из шести повторах, а бар ошибки показывает стандартную ошибку среднего значения.(В) растворимые и нерастворимые фракции клеточных лизатов от клеток , экспрессирующих scFvs цитоплазматической анализировали с помощью Вестерн - блот зондируют анти-6 - антитело × -His. Общая концентрация белка была использована для нормализации загрузки образцов. Переиздание (А) и адаптированный (B) из ссылки 19 с разрешения. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Инженерные антитела к цитоплазматической деятельности является сложной задачей из - за восстановительной среде цитоплазмы, что препятствует образованию стабилизирующего дисульфидных связей 6,7. Это приводит к тому большинство антител быть цитоплазматической неактивными, если они не разработаны для обеспечения стабильности и растворимости в цитоплазме, в дополнение к проектируется для аффинности связывания. Существующие методы фагового дисплея, бактериальной поверхности дисплея, а также методов отображения дрожжей поверхности все используют секреторный путь 14-16 для отображения сконструированных антител, но эти методы не имеют средств для конструирования внутриклеточный складывания. Антитела сконструированные с использованием дисплея внутренней мембраны улучшили цитоплазматическую стабильность и растворимость, так как контроль качества складывания пути Tat предотвращает транслокацию антител, которые плохо сложена и нестабильными в цитоплазме. Этот метод упрощает итерационный процесс инженерного внутриклеточных антител для аффинного ай растворимость, так как эти два свойства проектируются в одном шаге. Хотя этот метод был разработан для инженерных антител с растворимостью в восстановительной внутриклеточной среде, оно также может быть применено к инженерным антител функционировать в невосстанавливающих условиях, так как белки инженерии с помощью этого метода поддержания их складывание в окислительной среде периплазму.
Хотя этот метод значительно упрощает процесс инженерных антител с высоким сродством и высокой цитоплазмы растворимости, несколько ограничений важно учитывать при использовании этого протокола. При анализе вторичных сигналов экрана ELISA для определения перспективных ScFv вариантов, порог для различения потенциально интересных вариантов и те, которые, возможно, не обладают адекватными антигенсвязывающему, вероятно, не будет до тех пор, очевидно, после того, как несколько клонов были дополнительно характеризоваться не. Важно искать улучшенного связывания по сравнению с исходным антителом; Однако,аномально высокий уровень сигнала может свидетельствовать о авидности 29 или агрегации эффектов 30, вызов , который не является уникальным для внутренней мембраны дисплея скринингового подхода. Ключевым ограничением помнить при использовании этого протокола является невозможность восстановить сферопластов после того, как панорамирование, так как они не являются жизнеспособными (неопубликованные данные). Это приводит к необходимости амплификации ДНК и преобразования шаги, чтобы восстановить плазмид антитело-кодированием.
Несколько важных шагов протокола позволяют одновременное проектирование складывания и связывание антител. Для скрининга, чтобы быть успешным, библиотека ScFv экранируется должны быть выражены в виде слияния с сигнального пептида ssTorA. Без этой последовательности, антитела не будут направлены на пути Tat и , таким образом , не будет транслоцируется периплазмы 19. Кроме того, важно, что С-концевой эпитоп метка слита с антителами, чтобы обнаружить отображенных антител в бункерединь анализы. Очевидно, что Е. Штамм палочка используется для выражения scFvs также должны иметь необходимую Tat тропинка машины, но это правда из наиболее часто используемых E. палочки штаммов.
Модификации этого протокола можно повысить свой потенциал для выделения антител с требуемыми характеристиками. Вычитательной шаг панорамирование может быть завершена до панорамирование против антигена-мишени, чтобы истощить библиотеку ScFv недействующих желаемого компонентов. Библиотека сферопласты можно инкубировать с использованием магнитных шариков, покрытых BCCP отдельно или с покрытием с не желаемого белка, и Сферопласты, которые связываются с этими шариками могут быть отброшены, прежде чем скрининг оставшиеся несвязавшихся сферопластов для связывания с цели. Как уже упоминалось в Представитель Результаты, способ улучшить сродство изолированного ScFv должен включать растворимый конкурент в реакции панорамирование, чтобы конкурировать с scFvs отображаются на сферопластов. Поскольку растворимой компеetitor представляет собой очищенный белок, не ДНК не усиливается от нее, так что только Последовательности scFvs, отображаемых на Сферопласты будут восстановлены в ПЦР-реакции. Кроме того, этот способ может быть распространен на инженерные и другие типы антител или к не-антитела связывающих белков.
Кишечная палочка внутренней мембраны дисплей является мощной платформой для инженерных антител с высоким сродством и высоким уровнем внутриклеточного растворимости. Этот метод особенно подходит для эффективного проектирования антител, предназначенных для работы во внутриклеточной среде. Эти внутриклеточные антитела уже в настоящее время изучаются в качестве потенциальных терапевтических средств в ряде областей, в том числе нейродегенеративных заболеваний, рака и вирусных инфекций 31. Эта методика позволит более широкое применение внутриклеточных антител в качестве инструментов для исследований и медицины в этих областях и любой другой области , где изучают белок - мишень на месте желательно.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
We thank Tomer Zohar for work on scFv screening and characterization assays. A portion of this work was supported by award number F32CA150622 from the National Cancer Institute (to AJK). The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Cancer Institute or the National Institutes of Health.
Материалы
| Name | Company | Catalog Number | Comments |
| scFv library | Varies | A suitable scFv library should be obtained from a commercial or academic source. | |
| MC4100 E. coli cells | Coli Genetic Stock Center | 6152 | Cells need to be chemically competent or electrocompetent, depending on the selected transformation method. |
| Glycerol | Fisher Scientific | BP229-4 | |
| Difco dehydrated culture media LB Broth, Miller (Luria-Bertani) | BD | 244610 | |
| Chloramphenicol (Cm) | Fisher Scientific | BP904-100 | |
| Sodium chloride (NaCl) | Fisher Scientific | BP358-1 | |
| Potassium chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, dibasic (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Potassium phosphate, monobasic (KH2PO4) | Fisher Scientific | BP362-500 | |
| Bovine serum albumin (BSA) | Fisher Scientific | BP9706-100 | |
| Sucrose | Fisher Scientific | BP220-1 | |
| Tris base | Fisher Scientific | BP1521 | |
| Ethylenediaminetetraacetic acid (EDTA), 0.5 M | Fisher Scientific | BP2482-500 | |
| Magnesium chloride (MgCl2) | Fisher Scientific | BP214-500 | |
| Lysozyme | Sigma Aldrich | L3790-10X1ML | |
| Vortex mixer | VWR | 97043-564 | |
| Bicine | Fisher Scientific | BP2646100 | |
| D-Biotin | Fisher Scientific | BP232-1 | |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher Scientific | BP1755-1 | |
| BugBuster Master Mix (cell lysis detergent) | EMD Millipore | 71456 | |
| Vivaspin 2 MWCO, 3,000 daltons | GE Healthcare Sciences | 28932240 | |
| Target antigen | Varies | N/A | Purified target antigen may be purchased or produced/purified. |
| Dynabeads MyOne Streptavidin T1 | Invitrogen | 65601 | |
| Dynamag-2 magnet | Invitrogen | 12321D | |
| Tube rotator | VWR | 13916-822 | |
| PCR primers | IDT | N/A | Primer sequences are as described in the protocol. |
| 10x T4 DNA ligase reaction buffer | New England BioLabs | B0202S | |
| T4 Polynucelotide kinase (PNK) | New England BioLabs | M0201S | Make sure the T4 ligase buffer used in the primer phosphorylation reaction contains 1 mM ATP. |
| 5x Phusion HF buffer pack | New England BioLabs | B0518S | |
| Deoxynucleotide (dNTP) solution mix, 10 mM each dNTP | New England BioLabs | N0447L | |
| Phusion DNA polymerase | New England BioLabs | M0530S | Other high-fidelity polymerases may be used as an alternative, but the annealing temperature in Table 3 must be adjusted. |
| C1000 Touch thermal cycler with dual 48/48 fast reaction module | Bio-Rad | 185-1148 | |
| Agarose | Promega | V3121 | |
| SYBR Safe DNA gel stain | Invitrogen | S33102 | |
| Wizard SV gel and PCR clean-up system | Promega | A9281 | |
| T4 DNA ligase | New England BioLabs | M0202S | |
| Microdialysis membrane filter | EMD Millipore | VSWP04700 | |
| Agar | BD | 214030 | |
| 96-well polystyrene round-bottom cell culture plates | VWR | 10062-902 | |
| Costar general polystyrene assay plate lids | Corning | 3931 | |
| Microtitre plate shaker | VWR | 12620-926 | |
| Costar 96 well EIA/RIA Easy Wash clear flat bottom polystyrene high bind microplate | Corning | 3369 | |
| Bel-blotter polycarbonate 96-well replicating tool | Bel-Art Products | 378760002 | |
| Instant nonfat dry milk | Quality Biological | A614-1000 | |
| Tween 20 (polysorbate 20) | Fisher Scientific | BP337-500 | |
| PopCulture reagent (concentrated cell lysis detergent) | EMD Millipore | 71092-3 | |
| Monoclonal ANTI-FLAG M2-Peroxidase(HRP) antibody produced in mouse | Sigma Aldrich | A8592 | |
| SigmaFast OPD | Sigma Aldrich | P9187-50SET | |
| Sulfuric acid (H2SO4), 10 N solution | Fisher Scientific | SA200-1 | |
| Reynolds Wrap aluminum foil | VWR | 89079-075 | |
| BioTek Epoch microplate spectrophotometer | Fisher Scientific | 11120570 |
Ссылки
- Biocca, S., Pierandrei-Amaldi, P., Campioni, N., Cattaneo, A. Intracellular immunization with cytosolic recombinant antibodies. Biotechnology (NY). 12 (4), 396-399 (1994).
- Chen, S. Y., Bagley, J., Marasco, W. A. Intracellular antibodies as a new class of therapeutic molecules for gene-therapy. Hum. Gene Ther. 5 (5), 595-601 (2008).
- Gargano, N., Biocca, S., Bradbury, A., Cattaneo, A. Human recombinant antibody fragments neutralizing human immunodeficiency virus type 1 reverse transcriptase provide an experimental basis for the structural classification of the DNA polymerase family. J Virol. 70 (11), 7706-7712 (1996).
- Mhashilkar, A. M., et al. Inhibition of HIV-1 Tat-mediated LTR transactivation and HIV-1 infection by anti-Tat single chain intrabodies. Embo J. 14 (7), 1542-1551 (1995).
- Strube, R. W., Chen, S. Y. Characterization of anti-cyclin E single-chain Fv antibodies and intrabodies in breast cancer cells: enhanced intracellular stability of novel sFv-F-c intrabodies. J. Immunol. Meth. 263 (1-2), 149-197 (2002).
- Mössner, E., Koch, H., Plückthun, A. Fast selection of antibodies without antigen purification: adaptation of the protein fragment complementation assay to select antigen-antibody pairs. J. Mol. Biol. 308 (2), 115-122 (2001).
- Wörn, A., et al. Correlation between in vitro stability and in vivo performance of anti-GCN4 intrabodies as cytoplasmic inhibitors. J Biol Chem. 275 (4), 2795-2803 (2000).
- Knappik, A., Plückthun, A. Engineered turns of a recombinant antibody improve its in vivo folding. Protein Eng. 8 (1), 81-89 (1995).
- Martineau, P., Jones, P., Winter, G. Expression of an antibody fragment at high levels in the bacterial cytoplasm. J Mol Biol. 280 (1), 117-127 (1998).
- Steipe, B., Schiller, B., Plückthun, A., Steinbacher, S. Sequence statistics reliably predict stabilizing mutations in a protein domain. J. Mol. Biol. 240 (3), 188-192 (1994).
- Daugherty, P. S. Protein engineering with bacterial display. Curr Opin Struct Biol. 17 (4), 474-480 (2007).
- Lener, M., et al. Diverting a protein from its cellular location by intracellular antibodies. Eur. J. Biochem. 267 (4), 1196-1205 (2000).
- Lynch, S. M., Zhou, C., Messer, A. An scFv intrabody against the nonamyloid component of α-synuclein reduces intracellular aggregation and toxicity. J. Mol. Biol. 377 (1), 136-147 (2008).
- Gai, S. A., Wittrup, K. D. Yeast surface display for protein engineering and characterization. Curr. Opin. Struc. Biol. 17 (4), 467-473 (2007).
- Kieke, M. C., et al. Selection of functional T cell receptor mutants from a yeast surface-display library. Proc. Natl. Acad. Sci. USA. 96 (10), 5651-5656 (1999).
- Steiner, D., Forrer, P., Stumpp, M. T., Pluckthun, A. Signal sequences directing cotranslational translocation expand the range of proteins amenable to phage display. Nat. Biotechnol. 24, 823-831 (2006).
- Pugsley, A. P. The complete general secretory pathway in gram-negative bacteria. Microbiol. Rev. 57 (1), 50-108 (1993).
- Rapoza, M. P., Webster, R. E. The filamentous bacteriophage assembly proteins require the bacterial SecA protein for correct localization to the membrane. J. Bacteriol. 175 (6), 1856-1859 (1993).
- Karlsson, A. J., et al. Engineering antibody fitness and function using membrane-anchored display of correctly folded proteins. J. Molec. Biol. 416 (1), 94-107 (2012).
- DeLisa, M. P., Tullman, D., Georgiou, G. Folding quality control in the export of proteins by the bacterial twin-arginine translocation pathway. Proc Natl Acad Sci U S A. 100 (10), 6115-6120 (2003).
- Fisher, A. C., Kim, W., DeLisa, M. P. Genetic selection for protein solubility enabled by the folding quality control feature of the twin-arginine translocation pathway. Protein Sci. 15 (3), 449-458 (2006).
- Maynard, J., Georgiou, G. Antibody engineering. Annu Rev Biomed Eng. 2, 339-376 (2000).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. 1, (2012).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--the database of key numbers in molecular and cell biology. Nucleic Acids Res. 38, D750-D753 (2010).
- Hermanson, G. T. . Bioconjugate Techniques. , (2013).
- Tayapiwatana, C., Chotpadiwetkul, R., Kasinrerk, W. A novel approach using streptavidin magnetic bead-sorted in vivo biotinylated survivin for monoclonal antibody production. J Immunol Methods. 317 (1-2), 1-11 (2006).
- Zhu, G., Song, L., Lippard, S. J. Visualizing inhibition of nucleosome mobility and transcription by cisplatin-DNA interstrand crosslinks in live mammalian cells. Cancer Res. 73 (14), 4451-4460 (2013).
- Bogsch, E. G., et al. An essential component of a novel bacterial protein export system with homologues in plastids and mitochondria. J. Biol. Chem. 273, 18003-18006 (1998).
- Julian, M. C., et al. Co-evolution of affinity and stability of grafted amyloid-motif domain antibodies. Protein Eng. Des. Sel. 28 (10), 339-350 (2015).
- Garber, K. Bispecific antibodies rise again. Nat. Rev. Drug. Discov. 13 (11), 799-801 (2014).
- Marschall, A. L., Dübel, S., Böldicke, T. Specific in vivo knockdown of protein function by intrabodies. MAbs. 7 (6), 1010-1035 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены